нулевые мутанты погибают приблизительно на ст. e11 вследствие преимущественно дефекта биосинтеза noradrenalin и во вторую очередь из-за сердечной недостаточности (Gata3; Pandolfi et al., 1995; Lim et al., 2000). Но они могут быть восстановлены кормлением Gata3 гетерозиготных intercrossed самок синтетическими промежуточными образованиями catecholamine, или путем восстановления функции GATA-3 специфически в SA клонах с использованием человеческого dopamine β-hydroxylase (hDBH) промотора, чтобы управлять экспрессией GATA-3 трансгена (Tg
; Lim et al., 2000; Morigu chi et al., 2006). Ранее сообщалось, что
экспрессируется в клетках хрусталиковых волокон эмбрионов мыши (Oosterwegel et al., 1992; Lakshmanan et al., 1999), хотя физиологическое значение этого наблюдения оставалось неясным. Здесь мы исследовали последствия мутаций потери функции GATA-3 для развития хрусталиков Tg
-rescued Gata3 нулевых мутантов. Мы продемонстрировали, что инактивация
ведет к аномальному развитию задних клеток хрусталиковых волокон, которые обнаруживают пониженные уровни маркера дифференцировки -crystallin, непрерывную экспрессию хрусталиковым пузырьком маркера E-cadherin повышенный сигнал маркеров пролиферации, т.e., инкорпорацию BrdU и иммунореактивность Ki67. Аномальная пролиферация клеток хрусталиковых волокон у Tg
, устраняемая в Gata3 нулевых мутантных хрусталиках, коррелирует с пониженными уровнями Cdkn1b/p27 и Cdkn1c/p57 CKIs, а также увеличением уровня Ccnd2/Cyclin D2. Затем эти клетки подвергаются апоптической клеточной гибели. Молекулярный путь, который регулирует дифференцировку хрусталиков интимно взаимосвязан с контролем нормлаьного клеточного цикла, а GATA-3 играет важную роль с клеточной дифференцировке клеток хрусталиковых волокон путем индукции выхода из клеточного цикла в качестве части его регуляторных функций.
В данной работе мы продемонстрировали, что экспрессия GATA-3 начинается в развивающемся хрусталиковом пузырьке в средине эмбриогенеза (около e11.5) и продолжает экспрессироваться в клетках волокон в течение всего развития эмбрионального хрусталика. Его экспрессия специфически ограничивается клетками волокон во время морфогенеза хрусталика. В соответствии с его пространственно-временной экспрессией в развивающемся хрусталике, отсутствие GATA-3 приводит к нарушению дифференцировки задних клеток хрусталиковых волокон со ст. e12.5 , это демонстрируется уменьшением уровней -crystallin и затянувшейся экспрессией E-cadherin в клетках первичных хрусталиковых волокон. Отмечается также увеличение количества митотических (BrdU- или Ki67-иммунопозитивных) и апоптических клеток волокон в истощенных по GATA-3 хрусталиках.
Cell Cycle Regulation by GATA Factors Has Been Reported in a Variety of Different Tissues
Недавно было сообщено, что Gata2-дефицитные эмбриональные нейроэпителиальные клетки мыши обнаруживают аберрантную пролиферацию и что избыточная экспрессия GATA-2, индуцирует нейральную дифференцировку путем ингибирования пролиферации нейральных предшественников посредством активации экспрессии Cdkn1b/p27 (El Wakil et al., 2006). При дифференцировке эритроидных клеток GATA-1, как сообщалось, индуцирует дифференцировку эритромегакариоцитов благодаря супрессии активного клеточного цикла клеток гематопоэтических предшественников посредством индукции экспрессии Cdkn2a/p16 (Pan et al., 2005). Хотя всё ещё неясно, GATA-2 или GATA-1 непосредственно регулируют экспрессию Cdkn1b/p27 или Cdkn2a/p16 соотв., эти сообщения, также как и наблюдения данной работы подтверждают, что GATA факторы обладают потенциальной регуляторной функцией контроля клеточного цикла в процессе нормальной дифференцировки за счет активации экспрессии CKIs. GATA-3, как было установлено, супрессирует аномальную пролиферацию мезонефрических клеток, а также клеток эпителия молочных желез, хотя молекулярные основы этого феномена остаются неясными (Grote et al., 2006; Kouros-Mehr et al., 2006). Недавно транскриптомный анализ условных делеций GATA-3 в волосяных фолликулах показал, что множественные гены, регулирующие клеточный цикл, обнаруживают измененную экспрессию (Kurek et al., 2007). Необходимы дальнейшие исследования для определения как GATA-3 функционально координирует регуляцию клеточного цикла с нормальной дифференцировкой в разных тканях. экспрессирующих GATA-3, включая клетки хрусталиковых волокон.
Хотя механические детали того, как потеря GATA-3 вызывает нарушения дифференцировки хрусталиковых волокон, неизвестны, но регуляторы клеточного цикла могут быть потенциальными ключевыми молекулами, лежащими в основе аномального увеличения пролиферирующих клеток. В хрусталиках дикого типа эпителиальные клетки вблизи экваториальной зоны выходят из клеточного цикала, чтобы дать клетки волокон и в ходе этого процесса они инициируют экспрессию Cdkn1b/p27 и Cdkn1c/p57. Cdkn1b/p27 и Cdkn1c/ p57 кооперативно контролируют выход из клеточного цикла и последующую дифференцировку в клетки хрусталиковых волокон. Cdkn1b/p27 обычно безразличен для развития хрусталика из-за его перекрывания с Cdkn1c/p57, тогда как Cdkn1b/p27-/- и Cdkn1c/p57+/-m, как и у Gata3-дефицитных мышей, приводит к существенной нехватке выхода из клеточного цикла и последующей дифференцировки клеток хрусталиковых волокон (Zhang et al., 1998; Nagahama et al., 2001). В Gata3-дефицитных хрусталиках мы продемонстрировали, что иммунореактивности Cdkn1b/p27 и Cdkn1c/p57 драматически супрессируются в экваториальной зоне и что количество их мРНК снижается в хрусталиках, указывая тем самым, что дефицит GATA-3 приводит к супрессии двух CKIs на уровне транскрипции. Однако мы оказались неспособны идентифицировать законсервированный консенсус сайтов связывания GATA вблизи промоторов Cdkn1b/p27 и Cdkn1c/p57 или наблюдать GATA-3-зависимую транс-активацию репортерного гена цис-сцепленного с 1.6-kbp Cdkn1b/p27 или 2.0 kbp Cdkn1c/p57 промотора в нескольких линиях клеток в экспериментах по ко-трансфекции (data not shown), показав тем самым, что Cdkn1b/p27 и Cdkn1c/p57 или не являются непосредственными генами мишенями для GATA-3 или что GATA-3 регулирует эти гены посредством энхансеров, которые лежат вне границ промотора. Мы исследовали экспрессию мРНК Sox1, Foxe3, Prox1, c-Maf и Pax6 на ст. e16.5 в GATA-3-дефицитных хрусталиках, чтобы установить потенциальные генетические взаимодействия между GATA-3 и каждым из этих известных регуляторов развития хрусталика. Экспрессия Sox1 инициируется в хрусталиковом пузырьке примерно на ст. e10 и продолжает экспрессироваться в клетках хрусталиковых волокон на ст. e15.5 (Nishiguchi et al., 1998). Экспрессия Foxe3, Prox1 и c-Maf впервые обнаруживается около e9.0 -e9.5 в хрусталиковой плакоде (Wigle et al., 1999; Kawauchi et al., 1999; MedinaMarinez et al., 2005). Экспрессия Foxe3 позднее оказывается ограниченной эпителием переденй части хрусталика, тогда как экспрессия Prox1 и c-Maf поддерживается в клетках хрусталиковых волокон (Wigle et al., 1999; Kawauchi et al., 1999; MedinaMartinez et al., 2005). Экспрессия Pax6 обнаруживается значительно раньше (в головной нейральной эктодерме), включая оптическую ямку на ст. e8.0, хотя начиная со ст. e13.5 экспрессия Pax6 подавляется в клетках хрусталиковых волокон (Grindley et al., 1995; Donner et al., 2007). Учитывая эти пространственно-временные паттерны экспрессии и сходства в нехватках хрусталиков, встречающиеся у разных мутантных мышей, мы первоначально ожидали установить регуляторные взаимоотношения между GATA-3 и экспрессией Sox1 или Prox1 в развивающихся клетках хрусталиковых волокон. Однако все эти транскрипционные регуляторы оказывались лишь слегка, если вообще, изменены в GATA-3 дефицитных хрусталиках. Учитывая более позднее появление экспрессии GATA-3 в хрусталиковом пузырьке на ст. e10.5 , а также относительно умеренный дефицит хрусталиков у Gata3 мутантных мышей, мы полагаем, что GATA-3 может быть расположен в более низком положении в иерархии, но выше -crystallin и обеих CKIs (Cdkn1b/p27 и Cdkn1c/p57) в генетической программе развития хрусталика. Интересно, что экспрессия GATA-3 строго активируется в остатках c-Maf-дефицитных хрусталиков. Это наблюдение четко демонстрирует, что экспрессия GATA-3 непосредственно или косвенно негативно контролируется с помощью c-Maf в нормальных развивающихся клетках хрусталиковых волокон, поэтому дефицит c-Maf дерепрессирует экспрессию GATA-3, возможно, чтобы компенсировать супрессированную активации генов crystallin. Точное картирование специфичных для хрусталика регуляторных последовательностей гена Gata3, которые, по-видимому, расположены в области в 2-kbp, лежащей перед 5' гена (George et al., 1994; Lieuw et al., 1997), сможет предоставить дополнительную информацию о характеристиках вышестоящих регуляторов экспрессии GATA-3 в клетках хрусталиковых волокон.
Во время дифференцировки клетки зрелых хрусталиковых волокон продуцируют многочисленные β- и γ-crystallins (McAvoy, 1978). Из субтипов кристаллинов, α-crystallins обычно экспрессируются как в хрусталиковом эпителии, так и с клетках хрусталиковых волокон и впервые экспрессируются на ст. хрусталикового пузырька (McAvoy, 1978; Murer-Orland et al., 1987; Goring et al., 1992; Horwitz, 2003). Экспрессия β-Crystallin, которая начинается на ст. e11 у эмбрионов мыши, служит ранним маркером дифференцировки хрусталиковых волокон, тогда как активация гена γ-crystallin инициируется около e12.5 (Goring et al., 1992; Nishiguchi et al., 1998; Ring et al., 2000). Мы показали, что экспрессия γA, γC и γD-crystallin, которая обычно ограничивается αA- и β1-crystallin в Gata3/:TghDBH-G3 хрусталиках. В Gata3 мутантных хрусталиках отсутствие дифференцировки хрусталиковых волокон ассоциирует с аберрантным накоплением митотических задних клеток. Имеются два возможных объяснения этого наблюдения. Одно из них связано с тем, что GATA-3 прежде всего способствует дифференцировке хрусталиковых волокон, т.е. активации генов γ-crystallin, а также супрессии экспрессии E-cadherin, поэтому дефицит GATA-3 д. в первую очередь вызывать дефицит клеток волокон, который в свою очередь д. приводить к накоплению недозрелых подобных эпителиальным клеткам задних клеток. Др. возможность заключается в том, что дефицит GATA-3 преимущественно, но косвенно ведет к супрессии транскрипции Cdkn1b/p27 и Cdkn1c/ p57, который затем вызывает неспособность к прекращению клеточных циклов во время перехода от эпителия к клеткам волокон. В результате задние клетки хрусталиковых волокон не дифференцируются полностью и в конечном итоге подвергаются апоптозу. Хотя эти два объяснения могут быть лишь частично верными, клеточная дифференцировка и затухание клеточных циклов, скорее всего, тонко взаимосвязаны. Поэтому в дальнейшем необходимо определить, как GATA-3 действует во время индукции клеточной дифференцировки, и как он регулирует супрессию клеточного цикла во время развития хрусталика. Итак, мы продемонстрировали, что GATA-3 важен для терминальной дифференцировки клеток хрусталиковых волокон. Интересно бы прояснить лежащие в основе механизмы, с помощью которых экспрессия CKIs и CDKs контролируется с помощью GATA факторов и идентифицировать др. факторы, связанные с клеточным циклом и апоптозом, которые могли бы быть ответственными за увеличение клеточной гибели в Gata3-дефицитных клетках хрусталиковых волокон. Мы полагаем. что Gata3 мутантные хрусталики мыши могут служить удобной моделью для выяснения общих принципов регуляции клеточного цикла с помощью GATA транскрипционных факторов.
Сайт создан в системе
uCoz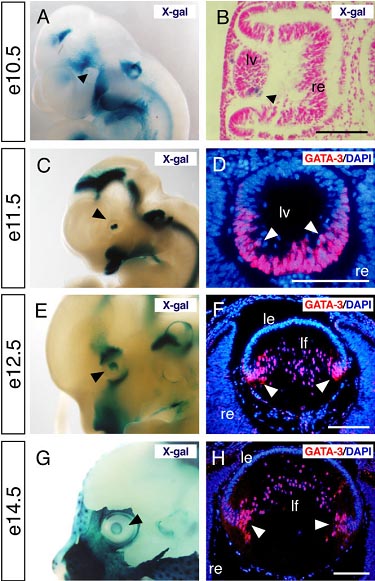 Fig. 1. Optic expression of GATA-3 during embryogenesis. A–F: Gata3lacZ knock-in heterozygotes at embryonic day (e) 10.5, e11.5, e12.5, and e14.5 were stained with X-gal and photographed in whole-mounts (A,C,E,G) and section (B). Black arrowheads in each panel indicate lacZpositive lens. D,F,H: GATA-3 immunoreactivity was specifically observed in the posterior part of the lens vesicle in e11.5 embryos and in lens fiber cells from e12.5 onward (white arrowheads). le, lens epithelium; lf, lens fiber; lv, lens vesicle; re, retina. Scale bars 100 m.
Fig. 1. Optic expression of GATA-3 during embryogenesis. A–F: Gata3lacZ knock-in heterozygotes at embryonic day (e) 10.5, e11.5, e12.5, and e14.5 were stained with X-gal and photographed in whole-mounts (A,C,E,G) and section (B). Black arrowheads in each panel indicate lacZpositive lens. D,F,H: GATA-3 immunoreactivity was specifically observed in the posterior part of the lens vesicle in e11.5 embryos and in lens fiber cells from e12.5 onward (white arrowheads). le, lens epithelium; lf, lens fiber; lv, lens vesicle; re, retina. Scale bars 100 m.