Embryonic origin of human hematopoiesis | |
|
ABSTRACT Hematopoietic stem cells (HSC) are at the of the adult hematopoietic system. They give rise to all blood cells through a complex series of proliferation and differentiation events that occur throughout the lifespan of the individual. Because of their potential clinical importance in transplantation, recent research has focused on the developmental origins of embryonic HSC.During development in vertebrate embryos, two independent anatomical sites generate hematopoietic cells. The yolk sac is responsible for a first ephemeral hematopoiesis, characterized by the early appearance of hematopoietic progenitors with limited development ability that rapidly differentiate toward erythro-myeloid lineages. Self-renewing, multipotent adult-type HSC that also exhibit B and T lymphoid potentials emerge autonomously in the aorta/gonad/mesonephros (AGM) region inside the embryo. In this review, we provide a brief summary of recent developments regarding the origins of hematopoietic stem cells in the early human embryo. The recent discovery that angiotensin-converting enzyme (ACE) is a novel cell surface marker of human HSC is discussed in detail.
The placenta as a haematopoietic organ | KATRIN OTTERSBACH and ELAINE DZIERZAK Int. J. Dev. Biol. 54: 1099-1106 (2010) doi: 10.1387/ijdb.093057ko Недавно плацента была описана как ткань, богатая гемопоэтическими стволовыми клетками и клетками предшественниками, это открывает не только новые горизонты исследования, в смысле как гематопоэз регулируется в этой уникальной ткани млекопитающих, но и также ведет к пересмотру давно стоящих и всё ещё нерешенных вопросов о значении множественных гемопоэтических органов во время развития. Благодаря удивительной способности к экспансии гемопоэтических стволовых клеток и клеток предшественников изучение плацентарного гематопоэза имеет очевидный клинический интерес. В работе суммируются современные известные данные о регуляторных процессов гематопоэза плаценты мыши и описываются самые последние данные, демонстрирующие, что плацента человека, подобно своему аналогу у мышей, также является источником гемопоэтических стволовых клеток и клеток предшественников в ходе всего развития. Не млекопитающие виды позвоночных, такие как куры, рыбки данио и лягушки, имеют хорошо функционирующую гемопоэтическую систему в отсутствие плаценты (reviewed in Cumano and Godin, 2007; Dzierzak and Speck, 2008). Было предположено, что более одного источника необходимо для предоставления достаточных количеств HSCs для колонизации печени плода (Kumaravelu et al. 2002). Следовательно, плацента используется в качестве внешней HSC территории для предоставления больших количеств HSCs и предшественников, чем способны продуцировать YS и AGM? Вообще-то богатая факторами роста и гормонами, васкуляризованная плацентарная ниша способствует пролиферации HSCs, мигрирующих из AGM посредством пупочных сосудов в печень плода. Эта возможность подтверждается наблюдением на мышах, что HSCs становятся обнаружимыми в плаценте спустя день после появления и[ в AGM и их количества быстро снижаются опять же спустя день после того как останавливается продукция HSC в AGM (AGM прекращает свое существование после E12). Следовательно, так только продукция и миграция HSC в эмбрионах мыши заканчивается и печень плода полностью колонизируется, ток HSCs через плаценту также останавливается и HSCs здесь более не обнаруживаются. Также морфология плаценты, по-видимому, не изменяется драматически после того как снижается количество HSC на ст. E13. Т.о., может не происходить изменений в гемопоэтических условиях в плаценте, которые бы вызывали исчезновение HSCs. На самом деле, происходящие из плаценты мыши гемопоэтические предшественники, остаются многочисленными после E13 (Alvarez-Silva et al. 2003) и поддерживающие гематопоэз линии стромальных клеток выделяются из плаценты человека в ходе всего развития. Однако было бы интересно исследовать у мышей обладают ли происходящие из плаценты линии стромальных клеток на поздних стадиях развития той же самой поддерживающей способностью, как и линии стромальных клеток, продуцируемые на пике экспансии HSC в плаценте.
Др. возможность заключается в том, что HSCs возникают в плаценте. CD41+ гемопоэтические клетки обнаруживаются в плаценте в отсутствие клеточного обмена между разными тканями посредством циркуляции (Rhodes et al. 2008), а на ранних стадиях развития нормальной плаценты аллантоис и хорион обладают гемопоэтическим потенциалом (Corbel et al. 2007; Zeigler et al. 2006). Тот факт, что некоторые плацентарные HSCs обладают фенотипом, указывающим на эндотелиальное происхождение (Ottersbach and Dzierzak, 2005; Taoudi et al. 2005), подтверждает возможность, что некоторые HSCs происходят из плацентарного гемогенного эндотелия. Т.о., является ли плацента др. примером генерации HSC вместе с крупными сосудами плода ожидает подтверждения с помощью отслеживания клонов in vivo imaging. Плацента в качестве ниши HSC описана у мышей всего 5 лет назад и пока мало известно о клеточных и молекулярных механизмах регуляции гемопоэтической активности в этой ткани, особенно у человека. Как только некоторые из компонент ниш будут идентифицированы, станет возможным использование этой информации, чтобы специфически нарушать плацентарный гематопоэз и понять важность плаценты для гематопоэза у плода.
|
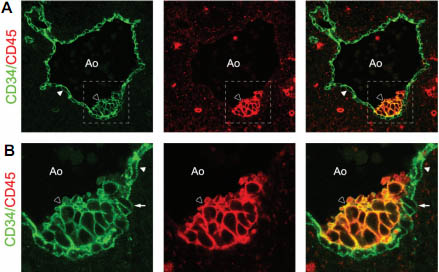 Fig. 1. Hematopoietic stem cell clusters inside human embryonic arteries. (A) Cross
sections of a 34-day human aorta (Ao) stained with the anti-CD34 (green) and anti-CD45 (red) antibodies. Arrows indicate the clusters of hematopoietic stem cells adhering to the ventral aspect of the aortic endothelium (white arrowhead). (B) Confocal images at higher magnification of the region included in the dotted white line in panel A show the changed morphology of endothelial cells underlying hematopoietic clustered progenitors (arrow).
Fig. 1. Hematopoietic stem cell clusters inside human embryonic arteries. (A) Cross
sections of a 34-day human aorta (Ao) stained with the anti-CD34 (green) and anti-CD45 (red) antibodies. Arrows indicate the clusters of hematopoietic stem cells adhering to the ventral aspect of the aortic endothelium (white arrowhead). (B) Confocal images at higher magnification of the region included in the dotted white line in panel A show the changed morphology of endothelial cells underlying hematopoietic clustered progenitors (arrow). 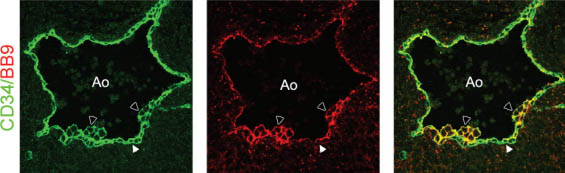 Fig. 2. Expression of BB9/angiotensin-converting-enzyme (BB9/ACE) in the human embryo. Cross sections through the dorsal aorta (Ao) in a 34-day embryo. BB9/ACE is expressed by hematopoetic CD34+CD45+ cell clusters associated with the endothelium on the ventral site of the aorta (arrowheads), as well as by underlying endothelial CD34+
cells (white arrowheads)
Fig. 2. Expression of BB9/angiotensin-converting-enzyme (BB9/ACE) in the human embryo. Cross sections through the dorsal aorta (Ao) in a 34-day embryo. BB9/ACE is expressed by hematopoetic CD34+CD45+ cell clusters associated with the endothelium on the ventral site of the aorta (arrowheads), as well as by underlying endothelial CD34+
cells (white arrowheads) | |
| ESTELLE OBERLIN, BOUCHRA EL HAFNY , LAURENCE PETIT-COCAULT
and MICHELE SOUYRI Definitive human and mouse hematopoiesis originates from the embryonic endothelium: a new class of HSCs based on VE-cadherin expression Int. J. Dev. Biol. 54: 1165-1173 (2010) |
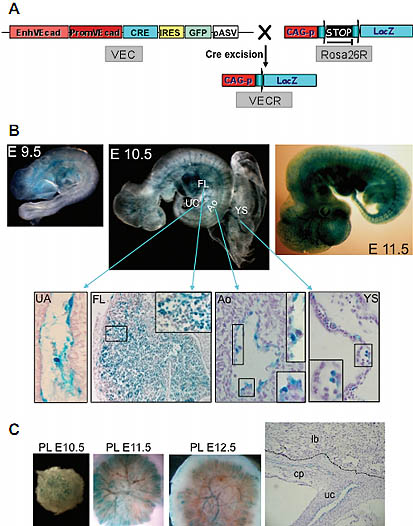 Fig. 4. Generation of the VEC mice and LacZ analysis of VECR embryos. (A)
Schematic representation of the VE-cadherin promoter+enhancer driven Cre
recombinase transgene (VEC), and of the obtention of the double transgenic VECR
mice. (B) Whole-mount X-gal staining of E9.5, E10.5 and E11.5 VECR embryos shows
progressive LacZ expression in intersomitic vessels, endocardium, as well as in the
aorta (Ao), fetal liver (FL), yolk sac (YS) and umbilical (UA) and vitelline (not shown)
arteries at E10.5. Down panel shows representative illustrations of 7.5 µM cryosections of whole mounted E10.5 embryo and yolk sac, focused on UA, FL, Ao and YS
respectively. Boxed areas are magnified. (C) Whole-mount X-gal staining of placenta at
E10.5, 11.5, 12.5. 7.5 µM cryosections of E12.5 placenta showing that LacZ mainly
labels the big vessels of the chorionic plate.
Fig. 4. Generation of the VEC mice and LacZ analysis of VECR embryos. (A)
Schematic representation of the VE-cadherin promoter+enhancer driven Cre
recombinase transgene (VEC), and of the obtention of the double transgenic VECR
mice. (B) Whole-mount X-gal staining of E9.5, E10.5 and E11.5 VECR embryos shows
progressive LacZ expression in intersomitic vessels, endocardium, as well as in the
aorta (Ao), fetal liver (FL), yolk sac (YS) and umbilical (UA) and vitelline (not shown)
arteries at E10.5. Down panel shows representative illustrations of 7.5 µM cryosections of whole mounted E10.5 embryo and yolk sac, focused on UA, FL, Ao and YS
respectively. Boxed areas are magnified. (C) Whole-mount X-gal staining of placenta at
E10.5, 11.5, 12.5. 7.5 µM cryosections of E12.5 placenta showing that LacZ mainly
labels the big vessels of the chorionic plate.