Недавние исследования на модельных мышах подтвердили важность Sirt1 в дифференцировке стволовых клеток. Sirt1 влияет на нейральную и глиальную спецификацию нейральных предшественников (5), регулирует дифференцировку скелетных миобластов (6) и ингибирует сперматогенез (7). Независимо полученные дефицитные по
Sirt1 мыши обнаруживают тяжелые нейральные дефекты, включая экзэнцефалию и нарушенный морфогенез нейральной части сетчатки (8, 9). В противоположность мышам у человека роль SIRT1 в дифференцировке эмбриональных стволовых клетках человека (hESC) изучена плохо. Здесь мы описываем путь, которые подавляет SIRT1 в время дифференцировки стволовых клеток. Кроме того, мы продемонстрировали, что SIRT1 регулирует экспрессию специфических генов развития в плюрипотентных hESC и что её подавление необходимо для корректного становления программ специфической дифференцировки во время дифференцировки стволовых клеток.
Discussion
Наше исследование показало, что SIRT1 регулирует специфические онтогенетические гены, важные для дифференцировки hESC. Неотразимые доказательства. полученные на мышиных моделях, показывают, что Sirt1 является центральным регулятором функции эмбриональных (21) и соматических (5) стволовых клеток. У mESC, Sirt1 ассоциируется с реакцией на повреждения ДНК после легкого оксидативного стресса (24). Наши результаты расширяют эти находки, показывая, что SIRT1 может быть важным регулятором дифференцировки hESC и также указывают на молекулярный путь регуляции SIRT1 в стволовых клетках. Мы показали, что SIRT1 подавляется во время дифференцировки hESC на уровне мРНК и белка и что снижение мРНК зависит от CARM1-зависимого метилирования HuR Arg217. Было предположено, что Carm1 помогает поддерживать плюрипотентность mESC путем регуляции метилирования гистонов на промоторах специфичных генов плюрипотентности (25, 26). Кроме того, Wu et al. (26) показали, что онтогенетические факторы избыточно экспрессируются после developmental factors are overexpressed after iCarm1, но они не показали, как гены позитивно регулируются. Поскольку существует некоторое перекрывание iCarm1-избыточно экспрессируемых генов в mESC с теми, чьи промоторы связываются с помощью SIRT1 в hESC (Datasets S4 and S5), то мы пришли к заключению, что наши данные и те, что получены Wu et al. помогают объяснить центральную роль CARM1 в плюрипотентности. Подавление CARM1 может оказывать непосредственный эффект на плюрипотентность, регулируя структуру хроматина, и косвенный эффект путем запуска онтогенетических генов посредством SIRT1 (Fig. 6). Эта гипотеза может объяснить наше наблюдение, что в отличие от iCARM1, сам по себе iSIRT1 не может индуцировать дифференцировку hESC. CARM1 действует как на гены плюрипотентности, так и дифференцировки, а её нокдаун способен понуждать к дифференцировке. Репрессия генов плюрипотентности абсолютно необходима для индукции дифференцировки ES клеток, а в hESC, SIRT1, по-видимому, действует преимущественно на онтогенетические гены.
Поскольку принципиальный механизм, регулировать функцию HuR, как полагают, заключается в изменении его цитоплазматического уровня (17), мы смогли предсказать это как причину снижения ассоциации между HuR и SIRT1 транскриптом. Наши результаты, тем не менее подтвердили, что связывание HuR/SIRT1 мРНК базируется на CARM1-зависимом метилировании HuR, в соответствии с о способностью CARM1 метилировать HuR и увеличивать активность связывания HuR/РНК, обеспечиваемую метилированием HuR по Arg217 (19). HuR регуляция мРНК SIRT1 не является новой находкой; HuR регулирует SIRT1 в раковых клетках (14). Здесь мы показали, что HuR также регулирует SIRT1 во время дифференцировки hESC, это согласуется с известной ролью HuR в миогенной дифференцировке (15), это подтверждает, что HuR регуляция SIRT1 является общим механизмом дифференцировки стволовых клеток. Тем не менее необходимо подчеркнуть, что хотя путь CARM1/HuR, описанный здесь., по-видимому, является основным механизмом подавления мРНК SIRT1 во время дифференцировки hESC, он не один ответственен за контроль SIRT1 в hESC. Более быстрое подавление белка SIRT1, чем мРНК указывает на то, что др. механизмы участвуют в контроле уровней белка SIRT1.
Наши результаты показывают, что элиминация Sirt1 в ES клетках оказывает слабое влияние на экспрессию факторов плюрипотентности и развития. Это наблюдение противоречит предыдущим находкам (27) и указывает на то, что ES клетки млекопитающих обладают избыточными активностями, которые маскируют функцию Sirt1. Наши данные, тем не менее. показали, что подавление SIRT1 необходимо для становления программ правильной специфической дифференцировки во время дифференцировки ESC человека и мыши по двум причинам: (i) SIRT1 соединяется с и эпигенетически регулирует специфические гены развития в плюрипотентных hESC, и (ii) экспрессия
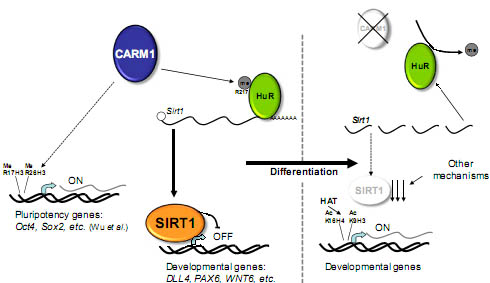 Fig. 6. Model for SIRT1 action on developmental gene promoters during hESC differentiation. As described by Wu et al. (26), Carm1 regulates pluripotency gene promoters by histone methylation in mESC. In pluripotent hESC, CARM1 methylation of HuR increases HuR/SIRT1 binding and, consequently, SIRT1 mRNA stability and the SIRT1 protein level. In these conditions, SIRT1 binds to the promoter and epigenetically represses specific developmental genes such as DLL4, PAX6, and WNT6. During differentiation, the decrease in CARM1 is associated with a decrease in HuR methylation and, consequently, of HuR/SIRT1 binding, resulting in less SIRT1 mRNA and protein and the epigenetic reactivation of developmental genes targeted by SIRT1.
Fig. 6. Model for SIRT1 action on developmental gene promoters during hESC differentiation. As described by Wu et al. (26), Carm1 regulates pluripotency gene promoters by histone methylation in mESC. In pluripotent hESC, CARM1 methylation of HuR increases HuR/SIRT1 binding and, consequently, SIRT1 mRNA stability and the SIRT1 protein level. In these conditions, SIRT1 binds to the promoter and epigenetically represses specific developmental genes such as DLL4, PAX6, and WNT6. During differentiation, the decrease in CARM1 is associated with a decrease in HuR methylation and, consequently, of HuR/SIRT1 binding, resulting in less SIRT1 mRNA and protein and the epigenetic reactivation of developmental genes targeted by SIRT1.
маркеров плюрипотентности и, прежде всего, дифференцировки четко меняется в дифференцирующихся после нокдауна SIRT1 в hESC и в Sirt1 KO/SuperSirt1 mESC. Мы показали. что некоторые нижестоящие эффекты подавления SIRT1 обеспечиваются с помощью эпигенетической реактивации специфических онтогенетических генов, что согласуется с ролью Sirt1 в клеточной дифференцировке в качестве компонента polycomb repressive complex 4 (PRC4) (11). Функция SIRT1по подержанию hESC д. быть более сложной, однако, поскольку её негативная регуляция также ассоциирует с гиперацетилированием p53 hyperacetylation (this study and refs. 9 and 21). Из 10 генов мишеней для SIRT1, отобранных для ChIP оценки, три (
LHX1, PAX6, WNT6) ассоциировали с нейральным развитием (28-30); др. три (
DLL4, TBX3, PAX6) , как полагают, выполняют роль в морфогенезе сетчатки (29, 31). Эти данные подтверждают вклад SIRT1 в детерминацию нейральной судьбы и образование сетчатки во время эмбрионального развития. Эта возможность подтверждается находками, что (i) экспрессия, тестированных нейроэктодермальных маркеров, чётко возрастала во время Sirt1 KO mESC дифференцировки и снижалась во время дифференцировки SuperSirt1 mESC (Fig. 5 and Fig. S4C), (ii) Sirt1 участвует в детерминации судьбы нейральных предшественников (5), и (iii ) Sirt1 KO мыши обнаруживают заметные дефекты сетчатки (8, 9).
Помехи и нокаут Sirt1, соотв., во время дифференцировки ESC человека и мыши, показали. что Sirt1 может также затрагивать экспрессию генов плюрипотентности. Поскольку затрагиваемый ряд генов плюрипотентности значительно меньше, чем онтогенетических генов и эта регулдяция не прямая (поскольку Sirt1 редко соединяется с промоторами генов плюрипотентности в ESC), то роль Sirt1 как потенциального регулятора генов плюрипотентности оказывается неясной. Хотя Sirt1 участвует в поддержании плюрипотентности в стволовых клетках, это не не является крайне необходимым, поскольку Sirt1 KO mESC не дифференцируются спонтанно, Sirt1 KO мыши жизнеспособны (8, 9), а iSIRT1 в клетках Shef-1сам по себе не вызывает дифференцировку (Fig. S3 Dand G). Избыточная экспрессия Sirt1 во время дифференцировки mESC изменяет экспрессию значительно большего количества генов плюрипотентности, чем это вызывает его истощение в ESC человека и мыши, указывая тем самым, что аномально высокие уровни Sirt1 могут оказывать влияние на программы плюрипотентности. Хотя мы обнаружили измененные паттерны экспрессии генов развития и плюрипотентности в SuperSirt1 mESC, эти мыши обнаруживали явные проблемы развития (20). Это расхождение указывает на то,что хотя подавление Sirt1 задерживается во время дифференцировки SuperSirt1 mESC, что проявляется в непосредственных эффектах на экспрессию генов развития и плюрипотентности, это отклонение, по-видимому, компенсируется в течение продолжительного времени.
Итак, наши данные предоставляют доказательства эпигенетического пути в дифференцировке hESC, при этом SIRT1 регулирует дифференцировку hESC, частично посредством CARM1/HuR пути (Fig. 6). Этот путь вовлекает эпигенетическую регуляцию ключевых онтогенетических генов, таких как эффекторы морфогенеза нейральной части сетчатки DLL4, TBX3 и PAX6. В сочетании с фенотипом разных Sirt1-дефицитных линий мышей. наши результаты показали, что в то время, как SIRT1 выполняет минимальную роль в способствовании или импринтировании дифференцировки hESC, она вносит вклад в становление специфических программ развития/дифференцировки, особенно в приобретении нейроэктодермальной судьбы.
Сайт создан в системе
uCoz Fig. 6. Model for SIRT1 action on developmental gene promoters during hESC differentiation. As described by Wu et al. (26), Carm1 regulates pluripotency gene promoters by histone methylation in mESC. In pluripotent hESC, CARM1 methylation of HuR increases HuR/SIRT1 binding and, consequently, SIRT1 mRNA stability and the SIRT1 protein level. In these conditions, SIRT1 binds to the promoter and epigenetically represses specific developmental genes such as DLL4, PAX6, and WNT6. During differentiation, the decrease in CARM1 is associated with a decrease in HuR methylation and, consequently, of HuR/SIRT1 binding, resulting in less SIRT1 mRNA and protein and the epigenetic reactivation of developmental genes targeted by SIRT1.
маркеров плюрипотентности и, прежде всего, дифференцировки четко меняется в дифференцирующихся после нокдауна SIRT1 в hESC и в Sirt1 KO/SuperSirt1 mESC. Мы показали. что некоторые нижестоящие эффекты подавления SIRT1 обеспечиваются с помощью эпигенетической реактивации специфических онтогенетических генов, что согласуется с ролью Sirt1 в клеточной дифференцировке в качестве компонента polycomb repressive complex 4 (PRC4) (11). Функция SIRT1по подержанию hESC д. быть более сложной, однако, поскольку её негативная регуляция также ассоциирует с гиперацетилированием p53 hyperacetylation (this study and refs. 9 and 21). Из 10 генов мишеней для SIRT1, отобранных для ChIP оценки, три (LHX1, PAX6, WNT6) ассоциировали с нейральным развитием (28-30); др. три (DLL4, TBX3, PAX6) , как полагают, выполняют роль в морфогенезе сетчатки (29, 31). Эти данные подтверждают вклад SIRT1 в детерминацию нейральной судьбы и образование сетчатки во время эмбрионального развития. Эта возможность подтверждается находками, что (i) экспрессия, тестированных нейроэктодермальных маркеров, чётко возрастала во время Sirt1 KO mESC дифференцировки и снижалась во время дифференцировки SuperSirt1 mESC (Fig. 5 and Fig. S4C), (ii) Sirt1 участвует в детерминации судьбы нейральных предшественников (5), и (iii ) Sirt1 KO мыши обнаруживают заметные дефекты сетчатки (8, 9).
Fig. 6. Model for SIRT1 action on developmental gene promoters during hESC differentiation. As described by Wu et al. (26), Carm1 regulates pluripotency gene promoters by histone methylation in mESC. In pluripotent hESC, CARM1 methylation of HuR increases HuR/SIRT1 binding and, consequently, SIRT1 mRNA stability and the SIRT1 protein level. In these conditions, SIRT1 binds to the promoter and epigenetically represses specific developmental genes such as DLL4, PAX6, and WNT6. During differentiation, the decrease in CARM1 is associated with a decrease in HuR methylation and, consequently, of HuR/SIRT1 binding, resulting in less SIRT1 mRNA and protein and the epigenetic reactivation of developmental genes targeted by SIRT1.
маркеров плюрипотентности и, прежде всего, дифференцировки четко меняется в дифференцирующихся после нокдауна SIRT1 в hESC и в Sirt1 KO/SuperSirt1 mESC. Мы показали. что некоторые нижестоящие эффекты подавления SIRT1 обеспечиваются с помощью эпигенетической реактивации специфических онтогенетических генов, что согласуется с ролью Sirt1 в клеточной дифференцировке в качестве компонента polycomb repressive complex 4 (PRC4) (11). Функция SIRT1по подержанию hESC д. быть более сложной, однако, поскольку её негативная регуляция также ассоциирует с гиперацетилированием p53 hyperacetylation (this study and refs. 9 and 21). Из 10 генов мишеней для SIRT1, отобранных для ChIP оценки, три (LHX1, PAX6, WNT6) ассоциировали с нейральным развитием (28-30); др. три (DLL4, TBX3, PAX6) , как полагают, выполняют роль в морфогенезе сетчатки (29, 31). Эти данные подтверждают вклад SIRT1 в детерминацию нейральной судьбы и образование сетчатки во время эмбрионального развития. Эта возможность подтверждается находками, что (i) экспрессия, тестированных нейроэктодермальных маркеров, чётко возрастала во время Sirt1 KO mESC дифференцировки и снижалась во время дифференцировки SuperSirt1 mESC (Fig. 5 and Fig. S4C), (ii) Sirt1 участвует в детерминации судьбы нейральных предшественников (5), и (iii ) Sirt1 KO мыши обнаруживают заметные дефекты сетчатки (8, 9).