CXCR7 (RDC1) эволюционно законсервированный 7 раз пронизывающий мембрану G-protein-coupled receptor (GPCR) с мотивами, характерными для хемокиновых рецепторов, такой как DRY мотив. Он экспрессируется в головном мозге, сердце, почках, селезенке, тимусе и различных опухолях и ассоциирует с клетками сосудистого эндотелия (Heesen et al., 1998; Madden et al., 2004; Burns et al., 2006; Miao et al., 2007). CXCR7 соединяется с лигандом CXCL12 (SDF-1) с высоким сродством (Balabanian et al, 2005; Burns et al., 2006), что противоречит мнению, что CXCL12 обладает взаимосвязью только с CXCR4, что было предположено исход из почти идентичных фенотипов нокаутных мышей CXCL12 и CXCR4 (Nagasawa et al., 1996; Ma et al., 1998; Tachibana et al., 1998; Zou et al., 1998). CXCR7 также соединяется с др. хемокином , CXCL11 (I-TAC) (Burns et al., 2006). Однако значение связывания лиганда с CXCR7 неясно, поскольку CXCR7, по-видимому, не передает какие-либо внутриклеточные сигналы, такие как Ca2+ мобилизация или передача сигналов mitogen-activated protein kinase (MAPK), которые являются маркерами активации хемокиновых рецепторов ( Burns et al., 2006; Proost et al., 2007: Bofda-jipour et al., 2008; Hartmann et al., 2008).
Несмотря на отсутствие лигандом обусловленной передачи сигналов , экспрессия и соединение лиганда с CXCR7 имеет важные клеточные и физиологические следствия. Во время CXCR4-обеспечиваемой миграции примордиальных зародышевых клеток (Boldajipour et al., 2008) и зачатка латеральной линии
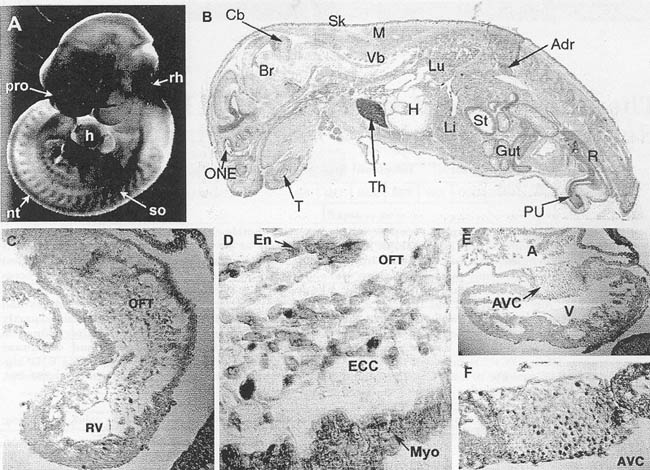 Fig. 1. Expression pattern of Cxcr7 mRNA in developing mouse heart. A: Whole-mount in situ hybridization was carried out with digoxigenin DIGHabeied Cxcr7 nboprobe at E10.5. Cxcr7 mRNA is expressed in the prosencephalon, rhombencephalon, somites, neural tube, ana heart, h. neart; nt, neural tube; pro, prosencephalon: rh, rhomboencephalon; so, somite. B: Section in situ hybridization image of sagittaliy sectioned P1 mouse. CxcrT is expressed in various tissues, including brain, thymus, heart, stomach, and liver. Adr, adrenal gland: Br. brain: Cb, cerebellum; H. heart; Li, liver; Lu, !ung; M, muscle; ONE. optic nerve ending; PU, penile urethra; R, rectum; Sk, skin; St, stomach; T. tooth; Th, thymus; Vb, vertebrae. C-F: Transverse sections made after whole-mount in situ hybridization. Cxcr7 is expressed in endocardial cells and endocardial cushion mesenchymal cells in both outflow tract (OFT) and atrioventricular canal (AVC) regions. Its expression in myocardial ceils is much weaker than that of endocardial ceils. D and F are high-magnification images of OFT and AVC endocardial cushion regions, respectively. En, endocardium; ECC, endocardia! cushion; Myo, myocardium; A, atrium; V, ventricle: RV, right ventricle.
Fig. 1. Expression pattern of Cxcr7 mRNA in developing mouse heart. A: Whole-mount in situ hybridization was carried out with digoxigenin DIGHabeied Cxcr7 nboprobe at E10.5. Cxcr7 mRNA is expressed in the prosencephalon, rhombencephalon, somites, neural tube, ana heart, h. neart; nt, neural tube; pro, prosencephalon: rh, rhomboencephalon; so, somite. B: Section in situ hybridization image of sagittaliy sectioned P1 mouse. CxcrT is expressed in various tissues, including brain, thymus, heart, stomach, and liver. Adr, adrenal gland: Br. brain: Cb, cerebellum; H. heart; Li, liver; Lu, !ung; M, muscle; ONE. optic nerve ending; PU, penile urethra; R, rectum; Sk, skin; St, stomach; T. tooth; Th, thymus; Vb, vertebrae. C-F: Transverse sections made after whole-mount in situ hybridization. Cxcr7 is expressed in endocardial cells and endocardial cushion mesenchymal cells in both outflow tract (OFT) and atrioventricular canal (AVC) regions. Its expression in myocardial ceils is much weaker than that of endocardial ceils. D and F are high-magnification images of OFT and AVC endocardial cushion regions, respectively. En, endocardium; ECC, endocardia! cushion; Myo, myocardium; A, atrium; V, ventricle: RV, right ventricle.
(Dambly-Chaudiere et al., 2007; Valentin et al., 2007) у рыбок данио, OXCR7 создает важный градиент CXCL12 путем секвестрации и интернализации CXCL12. CXCR7 образует гетеродимер с CXCR4 и модулирует определенные аспекты его функции (Sierro et al., 2007; Hartmann et al., 2008: Kalatskaya et al., 2009; Levoye et al., 2009). CXCR7 также важен для CXCR4-обеспечиваемой транс-эндотелиальной миграции опухолевых клеток, но не внутритканевого хемотаксиса (Zabel et al., 2009). В целом, CXCR7 является атипичным хемокиновым рецептором, который не прямо активирует нижестоящие пути, а скорее модифицирует или тонко настраивает активацию CXCR4 в ответ на CXCL12. При определенных условиях, CXCR7 может также обладать CXCR4-независимой функцией, т.к. он способствует выживанию и адгезии клеток даже в отсутствие соединения с лигандом, механизм её неизвестен (Raggo et al., 2005; Burns et al., 2006; Miao et al., 2007).
Морфогенез кардиальных клапанов сложный и деликатный процесс с вовлечением мириада сигнальных событий (Armstrong and Bischoff, 2004). Мы установили, что CXCR7 экспрессируется в развивающемся и во взрослом сердце, особенно в эндокардиальных клетках и их мезенхимных производных. Учитывая комплементарность паттернов экспрессии CXCR4 и CXCL12 в сердце и идентичные фенотипы в результате потери функции у мышей, мы полагаем, что CXCR7 важен для развития сердца. Последствия делеции CXCR7 описаны двумя группами, но фенотипы были отличными, это указывает на его функцию in vivo, как неясную, особенно в отношении эффектов CXCR7 на развитие сердца.
В данном исследовании мы получили Cxcr7 floxed мышей, характеризующихся глобальными и клеточно-специфическими последствиями при полной потери функции Cxcr7 . Полная делеция Cxcr7 приводила к перинатальной гибели из-за увеличенных полулунных клапанов (аортальных и пульмональных) и редких дефектов межжелудочковой перегородки.
Разрушение путей передачи сигналов EGFR у мышей также вызывает гипертрофию кардиальных клапанов из-за повышенной пролиферации на поздней ст. развития клапанов (Chen et al., 2000; Jackson et al., 2003). Имеются доказательства, что передача сигналов EGFR противодействует передаче сигналов BMP (Kretzschmar et al., 1997; Nonaka et al.. 1999; Lo et al., 2001), а уровни pSmad1/5/8 могут быть увеличены в нокаутных Hbegf клапанах (Jackson et al.. 2003), это согласуется со связью между передачей сигналов EGFR и Cxcr7. Активация EGFR противодействует передаче сигналов BMP с помощью фосфорилированных Smad белков в линкерной области, отличной от сайта фосфорилирования с помощью BMP рецептора (Kretzschmar et al.f 1997) или с помощью стабилизации Smad транскрипционного корепрессора TGIF (Lo et al.. 2001). Оба эффекта обеспечиваются с помощью MAPK Erk. В одном исследовании Hbegf мРНК подавлялась в Cxcr7-/- полулунных клапанах, указывая на взаимоотношения между передачей сигналов EGFR и CXCR7 (Sierro et al., 2007). Неясно, как CXCR7 регулирует экспрессию Hbegf. В нашем исследовании воздействие CXCL12, прежде всего, на мезенхимные клетки аортальных клапанов овец, которые экспрессируют Cxcr7, или Cxcr7-трансфицированные COS1 клетки, не активировало передачи сигналов EGFR (data not shown).
Рецептор CXCR7 обладает тем же самым лигандом, CXCL12, что и рецептор CXCR4, но связывание лиганда с CXCR7 не активирует классические хемокиновые пути, такие как мобилизация Ca2+ или передача сигналов MAPK (Burns et al., 2006: Proost et al., 2007; Boldajipour et al., 2008; Hart-mann et al., 2008). Хотя CXCR7 может модулировать функцию CXCR4 посредством секвестрации лиганда или гетеродимеризации (Dambly-Chaudiere et al, 2007; Sierro et al., 2007; Valentin et al., 2007; Boldajipour et al., 2008; Levoye et al.. 2009; Zabel et al., 2009), утолщения полулунных клапанов являются уникальным фенотипом Cxcr7 нокаутных мышей, которые не наблюдаются ни у Cxcr4 ни у Cxcl 12 нокаутных мышей, у которых VSD является основным кардиальным фенотипом. Напротив, утолщение полулунных клапанов вызывается как дефицитом Cxcr7, так и нарушением передачи сигналов EGFR, хотя VSD и верхом сидящая аорта (overriding aorta) уникальны для Cxcr7-/- мышей. Т.о., CXCR7 может влиять на морфогенез полулунных клапанов и межжелудочковой перегородки и созревание OFT посредством двух отдельных механизмов. Было бы интересно протестировать, активирует ли CXCR7 разные пути в мезенхимных клетках подушек, происходящих из эндокарда и нервного гребня. i
Дефекты клапанов находятся среди наболее частых форм врожденных пороков сердца у человека и обычно связанными с аномальным утолщением аортальных и пульмональных клапанов. Эти последствия могут варьировать в пределах от сердечной недостаточности у новорожденных до сердечной гипертрофии в поздней жизни в зависимости от тяжести стеноза. Многочисленные сигнальные пути связаны с образованием клапанов (Armstrong and BischofF, 2004). Нарушение любого из этих путей во время беременности может приводить к фатальным последствиям, подчеркивая воажность выяснения точных механизмов формирования клапанов. Напр., отсутствие Ptpn11, который участвует в сигнальном пути, обеспечиваемом с помощью EGFR, приводит к диспластическим клапанам оттока (Chen et al., 2000). У человека мутации PTPN11, который кодирует белок tyrosine phosphatase Shp-2, вызывает синдром Noonan, характеризующийся стенозом пульмональных клапанов (Tartaglia et al., 2001). Сходным образом мутации NOTCH 1 у человека (Garg et al., 2005) вызывают утолщенные створки аортальных клапанов и могут приводить к стенозу аортальных клапанов в ранней или позденей жизни. Было бы интересно установить, вносит ли CXCR7 или пути, которые его регулируют, вклад в в болезни аортальных и пульмональных клапанов у человека.
Сайт создан в системе
uCoz  Fig. 1. Expression pattern of Cxcr7 mRNA in developing mouse heart. A: Whole-mount in situ hybridization was carried out with digoxigenin DIGHabeied Cxcr7 nboprobe at E10.5. Cxcr7 mRNA is expressed in the prosencephalon, rhombencephalon, somites, neural tube, ana heart, h. neart; nt, neural tube; pro, prosencephalon: rh, rhomboencephalon; so, somite. B: Section in situ hybridization image of sagittaliy sectioned P1 mouse. CxcrT is expressed in various tissues, including brain, thymus, heart, stomach, and liver. Adr, adrenal gland: Br. brain: Cb, cerebellum; H. heart; Li, liver; Lu, !ung; M, muscle; ONE. optic nerve ending; PU, penile urethra; R, rectum; Sk, skin; St, stomach; T. tooth; Th, thymus; Vb, vertebrae. C-F: Transverse sections made after whole-mount in situ hybridization. Cxcr7 is expressed in endocardial cells and endocardial cushion mesenchymal cells in both outflow tract (OFT) and atrioventricular canal (AVC) regions. Its expression in myocardial ceils is much weaker than that of endocardial ceils. D and F are high-magnification images of OFT and AVC endocardial cushion regions, respectively. En, endocardium; ECC, endocardia! cushion; Myo, myocardium; A, atrium; V, ventricle: RV, right ventricle.
(Dambly-Chaudiere et al., 2007; Valentin et al., 2007) у рыбок данио, OXCR7 создает важный градиент CXCL12 путем секвестрации и интернализации CXCL12. CXCR7 образует гетеродимер с CXCR4 и модулирует определенные аспекты его функции (Sierro et al., 2007; Hartmann et al., 2008: Kalatskaya et al., 2009; Levoye et al., 2009). CXCR7 также важен для CXCR4-обеспечиваемой транс-эндотелиальной миграции опухолевых клеток, но не внутритканевого хемотаксиса (Zabel et al., 2009). В целом, CXCR7 является атипичным хемокиновым рецептором, который не прямо активирует нижестоящие пути, а скорее модифицирует или тонко настраивает активацию CXCR4 в ответ на CXCL12. При определенных условиях, CXCR7 может также обладать CXCR4-независимой функцией, т.к. он способствует выживанию и адгезии клеток даже в отсутствие соединения с лигандом, механизм её неизвестен (Raggo et al., 2005; Burns et al., 2006; Miao et al., 2007).
Fig. 1. Expression pattern of Cxcr7 mRNA in developing mouse heart. A: Whole-mount in situ hybridization was carried out with digoxigenin DIGHabeied Cxcr7 nboprobe at E10.5. Cxcr7 mRNA is expressed in the prosencephalon, rhombencephalon, somites, neural tube, ana heart, h. neart; nt, neural tube; pro, prosencephalon: rh, rhomboencephalon; so, somite. B: Section in situ hybridization image of sagittaliy sectioned P1 mouse. CxcrT is expressed in various tissues, including brain, thymus, heart, stomach, and liver. Adr, adrenal gland: Br. brain: Cb, cerebellum; H. heart; Li, liver; Lu, !ung; M, muscle; ONE. optic nerve ending; PU, penile urethra; R, rectum; Sk, skin; St, stomach; T. tooth; Th, thymus; Vb, vertebrae. C-F: Transverse sections made after whole-mount in situ hybridization. Cxcr7 is expressed in endocardial cells and endocardial cushion mesenchymal cells in both outflow tract (OFT) and atrioventricular canal (AVC) regions. Its expression in myocardial ceils is much weaker than that of endocardial ceils. D and F are high-magnification images of OFT and AVC endocardial cushion regions, respectively. En, endocardium; ECC, endocardia! cushion; Myo, myocardium; A, atrium; V, ventricle: RV, right ventricle.
(Dambly-Chaudiere et al., 2007; Valentin et al., 2007) у рыбок данио, OXCR7 создает важный градиент CXCL12 путем секвестрации и интернализации CXCL12. CXCR7 образует гетеродимер с CXCR4 и модулирует определенные аспекты его функции (Sierro et al., 2007; Hartmann et al., 2008: Kalatskaya et al., 2009; Levoye et al., 2009). CXCR7 также важен для CXCR4-обеспечиваемой транс-эндотелиальной миграции опухолевых клеток, но не внутритканевого хемотаксиса (Zabel et al., 2009). В целом, CXCR7 является атипичным хемокиновым рецептором, который не прямо активирует нижестоящие пути, а скорее модифицирует или тонко настраивает активацию CXCR4 в ответ на CXCL12. При определенных условиях, CXCR7 может также обладать CXCR4-независимой функцией, т.к. он способствует выживанию и адгезии клеток даже в отсутствие соединения с лигандом, механизм её неизвестен (Raggo et al., 2005; Burns et al., 2006; Miao et al., 2007).