Посещений:  ГЕМАТОЭЕЦЕФАЛИЧЕСКИЙ БАРЬЕР
ГЕМАТОЭЕЦЕФАЛИЧЕСКИЙ БАРЬЕР
Становление и поддержание. Генетический контроль
|
|
Current concepts of blood-brain barrier development
STEFAN LIEBNER, CATHRIN J. CZUPALLA and HARTWIG WOLBURG
 Int. J. Dev. Biol. 55: 467-476
doi: 10.1387/ijdb.103224sl
|
Homeostasis of the central nervous system (CNS) microenvironment is essential for
its normal function and is maintained by the blood-brain barrier (BBB). The BBB proper is made up of endothelial cells (ECs) interconnected by tight junctions (TJs) that reveal a unique morphology and biochemical composition of the body’s vasculature. In this article, we focus on developmental aspects of the BBB and describe morphological as well as molecular special features of the neurovascular unit (NVU) involved in barrier induction. Recently, we and others identified the Wnt/β-catenin pathway as crucial for brain angiogenesis, TJ and BBB formation. Based on these findings we discuss other pathways and molecular interactions for BBB establishment and maintenance. At the morphological level, our concept favors a major role for polarized astrocytes (ACs) therein. Orthogonal arrays of particles (OAPs) that are the morphological correlate of the water channel protein aquaporin-4 (AQP4) are specifically formed in the membrane of the AC endfoot. The polarized AC endfoot and hence OAPs are dependent on agrin and dystroglycan, of which agrin is a developmentally regulated extracellular matrix (ECM) component. Understanding the mechanisms leading to BBB development will be key to the understanding of barrier maintenance that is crucial for, but frequently disturbed, in the diseased adult brain.
|
Оригинальная находка Paul Ehrlich, что вливание краски не окрашивает ткани головного мозга вместе с дополняющим наблюдением его компаньона Edwin E. Goldmann, что а же самая краска, введенная в спинномозговую жидкость окрашивает исключительно ткани головного мозга, привели к концепции биологического барьера между кровообращением и головным мозгом (for review see Liebner and Engelhardt, 2005). Термин "blood-brain barrier" (гематоэнцефалический барьер) введен Lewandowsky, который наблюдал, что нейротоксические соединения ведут нейрональной клеточной гибели только, если они введены непосредственно в головной мозг, но не после системных инъекций в сосудистую сеть (for review see Liebner and Engelhardt, 2005). Однако клеточные основы барьера между кровью и головным мозгом и между кровью и спинномозговой жидкостью оставались неясными длительное время. Сегодня мы знаем, что у большинства позвоночных BBB располагается внутри эндотелия (эндотелиальный BBB; только у акулообразных BBB локализуется в ACs) и в эпителиальных клетках хороидного сплетения и в tanycytes circumventricular organs (CVOs; глиальный blood-cerebrospinal fluid barrier [BCSFB]) (Abbott et al., 2010). Структуры в основном отвечающие за ограничения и контроль околоклеточного тока между эпителиальными и эндотелиальными клетками были идентифицированы в качестве TJs. Первоначально эти межклеточные контакты исследовали исключительно с помощью морфологических методов, таких как эксперименты по отслеживанию с использованием электрон-плотных трассеров, подобных азотнокислому лантану или пероксидазы хрена, и замораживанием-скалыванием.С середины 1980s шаг за шагом была выявлена молекулярная организация TJs , но сначала в эпителиальных клетках. Сегодня известны многие молекулы, участвующие в формировании, а также регуляции барьерных свойств, но мы далеки от понимания молекулярных взаимодействий, которые представляют трансклеточный барьер. Регуляция эндотелиальных BBB TJs, по-видимому, намного сложнее, чем таковые эпителиальных клеток. В культуре, последние, но не ECs, формируют TJs со всеми морфологическими, молекулярными и физиологическими свойствами, которые известны для их аналогов in vivo. Следовательно, очень важно понять в деталях, как формируются свойства эндотелиального барьера и какие клеточные и молекулярные предпосылки имеются в наличии. Становится очевидным, что плотность BBB не столько "включается" в специфический момент времени во время ангиогенеза в головном мозге, а скорее укрепление барьера происходит в виде постепенного процесса, которые не зависит от сосудистой пролиферации и начинается во время эмбриогенеза, когда ангиогенез ещё не завершен (for review see Liebner and Engelhardt, 2005). С др. стороны, необходимо подчеркнуть, что четкая корреляция между структурой плотных соединений и проницаемостью не продемонстрирована до сих пор (Saunders et al., 2008). Сегодня ясно, что эндотелиальные TJs BBB являются элементами, ответственными за микроусловия в головном мозге сложным способом, который включает окружающую basal lamina (BL), а также "вторую линию обороны", состоящую из pericytes (PCs), ACs и микроглии. Вместе с промежуточными нейронами, осуществляющими случайные контакты с эндотелием, эта уникальная клеточная композиция и определяется как нейроваскулярная единица (NVU) (Fig. 1). Хотя опубликованы сотни и тысячи работ, описывающих BBB, известно лишь немного о сигнальной трансдукции от AC к EC или возможно от EC к AC, чтобы индуцировать и поддерживать барьерные свойства. И это только затрудняет ситуацию созревания и её поддержания. Kim и сотр. убедительно продемонстрировали
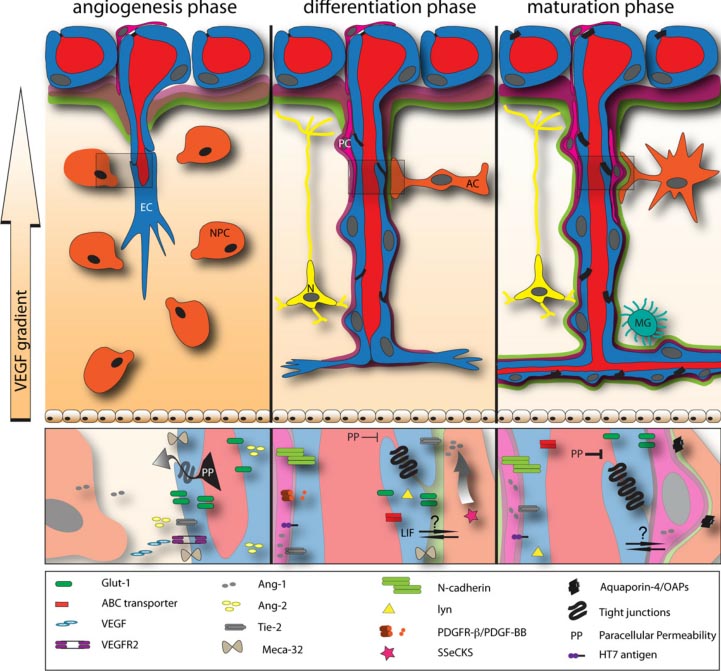 Fig. 1. Differentiation of the Blood-brain barrier (BBB). Angiogenesis phase: Vascular sprouts radially invade the embryonic neuroectoderm towards a concentration gradient of VEGF-A, which is produced by neuroectodermal cells located in the ventricular layer. VEGF-A binds to its endothelial receptor, the receptor tyrosine kinase flk-1/KDR/VEGFR2. The EC specific receptor tyrosine kinase Tie-2 and its ligand Ang-1 are involved in angiogenic sprouting early during embryogenesis. The cerebral ECs show Glut-1 evenly distributed and the MECA-32 antigen is highly expressed, contributing to poor barrier characteristics and high paracellular permeability (PP). Differentiation phase: The phenotype of cerebral ECs changes such that they downregulate expression of the MECA-32 antigen. Glut-1 is now enriched on the abluminal surface of the endothelium. De novo expression of ABC transporters and the nonreceptor tyrosine kinase lyn can be observed. The TJs become complex and thus tight for small polar molecules. Phenotypic changes of ECs are accompanied by their close contact with PCs and astroglial cells. Recruitment of PCs along the differentiating BBB vessels is ensured by several mechanisms. PDGF-BB produced by ECs binds to its receptor PDGFR-b on PCs; N-cadherin enriched at sites of PC-EC contact; Ang-1 expressed by PCs binds to the endothelial receptor tyrosine kinase Tie-2. ECs produce LIF , inducing the maturation of ACs via the LIF-Rb. Furthermore, increased oxygen level and EC-derived PDGF-BB lead to an upregulation of SSeCKS in ACs that in turn upregulates Ang-1. Maturation phase: Despite the fact that the cerebral ECs form the barrier proper, close contact with PCs, ACs and maybe neuronal cells is required for the maintenance of the BBB. The molecular mechanisms involved in this crosstalk required for BBB maintenance in the mature CNS remain unknown to date.
Fig. 1. Differentiation of the Blood-brain barrier (BBB). Angiogenesis phase: Vascular sprouts radially invade the embryonic neuroectoderm towards a concentration gradient of VEGF-A, which is produced by neuroectodermal cells located in the ventricular layer. VEGF-A binds to its endothelial receptor, the receptor tyrosine kinase flk-1/KDR/VEGFR2. The EC specific receptor tyrosine kinase Tie-2 and its ligand Ang-1 are involved in angiogenic sprouting early during embryogenesis. The cerebral ECs show Glut-1 evenly distributed and the MECA-32 antigen is highly expressed, contributing to poor barrier characteristics and high paracellular permeability (PP). Differentiation phase: The phenotype of cerebral ECs changes such that they downregulate expression of the MECA-32 antigen. Glut-1 is now enriched on the abluminal surface of the endothelium. De novo expression of ABC transporters and the nonreceptor tyrosine kinase lyn can be observed. The TJs become complex and thus tight for small polar molecules. Phenotypic changes of ECs are accompanied by their close contact with PCs and astroglial cells. Recruitment of PCs along the differentiating BBB vessels is ensured by several mechanisms. PDGF-BB produced by ECs binds to its receptor PDGFR-b on PCs; N-cadherin enriched at sites of PC-EC contact; Ang-1 expressed by PCs binds to the endothelial receptor tyrosine kinase Tie-2. ECs produce LIF , inducing the maturation of ACs via the LIF-Rb. Furthermore, increased oxygen level and EC-derived PDGF-BB lead to an upregulation of SSeCKS in ACs that in turn upregulates Ang-1. Maturation phase: Despite the fact that the cerebral ECs form the barrier proper, close contact with PCs, ACs and maybe neuronal cells is required for the maintenance of the BBB. The molecular mechanisms involved in this crosstalk required for BBB maintenance in the mature CNS remain unknown to date.
формирование эндотелиальных blood-retina barrier (BRB) TJs, охарактеризовав тесные взаимодействия ECs с PCs и ACs (Kim et al., 2009). Здесь мы сконцентрируемся на развитии BBB, но начнем с описания структуры и функции ECs микрососудов головного мозга в зрелой системе, чтобы иметь основу для рассмотрения более ранних стадий.
Phenotype of the mature blood-brain barrier
BBB сталкивается с конфликтом по защите - с одной стороны - микроусловий ЦНС от токсинов и флюктуаций в составе крови, а - с др. стороны - доставляет энергетические субстраты и питательные вещества для ЦНС. Природа разрешает этот вопрос путем комбинирования барьера с транспортным механизмом. Структуры субклеточного барьера представлены эндотелиальными TJs, тогда как механизмы доставки представлены множеством рецепторов и транспортеров, прежде всего glucose transporter isoform 1 (Glut1). Клетки, отвечающие за установление барьера и за предоставление всех рецепторов транспортеров, являются капиллярные ECs в случае BBB и эпителиальные (глиальные) клетки в случае барьера между кровью и спинномозговой жидкостью.
The epithelial (glial) cells of the blood-cerebrospinal fluid barrier
Эпителиальные (глиальные) клетки, включают эпендимные клетки желудочков головного мозга, эпителиальные клетки хороидного сплетения, tanycytes из околожелудочковых органов, pituicytes из гипоталямическо-гипофизарной системы и пигментные эпителиальные клетки сетчатки. В качестве не нейрональных, нейроэктодермальных клеток они чётко определяются как субтипы глиальных клеток, отвечающих за гомеостаз в ЦНС и формирование BCSFB и внешнего BRB. Эпителиальные клетки хороидного сплетения, tanycytes и пигментные эпителиальные клетки сетчатки поддерживаются с помощью базальной ламины (BL), это отличает их от "нормальных" несущих реснички эпендимных клеток, выстилающих основную часть поверхности желудочков. Апикальная поверхность эпендимных клеток, по крайней мере, у млекопитающих, характеризуется заметными региональными вариациями по всем желудочкам. Эпендимные клетки постоянно несут группы из киноцилий, перемешанных с микроворсинками разной частоты и размеров. Напротив, в эпителиальных клетках хороидного сплетения микроворсинки частые и вытянутые в длину, тогда как одиночные реснички или группы ресничек обнаруживаются редко. На базальном полюсе расширенный базальный лабиринт эпителиальных клеток хороидного сплетения располагается на BL, отделяющей внутреннюю строму соединительной и сильно васкуляризованной ткани. ECs кровеносных сосудов хороидного сплетения постоянно фенестрированы, чтобы обеспечивать высокую проницаемость. Фенестрация, как известно, вызывается vascular endothelial growth factor (VEGF), и являются физиологической основой для способности эндотелиальных клеток хороидного сплетения продуцировать спинномозговую жидкость (CSF) из крови. Чтобы предупредить диффузию приносимых кровью субстанций в желудочки, эпителиальные клетки хороидного сплетения оснащены TJs. Эти TJs являются собственно местом BCSFB (for a recent review on choroid plexus, see Wolburg and Paulus, 2010).
The endothelial cell
Фенотип зрелых BBB капилляров в головном мозге млекопитающих, прежде всего, может быть охарактеризован малой высотой ECs, межэндотелиальными TJs, небольшим количеством ямок на просветной поверхности клеток и большим количеством эндотелиальных митохондрий (for review see Liebner and Engelhardt, 2005). В капиллярном ложе васкулатуры имеется лишь одна BL между EC и AC или PC. ECs прекапиллярных артериол и посткапиллярных венул имеют собственную BL, которая отделена от глиальной базальной пластинки. Пространство между обеими базальными листками наз. периваскулярным пространством и оно является продолжением пространства Virchow-Robin на поверхности головного мозга. TJs в целом представляют контактные зоны между клетками или между частями одной и той же клетки (как это имеет место в BBB ECs), в которых межклеточный зазор закрыт ("Zonula occludens"). На ультратонких срезах TJs распознаются в виде цепочки точек слияний ("kissing") , которые выглядят в репликах замороженных сколов как поперечно перерезанные нити, образующие более или менее сложные сети (Fig. 2 A-C). Сложность сети безусловно коррелирует с проницаемостью, а значит и со стадией развития (Wolburg and Lippoldt, 2002). Используя метод заморозки-сколов, можно наблюдать половинки мембраны в трансмиссионном ЭМ от внутренности клетки, учитывая аспект поверхности наружного скола или E-face, или от внешней стороны клетки, учитывая аспект внутренней или протоплазматической поверхности скола или P-face (Fig. 2 D-I). Относительно BBB EC TJs, они, как было установлено, наиболее сложны из всей сосудистой сети тела. Но также ассоциация частиц с P-face или E-face является параметром, который позволяет оценить качество TJs. BBB TJs являются уникальными среди всех эндотелиальных TJs, учитывая, что их P-face ассоциация является высокой или даже слегка более высокой, чем ассоциация с E-face.
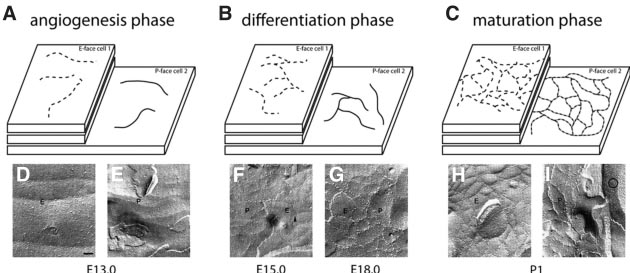 Fig. 2. Development of tight junction morphology in brain endothelial cells. TJ morphology develops in parallel to brain angiogenesis, vessel differentiation and maturation. (A) During the angiogenesis phase (E13.0), only particle-free grooves on the E-face and ridges on the P-face can be observed in freeze fracture preparations. (B) In the differentiation phase (E15.0, E18.0), the network of E- and P-face structures becomes more complex and increasingly filled with particles. (C) The postnatal maturation phase (P1) is characterized by a highly complex network of strands and particle enriched E-face grooves (40% particles) and P-face strands (60% particles). The latter frequently show continuous ridges that may represent residual membrane structures. Note in (I) the astrocyte endfoot appose to the endothelium, revealing high density of OAPs (encircled area).
Fig. 2. Development of tight junction morphology in brain endothelial cells. TJ morphology develops in parallel to brain angiogenesis, vessel differentiation and maturation. (A) During the angiogenesis phase (E13.0), only particle-free grooves on the E-face and ridges on the P-face can be observed in freeze fracture preparations. (B) In the differentiation phase (E15.0, E18.0), the network of E- and P-face structures becomes more complex and increasingly filled with particles. (C) The postnatal maturation phase (P1) is characterized by a highly complex network of strands and particle enriched E-face grooves (40% particles) and P-face strands (60% particles). The latter frequently show continuous ridges that may represent residual membrane structures. Note in (I) the astrocyte endfoot appose to the endothelium, revealing high density of OAPs (encircled area).
Интересно, что в культуре клеток, где отсутствуют специфические для головного мозга микроусловия, морфология замороженных сколов BBB ECs сходна с таковой для non-BBB ECs in vivo (Wolburg and Lippoldt, 2002). Во время развития BBB у крыс P-face ассоциация EC TJs постоянно увеличиваются, указывая, что ассоциация частиц нити с внутренним листком мембраны отражает качество барьера и находится под контролем прирожденных факторов головного мозга (Fig. 2). Молекулярная биология TJs была суммирована в др. работе (reviewed in Wolburg and Lippoldt, 2002). Большинство данных было получено на эпителиальных клетках, возможно из-за того, что регуляция BBB эндотелиальных TJs может быть значительно сложнее, чем та, что в эпителиальных клетках. С одной стороны, большинство молекул TJ, включая каркасные белки, посредники между собственно TJ и цитоскелетом, не были описаны столь подробно для ECs. Короче, после детекции ассоциированных с TJ белков. таких как ZO-1, ZO-2, ZO-3 и cingulin, внутримембранные белки были найдены непосредственно вовлеченными в ограничение проницаемости между эндотелиальными клетками. Первым из найденных белков был occludin, белок с 4 трансмембранными доменами; однако, occludin, по-видимому, не является наиболее важным компонентом TJ , ограничивающим проницаемость, поскольку occludin-дефицитные мутантные мыши жизнеспособны и обнаруживают интактные биологические барьеры. Открытие claudins, нового семейства генов для белков, связанных с TJ, которые также имеют 4 трансмембранных домена, не имеющих гомологии с occludin (for review see Wolburg and Lippoldt, 2002), имело важное значение для исследований TJ. Помимо этого члены сверхсемейства иммуноглобулинов, такие как junctional adhesion molecules (JAMs) и endothelial selective adhesion molecule (ESAM), являются компонентами TJs, которые, по-видимому, выполняют регуляторные функции барьера. Область регуляции TJs с помощью слипчивых соединений подчеркивалось неоднократно (Dejana et al., 2009).
The pericyte
PCs являются интегральным составляющим каждого капилляра с разными частотами в разных сосудистых ложах. На ЭМ уровне PCs могут быть легко распознаны, т.к. полностью окружены с помощью BL. Иммуногистохимически они могут быть мечены антителами против гладкомышечного актина, desmin, high molecular weight melanoma antigen (HMW-MMA, наз. NG2 у мышей), platelet-derived growth factor b-receptor (PDGFR-b), aminopeptidase N или regulator of G-protein signalling-5 (RGS5). В ЦНС и в особенности в сетчатке PCs наиболее обильны. Имеется большое количество исследований роли PCs во время эмбрионального ангиогенеза (see below) и по метаболической взаимозависимости между ECs и PCs, касающейся регуляции кровотока в головном мозге и сетчатке или созревания гематоцефалического и гематоретинальнго барьера (for review see Krueger and Bechmann, 2010). Необходимо отметить, что недавняя работа показала, что PCs играют критическую роль в становлении BBB.
The astrocyte
ACs составляют наиболее многочисленный класс клеток в ЦНС. Упомянем только некоторые функции ACs, они вовлечены в физиологические и биохимические цели, такие как компартментализация нейральной паренхимы, поддержание гомеостаза ионов во внеклеточном пространстве, регуляция pH, поглощение и преобразование нейротрансмиттеров, предоставление богатых энергией субстратов нейронам и в опосредовании сигналов от нейронов к сосудистой сети (for a recent comprehensive review, see Sofroniew and Vinters, 2010). Непосредственное место соединения между нейроглиальным и сосудистым компартментом устанавливается с помощью периваскулярных глиальных синаптических стоп (ножек) (endfeet) в NVU. Поэтому неудивительно, что недавно в литературе эти синаптические ножки (стопы) (endfeet) были отмечены как ключевые checkpoints для метаболизма головного мозга (Wolburg et al., 2009). В нашем контексте особенно важно, что ACs, как полагают, играют решающую роль в поддержании барьерных свойств ECs микрокапилляров головного мозга и в контроле тока крови в мозге (Abbott et al., 2010).
Одним из наиболее впечатляющих морфологических свойств ACs млекопитающих и птиц является полярная гетерогенность мембранных доменов астроцитов. Там, где осуществляются астроглиальные контакты в виде синаптических ножек (стоп) с поверхностной или периваскулярной BL (glia limitans superficialis et perivascularis), глиальная мембрана содержит многочисленные кваджратные массивы или внутримембранные OAPs (Wolburg et al., 2011). Если мембраны глиальных клеток теряют контакты с BL и превращаются в глубокие области нейропиля, то плотность OAPs драматически снижается. Такого типа полярность астроглии, по-видимому, коррелирует с созреванием BBB во время развития. Сегодня становится ясно, что OAPs содержат белки водных каналов AQP4. Поэтому было предпринято исследование роль AQP4 для целостности BBB у нокаутных по AQP4 мышей. Однако данные оказались неоднозначны и современные исследования приводят противоречивые данные (Wolburg et al., 2011).
Aquaporins обеспечивают перемещение воды между внутриклеточным, интерстициальным, васкулярным и вентрикулярным компартментами, это находится под строгим контролем градиентов осмотического и гидростатического давления (for review see Amiry-Moghaddam and Ottersen, 2003). Интересно, что внутренняя ректификация калиевым каналом Kir4.1, K + проводимость,
и dystrophin-dystroglycan complex (DDC) локализуются совместно с AQP4. Dystrophin является каркасным белком, связывающим мембрану и цитоскелет. У dystrophin-дефицитных мышей, Nico с соавт. наблюдали усиление сосудистой проницаемости, потерю некоторых компонентов плотных соединений и снижение экспрессии AQP4 (Nico et al., 2003).
Maintenance of the blood-brain barrier
Как мы видели выше, непосредственное взаимодействие между нейрологическим компартментом и сосудистым компартментом устанавливается с помощью околососудистых глиальных стоп (ножек), формирующих глиальный ограничивающий барьер. Временная корреляция между дифференцировкой астроглии и созреванием BBB во время эмбрионального развития указывает на функциональную роль ACs для установления и/или поддержания BBB. В этом контексте роль agrin для поддержания BBB особенно интересна. Agrin является внеклеточным гепаран сульфат протеогликаном, который первоначально был охарактеризован как важная молекула для образования кластеров ацетилхолиновых рецепторов в моторной концевой пластинке (Bezakova and Ruegg, 2003), но он был также описан как важный внутри ЦНС, особенно для целостности BBB (Berzin et al., 2000). Некоторые сплайс-варианты agrin были охарактеризованы: A0B0 был описан, как специфически присутствующий в BL эндотелиальных клеток капилляров ЦНС, тогда как нейроны экспрессируют изоформы с инсерциями в B сайт сплайсинга (Kroger and Schroder, 2002). Agrin A0B0, если присутствует в первичной культуре AC, то не оказывает влияния на уровень экспрессии AQP4 ни на способность к транспорту воды в гипотонических challenge экспериментах (Noell et al., 2009). Однако, agrin A0B0 был способен индуцировать повышенную инсерцию AQP4 в мембрану культивируемых ACs.
Механизм, с помощью которого agrin участвует в поддержании BBB пока неясен. Agrin может косвенно регулировать распределение AQP4 в глиальной мембране (Wolburg et al., 2009). Он соединяется с a-dystroglycan, который является членом семейства рецепторов "deleted in colorectal cancer" (DCC) (Gee et al., 1994), но не прямо с AQP4. Благодаря тесному соединению между AQP4 и a-dystroglycan, потеря agrin сопровождается перераспределением AQP4 и, наконец, потерей OAPs и OAP-обусловлено полярности. В подтверждение этого наблюдения мы недавно показали, что у новорожденных agrin-нокаутных мышей концевая ножка астроцитов не свободна от AQP4, но свободна от OAPs (Wolburg et al., 2011) , это указывает, что AQP4 может также появляться в non-array форме
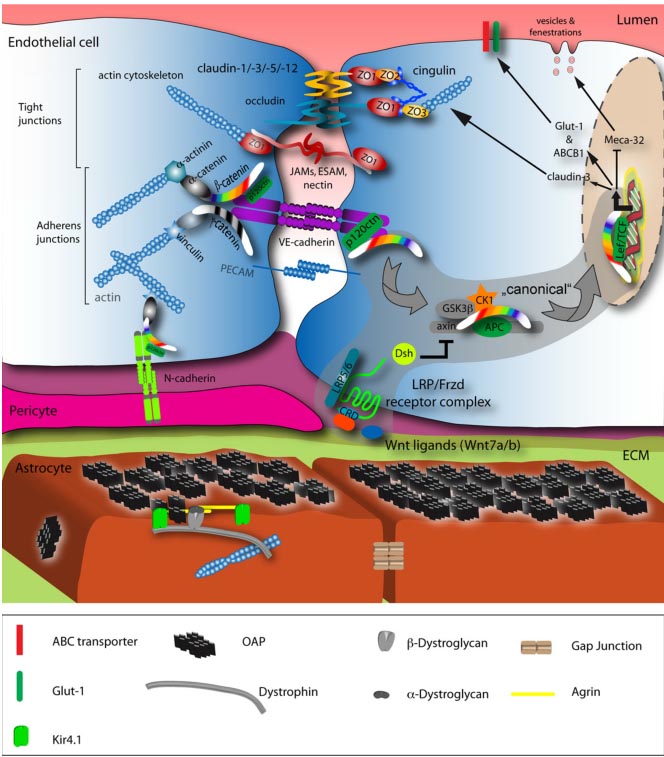 Fig. 3. Molecular organization of the neurovascular unit (NVU) and the role of Wnt signaling in brain endothelial cells (ECs). In the brain and spinal cord mainly Wnt7a and Wnt7b growth factors act on an uncharacterized Fzd-LRP receptor complex to elicit b-catenin target gene transcription. The positively regulated target genes identified so far are the TJ protein claudin-3, Glut-1 and ABCB1/MDR1. Conversely, the expression of Meca-32/Plvap becomes suppressed by b-catenin transcription via an unknown mechanism. See the grey supported area and arrows for the "canonical" Wnt pathway. In the mature BBB, AC endfeet are almost entirely covered by OAPs, formed by AQP4 that can only be visualized in their structure by freeze fracture electron microscopy (right). AQP4 is linked to a-/b-dystroglycan that in turn binds to agrin and Kir4.1. Intracellular, the complex is bound to the actin cytoskeleton via dystrophin.
Fig. 3. Molecular organization of the neurovascular unit (NVU) and the role of Wnt signaling in brain endothelial cells (ECs). In the brain and spinal cord mainly Wnt7a and Wnt7b growth factors act on an uncharacterized Fzd-LRP receptor complex to elicit b-catenin target gene transcription. The positively regulated target genes identified so far are the TJ protein claudin-3, Glut-1 and ABCB1/MDR1. Conversely, the expression of Meca-32/Plvap becomes suppressed by b-catenin transcription via an unknown mechanism. See the grey supported area and arrows for the "canonical" Wnt pathway. In the mature BBB, AC endfeet are almost entirely covered by OAPs, formed by AQP4 that can only be visualized in their structure by freeze fracture electron microscopy (right). AQP4 is linked to a-/b-dystroglycan that in turn binds to agrin and Kir4.1. Intracellular, the complex is bound to the actin cytoskeleton via dystrophin.
Т.о., без всяких исключений все образования BBB в головном мозге взрослых и здоровых млекопитающих ассоциированы с высокой OAP-связанной полярностью концевой ножки околососудистых астроцитов, это, по-видимому, важно для целостности BBB (Fig. 3). В свою очередь, высокая OAP-обусловленная полярность ACs, по-видимому, по крайней мере, частично зависит от присутствия agrin. Др. роль agrin в поддержании BBB связана с проблемой стабильности молекулярного состава BBB эндотелиальных TJs. В глиобластоме человека описаны 4 типа микрососудов, которые характеризуются разными количествами agrin, tenascin, occludin и двух claudins. Если агрин полностью отсутствует, то tenascin экспрессируется на высоком уровне, а TJ молекулы теряются. Однако мы не знаем подробнее, влияет ли агрин непосредственно на состав TJs, или нарушения TJs являются косвенным следствием снижения полярности AC, вызываемым потерей аргина (как объяснено выше).
Development of the brain vasculature
Развитие сосудистой сети головы начинается, когда миграция мезодермальных гемангиобластов приводи к образованию т.наз. кровяных островков, которые, в свою очередь, дифференцируются путем слияния в первичное сосудистое сплетение. Этот процесс обозначается как васкулогенез, de novo формирование кровеносных сосудов. Затем примитивная капиллярная сеть расширяется за счет пролиферации и разрастания, события, обозначаемого как ангиогенез, которое в противовес васкулогенезу вызывает рост новых кровеносных сосудов из предсуществующих (for review see Liebner and Engelhardt, 2005). ЦНС приобретает свою сосудистую сеть исключительно за счет ангиогенеза, процесса связанного с пролиферацией, разрастанием и миграцией EC. Примерно на 9 день эмбриогенеза у грызунов сосуды perineural vascular plexus (PNVP) покрывают весь головной мозг и начинают расти радиально вдоль предварительно сформированной решетки из радиальной глии и предшественников нейральных клеток (NPCs) в нейроэктодермальную ткань, формируя недифференцированную сеть капилляров (Virgintino et al., 1998) (Fig. 1). Эти NPCs дают дифференцированные нейроны и ACs, которые будут динамично общаться с эндотелием головного мозга, чтобы сформировать регуляторные и полностью функциональные NVU (Anthony et al., 2004).
Декаду тому назад васкуляризация ЦНС считалась пассивным событием, управляемым потребностью ткани развивающегося головного мозга в питательных веществах и кислороде. Недавно было показано, что клеточно автономные сигналы, по-видимому, запускают развитие как кровеносных сосудов, так и нейронов (Vasudevan et al., 2008). Кроме того, известно, что васкуляризация головного мозга осуществляется в соответствии с тонко регулируемой пространственной и временной программой, которая достигает кульминационного момента на ранних постнатальных стадиях.
В 1980s W. Risau поставил вопрос, что заставляет ECs врастать в нейроэктодерму. первые паракринные факторы, которые являются , как полагают, основными индукторами врастания эндотелия в нейроэктодерму, были кислый и щелочной факторы роста фибробластов (aFGF, bFGF). Хотя известно, что они являются сильными индукторами ангиогенеза in vivo в целом, оказалось, что паттерн их экспрессии и соотв. их рецепторов не согласуется с пространственно-временным появлением ангиогенного процесса внутри головного мозга (for review see Liebner and Engelhardt, 2005).
Наиболее выдающимся индуктором роста сосудистого эндотелия является VEGF, паракринный фактор, который в частности активирует пролиферацию , выживание и разрастание эндотелия путем соединения со своими рецепторами VEGF receptor 1 (VEGFR1, flt-1) и VEGF receptor 2 (VEGFR2, flk-1, KDR) (Carmeliet, 2005). VEGF играет главную роль в стимуляции ангиогенеза внутри развивающегося головного мозга с помощью ведения ECs вдоль концентрационного градиента от поверхности мягкой мозговой оболочки к слою эпендимных клеток (Fig. 1). Образование и рост сосудов, как было установлено, зависит от разных др. ростовой фактор-рецептор сущностей. таких как angiopoietins (Ang-1, Ang-2) и их общий рецептор Tie2. Система Ang-Tie ответственна за рекрутирование периваскулярных клеток и также участвует в разрастании и ремоделировании сосудов помимо адгезии с ECM (Augustin et al., 2009).
И VEGF и Ang-1 были открыты по экспрессии в двигательных нейронах, расположенных в тесной близи к нейроэктодерме, пронизываемой сосудами, это указывает на вовлечение их в ангиогенное разрастание. Путем ингибирования индукции этих двигательных нейронов у эмбрионов мыши с использованием cyclopamine, ингибитора передачи сигналов sonic hedgehog (Shh), драматически нарушалось разрастание сосудов, демонстрируя, что ангиогенез нервной трубки зависит от передачи сигналов Shh, это, по-видимому, обеспечивается с помощью Ang-1 позитивных двигательных нейронов (Nagase et al., 2005). Также в др. контексте ингибирование Shh приводит к снижению физиологического ангиогенеза в сетчатке и ингибированию патологической васкуляризации (Surace et al., 2006).
Сходным образом platelet derived growth factor B (PDGF-BB), по-видимому, играет определенную роль в рекрутировании PC, т.к. мыши с дефицитом полностью лишены покрытия PC этих сосудов головного мозга. Помимо передачи сигналов PDGF также прямой контакт между PCs и ECs во время ангиогенеза в головном мозге обеспечивается с помощью рецепторов N-cadherin слипчивых соединений (Fig.1 and
3), это, по-видимому, является критическим для собственно роста и стабильности эндотелия. Как упоминалось выше, покрытие PC варьирует среди разных типов сосудов и является наиболее многочисленным в сосудах ЦНС. Напр., соотношение PC к EC в сетчатке 1:1, а в сосудах головного мозга соотношение 1:3 и пропорция 1:100 в сосудах сердечной мышцы (Zlokovic, 2008). Хотя распределение и обилие PC свидетельствует о специфической роли этого типа клеток в BBB, но вплоть до недавнего времени прямых доказательств in vivo не было получено. Armulik et al. (2010), а также Daneman et al. (2010) смогли показать, что нарушение покрытия с помощью PC путем генетического устранения PDGF-BB, приводит к текучести BBB, это однако не связано с нарушениями соединений между эндотелиальными клетками. Это выразительно подчеркивает важность взаимодействия между разными типами клеток для соотв. развития и поддержания кровеносных сосудов головного мозга.
Кроме того, было показано, что гетеродимерный αvβ8-integrin и его лиганд, латентный transforming growth factor β (TGFβ), являются критическими для эмбрионального нейрососудистого развития, т.к. устранение одной из субъединиц интегрина ведет к морфологическим аномалиям структуры сосудов головного мозга и к нейрососудистым нарушениям (Zhu et al., 2002). αvβ8-integrin экспрессируется астроцитами, а не ECs головного мозга, указывая, что паракринные коммуникации ACs и ECs д. способствовать возникновению и поддержке целостности сосудов головного мозга. В самом деле, оказалось, что описываемые нейрососудистые нарушения, включая внутримозговые кровоизлияния и деформации кровеносных сосудов, обусловлены отсутствием обеспечиваемой интегрином активации TGF-β, это, в свою очередь, ингибирует активацию нижестоящих чувствительных к TGF-β генов, напр., plasminogen activator inhibitor-1 (PAI-1) и thrombospondin-1 (TSP-1), которые , как известно, способствуют дифференцировке и стабилизации сосудов (Cambier et al., 2005).
Относительно разрастания сосудов передача сигналов Dll4/Notch1 была идентифицирована в качестве ключевого механизма, координирующего паттерн верхушечных и стебельковых клеток во время ангиогенного разрастания. Phng et al. смогли показать, что Notch-regulated ankyrin repeat protein (Nrarp) действует как молекулярная связка между Notch- и Lef1-зависимой передачей сигналов Wnt в ECs (reviewed in Phng and Gerhardt, 2009). Wnt белки являются секретируемыми гликопротеинами, которые соединяются с N-терминальным cystein-rich domain (CRD) из 7-раз пронизывающего трансмембранных Frizzled (Fzd) рецепторов. β-Catenin является основным компонентом канонического пути передачи сигналов Wnt (Wnt/β-catenin ), в качестве транскрипционного фактора, обеспечивающего регуляцию клеточных реакций, таких как клеточный цикл, апоптоз, дифференцировка и коммуникации клеток (for review see Liebner and Plate, 2010) (Fig. 3). Однако, в противоположность гематопоэтической системе, мало известно о роли передачи сигналов Wnt в ECs и ангиогенеза во время развития, в частности.
Но в последние годы растут доказательства. указывающие на роль пути Wnt в ангиогенезе и сосудистом гомеостазе, принимая во внимание, что некоторые находки in vitro и in vivo показывают, что различные функциональные сосудистые дефекты обусловлены мутациями Wnt и Fzd генов (Zerlin et al., 2008). Так. становится ясно, что канонический путь является критическим для собственно нейрососудистого развития у мышей (Fig. 3). В частности, одновременное устранение ростовых факторов Wnt7a/7b ведет к эмбрионально летальным нейрососудистым фенотипическим отклонениям, т.к. это вызывает специфические для ЦНС кровоизлияния и дезорганизации нервной ткани. Активация канонического пути передачи сигналов Wnt специфична для ЦНС, тогда как она не обнаруживается в периферических тканях, включая сердце, печень и легкие. Кроме того, Wnt/β-catenin путь необходим и достаточен для индукции BBB-типа эндотелиальных TJs in vitro и in vivo на молекулярном и структурном уровне (for review see Liebner and Plate, 2010).
Differentiation of the blood-brain barrier and phenotypic
changes
Во время раннего развития адгезия между ECs и PCs может быть результатом высвобождения хемотактических факторов с помощью ECs, чтобы вызывать миграцию PCs в направлении EC стенки и последующее созревание сосудов за счет увеличения продукции компонентов внеклеточного матрикса, выявляемых действием активированных TGF-β и др. белков (Lai and Kuo, 2005). Среди них PDGF-BB, высокого сродства лиганд для рецепторной тирозин киназы PDGF-Rb, присутствующий на PCs, продуцируется с помощью ECs во время развития. PDGF-BB, как было установлено, участвует в васкуляризации головного мозга, поскольку делеция гена PDGF-BB ведет к потере PC, эндотелиальной гипоплазии, аномальному морфогенезу сосудов и образованию летальных микроаневризм во время позднего эмбриогенеза. Недавно было показано, что делеция C-терминальной части мотива удержания PDGF с помощью генного таргетинга ведет к аномальному использованию PC. Поскольку этот мотив удержания связывает heparansulfate протеогликаны, а изменения синтеза heparansulfate с помощью дефектной N-sulfation, ведет к отсоединению PCs, считается, что heparansulfate важен для передачи сигналов PDGF во время сосудистого развития (reviewed in Gaengel et al., 2009).
Находится ли agrin также среди heparansulfate протеогликанов, модифицирующих передачу сигналов PDGF, пока неизвестно. Как упоминалось выше, активное рекрутирование PC является одним из признаков функциональности BBB, но дифференцировка BBB заключает в себе взаимодействия с дополнительными типами клеток, а именно с ACs. ACs покрывают почти всю поверхность микрокапилляров своими структурами ножек в зрелых NVU. Образование этих конечных ножек является следствием взаимодействия с ECs и в то же самое время ACs посредством структуры endfoot способствуют дифференцировке EC и созреванию BBB (Wolburg et al., 2009).Несмотря на широко принимаемую важность их для образования и поддержания BBB мало известно о молекулярной динамике интимного взаимодействия между ECs и ACs. Однако, Lee с сотр. идентифицировали потенциальный tumor suppressor src-suppressed C-kinase substrate (SSeCKS, произносится "essex", человеческим ортологом является gravin), который активируется в ACs с помощью происходящего из эндотелия PDGF-BB и подавляет в астроцитах экспрессию VEGF (Lee et al., 2003). Более того, SSeCKS заметно усиливает активность Ang-1, известного фактора созревания сосудов, приводя к усилению соединений между эндотелиальными клетками (Fig. 1). С др. стороны, дифференцировка ACs из общих нейроэктодермальных предшественников поддерживается ангиогенным эндотелием, которые высвобождает leukemia inhibitory factor (LIF), который в свою очередь способствует дифференцировке AC. Механически, LIF активирует STAT3 совместно с ретиноевой кислотой (RA) и BMP2, это ведет к экспрессии glial fibrillary acidic protein (GFAP) (Fukushima et al., 2009). Кроме того, Notch путь посредством Notch1-ICD и его нижестоящей мишени Hes5, может индуцировать дифференцировку AC даже более эффективно (Rodriguez-Rivera et al., 2009). Как упоминалось ранее, путь Notch играет фундаментальную роль в ангиогенном разрастании и дифференцировке эндотелия. Notch1, который экспрессируется стебельковыми клетками и активируется с помощью Dll4 в верхушечных клетках, ведет к супрессии ангиогенного фенотипа и, следовательно,к стабилизации сосудов (for review see Phng and Gerhardt, 2009). Можно предположить, что прямой контакт между NPCs и ECs может приводить к активации пути Notch в NPCs и затем к дифференцировке в ACs. Верна ли эта гипотеза, покажет будущее.
Поскольку клеточные компоненты NVU обнаруживаются вместе, барьерные свойства ECs развиваются параллельно. ECs последовательно теряют пузырьки и фенестрации, которые могут быть результатом высоких уровней VEGF-A на ранних эмбриональных стадиях. Более того, ранние TJs, которые не более, чем свободные от частиц борозды на E-face и возвышения на P-face, последовательно приобретают молекулярный состав и морфологию взрослых, характеризующиеся экспрессией claudin-3 и claudin-5 и сложной сетью с P-face ассоциированных частиц (Wolburg et al., 2009) (Fig. 2). Выработка барьерных характеристик в ECs связана с потерей характеристик протекающих сосудов. Это особенно интересно в отношении plasmalemma vesicle associated protein (Plvap или Meca-32) (Hallmann et al., 1995). Хотя Meca-32 также отсутствует в некоторых периферических кровеносных сосудах у взрослых, напр., в сосудах скелетных мышц, его подавление в сосудах головного мозга тонко коррелирует с экспрессией claudin-3 и созреванием барьера (Liebner et al., 2008). Однако, механизм, с помощью которого Meca-32 негативно регулируется, ещё предстоит выяснить.
Дифференцировка барьерного фенотипа представляет собой активацию специфических транспортных систем, упоминаемых выше. Наиболее впечатляет Glut-1, он активируется и преимущественно распределяется на лишенной просвета (ablumenal) мембране в дифференцирующемся BBB эндотелии (Dobrogowska and Vorbrodt, 1999). Однако, как подчеркивают Simpson et al. (2001), метод, с помощью которого было измерено распределение Glut-1 играет решающую роль в предопределении соотношения просвета к отсутствию просвета (Simpson et al., 2001). Более того, др. транспортеры, такие как транспортер transferrin, а также транспортеры различных аминокислот становятся специфически высоко экспрессируемыми в BBB. Отдельный класс BBB-специфических систем транспортеров является семейство транспортеров резистентности ко множественным лекарствам (ATP-binding cassette, ABC) . Эти транспортеры, из которых Mdr1/ABCB1b и ABCG2 экспрессируются наиболее заметно, рассматриваются как вторая линия защиты, отвечающая за очистку от вредных соединений (Abbott et al., 2010). Интересно, что члены P450 oxygenases, и в особенности изоформа Cyp1b1, как полагают, экспрессируется на высоком уровне в ECs BBB (Dauchy et al., 2009). Хотя регуляция и функция Cyp1b1 в BBB пока неясна, она может быть важной для предупреждения проникновения вредных ксенобиотиков в головной мозг посредством метаболизации этих субстанций.
Molecular mechanisms of blood-brain barrier induction
and differentiation
Сегодня клеточная и молекулярная структура BBB описана и многие функциональные аспекты BBB в отношении физиологических, патологических и фармакологических характеристик выяснены. Однако, знание клеточных и молекулярных факторов и путей, которые предопределяют весь спектр BBB-специфических дифференцировок эндотелия,до сих пор известны только поверхностно.
Когда начинается ангиогенез головного мозга, ECs неизбежно приходят в контакт с нейроэктодермальными клетками, подобными нейробластам, и с различными глиальными предшественниками. Недавно было установлено, что уже сосуды в перинейральном сосудистом сплетении мышей на 9.5 день эмбриогенеза получают сигналы от пути Wnt, которые участвуют в индукции BBB (for review see Liebner and Plate, 2010). Анализ BAT-gal репортера у мышей для β-catenin управляемой передачи сигналов Wnt, выявил, что ECs из PNVP, строго экспрессируют LacZ репортерный ген. Следовательно, индукция BBB фенотипа, скорее с помощью передачи сигналов Wnt/β-catenin, происходит параллельно с ангиогенезом в головном мозге в первую очередь в разрастающихся сосудах, когда типы клеток головного мозга ещё не дифференцированы (Fig. 1). В самом деле, Wnt7a/b в качестве идентифицированных физиологических Wnt ростовых факторов, как было установлено, необходимы для ангиогенеза в ЦНС, а также для индукции барьерных свойств с помощью регуляции экспрессии Glut1 (reviewed in Liebner and Plate, 2010). Действительно ли Wnt ростовые факторы экспрессируются постнатальными ACs или др. дифференцированными, нейроэктодермальными типами клеток и обладают ли эти факторы свойствами индукции и поддержания барьера в ECs, является предметом проводимых исследований.
Помимо канонического Wnt пути, орфановый G protein-coupled receptor (GPCR) 124/tumor endothelial marker 5 был недавно идентифицирован в качестве главного регулятора развития ангиогенеза в ЦНС и индукции эндотелиального барьера за счет позитивной регуляции Glut-1. Помимо существенного фенотипического сходства с Wnt7a/b нокаутами, связь или эпистатический эффект GPCR124 с β-catenin не была описана подробно (Kuhnert et al., 2010). Это в дальнейшем было подтверждено публикациями, показавшими, что NPCs обеспечивают BBB-индуцирующими сигналами ECs, которые, однако, активны во время ранней фазы дифференцировки барьера (Weidenfeller et al., 2007). Во время позднего и раннего постнатального развития, когда нейроны и глиальные типы клеток начинают дифференцироваться, качества индуктивных сигналов для BBB могут измениться, это подтверждается находками, что в кондиционированной среде после постнатальных ACs наблюдается задержанный, но более длительный эффект на BBB характеристики в первичных ECs головного мозга (Weidenfeller et al., 2007, and own unpublished results). В самом деле, было продемонстрировано in vivo, что ACs способны индуцировать некоторые BBB-характеристики в сосудах передней камеры глаза, хотя молекулярные характеристики астроцитарных факторов ещё необходимо выяснить (for review see Liebner and Plate, 2010). Общепринято, что окружение в головном мозге достаточно, чтобы индуцировать эндотелиальные барьерные свойства. То, что ECs не обнаруживают предетерминации к BBB-фенотипу было элегантно продемонстрировано с помощью курица-перепел ксенотрансплантаций, причем сосуды из целомической полости эмбрионов кур приобретали BBB характеристики, когда врастали в развивающийся трансплантированный головной мозг перепела (reviewed in Liebner and Engelhardt, 2005).
Помимо нейроэктодермальных клеток также PCs участвуют в индукции барьерных характеристик в ECs. Dente et al. (Dente et al., 2001) и Nakagawa et al. (Nakagawa et al., 2007) сообщили о PCs, вызывающих улучшение барьерных свойств при совместном культивировании с ECs микрососудов. Кроме того, PCs, как было установлено, защищают барьерные свойства в условиях кислородного голодания (Al Ahmad et al., 2009). С др. стороны, Zozulya с коллегами продемонстрировали, что PC кондиционная среда или совместное культивирование PCs с ECs головного мозга свиней увеличивают экспрессию matrix metallo-protease 9 (MMP-9) в ECs, маркера для ангиогенных сосудов (Zozulya et al., 2008). Поэтому transendothelial electrical resistance (TEER) ECs было снижено при совместном культивировании с PC, указывая на снижение барьерных свойств в этих клетках. Сегодня трудно нарисовать чёткую картину роли PCs в индукции и поддержании BBB. В частности, в то время как для постнатальных ACs, а также для PCs молекулярный механизм, в основе этих барьер-модулирующих свойств остается неизвестен.
Помимо Wnt пути, которые, по-видимому, играет основную роль в ангиогенезе в головном мозге и в индукции BBB, др. сигнальные петли могут оказывать влияние, чтобы модулировать барьерные свойства. Некоторые доказательства также подчеркивают роль ECM для нормального развития и поддержания сосудов головного мозга. В частности, laminin a4, по-видимому, является критическим для трансмиграции T лимфоцитов через эндотелий в воспаленный головной мозг (Wu et al., 2009). Дефицитные по Laminin a4 мыши повсеместно усиливают активность laminin a5 вдоль сосудов головного мозга, приводя к заметной инфильтрации T лимфоцитов в паренхиму головного мозга. Laminin a5 непосредственно ингибирует integrin a6b1-обусловленную миграцию T лимфоцитов с помощью laminin a4. Эти данные подчеркивают важность ECM в обеспечении эндотелиальной проницаемости для трансмиграции воспалительных клеток и , следовательно, поддержания BBB.
Активация димерного ростового фактора PDGF-CC с помощью tissue plasminogen activator (tPA), который важен для тромболитического действия ишемического инсульта, вызывает открытие BBB с помощью tPA (Su et al., 2008). PDGF-CC скорее, чем plasminogen был идентифицирован в качестве субстрата для tPA (Su et al., 2008), введение внутрь желудочков tPA или PDGF-CC приводит к увеличению проницаемости BBB, этому можно противодействовать с помощью анти- PDGF-CC антител. Сходным образом, противодействие в астроглии расположенного PDGF рецептора после ишемического инсульта оказывает сравнимые эффекты (Su et al., 2008). Т.о., активация передачи сигналов PDGF с помощью tPA, по-видимому, участвует в ухудшении целостности BBB со всеми известными клиническими осложнениями инсультов.
Outlook
Since its first definition more than 100 years ago by Paul Ehrlich and Edwin Goldmann, the BBB has become a tremendously important functional structure of the vascular tree, which experiences increasing attention from various scientific disciplines. In particular, the development of BBB-passing pharmaceutical compounds for the treatment of neurological diseases is of upmost importance. As Western societies grow continuously older, the probability and incidence of age-related neurological diseases such as Alzheimer’s disease (AD), stroke and brain tumors there is an increasing demand
for the treatment of these plagues. Academic scientists and pharmaceutical companies follow different strategies to address this issue. Beside the possibility to highjack BBB-specific transporters, also the modulation of paracellular barrier properties is one reasonable option. To follow the latter strategy, the profound understanding of the molecular inductive and maintaining mechanisms is crucial. In the last couple of years we made one major step forward in this process, by identifying the canonical Wnt pathway as a brain-specific angiogenic pathway that is key for the early induction of the BBB phenotype in ECs (for review see Liebner and Plate, 2010). Still, many questions remain unanswered as it is not clear by now of which nature the BBB-maintaining signals are, and which cell types are providing them. Furthermore, the Wnt pathway may participate directly or indirectly in the induction of additional barrier related
genes than claudin-3 and Glut-1, which have been identified so far. In particular, active Wnt signaling in brain ECs, may influence the communication between ECs, ACs and PCs in the NVU, and may therefore participate in the formation of this unique and highly
polarized cell-cell interactions.
As we have mentioned above, the heparansulfate proteoglycan agrin may play a decisive role in establishing the polarity of perivascular ACs that in turn may induce and maintain the BBB. The complexity of the regulatory processes at the BBB seems to be as
advanced as the synaptic and even cognitive processes. Presumably, an increase of the BBB permeability is not necessarily an indication of pathological processes (stroke, inflammation, tumor, neurodegenerative diseases), but may rather be a brain-specific capability to access hematogenous factors in the circulation that modulate neural characteristics including turnover of adult neural tem cells. Investigating such processes would create a “vascular neurobiology”. However, at present such subtle regulatory events are not detectable by any non-invasive imaging technique used in the clinical routine. Nevertheless, understanding all the endothelial, glial, pericyte and extracellular components of the BBB that may operate together at certain periods during development or during pathological conditions, will be the greatest challenge in the future of this growing, exciting, interdisciplinary field of research.
|
Сайт создан в системе
uCoz Fig. 1. Differentiation of the Blood-brain barrier (BBB). Angiogenesis phase: Vascular sprouts radially invade the embryonic neuroectoderm towards a concentration gradient of VEGF-A, which is produced by neuroectodermal cells located in the ventricular layer. VEGF-A binds to its endothelial receptor, the receptor tyrosine kinase flk-1/KDR/VEGFR2. The EC specific receptor tyrosine kinase Tie-2 and its ligand Ang-1 are involved in angiogenic sprouting early during embryogenesis. The cerebral ECs show Glut-1 evenly distributed and the MECA-32 antigen is highly expressed, contributing to poor barrier characteristics and high paracellular permeability (PP). Differentiation phase: The phenotype of cerebral ECs changes such that they downregulate expression of the MECA-32 antigen. Glut-1 is now enriched on the abluminal surface of the endothelium. De novo expression of ABC transporters and the nonreceptor tyrosine kinase lyn can be observed. The TJs become complex and thus tight for small polar molecules. Phenotypic changes of ECs are accompanied by their close contact with PCs and astroglial cells. Recruitment of PCs along the differentiating BBB vessels is ensured by several mechanisms. PDGF-BB produced by ECs binds to its receptor PDGFR-b on PCs; N-cadherin enriched at sites of PC-EC contact; Ang-1 expressed by PCs binds to the endothelial receptor tyrosine kinase Tie-2. ECs produce LIF , inducing the maturation of ACs via the LIF-Rb. Furthermore, increased oxygen level and EC-derived PDGF-BB lead to an upregulation of SSeCKS in ACs that in turn upregulates Ang-1. Maturation phase: Despite the fact that the cerebral ECs form the barrier proper, close contact with PCs, ACs and maybe neuronal cells is required for the maintenance of the BBB. The molecular mechanisms involved in this crosstalk required for BBB maintenance in the mature CNS remain unknown to date.
Fig. 1. Differentiation of the Blood-brain barrier (BBB). Angiogenesis phase: Vascular sprouts radially invade the embryonic neuroectoderm towards a concentration gradient of VEGF-A, which is produced by neuroectodermal cells located in the ventricular layer. VEGF-A binds to its endothelial receptor, the receptor tyrosine kinase flk-1/KDR/VEGFR2. The EC specific receptor tyrosine kinase Tie-2 and its ligand Ang-1 are involved in angiogenic sprouting early during embryogenesis. The cerebral ECs show Glut-1 evenly distributed and the MECA-32 antigen is highly expressed, contributing to poor barrier characteristics and high paracellular permeability (PP). Differentiation phase: The phenotype of cerebral ECs changes such that they downregulate expression of the MECA-32 antigen. Glut-1 is now enriched on the abluminal surface of the endothelium. De novo expression of ABC transporters and the nonreceptor tyrosine kinase lyn can be observed. The TJs become complex and thus tight for small polar molecules. Phenotypic changes of ECs are accompanied by their close contact with PCs and astroglial cells. Recruitment of PCs along the differentiating BBB vessels is ensured by several mechanisms. PDGF-BB produced by ECs binds to its receptor PDGFR-b on PCs; N-cadherin enriched at sites of PC-EC contact; Ang-1 expressed by PCs binds to the endothelial receptor tyrosine kinase Tie-2. ECs produce LIF , inducing the maturation of ACs via the LIF-Rb. Furthermore, increased oxygen level and EC-derived PDGF-BB lead to an upregulation of SSeCKS in ACs that in turn upregulates Ang-1. Maturation phase: Despite the fact that the cerebral ECs form the barrier proper, close contact with PCs, ACs and maybe neuronal cells is required for the maintenance of the BBB. The molecular mechanisms involved in this crosstalk required for BBB maintenance in the mature CNS remain unknown to date.  Fig. 2. Development of tight junction morphology in brain endothelial cells. TJ morphology develops in parallel to brain angiogenesis, vessel differentiation and maturation. (A) During the angiogenesis phase (E13.0), only particle-free grooves on the E-face and ridges on the P-face can be observed in freeze fracture preparations. (B) In the differentiation phase (E15.0, E18.0), the network of E- and P-face structures becomes more complex and increasingly filled with particles. (C) The postnatal maturation phase (P1) is characterized by a highly complex network of strands and particle enriched E-face grooves (40% particles) and P-face strands (60% particles). The latter frequently show continuous ridges that may represent residual membrane structures. Note in (I) the astrocyte endfoot appose to the endothelium, revealing high density of OAPs (encircled area).
Fig. 2. Development of tight junction morphology in brain endothelial cells. TJ morphology develops in parallel to brain angiogenesis, vessel differentiation and maturation. (A) During the angiogenesis phase (E13.0), only particle-free grooves on the E-face and ridges on the P-face can be observed in freeze fracture preparations. (B) In the differentiation phase (E15.0, E18.0), the network of E- and P-face structures becomes more complex and increasingly filled with particles. (C) The postnatal maturation phase (P1) is characterized by a highly complex network of strands and particle enriched E-face grooves (40% particles) and P-face strands (60% particles). The latter frequently show continuous ridges that may represent residual membrane structures. Note in (I) the astrocyte endfoot appose to the endothelium, revealing high density of OAPs (encircled area).  Fig. 3. Molecular organization of the neurovascular unit (NVU) and the role of Wnt signaling in brain endothelial cells (ECs). In the brain and spinal cord mainly Wnt7a and Wnt7b growth factors act on an uncharacterized Fzd-LRP receptor complex to elicit b-catenin target gene transcription. The positively regulated target genes identified so far are the TJ protein claudin-3, Glut-1 and ABCB1/MDR1. Conversely, the expression of Meca-32/Plvap becomes suppressed by b-catenin transcription via an unknown mechanism. See the grey supported area and arrows for the "canonical" Wnt pathway. In the mature BBB, AC endfeet are almost entirely covered by OAPs, formed by AQP4 that can only be visualized in their structure by freeze fracture electron microscopy (right). AQP4 is linked to a-/b-dystroglycan that in turn binds to agrin and Kir4.1. Intracellular, the complex is bound to the actin cytoskeleton via dystrophin.
Fig. 3. Molecular organization of the neurovascular unit (NVU) and the role of Wnt signaling in brain endothelial cells (ECs). In the brain and spinal cord mainly Wnt7a and Wnt7b growth factors act on an uncharacterized Fzd-LRP receptor complex to elicit b-catenin target gene transcription. The positively regulated target genes identified so far are the TJ protein claudin-3, Glut-1 and ABCB1/MDR1. Conversely, the expression of Meca-32/Plvap becomes suppressed by b-catenin transcription via an unknown mechanism. See the grey supported area and arrows for the "canonical" Wnt pathway. In the mature BBB, AC endfeet are almost entirely covered by OAPs, formed by AQP4 that can only be visualized in their structure by freeze fracture electron microscopy (right). AQP4 is linked to a-/b-dystroglycan that in turn binds to agrin and Kir4.1. Intracellular, the complex is bound to the actin cytoskeleton via dystrophin.