Посещений:  ДЕФИНИТИВНАЯ ЭНТОДЕРМА
ДЕФИНИТИВНАЯ ЭНТОДЕРМА
Дифференцировка из эмбриональных стволовых клеток
|
|
Signaling pathways during maintenance and definitive
endoderm differentiation of embryonic stem cells
LINA SUI, LUC BOUWENS and JOSUE K. MFOPOU
 Int. J. Dev. Biol. 57: 1-12 (2013)
doi: 10.1387/ijdb.120115ls
|
ABSTRACT Embryonic stem cells (ESCs) have the potential to be used as unlimited resources for tissue replacement therapy, thereby compensating for organ donor shortage. To reach this goal, the molecular principles governing early differentiation events in the developing embryo need to be addressed, understood and properly implemented in vitro. Studies carried out in several vertebrate models have established that Nodal/Activin A, BMP , WNT and FGF signaling pathways regulate early embryo development and that these pathways are similarly used during germ layer formation by cultured ESCs. However, differences have also been identified in the way these pathways function or interact in mouse vs. human ESCs, making it sometimes difficult to extrapolate findings from one system to the other. In this review, we discuss and compare the role of the relevant signaling pathways and their crosstalk during undifferentiated growth and during the endoderm differentiation of mouse and human ESCs.
|
Мышиные эмбриональные стволовые клетки (mESCs) впервые были выделены в 1981 и происходили из inner cell mass (ICM) эмбрионов на ст. предимплантации бластоциста (Evans and Kaufman, 1981, Martin, 1981). Они оказались способны к самообновлению и дифференцировке в любой тип соматических клеток в культуре или после трансплантации in vivo. Относительно этих свойств эмбриональные стволовые клетки человека (hESCs) (Thomson et al., 1998) были способны непосредственно отвечать на усилия дифференцировать их в определенный тип клеток, такой как нейроны (Cho et al., 2008, Di Giorgio et al., 2008, Mueller et al., 2005, Nat and Dechant, 2011), кардиомиоциты (Laflamme et al., 2007, Mummery et al., 2007, Parsons et al., 2011, Xu et al., 2009), гепатоциты (Agarwal et al., 2008, Hay et al., 2008, Touboul et al., 2010) и панкреатические эндокринные клетки (Assady et al., 2001, Cai et al., 2010, D'Amour et al., 2006, Jiang et al., 2007a, Jiang et al., 2007b, Johannesson et al., 2009, Kroon et al., 2008, Mfopou et al., 2010a, Xu et al., 2011, Zhang et al., 2009) в предположении будущего их использования для замещения нефункциональных или отсутствующих клеток при болезни. ESCs не только использовали как потенциальный инструмент для замещения клеток, моделирования болезни, открытия и тестирования токсичности лекарств; они также служили в качестве модели для понимания молекулярных механизмов формирования зародышевых слоёв во время раннего развития, жизненно важный процесс, который в дальнейшем предопределяет онтогенез орган-специфических клеток. Три зародышевых слоя, а именно, энтодерма, мезодерма и эктодерма, специфицируются во время гаструляции в развивающемся эмбрионе, закладывая при этом маркеры будущих тканей и органов. Сходным образом, спецификация эквивалентов этих зародышевых слоёв in vitro, по-видимому, одно из первых и чрезвычайно важных событий, необходимое во время дифференцировки ESC для генерации желаемых типов клеток. Относительно энтодермы, был идентифицирован ряд сигнальных путей, которые контролируют их дифференцировку у низших и высших позвоночных, включая Nodal/Activin A, BMP, WNT и FGF (Hansson et al., 2009, McLean et al., 2007, Morrison et al., 2008, Poulain et al., 2006, Rodaway et al., 1999, Rossant, 2008, Slack, 1994, Sumi et al., 2008, Vallier et al., 2009b, Xu et al., 2011, Zhang et al., 2008, Zheng et al., 2010). Хотя вклад этих путей законсервирован у многих видов, их характерные функции (индуктивные или репрессивные) и их временная активность могут варьировать существенно, объясняя частично контрастирующие находки, которые были описаны, напр., между mESCs и hESCs.
The signaling pathways maintaining undifferentiated
ESCs status
Мышиные или человеческие ESCs в основном охарактеризованы благодаря их способности производить множественные копии самих себя в течение длинных периодов культивирования (самообновление) и генерировать клетки, относящиеся к трем зародышевым слоям после дифференцировки (плюрипотентность). Эти важные свойства mESCs и hESCs (Rossant, 2008, Vallier et al., 2009b) действительно находятся под контролем сигнальных путей, которые отличаются у двух видов. Недифференцированные mESCs в основном поддерживаются под контролем передачи сигналов LIF и BMP (Chambers and Smith, 2004, Williams et al., 1988, Ying et al., 2003a), тогда как hESCs нуждаются в передаче сигналов Activin и FGF, чтобы поддерживать в течение длительного времени самообновление и плюрипотентность (Ding et al., 2010, Vallier et al., 2005, Xiao et al., 2006). Однако, эти сигнальные пути конвергируют в направлении активации основной транскрипционной сети, поддерживая самообновление, которое одинаково в обеих системах и использует Oct4, Nanog и Sox2 (Schnerch et al., 2010) (Fig.1). Расхождения, наблюдаемые между mESCs и hESCs в отношении их потребностей для недифференцированного роста не могут быть объяснены только видовыми отличиями, по большей части они объясняются разным онтогенетическим происхождением этих плюрипотентных клеток. hESCs возникают на более поздней стадии, чем mESCs, в тот момент, когда инициируется дифференцировка эпибласта. Возможно, что происхождение плюрипотентных стволовых клеток из ICM клеток мыши облегчается за счет
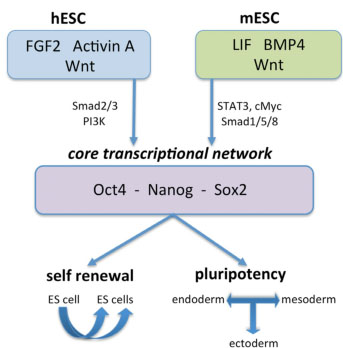 Fig. 1. Schematic representation of the differences in signaling path-
ways regulating self-renewal and pluripotency of human and mouse
ESCs. Undifferentiated mESCs are mainly maintained under the control
of LIF and BMP signaling, whereas hESCs are in need of Activin and FGF
signaling to sustain long-term self-renewal and pluripotency. The Wnt
signaling also plays a role in self-renewal of hESCs and mESCs, but its
underlying mechanism is still to be addressed. These signaling pathways
in both systems converge towards the activation of a core transcriptional
network that involves Oct4, Nanog and Sox2.
Fig. 1. Schematic representation of the differences in signaling path-
ways regulating self-renewal and pluripotency of human and mouse
ESCs. Undifferentiated mESCs are mainly maintained under the control
of LIF and BMP signaling, whereas hESCs are in need of Activin and FGF
signaling to sustain long-term self-renewal and pluripotency. The Wnt
signaling also plays a role in self-renewal of hESCs and mESCs, but its
underlying mechanism is still to be addressed. These signaling pathways
in both systems converge towards the activation of a core transcriptional
network that involves Oct4, Nanog and Sox2.
задержки имплантации или эмбриональной диапаузы (Hondo and Stewart,
2005, Lopes et al., 2004, Renfree and Shaw, 2000), которая существует у этого вида, но отсутствует у эмбрионов человека. Интересно, что плюрипотентные клетки происходили также от постимплантационных эмбрионов мышей и крыс и обнаруживали сходные с hESCs и эпибластом экспрессию генов и паттерны сигнальных реакций (Brons et al., 2007,
Tesar et al., 2007). Помимо общих сигнальных путей для самообновления с hESCs, epiblast stem cells (EpiSCs) обладают также сходными культуральными характеристиками, включая потребность в прохождении через глыбки, низкую клональную способность и пониженную эффективность образования химер. Следовательно, мышиный и крысиные EpiSCs являются точными онтогенетическими аналогами hESCs и могут рассматриваться как "primed", в противоположность mESCs, которые являются "naive" плюрипотентным состоянием (Nichols et al., 2009). Принимая во внимание легкость манипуляций и стабильность фенотипа "naive" плюрипотентных клеток в культуре, современные исследования проводятся на таких клетках из ранних эмбрионов человека (до стадии эпибласта), а также по превращению современных линий hESCs в "naive" состояние(Gu
et al., 2012, Hanna et al., 2010, Zhou et al., 2010).
Self-renewal and pluripotency in mESCs
mESCs первоначально были выделены из ICM ранних бластоцистов мыши и поддерживались на митотически инактивированных мышиных эмбриональных фибробластах (питающий слой), которые вносили вклад путем секреции анти-дифференционных цитокинов, таких как BMP4 и LIF (Martin, 1981, Qi et al., 2004). LIF рецептор, но не лиганд, обычно экспрессируется клетками ICM и участвует в поддержании плюрипотентности у эмбрионов мыши (Nichols et al., 1996). Интересно, что экзогенный LIF в комбинации с сывороткой или BMP4 поддерживает самообновление6 в культуре mESCs, лишенной питающего слоя. В подобном окружении и одинаково с его функцией во время гаструляции, BMP4/SMAD путь репрессирует обычную в таком случае нейральную дифференцировку (Di-Gregorio et al., 2007), тогда как в отсутствие LIF он генерирует униформные слои плоских клеток (Kunath et al., 2007, Ying et al., 2003a). Итак, LIF и BMP4 могут репрессировать события дифференцировки, запускаемые с помощью аутокринного FGF4-обусловленного ERK фосфорилирования. Эта гипотеза привела к открытию, что ингибирование FGF (с помощью SU5402 и PD184352) в комбинации с ингибированием GSK3 с помощью CHIR99021 поддерживает плюрипотентность в условиях, лишенных сыворотки и питающего слоя (Ying et al., 2008). Эти последние находки согласуются с предыдущими наблюдениями, что ингибирование FGF/MAPK улучшает самообновление mESCs (Burdon et al., 1999, Burdon et al., 2002, Kunath et al., 2007). Помимо LIF и BMP4, WNT лиганды, экспрессируемые mESCs и с помощью питающих клеток также являются критическими для предупреждения дифференцировки mESCs, но подобно стимуляции WNT путем ингибирования GSK3, точный способ действия всё ещё предмет споров (Sato et al., 2004, ten Berge et al., 2011, Wray et al., 2011, Ying et al., 2008). В самом деле, ICM клетки также экспрессируют небольшие количества WNT лигандов и их секретируемых антагонистов, подтверждая, что этот путь играет роль в предимплантационном развитии (Kemp
et al., 2007).
Self-renewal and pluripotency in hESCs
hESCs, возникающие на ст. бластоциста в эмбрионах человека; они обнаруживают активированными пути Nodal/Activin, FGF и WNT и обладают потенциалом долговременного поддержания в недифференцированном состоянии и генерации производных трех зародышевых слоёв (Sato et al., 2004, Thomson et al., 1998, Xiao et al., 2006). Подобно LIF в mESCs, Activin A достаточен и необходим для поддержания плюрипотентности hESC в долговременной культуре с 20% serum replacer (KSR), который вносит вклад на ряду с др. за счет активации PI3K пути (Li et al., 2007, McLean et al., 2007, Xiao et al., 2006), и отменяет функцию передачи сигналов Nodal в поддержании недифференцированного состояния эпибласта (Camus et al., 2006, Granier et al., 2011, Mesnard et al., 2006). Напротив, Activin A не поддерживает плюрипотентности в chemically defined medium (CDM), указывая тем самым, что и Activin A и активированный PI3K важны для недифференцированных hESCs (Vallier et al., 2005).
Передача сигналов FGF является критической для эмбрионального развития, что выявляется по пери-имплантационной гибели некоторых мутантов и по экспрессии FGF4 в эпибласте (rev. (Lanner and Rossant, 2010)). FGFs высвобождаются hESCs и также участвуют в поддержании их плюрипотентности за счет внутриклеточной активации нижестоящих путей PI3K/AKT и/или MAPK/ERK. Напротив, ингибитор FGF рецептора SU5402 вызывает дифференцировку hESC, тогда как активный PI3K/AKT блокирует дифференцировку энтодермы, вызываемую с помощью Activin A (Armstrong et al., 2006, Ding et al., 2010, Dvorak et al., 2005, Li et al., 2007, McLean et al., 2007). Поскольку исследование молекулярных механизмов FGF-обусловленного поддержания hESC, позволило предположить, что MAPK/ERK необходим для плюрипотентности (Dvorak et al., 2005, Li et al., 2007); , однако, исследование Ding et al., показало, что активированный PI3K скорее, чем MAPK, обеспечивает плюрипотентность hESCs (Ding et al., 2010). Эти расхождения могут возникать в экспериментальных моделях, принимая во внимание, что FGF2 голодание может длиться или 12 ч или 5 дней (Ding et al., 2010, Li et al., 2007). Поскольку ни FGF ни Activin A в отдельности недостаточны, чтобы поддержать плюрипотентность в условиях отсутствия питающего слоя (Vallier et al., 2005), то взаимодействие между сигнальными путями, скорее всего, оперативное и регулирует рост недифференцированных hESCs. Напр., добавление Activin A и FGF2 в комбинации с ингибированием ERK1/2 делает возможным самообновление hESC в CDM на collagen I, покрывающем поверхность (Na et al., 2010). В этой системе отсутствие BMP4-подобных сигналов (usually present in KSR) и ингибирование фосфорилирования ERK исключают спонтанную дифференцировку в направлении мезэнтодермальной и нейральной судеб. Это д. указывать на то, что "базовое состояние" (Ying et al., 2008) также существует для hESCs и потребности в нем ещё предстоит распутать in vitro.
Как упоминалось выше в отношении mESCs, активная передача сигналов WNT вносит вклад в поддержание плюрипотентности во время культивирования hESC (Sato et al., 2004, ten Berge et al., 2011). FGF2 может вызывать фосфорилирование GSK3b (нижестоящей мишени для PI3K), активируя тем самым путь WNT в hESCs. Однако, WNT постепенно теряет свою способность поддерживать недифференцированные hESCs в долговременной культуре, указывая тем самым, что он не является фактором, противодействующим дифференцировке (Ding et al.,
TABLE 1
GROWTH FACTORS REQUIRED FOR SELF-RENEWAL
IN PLURIPOTENT STEM CELLS DERIVED FROM THE EMBRYO
2010, Dravid et al., 2005). Хотя некоторые исследования идентифицировали специфические пути, которые регулируют плюрипотентность в развивающихся эмбрионах и в ESCs и прокладывают путь для разработки "оптимальных средств" для недифференцированного роста in vitro (Table 1), но взаимодействия между этими путями всё ещё необходимы для четкого понимания обеих систем, это также может служить оправданием культур высокого качества стволовых клеток за счет ограничения спонтанной дифференцировки и хромосомных аномалий.
The signaling pathways in endoderm specification
from ESCs
Изучение онтогенетических моделей, таких как рыбки данио и мыши, первоначально были нацелены на существование временного зародышевого слоя, названного мезэнтодермой, которая присутствует во время ранней гаструляции и является бипотенциальной в отношении энтодермы и мезодермы (Lawson et al., 1991, Rodaway and Patient, 2001, Rodaway et al., 1999). Присутствие такого промежуточного зародышевого слоя также подтверждено и его характеристики определены во время дифференцировки in vitro mESCs и hESCs (Tada et al., 2005). Интересно, что некоторые сигналы, участвующие в дифференцировке mESCs и hESCs в примитивную полоску (PS), мезэнтодерму и затем далее в энтодерму или мезодерму, законсервированы (Table 2). Следовательно, несмотря на значительные различия в поддержании между mESCs и hESCs, сходные пути контролируют дифференцировку в определенные зародышевые слои. Это д. вносить ценный вклад в дифференцировку in vitro и д. помочь в преодолении межвидовых границ с помощью хорошо разработанного универсального протокола дифференцировки. Однако, это не всегда происходит на практике. Несмотря на это недавнее открытие недостаточно доступных данных о дифференцировке EpiSCs в дефинитивную энтодерму.
Definitive endoderm differentiation in mESCs
Nodal/Activin A pathway
Образование PS является важной ступенью перед генерацией производных энтодермы и мезодермы in vivo. Передача сигналов Nodal/Activin A является критической для индукции образования PS, принимая во внимание, что эта структура отсутствует у Nodal-/- мутантных эмбрионов мышей (Conlon et al., 1994, Zhou et al., 1993). In vitro, Nodal/Activin A индуцирует переднюю и заднюю часть PS зависимым от концентрации способом как в слипчивых культурах ESCs (Hansson et al., 2009, Tada et al., 2005, Yasunaga et al., 2005) так и в эмбриоидных телах (EBs), поддерживаемых в суспензии (Gadue et al., 2006, Kubo et al., 2004).
Напр., высокая концентрация Activin A (10-100ng/ml) способствует образованию передней части PS и в дальнейшем дает DE, если сохраняется стимуляция. Напротив, низкая концентрация (1-3ng/ml) в основном специфицирует заднюю часть PS и затем заднюю мезодерму. Хотя это общий принцип приложим к слипчивым и суспензионным культурам и согласуется с функцией Nodal/Activin A в эмбриональном развитии (Schier, 2003, Tam et al., 2003), экспрессия Gsc (маркер мезодермы и DE) индуцируемая высокой дозой Activin A ниже в EBs или в сыворотке по сравнению с клетками, культивируемыми в монослое без сыворотки (Tada et al., 2005). Однако индукция в монослое DE в отсутствие сыворотки сильно ограничивается из-за очень плохой жизнеспособности клеток ((Morrison et al., 2008) and our personal observations). Это расхождение указывает на то, что присутствуют ещё не установленные факторы в сыворотке, а также что клеточная архитектура, формируемая в EB, играет жизненно важную роль в формировании мезодермы и DE из mESCs вследствие индукции Activin A, преимущественно за счет предоставления сигналов выживания.
BMP pathway
Подобно Nodal/Activin A, BMP также относится к сверхсемейству TGF-beta
факторов роста и дифференцировки. Он блокирует произвольную нейральную дифференцировку и поддерживает недифференцированное состояние mESCs одновременно с LIF. В отсутствие LIF, BMP4 возвращает себе способность индуцировать дифференцировку mESCs, и его эффект варьирует в зависимости от пространственной организации клеток. В слипчивых культурах BMP4 индуцирует эквиваленты поверхностной эктодермы (Kunath et al., 2007, Ying et al., 2003a) а также трофобласт-подобные клетки (Hayashi et al., 2010); последние, как полагают, не развиваются из культур mESCs (Beddington and Robertson, 1989). Более того, добавление BMP4 к культурам EBs ведет к образованию задней части PS и мезодермальных клеток (Nostro et al., 2008, Pearson et al., 2008), это указывает на его вовлечение в дифференцировку мезодермы во время гаструляции (Hogan, 1996, Wells and Melton, 1999). Это подтверждает, что BMP4 в первую очередь индуктор PS-подобной популяции, экспрессирующей T (Brachyury) и Mixl1 (Fujiwara et al., 2001), и объясняет индукцию при добавлении его в комбинации с Activin A на ранней стадии DE из mESCs (Morrison et al., 2008).
WNT pathway
Помимо передачи сигналов Nodal/Activin A путь WNT также важен для дифференцировки PS, которая отсутствует у WNT-/- мутантных эмбрионов мыши (Barrow et al., 2007, Liu et al., 1999). In vitro в бессывороточной среде передача сигналов WNT индуцирует популяцию задней части PS как в монослойных культурах из mESCs, так и в EBs (Gadue et al., 2006, Nakanishi et al., 2009). Комбинация WNT и Activin A улучшает индукцию DE, как показывает экспрессия Sox17, но этот эффект минимален, если WNT добавляется после инициации дифференцировки DE (Hansson et al., 2009). Соотв., ингибирование WNT с помощью Dkk1 уменьшает образование PS и DE в присутствие Activin A , на что указывает низкая экспрессия Mixl1 и Sox17 (Hansson et al., 2009). Эти данные согласуются с находками in vivo, что передача сигналов WNT, сходная с таковой BMP4, необходима для формирования PS, но не является индуктором переднего клона (Kemp et al., 2007).
FGF pathway
Передача сигналов FGF контролирует переход mESCs от плюрипотентности к детерминации клонов, а блокада этого пути ведет к поддержанию экспрессии маркеров плюрипотентности (Burdon et al., 1999, Kunath et al., 2007, Lanner and Rossant, 2010). Активация пути MAPK/ERK1/2, индуцируемая передачей сигналов FGF, необходима для нейральной спецификации mESCs в течение короткого временного периода, это объясняет, почему это рассматривается как самопроизвольный выбор судьбы спонтанно дифференцирующихся mESCs (Stavridis et al., 2007). Помимо этой роли на эктодермальные клоны, передача сигналов FGF из аутокринного или паракринного источников участвует также в приобретении мезодермальной судьбы (Ciruna and Rossant, 2001, Kunath et al., 2007). Однако добавление в культуры mESCs FGF лигандов не индуцирует образование PS и мезодермы в отсутствие передачи сигналов TGF-beta или Wnt (Zheng et al., 2010). Итак, вклад сигналов FGF в дифференцировку DE не прямой как в случае Activin A, но оказывается интегрированным в сигнальную сеть, построенную из
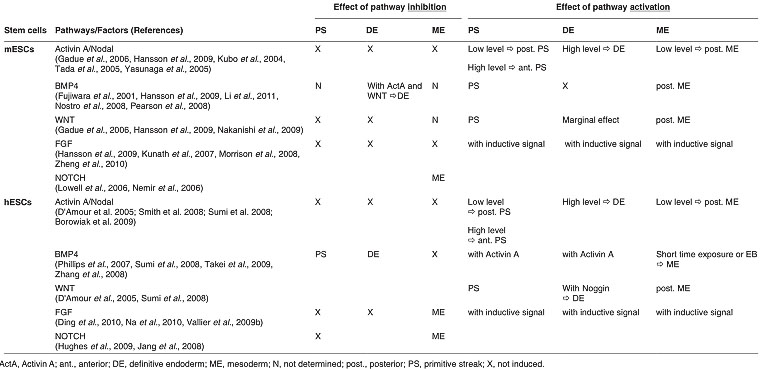
TABLE 2
OVERVIEW OF THE EFFECTS OF INHIBITING OR ACTIVATING RELEVANT PATHWAYS
ON GERM LAYER DIFFERENTIATION FROM EMBRYONIC STEM CELLS
описанных выше путей (Activin, BMP, WNT) и участвует в генерации временной популяции PS/мезэнтодермальных клеток, а также в детерминации этих клеток в направлении выбора судьбы DE (Hansson et al., 2009, Morrison et al., 2008).
Crosstalk between signaling pathways during definitive endoderm
differentiation from mESCs
Используя условия монослоя и культивирования EB, Morrison et al., показали, что mESCs, обработанные Activin A и BMP4 в течение первых двух дней и затем Activin A и EGF в течение 5 дней, генерируют высокую пропорцию (до 20%) клеток DE (Morrison et al., 2008).
Ингибирование сигналов Activin A, блокирующее BMP4, индуцирует дифференцировку PS, тогда как непрерывное воздействие BMP4 после образования PS способствует образованию мезодермы в противовес энтодерме. Будучи специализированной, мезодерма не может быть обращена обратно в DE путем добавления Activin A (Pearson et al., 2008). Напротив, комбинация BMP4 и Activin A предупреждает образование передней части PS, но благоприятствует дифференцировке задней части клона PS. (Hansson et al., 2009, Tada et al., 2005). Итак, передача сигналов Activin A и BMP4 индуцирует PS кооперативным способом и эффект BMP4 на индукцию PS, по-видимому, Activin A-зависим. После образования PS, Activin A направляет клетки на путь клона передней энтодермы, тогда как BMP4
способствует образованию заднего мезодермального клона. Взаимодействие между этими TGF-beta лигандами и путем WNT безусловно участвует в спецификации PS, принимая во внимание, что Activin A может индуцировать экспрессию Wnt3a и что постоянная стимуляция WNT пути в отдельности в mESCs индуцирует PS-подобный фенотип и в дальнейшем дает мезодермальные клетки (Bakre et al., 2007, Nakanishi et al., 2009, Xiao et al., 2006). Ингибирование передачи сигналов FGF рецептора выявляет роль FGF в формировании DE, индуцируемой с помощью Activin A (Hansson et al., 2009, Morrison et al., 2008). FGF2 усиливает Activin A-индуцируемую экспрессию Gsc и этому эффекту противодействует ингибирование FGF рецептора, подтверждая, что Gsc позитивная мезэнтодерма, происходящая из передней части PS, нуждается в передаче сигналов FGF и что судьба передней части PS далее усиливается за счет активной передачи сигналов FGF.
Более того, образование DE, оцениваемое по экспрессии Sox17, обнаруживает позднюю зависимость от передачи сигналов FGF (Hansson et al., 2009), однако дальнейшая стимуляция пути с помощью экзогенного FGF не усиливает Activin A-индуцируемую экспрессию маркера DE. Этот результат не согласуется в наблюдениями др. исследований, что добавление FGF лигандов на более поздних стадиях увеличивает имеющуюся популяцию DE (Morrison et al., 2008), хотя использованы др. протоколы индукции. Тем не менее, они указывают на участие передачи сигналов FGF в важной ступени индукции мезэнтодермы и DE.
В то время как все эти пути, как известно, вносят вклад в определенной степени в формирование PS и DE in vitro, остается трудно выполнимой задачей получение более чем 30% эффективности дифференцировки DE или поддержание адекватной жизнеспособности предшественников DE в монослойных культурах. Недавно установлено, что комбинация стимуляции TGF-beta, стимуляции WNT и ингибирования BMP эффективно индуцирует DE клетки (более 75% CxCR4 + клеток) в EBs из mESCs (Li et al., 2011). Наши наблюдения подтверждают эти находки на монослойных культурах и существенно улучшают ранее описанную эффективность (Hansson et al., 2009, Morrison et al., 2008). Итак, передачи сигналов Nodal/Activin A, WNT, BMP4 и FGF также взаимодействуют, чтобы регулировать образование PS и спецификацию DE из mESCs in vitro (Fig. 2). Однако мы всё ещё далеки от понимания, как в действительности сегодня системы дифференцировки in vitro воспроизводят все критические аспекты дифференцировки DE in vivo, включая пространственную организацию клеток и межклеточные контакты, время активности факторов роста и эффекты морфогенов.
Definitive endoderm differentiation in human ESCs
Дифференцировка DE клонов из hESCs была облегчена в результате первоначальных сообщений о развитии мышиных эмбрионов и дифференцировки энтодермы из mESCs. Стало очевидно из этих первых моделей, что четыре основных пути (Activin/Nodal, BMP,
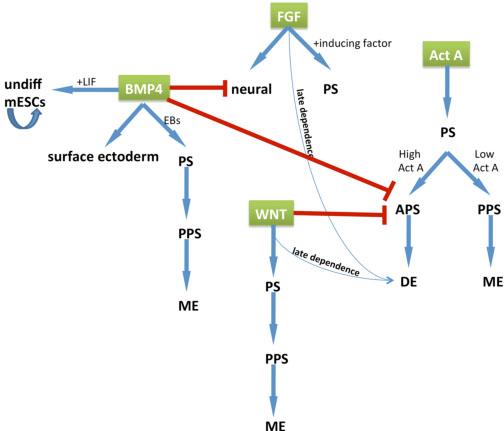 Fig. 2. Schematic representation of the roles played by several signaling pathways on germ layer pecification in mESCs. BMP4 induces surface ectoderm. The presence of other factors converts the role of BMP4 into mESCs maintenance and mesoderm induction. FGF induces neural ectoderm by default and augments PS formation synergistically with PS specific inducing factor, like Activin A. WNT contributes to PS induction followed by mesendoderm specification if continuously activated. The low level of Activin A favors mesendoderm formation. The definitive endoderm induced by high Activin A has a late dependence on FGF and WNT signaling. The specification of the anterior PS, which gives rise to the definitive endoderm, is blocked by BMP4 and WNT.
Fig. 2. Schematic representation of the roles played by several signaling pathways on germ layer pecification in mESCs. BMP4 induces surface ectoderm. The presence of other factors converts the role of BMP4 into mESCs maintenance and mesoderm induction. FGF induces neural ectoderm by default and augments PS formation synergistically with PS specific inducing factor, like Activin A. WNT contributes to PS induction followed by mesendoderm specification if continuously activated. The low level of Activin A favors mesendoderm formation. The definitive endoderm induced by high Activin A has a late dependence on FGF and WNT signaling. The specification of the anterior PS, which gives rise to the definitive endoderm, is blocked by BMP4 and WNT.
FGF и WNT), которые оперируют дифференцировкой энтодермы мышей, могут также принимать участие у людей. Эти пути, действительно, контролируют дифференцировку DE из hESCs и также функционируют в сигнальной сети, которая оперирует молекулярных и временных взаимодействий между ними.
Nodal/Activin A pathway
Помимо поддержания недифференцированного состояния hESCs, Activin A выполняет сходную роль в формировании зародышевых слоев как и в mESCs путем индукции образования BRY позитивной мезэнтодермы и путем генерации DE и мезодермы зависимым от концентрации способом (D'Amour et al., 2005, Gadue et al., 2006, Hansson et al., 2009, Kubo et al., 2004). Это демонстрирует, что функция передачи сигналов TGF-beta в формировании мезодермы и энтодермы хорошо законсервирована от низших до высших позвоночных (Tam et al., 2003, Thisse et al., 2000, Whitman, 2001). Однако индукция DE с помощью Activin A в монослойных культурах из hESCs значительно более эффективна, чем сообщалось для mESCs ((D'Amour et al., 2005, Hansson et al., 2009, Morrison et al., 2008) and personal observations). Хотя пути FGF и WNT могут модулировать степень дифференцировки DE, удивительно, что в отсутствие передачи сигналов Activin, они не могут ни поддерживать плюрипотентность hESC, ни управлять детерминацией мезэнтодермы в химически определенной среде (Sui et al., 2012b, Vallier et al., 2009b), (Fig. 3). Следовательно, Activin A действует выше др. факторов, которые модулируют дифференцировку энтодермы и абсолютно необходим для генерации этого зародышевого слоя. В самом деле ингибирование передачи сигналов Activin способствует дифференцировке нейроэктодермы вместо PS/DE (Smith et al., 2008). Итак, Activin A активно используется в качестве важного компонента индукции DE из hESCs в ряде протоколов, при этом генерируются происходящие из DE панкреатические клетки и гепатоциты (Agarwal et al., 2008, D'Amour et al., 2006, Hay et al., 2008, Kroon et al., 2008, Mfopou et al., 2010a, Xu et al., 2011). Activin A действует путем активации внутриклеточных переносчиков сигналов SMAD2/3. Недавнее скринирование химической библиотеки выявило небольшие молекулы (IDE1, IDE2), которые также активируют этот путь, приводя к образованию DE из mESCs и hESCs (Borowiak et al., 2009).
BMP pathway
BMP4-обработанные hESCs неспособны генерировать BRY позитивных мезэнтодермальных/мезодермальных предшественников (Sumi et al., 2008), но дают трофэктодерму или примитивную энтодерму в долговременных культурах (Pera et al., 2004, Vallier et al., 2009b, Xu et al., 2002). Этот эффект BMP4 действительно зависит от сопутствующего снижения передачи сигналов Activin и FGF, это обычно поддерживает экспрессию NANOG, учитывая что добавление FGF2 или принудительная экспрессия NANOG переключает BMP4-индуцируемую дифференцировку из внеэмбриональных клонов в мезэнтодерму (Yu et al., 2011, Zhang et al., 2008). Напротив, воздействие на hESCs BMP4 в течение короткого времени (не более 24 ч) или после образования EBs генерирует предшественников мезэнтодермы/мезодермы, способных к дальнейшей дифференцировке в гематопоэтические и кардиальные клоны (Takei et al., 2009, Zhang et al., 2008), (Fig. 3). Более того, BMP4 в комбинации с Activin A синергично генерирует клетки энтодермы, экспрессирующие FOXA2 и SOX17, из hESCs. Эти культуры в дальнейшем дают PDX1 и NKX6.1 позитивную панкреатическую энтодерму, показывая, что природа DE генерируется из FOXA2 + SOX17 + клеток таким способом (Phillips et al., 2007, Teo et al., 2012). Временная стимуляция
hESCs с помощью Activin A в течение одного дня в комбинации с BMP4, VEGF
и FGF2, как было установлено, генерирует мультипотентных предшественников мезодермы на 3.5 день, которая обладает потенциалом генерировать все мезодермальные клоны (Evseenko et al., 2010). Следовательно, BMP4 может модулировать спецификацию мезэнтодермы и мезодермы из hESCs, и
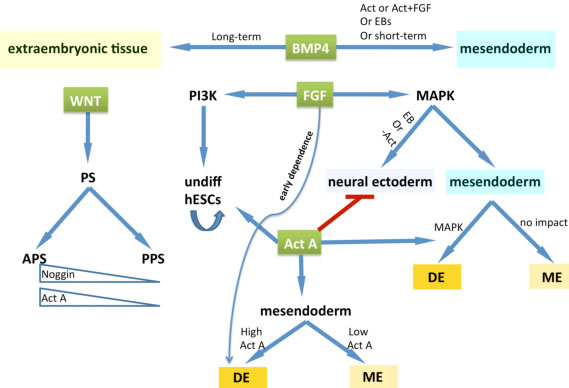 Fig. 3. Schematic representation of the roles played by several signaling pathways on germ layer specification in hESCs. The mesendoderm and extraembryonic tissue specification induced by BMP4 are dependent on the culture time periods and factors indicated in the graph. The WNT contributes to PS formation and anterior PS is further induced with Activin A activation and BMP signaling inhibition. Interaction of Activin A and PI3K, one of the FGF downstream pathways, allows for hESCs self-renewal.
The MAPK pathway, the other downstream pathway of FGF signaling, is mainly responsible for neural ectoderm and mesendoderm derivation. Beside the inhibition effect of Activin A on neural ectoderm development, its supplementation at high concentration could further induce the mesendoderm towards definitive endoderm.
Fig. 3. Schematic representation of the roles played by several signaling pathways on germ layer specification in hESCs. The mesendoderm and extraembryonic tissue specification induced by BMP4 are dependent on the culture time periods and factors indicated in the graph. The WNT contributes to PS formation and anterior PS is further induced with Activin A activation and BMP signaling inhibition. Interaction of Activin A and PI3K, one of the FGF downstream pathways, allows for hESCs self-renewal.
The MAPK pathway, the other downstream pathway of FGF signaling, is mainly responsible for neural ectoderm and mesendoderm derivation. Beside the inhibition effect of Activin A on neural ectoderm development, its supplementation at high concentration could further induce the mesendoderm towards definitive endoderm. точно контролировать его временной промежуток передачи сигналов и взаимодействовать с дополнительными путями, всё это жизненно важно для детерминации судеб клеток.
WNT pathway
Индукция типов клеток PS и мезэнтодермы с помощью Activin A, по крайней мере, частично связана с последующей активацией транскрипции WNT3a с помощью этого ростового фактора (Bakre et al., 2007, Kemp et al., 2007, Sumi et al., 2008, Xiao et al., 2006). В самом деле, передача сигналов WNT может индуцировать формирование BRY-позитивной PS в бессывороточной среде (Fig. 3); и как и культурах mESC, продолжительное воздействие WNT способствует образованию задней мезодермы (Sumi et al., 2008). Этот эффект передачи сигналов WNT на образование задней частиr PS и мезодермы может сдвигаться в направлении PS/DE и передней мезодермы путем добавления BMP антагониста Noggin (Sumi et al., 2008). Клетки PS первоначально индуцированные с помощью WNT могут в дальнейшем направляться на образование DE путем добавления Activin A и удаления WNT лигандов.
Итак, эти данные ведут к разработке протокола эффективной индукции DE, при этом Activin A и Wnt3a добавляются к недифференцированным hESCs на короткий период (1 или 2 дня), затем следует добавление Activin A и сыворотки (низкие концентрации) в течение 2 дней (D'Amour et al., 2005). Это приводит к оптимальной синхронности в генерации популяции мезэнтодермы и её дальнейшему превращению в DE клетки, и это сегодня считается стандартным протоколом индукции DE из hESCs (Mfopou et al., 2010b). Эта стратегия была успешно использована некоторыми исследователями на множественных клеточных линиях, включая человеческие индуцированные плюрипотентные стволовые клетки, и давала DE клетки, способные дифференцироваться далее в печеночные и панкреатические клоны (D'Amour et al., 2005, D'Amour et al., 2006, Johannesson et al., 2009, Kelly et al., 2011, Kroon et al., 2008, Mfopou et al., 2010a, Nostro et al., 2011, Sui et al., 2012a, Thatava et al., 2011), (Table 3). Однако использование добавления сыворотки мешает получению пригодных для клиники потомков с помощью этого протокола, что стимулировало поиски многих др. альтернатив (Table 3).
FGF pathway
Передача сигналов FGF выполняет разнообразные роли во время развития эмбрионов в зависимости от временного и пространственного контекста. Активная передача сигналов FGF необходима для поддержания плюрипотентности hESC. Блокада её нижестоящего эффектора MAPK ведет к потере маркеров плюрипотентности и дифференцировке в примитивную энтодерму и трофэктодерму (Dvorak et al., 2005, Li et al., 2007). Однако недавние исследования подтвердили, что ингибирование MAPK не влияет на самообновление hESCs, но предупреждает дифференцировку мезэнтодермы (Ding et al., 2010, Na et al., 2010). Эти наблюдения подтверждают, что MAPK путь контролирует дифференцировку, тогда как PI3K, др. нижестоящий эффектор передачи сигналов FGF, в основном связан с регуляцией плюрипотентности hESC. Сходным образом, роль FGF в спецификации зародышевого слоя варьирует с зависимости от контекста. В отсутствие факторов, противодействующих дифференцировке, напр., после истощения фактора самообновления Activin A или после образования EBs, активность FGF индуцирует нейроэктодермальную дифференцировку (Cohen et al., 2010, Vallier et al., 2009b). Влияние передачи сигналов FGF было широко и чётко определено для поддержания самообновления и для детерминации нейральных клонов из hESCs (Fig. 3). Однако, лишь в немногих исследованиях описана роль FGF в происхождении мезэнтодермы, энтодермы и мезодермы из hESCs. И только недавно независимые данные Na et al., и нашей группы четко показали, что передача сигналов FGF способствует Activin
A-индуцированной дифференцировке DE в бессывороточных условиях и что противодействие ей тяжело снижает детерминацию мезэнтодермы и DE (Na et al., 2010, Sui et al., 2012b). Интересно, что передача сигналов только FGF также неспособна управлять формированием DE из hESCs (Sui et al., 2012b, Vallier et al., 2009b), указывая тем самым, что это происходит как и в mESCs, передача сигналов TGF-beta необходима выше FGF пути во время дифференцировки мезэнтодермы и DE. Это подтверждает, что FGF не является основным индуцирующим DE фактором, а синергичным фактором, который активируется. чтобы поддержать вызываемое Activin A образование DE. Соответственно находкам Na et al., (Na et al., 2010), мы также продемонстрировали, что FGF нижестоящий эффектор MAPK/ERK скорее, чем PI3K/AKT, является критическим для дифференцировки мезэнтодермы и DE в присутствии Activin A. Однако образование передней части PS и мезэнтодермы, индуцируемое комбинированной WNT активацией и ингибированием BMP, по-видимому, использует передачу сигналов PI3K/AKT (Sumi et al., 2008). Хотя все эти исследования
TABLE 3
OVERVIEW OF FEW SYSTEMS USED FOR DEFINITIVE ENDODERM DIFFERENTIATION FROM HESCS
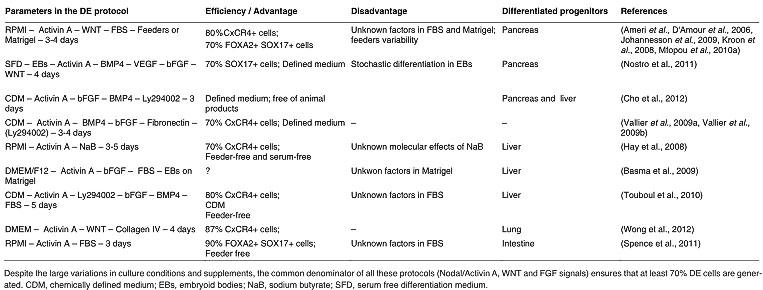
подчеркивают роль FGF в Activin A-индуцированной дифференцировке DE, имеются противоречащие данные о временном промежутке, в течение которого происходит этот эффект. Мы продемонстрировали, что дифференцировка DE обнаруживает раннюю зависимость от передачи сигналов FGF на базе снижения экспрессии SOX17 после ингибирования FGF на ранних стадиях (Sui et al., 2012b). Напротив, позднюю зависимость передачи сигналов FGF описали для mESCs
(Hansson et al., 2009, Morrison et al., 2008) и hESCs (Vallier
et al., 2009b). Эти расхождения, скорее всего, результат отличий в использованных моделях в этих исследованиях. Следует отметить, что в свете современных находок передача сигналов FGF необходима, но недостаточна для дифференцировки мезэнтодермы и DE и она действует как комплементарный фактор для поддержания стимулирующего эффекта Activin A на индукцию DE.
Other signaling pathways in germ layer commitment
Помимо хорошо изученных путей, описанных выше, пути Notch и RA также могут участвовать в детерминации зародышевого слоя. Роль передачи сигналов Notch в событиях, подобных ранней гаструляции, из ESCs противоречива. Потеря передачи сигналов Notch способствует формированию мезодермы и репрессии спецификации нейрального клона в культуре mESC (Lowell et al., 2006, Nemir et al., 2006). Хотя антагонизм пути Notch с gamma-secretase ингибитором не влияет на самообновление и дифференцировку в стандартных культурах hESCs (Fox et al., 2008, Noggle et al., 2006), он индуцирует мезодермальный клон и ослабляет нейральную и гематопоэтическую детерминацию в условиях культуры малого объема (Jang et al., 2008). Однако было также показано, что ингибирование Notch подавляет экспрессию маркеров PS даже в присутствии BMP4, устанавливая тем самым образование поверхностной эктодермы в hESCs и нейрального клона в mESCs (Hughes et al., 2009). Это подтверждает, что культуральные условия ESCs влияют на их реакции на Notch ингибиторы и что блокирование этого пути может при определенных условиях индуцировать клоны, которые, как известно, возникают из передней части PS/мезэнтодермы.
Главные находки относительно роли RA в детерминации зародышевого слоя сконцентрированы на дифференцировке нейральной эктодермы в mESCs и свидетельствуют в пользу взаимодействия этого пути с передачей сигналов FGF (Stavridis et al., 2010, Ying et al., 2003b). Сходным образом, исследования, описывают дифференцировку панкреатических клеток из DE, индуцированной в монослойной культуре mESCs путем комбинации RA и FGF2 (Kim et al., 2010). Однако добавление 15% FBS во время индукции DE не позволяет сделать уверенное заключение о вкладе передачи сигналов RA.
Concluding remarks
During long-term culture in vitro, mESCs and hESCs maintain
their self-renewal and pluripotency properties via integration of
different signaling pathways. Although several common growth
factors are expressed in both cell types including WNT and FGF
ligands, their role on the regulation of the pluripotent state is quite
different (Cohen et al., 2010, Kunath et al., 2007, Sato et al., 2004,
ten Berge et al., 2011, Xiao et al., 2006, Ying et al., 2008). For
instance, WNT is essential to sustain mESCs pluripotency whereas
in hESCs it is only responsible for the proliferation (Dravid et al.,
2005, Sato et al., 2004, ten Berge et al., 2011, Wray et al., 2011, Ying
et al., 2008). FGF signal in mESCs has to be inhibited to maintain
pluripotency whereas in hESCs it has to be activated (Armstrong
et al., 2006, Dvorak et al., 2005, Li et al., 2007, Ying et al., 2008).
These dramatic discrepancies between mESCs and hESCs re-
garding the maintenance of pluripotency are now uncovered and
are related to the developmental origins of these pluripotent cells.
With regards to this, pluripotent cells derived from rodent embryos
at the epiblast stage (EpiSCs, epiblast stem cells) display similar
characteristics and requirements with hESCs (Brons et al., 2007,
Rossant, 2008, Tesar et al., 2007, Vallier et al., 2009b). This led
to the suggestion that hESCs are much closer or equivalent to the
postimplantation epiblast rather than to the inner cell mass cells.
Whereas the functions played by Activin A, WNT, FGF and
BMP4 pathways during undifferentiated growth are quite different
among hESCs and mESCs, their role during early development
is conserved to some extent. For instance, Activin A induces DE
and mesoderm in a dose-dependent manner in both mouse and
human ESCs, with low concentrations driving mesoderm fate
and high concentrations favoring anterior endoderm fate. With
regards to mesendoderm and DE differentiation, FGF is mainly a
competence factor that improves germ layer formation in concert
with specific commitment factors and in a particular competence
window. Specific protocols developed for each system allow for
efficient generation of DE cells that are competent for further dif-
ferentiation into endoderm progenies such as liver, pancreas, lungs
and intestine (Table 3). While they sometimes significantly differ in
the use of feeder cells, extracellular matrix, serum or growth fac-
tors combinations, these protocols have as common denominator
the requirement for Activin/Nodal, WNT and FGF (MAPK/ERK)
signaling. These signals can be provided via growth factors or
small molecules supplementation, and in certain models are also
provided by the feeder cells or serum. Whereas the mesendoderm
stage is well described in both systems, it remains unclear for
now whether the passage from mESCs to DE involves an earlier
EpiSC-like intermediate stage.
Although we aimed at giving an overview of the main differences
in the signaling pathways that control pluripotency and early DE
commitment in mESCs and hESCs, we have made an effort to
keep it short and for this reason we would like to apologize for the
investigators whose works have not been covered owing to space
limitations. We also have not discussed DE differentiation from
EpiSCs, given the recent discovery of these lines. Further work will
be needed to foster the integrated understanding of the complex
interactions and crosstalk between different pathways involved in
endoderm differentiation, and to estimate how faithfully the in vitro
implementation of this knowledge recapitulates the in vivo events
(Wang et al., 2012). The current development of defined culture
conditions and the increasing interest in using small molecules
for pathways modulation will certainly affect the future of stem cell
differentiation. They will be valuable for further understanding the
basics of human embryo development and more interestingly, for
the implementation of this knowledge in the development of clinical
grade progenies from human pluripotent stem cells.
|
 Fig. 1. Schematic representation of the differences in signaling path-
ways regulating self-renewal and pluripotency of human and mouse
ESCs. Undifferentiated mESCs are mainly maintained under the control
of LIF and BMP signaling, whereas hESCs are in need of Activin and FGF
signaling to sustain long-term self-renewal and pluripotency. The Wnt
signaling also plays a role in self-renewal of hESCs and mESCs, but its
underlying mechanism is still to be addressed. These signaling pathways
in both systems converge towards the activation of a core transcriptional
network that involves Oct4, Nanog and Sox2.
Fig. 1. Schematic representation of the differences in signaling path-
ways regulating self-renewal and pluripotency of human and mouse
ESCs. Undifferentiated mESCs are mainly maintained under the control
of LIF and BMP signaling, whereas hESCs are in need of Activin and FGF
signaling to sustain long-term self-renewal and pluripotency. The Wnt
signaling also plays a role in self-renewal of hESCs and mESCs, but its
underlying mechanism is still to be addressed. These signaling pathways
in both systems converge towards the activation of a core transcriptional
network that involves Oct4, Nanog and Sox2. 
 Fig. 2. Schematic representation of the roles played by several signaling pathways on germ layer pecification in mESCs. BMP4 induces surface ectoderm. The presence of other factors converts the role of BMP4 into mESCs maintenance and mesoderm induction. FGF induces neural ectoderm by default and augments PS formation synergistically with PS specific inducing factor, like Activin A. WNT contributes to PS induction followed by mesendoderm specification if continuously activated. The low level of Activin A favors mesendoderm formation. The definitive endoderm induced by high Activin A has a late dependence on FGF and WNT signaling. The specification of the anterior PS, which gives rise to the definitive endoderm, is blocked by BMP4 and WNT.
Fig. 2. Schematic representation of the roles played by several signaling pathways on germ layer pecification in mESCs. BMP4 induces surface ectoderm. The presence of other factors converts the role of BMP4 into mESCs maintenance and mesoderm induction. FGF induces neural ectoderm by default and augments PS formation synergistically with PS specific inducing factor, like Activin A. WNT contributes to PS induction followed by mesendoderm specification if continuously activated. The low level of Activin A favors mesendoderm formation. The definitive endoderm induced by high Activin A has a late dependence on FGF and WNT signaling. The specification of the anterior PS, which gives rise to the definitive endoderm, is blocked by BMP4 and WNT.
 Fig. 3. Schematic representation of the roles played by several signaling pathways on germ layer specification in hESCs. The mesendoderm and extraembryonic tissue specification induced by BMP4 are dependent on the culture time periods and factors indicated in the graph. The WNT contributes to PS formation and anterior PS is further induced with Activin A activation and BMP signaling inhibition. Interaction of Activin A and PI3K, one of the FGF downstream pathways, allows for hESCs self-renewal.
The MAPK pathway, the other downstream pathway of FGF signaling, is mainly responsible for neural ectoderm and mesendoderm derivation. Beside the inhibition effect of Activin A on neural ectoderm development, its supplementation at high concentration could further induce the mesendoderm towards definitive endoderm.
Fig. 3. Schematic representation of the roles played by several signaling pathways on germ layer specification in hESCs. The mesendoderm and extraembryonic tissue specification induced by BMP4 are dependent on the culture time periods and factors indicated in the graph. The WNT contributes to PS formation and anterior PS is further induced with Activin A activation and BMP signaling inhibition. Interaction of Activin A and PI3K, one of the FGF downstream pathways, allows for hESCs self-renewal.
The MAPK pathway, the other downstream pathway of FGF signaling, is mainly responsible for neural ectoderm and mesendoderm derivation. Beside the inhibition effect of Activin A on neural ectoderm development, its supplementation at high concentration could further induce the mesendoderm towards definitive endoderm. 