Посещений:  ООЦИТЫ СТАДИИ ЗАРОДЫШЕВОГО ПУЗЫРЬКА
ООЦИТЫ СТАДИИ ЗАРОДЫШЕВОГО ПУЗЫРЬКА
Эпигенетические модификации
|
|
Genome organization and epigenetic marks
in mouse germinal vesicle oocytes
AMELIE BONNET-GARNIER, PRISCA FEUERSTEIN , MARTINE CHEBROUT , RENAUD FLEUROT, HABIB-ULLAH JAN , PASCALE DEBEY and NATHALIE BEAUJEAN
 Int. J. Dev. Biol. 56: 877-887 (2012)
doi: 10.1387/ijdb.120149ab
|
ABSTRACT During the final step of oogenesis, the oocyte nucleus is subject to large-scale modifications that correlate with transcriptional silencing. While oocytes with dense chromatin around the nucleolus are silent (SN, surrounded nucleolus), oocytes with uncondensed chromatin (NSN, non-surrounded nucleolus) are transcriptionally active. It is believed that epigenetic mechanisms that participate in gene expression regulation could play a role in this event. In this context, we examined the behaviour of heterochromatin and related histone modifications during the NSN to SN transition by immunostaining. Using fluorescent in situ hybridization on three dimensionalpreserved nuclei (3D-FISH), we also studied the distribution of centromeric, pericentromeric and
ribosomal (rDNA) sequences in relation to the nucleolus (also called the nucleolus-like body, NLB). We observed that in NSN-type oocytes, pericentromeric heterochromatin is aggregated within chromocenters. In SN-type oocytes, pericentromeric heterochromatin and centromeres form a discontinuous ring around the NLB. rDNA sequences, which initially present a pearl necklace structure, gather together in seven highly condensed foci at the NLB periphery. H3K9me3 and H4K20me3 heterochromatin marks clearly label chromocenters, whereas H3K4me3 and H4K5ac are totally excluded from heterochromatin regions, even in the very compact SN-nuclei. Remarkably, H3K27me3 displays an intermediate behavior. It appears that GV oocyte nuclei exhibit a specific epigenetic landscape. Histone modifications, related to both active and repressive chromatin structures, seem to follow the large-scale chromatin movements that occur during the NSN to SN transition. We also demonstrate that, while heterochromatin regions re-localize around the NLB, rDNA sequences adopt a highly compact structure in SN-type oocytes.
|
У мышей pre-antral ооциты арестованы в профазе I мейоза (также наз. зародышевом пузырьком или GV ооцитами) это является уникальной моделью, которая предоставляет возможность для изучения модификаций хроматина в связи с изменениями в экспрессии генов (see rev. De La Fuente, 2006). Во время этой финальной ступени оогенеза, ядро ооцита становится предметом важных модификаций ядерной архитектуры (Debey et al., 1993; Zuccotti et al., 1995). В самом деле, описаны два основных типа ядерной организации у GV ооцитов: SN-типа (Surrounded Nucleolus) и NSN-типа (Non Surrounded Nucleolus).
Необходимо упомянуть, что в полностью выросших GV ооцитах ‘ядрышко’ обнаруживает необычную ультраструктуру и функцию, и поэтому часто обозначается как ‘nucleolus like body’ или NLB (Bouniol-Baly et al., 1999; Kopecny et al., 1995). В SN-ооцитах хроматин компактен и образует кольцо вокруг этого NLB whereas, тогда как у NSN ооцитов хроматин не конденсируется вокруг NLB (Debey et al., 1993; Mattson and Albertini, 1990; Parfenov et al., 1989; Zuccotti et al., 1995). Эти изменения конфигурации хроматина скоррелированы с разной транскрипционной активностью (Bouniol-Baly et al., 1999; Christians et al., 1999; Miyara et al., 2003). SN типа ооциты молчащие, тогда как NSN-типа ооциты транскрипционно активны и синтезируют все классы РНК (Bouniol-Baly et al., 1999; De La Fuente and Eppig, 2001; Kaplan et al., 1982; Liu and Aoki, 2002). Хотя эти два типа ооцитов способны возобновлять мейоз, они не обладают одинаковой компетентностью к развитию (Inoue et al., 2008; Zuccotti et al., 1998; Zuccotti et al., 2008; Zuccotti et al., 2002). После оплодотворения, происходящие из NSN эмбрионы прекращают развитие на ст. двух клеток, тогда как происходящие из SN эмбрионы выполняют программу развития вплоть до ст. бластоциста и до рождения (Inoue et al., 2008; Zuccotti et al., 1998; Zuccotti et al., 2002). Среди различных эпигенетических механизмов, которые, как известно, участвуют
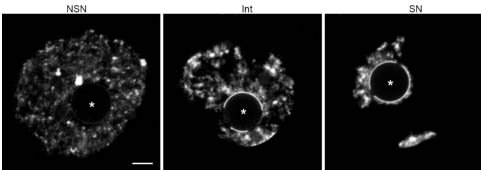 Fig. 1. Examples of the three types of chromatin configurations in germinal vesicle (GV) mouse oocytes. Representative images shown here are confocal single z-sections of DNA stainings with Yopro I. The NSN-type oocytes (Non Surrounded Nucleolus) show a decondensed chromatin configuration and the SN-type oocytes (Surrounded Nucleolus) a highly condensed chromatin with a ring around the NLB (Nucleolus Like Body). The Intermediate (Int) oocytes show a less condensed chromatin and a partial ring of chromatin around the NLB. The position of the NLB is indicated by (*). Scale bars: 5 mm.
Fig. 1. Examples of the three types of chromatin configurations in germinal vesicle (GV) mouse oocytes. Representative images shown here are confocal single z-sections of DNA stainings with Yopro I. The NSN-type oocytes (Non Surrounded Nucleolus) show a decondensed chromatin configuration and the SN-type oocytes (Surrounded Nucleolus) a highly condensed chromatin with a ring around the NLB (Nucleolus Like Body). The Intermediate (Int) oocytes show a less condensed chromatin and a partial ring of chromatin around the NLB. The position of the NLB is indicated by (*). Scale bars: 5 mm.
в регуляции экспрессии генов, находятся модификации гистонов (в основном ацетилирование и метилирование) и организация хроматина высокого порядка (Kouzarides, 2007; Zhou et al., 2011). Эти эпигенетиыческие механизмы могут вносить вклад в тонкую настройку уровней экспрессии генов: от активного до сбалансированного неактивного (Zhou et al., 2011) могут быть важными в контексте ядра ооцита, которое становится полностью молчащим. В последнюю декаду несколько групп уже проанлизировали гистоновые модификации, в полностью выросших ооцитах мышей. В то время как можно наблюдать интенсивное окрашивание всех ацетилированных лизиновых остатков гистона H4 (K5; K8, K12 и K16) или H3 (K9, K14 и K18) в GV ооцитах (De La Fuente et al., 2004; Kim et al., 2003; Sarmento et al., 2004; Spinaci et al., 2004), оно исчезает после разрыва зародышевого пузырька и в ооцитах в метафазе II (Kim et al., 2003). Метилированные гистоны были также изучены, хотя не было проведено сравнения между
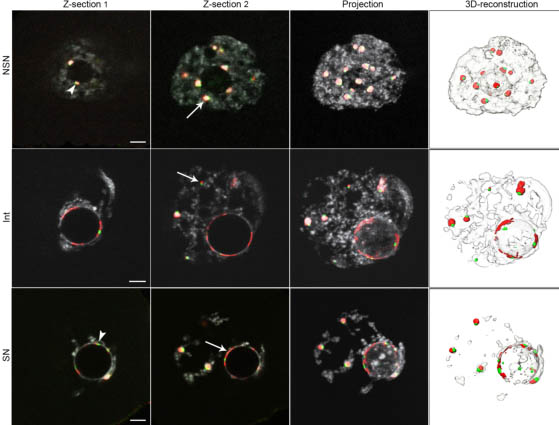 Fig. 2. Distribution of the pericentromeric and centromeric FISH signals in germinal vesicle (GV) oocytes. Oocytes were stained by FISH with major satellites (red) and minor satellites (green) probes; DNA was counterstained with propidium iodide (grey). Two different single confocal sections (z-section 1 and 2) are shown here for each type of GV oocytes (NSN, Int and SN), as well as the corresponding Z-stack projections and the 3D reconstructions. Arrows indicate the different major satellites signals we distinguished in our image analysis: (i) chromocenters (NSN, z-section 2), (ii) small aggregates (Int, z-section 2) and (iii) partial rims (SN, z-section 2). Arrowheads indicate minor satellites spots localized next to a chromocenter (NSN, z-section 1) or around the NLB (SN, z-section 1). Scale bars: 5 mm.
Fig. 2. Distribution of the pericentromeric and centromeric FISH signals in germinal vesicle (GV) oocytes. Oocytes were stained by FISH with major satellites (red) and minor satellites (green) probes; DNA was counterstained with propidium iodide (grey). Two different single confocal sections (z-section 1 and 2) are shown here for each type of GV oocytes (NSN, Int and SN), as well as the corresponding Z-stack projections and the 3D reconstructions. Arrows indicate the different major satellites signals we distinguished in our image analysis: (i) chromocenters (NSN, z-section 2), (ii) small aggregates (Int, z-section 2) and (iii) partial rims (SN, z-section 2). Arrowheads indicate minor satellites spots localized next to a chromocenter (NSN, z-section 1) or around the NLB (SN, z-section 1). Scale bars: 5 mm.
NSN и SN-типа ооцитами (Liu et al., 2004; Sarmento et al., 2004). В 2007, Kageyama с сотр. опреде6ляли количественно уровни некоторых эпигенетических меток, таких как ацетилирование гистонов (H3K9/K18 and H4K5/K12) и метилирование гистонов (H3K4 /K9 di and tri-methylated) во время финального созревуания GV ооцитов. Они пришли к заключению, что SN-типа ооциты обнаруживают относительно более высокие уровни эпигенетических модификаций по сравнению с NSN-типа ооцитами. Эти данные подтвердили, что эпигенетические модификации гистонов происходят во время созревания ооцитов и что это может быть связано со статусом транскрипции в ооците. Большинство упомянутых выше исследований предоставляют информацию о присутствии и уровнях модификаций гистонов в GV ооцитах, но очень мало информации о их ядерном распределении и о возможных взаимоотношениях с организацией хроматина высокого порядка. Эпигенетические модификации в самом деле, как полагают, модулируют структуру хроматина высшего порядка на ядерном уровне и тем самым регулируют экспрессию генов (Schneider and Grosschedl, 2007).
Многие примеры в литературе показывают такую реорганизацию ядра в ответ на дифференцировку, а также непосредственную связь между позицией и экспрессией генов (Francastel et al., 2000; Gilbert et al., 2004; Tessadori et al., 2007; Zink et al., 2004). Удивительно, околоцентромерный хроматин является структурой из констуитивного высого порядка хроматина, который играет роль не только в расхождении хромосом, но и также в транскрипционном молчании (Choo, 2000; Francastel et al., 1999). В интерфазных соматических клетках эти регионы обычно формируют хромоцентры, которые представляют собой кластеры перицентрических регионов разных хромосом, окруженнные центромерами соотв. хромосом (Bannister et al., 2001; Lachner et al., 2001). В GV ооцитах уже было продемонстрировано, что HP1 (a или b) белки - как известно, ассоциированные с перицентромерным гетерохроматином (Bannister et al., 2001; Lachner et al., 2001)- колокализуются с высоко конденсированными областями хроматина в нуклеоплазме NSN и SN ооцитов, а также вокруг NLB в SN ооцитах (Chang et al., 2005; Liu et al., 2012; Meglicki et al., 2008; Wang et al., 2008). Было также показано, что центромеры образуют кластеры вокруг NLB только SN ооцитов (De La Fuente et al., 2004; Garagna et al., 2004; Liu et al., 2012; Longo et al., 2003; Zuccotti et al., 2005), подтверждая, что распределе6ние перицентромерного гетерохроматина реорганизуется во время перехода от NSN к SN. Только два исследования (Liu et al., 2012; Meglicki et al., 2008) анализировали эпигенетические метки, связанные с гетерохроматиновыми регионами (центромерным и/или перицентромерным) у NSN- и SN-ооцитов. Они установили, что так наз.“репрессивные” H3K9me3 и H3K27me3 метки в самом деле располагаются в регионах плотного гетерохроматина, как и в соматических клетках (Peters et al., 2003), тогда как “permissive” H3Ac метка метила только деконденсированные эухроматиновые регионы.
Хотя кажетсся, что эпигенетические модификации могут играть важную роль в переходе от NSN к SN, но их взаимоотношение с реорганизацией хроматина высшего порядка, происходящее во время этого перехода, всё ещё плохо изучено. Чтобы получить больше информации о характере организации гетерохроматина во время пере6хода от NSN к SN, мы исследовали поведение центромерных и перицентромерных регионов с помощью подходов иммуноокрашивания, используя специфические родственные белки и соотв. им гистоновые модификации, а также 3D-FISH (Fluorescent In situ Hybridization) сл специфическими зондами, на ооцитах сохранивших 3D располжение ядер. Мы исследовали также распределение рибосомальных РНК генов (rDNA), которые ассоциированы с ядрышками. Zatsepina с соавт. (2000), в сомом деле, описали изменения ву распределении транскрипционного аппарата для rDNA , когда ядрышко становилось неактивным. Сходным образом, Longo с сотр. (2003) наблюдали, что NOR (Nucleolar Organizer Region) окрашивание меняется, когда ооциты приобретают SN ядерную организацию. Поэтому было исследовано взаимоотношение между этими рибосомальными регионами и перицентромерными, которые также окружают NLB.
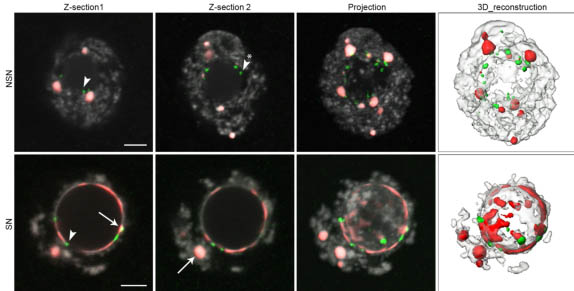 Fig. 6. Distribution of pericentromeric and rDNA sequences in germinal vesicle oocytes. Oocytes were stained by FISH with major satellites (red) and rDNA (green) probes; DNA was counterstained with propidium iodide (grey). Two different single confocal sections (z-section 1 and 2) are shown here for each type of GV oocytes (NSN and SN), as well as the corresponding z-stack projections and the 3D reconstructions. Arrows indicate the different major satellites signals we distinguished in our image analysis: partial rims (SN, z-section 1) or chromocenters (SN, z-section 2). Arrowheads indicate rDNA sequences associated to chromocenters (NSN, z-section 1) or to the NLB (SN, z-section 1). Arrowheads with (*) indicate rDNA sequences not associated to any major satellites signal. Scale bars: 5 mm.
Fig. 6. Distribution of pericentromeric and rDNA sequences in germinal vesicle oocytes. Oocytes were stained by FISH with major satellites (red) and rDNA (green) probes; DNA was counterstained with propidium iodide (grey). Two different single confocal sections (z-section 1 and 2) are shown here for each type of GV oocytes (NSN and SN), as well as the corresponding z-stack projections and the 3D reconstructions. Arrows indicate the different major satellites signals we distinguished in our image analysis: partial rims (SN, z-section 1) or chromocenters (SN, z-section 2). Arrowheads indicate rDNA sequences associated to chromocenters (NSN, z-section 1) or to the NLB (SN, z-section 1). Arrowheads with (*) indicate rDNA sequences not associated to any major satellites signal. Scale bars: 5 mm.
Discussion
Мы сравнивали ядерное распределение регионов конституитивного гетерохроматина (перицентрических и центромерных) а также повторов рибосомальных генов (rDNA) между NSN и SN-типа ооцитами, используя 3D-FISH, перспективную технику, которая позволяет анализировать 3D-расположение ядер. Мы также исследовали с помощью иммуноокрашивания и конфокальной микроскопии высокого разрешения, пять гистоновых модификаций: H4K5Ac, H3K4me3, H3K27me3, H3K9me3 и H4K20me3. Этот подход позволил нам осуществить детеальный анализ NSN, Int и SN состояния, с особым вниманием гетерохроматиновым регионам и окружению NLB.
Трехмерное расположение конституитивного гетерохроматина и рибосомальных последовательностей продемонстрировало крупномасштабные модификации во время перехода от non-surrounded nucleolus (NSN) к surrounded nucleolus (SN). Впервые показано, что конституитивный гетерохроматин и rDNA последовательности локализуются в 3D-preserved ооцитах. Относительно локализации гетерохроматина наши наблюдения (суммированы на Fig. 8) подтвердили предыдущие данные, полученные в основном с помощью иммуноокрашивания (Chang et al., 2005; De La Fuente et al., 2004; Garagna et al., 2004; Longo et al., 2003; Meglicki et al., 2008; Zuccotti et al., 2005). В NSN-типа ооцитах центромерный и перицентромерный гетенрохроматин организованы в основном в виде кластеров, наз. хромоцентрами -с типичными посттрансляяционными метками модификаций гистонов- как это было описано в соматических клетках мышей (Bannister et al., 2001; Lachner et al., 2001). Этот результат подтверждается двойным иммуноокрашиванием, которое мы осуществили антителами HP1b и CREST. Во время перехода к SN-типа ооцитам мы наблюдали, что затем появляется более деконденсированная структура и мы полагаем, что перицентромерные регионы расширяются, чтобы окружить NLB, образуя почти полное кольцо. Интересно, что центромерные точки (определяемые или с помощью FISH или иммуноокрашивания) не меняются ни в размере, ни в количестве (около 16 или около 12 соотв.) во время этого перехода. Это согласуется с количеством центромерных точек, описанных Garagna с сотр. (2004) для полностью созревших GV ооцитов (около 15 выявляется с помощью CREST антител). Следовательно, несмотря на глобальное уплотнение хроматина, которое происходит на SN стадии, перицентромерные последовательности, по-видимому, деконденсируются, а центромерные последовательности следуют им на периферии NLB.
Поскольку мы подтвердили, что последовательности перицентромерного гетерохроматина накапливаются вокруг NLB во время перехода от NSN к SN, поэтому затем мы попытались исследовать рибосомные последовательности, которые также локализуются по периферии NLB. В NSN-типа ооцитах, FISH сигналы, соответствующие рибосомальным генам распределялись в виде небольших фокусов, ассоциированных с поверхностью NLB. Интересно, что некоторые из них не обнаруживали какой-либо связи с перицентромерными последовательностями, это может отражать их сильно неконденсированное состояние. Это согласуется с тем фактом, что в NSN-типа ооцитах NLBs всё ещё активны (Zatsepina et al., 2000). FISH rDNA сигналы и в самом деле организованы подобно жемчужному ожерелью, т.e. подобно распределению RNA polymerase I транскрипционном комплексам (UBF/RPA53/RPA116), описанному Zatsepina и др. (Zatsepina et al., 2000). С одной стороны, в SN-типа ооцитах рибосомальные гены в большей степени собраны в кластеры: мы уже не выявили сигналов, подобных жемчужному ожерелью и общее количество rDNA сигналов снижалось по сравнению с NSN ооцитами (10.2 ±2.9 vs. 18.2 ±5.7). Мы также отметили, что повторяющиеся последовательности, конденсирующиеся на поверхности NLB приблизительно в 7 крупных фокусах находятся бок о бок с основными satellites FISH сигналами. Удивительно, это соответствовало количеству фокусов rDNA, кардтируемых с помощью FISH на метафазных хромосомах в соматических клетках (Romanova et al., 2006). Это указывает на то, что рибосомальные регионы принимают подобную хромомосомам структуру, сильно конденсированы, в SN ооцитах. Нобходимо однако подчеркнуть, что количество rDNA FISH сигналов в SN-типа ооцитах было выше, чем количество NOR окрашенных отложений (1 oили 2) , наблюдаемые Longo с сотр. (Longo et al., 2003) а также количества UBF/RPA53/RPA116 точек (3 - 5) , описанных Zatsepina и др. (Zatsepina et al., 2000). Это указывает на то, что только часть rDNA последовательностей всё ещё физически ассоциирует с компонентами аппарата RNA Polymerase I (Zatsepina et al., 2000) и мы можем удивляться, почему некоторые последовательности сохраняют белки аппарата транскрипции, а др. нет. Хотя наши результаты демонстрируют, что во время перехода от NSN к SN
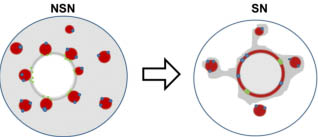 Fig. 8. Scheme illustrating the nuclear organization changes during
the NSN (non-surrounded nucleolus) to SN (surrounded nucleolus)
transition. Localization and shape of the centromeres (blue), pericentro-
meric heterochromatin (red) and ribosomal genes (green) are represented
in NSN and SN type oocytes. It clearly appears that during the NSN to SN
transition chromocenters number decreases to 3-4, rDNA switch from a
necklace-like to a chromosome-like structure and heterochromatin extend
to wrap all around the nucleolus-like body.
Fig. 8. Scheme illustrating the nuclear organization changes during
the NSN (non-surrounded nucleolus) to SN (surrounded nucleolus)
transition. Localization and shape of the centromeres (blue), pericentro-
meric heterochromatin (red) and ribosomal genes (green) are represented
in NSN and SN type oocytes. It clearly appears that during the NSN to SN
transition chromocenters number decreases to 3-4, rDNA switch from a
necklace-like to a chromosome-like structure and heterochromatin extend
to wrap all around the nucleolus-like body.
регионы гетерохроматина покрывают NLB, тогда как гены, кодирующие рибосомальные РНК, приобретают очень компактную структуру. Этим коренным изменениям в пространственной организации генома соответствовало глобальное замалчивание транскрипции и в частности репрессия транскрипции рибосомальных генов, которые располагадлись на поверхности NLB (Zatsepina et al., 2000).
Histone modifications and chromatin compaction in fully
grown oocytes
Посттрансляционные гистоновые модификации, как известно, меняют конфигурацию хроматина и тем самым регулируют доступность транскрипционных факторов или др. регуляторных белков по их связывающим сайтам (Zhou et al., 2011). В соматических клетках специфические гистоновые модификации были затем скоррелированы с разными транскрипционными состояниями: активные хроматиновые домены напр., обогащены H4K5ac или H3K4me3, тогда как неактивный хроматин характеризуется H3K9me3 и H4K20me3 (Schneider and Grosschedl, 2007). В данном исследовании мы изучали гистоновые модификации, уделяя основное внимание их 3D-распределениию в ядрах GV ооцитов. В NSN-типа ооцитах конституитивный гетерохроматин, формирующмий хромоцентры, обнаруживает те же самые характерные мордификации гистонов, что и в соматических клетках: они обогащены H4K20me3 и H3K9me3 и лишены H3K4me3 и H4K5ac. Наши наблюдения согласуются с предыдущими исследованиями (Kageyama et al., 2007; Liu et al., 2012; Meglicki et al., 2008). Кроме того, мы выявили ассоциацию HP1b с H3K9me3, благодаря совместному меччению, как и в соматических клетках (Bannister et al., 2001). впервые проанализировано распределение H4K20me3 в дщеталях, показавшее высокую специфичность ко-локализации с пперицентромерным гетерохроматином, даже более, чем в случае H3K9me3.
В SN-типа ооцитах большинство хроматина становится сильно плотно упакованным и аггрегирует вокруг NLB. Тем не менее H3K4me3 и H4K5ac, которые обычно ассоциируют с “открытым” состоянием хроматина всё ещё присутствуют (De La Fuente, 2006; Liu et al., 2012, the present study). Эти метки исключаются из конституитивного гетерохроматина, как и оржидалось, а также из др. более мелких гранулярных плотных регионов. Мы полагаем, что эти регионы могут быть факультативным гетерохроматинром, поскольку сходные гранулярные фокусы обнаруживаются при окрашивании H3K27me3 как в NSN, так и SN-типа ооцитах. Интересно, что окрашивание H3K27me3 более сходнос окрашиванием активных меток (H3K4me3 or H4K5ac), чем репрессивных (H3K9me3 or H4K20me3). Дальнейшее исследование взаимоотношений между H3K4me3 и H3K27me3 д. исследоваться в первую очередь, т.к. эти две метки, как известно, совместно локализуются в некоторых геномных регионах. Было подтверждено, что эти гистоновые модификации, наз. бивалентными метками, могут уравновешивать онтогенетические гены вплотьдо их более поздней активации или репрессии во время дифференцировки (Bernstein et al., 2006). Интересно, что ооциты, лишенныые MLL2- methyltransferase, ответственной за H3K4 три-метилирование во время роста ооцитов - обнаруживают неспособность к глобальному транскрипционному молчанию, это противоречит известной её роли в качестве активной метки (Andreu-Vieyra et al., 2010).
В соматических клетках эухроматин и гетерохроматин имеют разные глобальные эпигенетические метки (Trojer and Reinberg, 2007) , но в целом наши результаты подтверждают, что в SN-типа ооцуитах, общее правило гистонового кода не применимо. Поэтому мы предположили, что ядра GV ооцитов могут обладать специфическим ландшафтом гистоновых модификаций. Это может объяснить, почему эпигенетические метки, которые прикреплены к нуклеосомам, должны следовать движениям хроматина во время перехода от NSN к SN и агрегировать вокруг NLB без различия между активными и репрессивными метками. Некоторые авт. попытались вывить взаимотношение между этими перемещениями хроматина крупного масштаба и глобальным транскрипционным молчанием во время перехода от NSN
к SN. Они подтвердили, что эти два события хотя и сопутствуют др. др. являются независимыми и что транскрипционные молчание и активность могут возникать без ремоделирования хроматина (Andreu-Vieyra et al., 2010; De La Fuente et al., 2004). Однако точные механизмы, имеющие место, остаются плохо изученны и нуждаются в дальнейших исследованиях.
|
 Fig. 1. Examples of the three types of chromatin configurations in germinal vesicle (GV) mouse oocytes. Representative images shown here are confocal single z-sections of DNA stainings with Yopro I. The NSN-type oocytes (Non Surrounded Nucleolus) show a decondensed chromatin configuration and the SN-type oocytes (Surrounded Nucleolus) a highly condensed chromatin with a ring around the NLB (Nucleolus Like Body). The Intermediate (Int) oocytes show a less condensed chromatin and a partial ring of chromatin around the NLB. The position of the NLB is indicated by (*). Scale bars: 5 mm.
Fig. 1. Examples of the three types of chromatin configurations in germinal vesicle (GV) mouse oocytes. Representative images shown here are confocal single z-sections of DNA stainings with Yopro I. The NSN-type oocytes (Non Surrounded Nucleolus) show a decondensed chromatin configuration and the SN-type oocytes (Surrounded Nucleolus) a highly condensed chromatin with a ring around the NLB (Nucleolus Like Body). The Intermediate (Int) oocytes show a less condensed chromatin and a partial ring of chromatin around the NLB. The position of the NLB is indicated by (*). Scale bars: 5 mm.  Fig. 2. Distribution of the pericentromeric and centromeric FISH signals in germinal vesicle (GV) oocytes. Oocytes were stained by FISH with major satellites (red) and minor satellites (green) probes; DNA was counterstained with propidium iodide (grey). Two different single confocal sections (z-section 1 and 2) are shown here for each type of GV oocytes (NSN, Int and SN), as well as the corresponding Z-stack projections and the 3D reconstructions. Arrows indicate the different major satellites signals we distinguished in our image analysis: (i) chromocenters (NSN, z-section 2), (ii) small aggregates (Int, z-section 2) and (iii) partial rims (SN, z-section 2). Arrowheads indicate minor satellites spots localized next to a chromocenter (NSN, z-section 1) or around the NLB (SN, z-section 1). Scale bars: 5 mm.
Fig. 2. Distribution of the pericentromeric and centromeric FISH signals in germinal vesicle (GV) oocytes. Oocytes were stained by FISH with major satellites (red) and minor satellites (green) probes; DNA was counterstained with propidium iodide (grey). Two different single confocal sections (z-section 1 and 2) are shown here for each type of GV oocytes (NSN, Int and SN), as well as the corresponding Z-stack projections and the 3D reconstructions. Arrows indicate the different major satellites signals we distinguished in our image analysis: (i) chromocenters (NSN, z-section 2), (ii) small aggregates (Int, z-section 2) and (iii) partial rims (SN, z-section 2). Arrowheads indicate minor satellites spots localized next to a chromocenter (NSN, z-section 1) or around the NLB (SN, z-section 1). Scale bars: 5 mm.  Fig. 6. Distribution of pericentromeric and rDNA sequences in germinal vesicle oocytes. Oocytes were stained by FISH with major satellites (red) and rDNA (green) probes; DNA was counterstained with propidium iodide (grey). Two different single confocal sections (z-section 1 and 2) are shown here for each type of GV oocytes (NSN and SN), as well as the corresponding z-stack projections and the 3D reconstructions. Arrows indicate the different major satellites signals we distinguished in our image analysis: partial rims (SN, z-section 1) or chromocenters (SN, z-section 2). Arrowheads indicate rDNA sequences associated to chromocenters (NSN, z-section 1) or to the NLB (SN, z-section 1). Arrowheads with (*) indicate rDNA sequences not associated to any major satellites signal. Scale bars: 5 mm.
Fig. 6. Distribution of pericentromeric and rDNA sequences in germinal vesicle oocytes. Oocytes were stained by FISH with major satellites (red) and rDNA (green) probes; DNA was counterstained with propidium iodide (grey). Two different single confocal sections (z-section 1 and 2) are shown here for each type of GV oocytes (NSN and SN), as well as the corresponding z-stack projections and the 3D reconstructions. Arrows indicate the different major satellites signals we distinguished in our image analysis: partial rims (SN, z-section 1) or chromocenters (SN, z-section 2). Arrowheads indicate rDNA sequences associated to chromocenters (NSN, z-section 1) or to the NLB (SN, z-section 1). Arrowheads with (*) indicate rDNA sequences not associated to any major satellites signal. Scale bars: 5 mm.
 Fig. 8. Scheme illustrating the nuclear organization changes during
the NSN (non-surrounded nucleolus) to SN (surrounded nucleolus)
transition. Localization and shape of the centromeres (blue), pericentro-
meric heterochromatin (red) and ribosomal genes (green) are represented
in NSN and SN type oocytes. It clearly appears that during the NSN to SN
transition chromocenters number decreases to 3-4, rDNA switch from a
necklace-like to a chromosome-like structure and heterochromatin extend
to wrap all around the nucleolus-like body.
Fig. 8. Scheme illustrating the nuclear organization changes during
the NSN (non-surrounded nucleolus) to SN (surrounded nucleolus)
transition. Localization and shape of the centromeres (blue), pericentro-
meric heterochromatin (red) and ribosomal genes (green) are represented
in NSN and SN type oocytes. It clearly appears that during the NSN to SN
transition chromocenters number decreases to 3-4, rDNA switch from a
necklace-like to a chromosome-like structure and heterochromatin extend
to wrap all around the nucleolus-like body.