Посещений:  ООЦИТ: КОМПЕТЕНТНОСТЬ К РАЗВИТИЮ
ООЦИТ: КОМПЕТЕНТНОСТЬ К РАЗВИТИЮ
Роль OCT4
|
|
OCT4 and the acquisition of oocyte developmental
competence during folliculogenesis
MAURIZIO ZUCCOTTI, VALERIA MERICO, MARTINA BELLI, FRANCESCA MULAS, LUCIA SACCHI,BLAZ ZUPAN, CARLO ALBERTO REDI, ALESSANDRO PRIGIONE, JAMES ADJAYE, RICCARDO BELLAZZI,
and SILVIA GARAGNA
 Int. J. Dev. Biol. 56: 853-858 (2012)
doi: 10.1387/ijdb.120174mz
|
ABSTRACT The role that the transcription factor OCT4 plays during oocyte growth is yet unknown. In this review, we summarise the data on its potential role in the acquisition of oocyte developmental competence in the mouse. These studies describe the presence in MII oocytes and 2-cell embryos of an OCT4 transcriptional network that might be part of the molecular signature of maternal origin on which the inner cell mass and the embryonic stem cell-associated pluripotency is assembled and shaped. The Oct4-gene regulatory network thus provides a connection between eggs, early preimplantation embryos and embryonic stem cells.
|
Транскрипционный фактор OCT4 играет ключевую роль в поддержании клеточной плюрипотентности в разных типах клеток, таких как примордиальные зародышевые клетки (PGCs), сперматогонии, внутренняя клеточная масса бластоциста (ICM) и эпибласт. Но также во всех типах клеток, полученных экспериментально, таких как клетки эмбриональной карциномы , эмбриональные стволовые клетки (ESCs) и индуцированные плюрипотентные стволовые клетки (iPSCs). Напротив, его присутствие в яичниках, хотя и описано, остается необъяснимым. Обсуждаются данные по присутствию OCT4 в ооцитах мышей. Хотя всё ещё разрозненная информация указывает на потенциальную роль OCT4 в приобретении ооцитом компетентности к развитию и становлению плюрипотентности ICM.
OCT4 and pluripotency
Во время преимплантационного развития экспрессия de novo белка OCT4 впервые обнаруживается вскоре после активации эмбрионального генома на ст. 4-8 клеток и выполняет ключевую роль в становлении трофэктодермы (TE) и ICM клонов, поскольку подавление его экспрессии необходимо для дифференцировки TE (Adjaye et al., 2005; Zernicka-Goetz, 2011). Хотя описаны гетерогенные уровни экспрессии в разных бластомерах в течение преимплантации, уровень его экспрессии не является предсказательным для формирования паттерна клеточных клонов (Dietrich et al., 2007). Вместо этого, анализ кинетики поведения OCT4 (т.e., биологической активности транскрипционных факторов в живых клетках, выявляемый с помощью потери флюоресценции после фотоактивации) демонстрирует, что бластомеры с низкой кинетикой OCT4, скорее всего, будут давать плюрипотентные клетки в ICM (Plachta et al., 2011). Подавление активности OCT4 в клетках TE сопровождается подавлением в ICM др. ключевого фактора CDX2, важного для становления двух первых клеточных клонов в преимплантационном эмбрионе (Bruce and Zernicka-Goetz, 2010).
После имплантации OCT4 ограничивается эпибластом и позднее в развитии обнаруживается в примордиальных зародышевых клетках (PGCs) (Matsui et al., 1992; Resnik et al., 1992; Goto at al., 1999), во взрослом семявыносящем эпителии, где его присутствие ограничивается типом А сперматогоний (rev. Dym et al., 2009), примордиальными и растущими ооцитами (Pesce et al., 1998; Adjaye et al., 1999; Zuccotti et al., 2008; 2009).
OCT4 expression during oocyte growth
Большая часть наших знаний о профиле экспрессии гена Oct4 и его белке в ооците во время фолликулогенеза получена ооцитах оварий мышей, которые классифицируются на две основные группы в зависимости от конфигурации их хроматина, а также при наблюдении клеток, окрашенных прижизненно fluorochrome Hoechst 33342. После окрашивания ооцит классифицируется как окруженный ядрышком (SN), если он обладает кольцом Hoechst-позитивного гетерохроматина вокруг своего ядрышка, или как ооцит с не окруженным ядрышком (NSN) , если в нем отсутствует это кольцо и он обнаруживает более диспергированный хроматин (Fig. 1). У 4-6 недельных самок примордиальные и первичные ооциты с диаметром в 10-20 mm и после фазы роста до размера в 40 mm, обладают NSN-типа организацией хроматина. Затем, во время рекрутирования фолликула (41-50 mm) примерно 5% ооцитов приобретают SN-типа организацию хроматина; их количество увеличивается с ростом, достигая частоты примерно в 50% у полностью выросших антральных ооцитов (Zuccotti et al., 1995). Важным свойством этого модельного исследования является то, что полностью выросшие антральные SN ооциты и изолированные из яичников, культивированные in vitro на ст. MII и осемененные, они завершают преимплантационное (Zuccotti et al., 1998; 2002) и своевременное (Inoue et al., 2008) развитие; напротив, полностью выросшие NSN антральные ооциты прекращают своё развитие на ст. 2-х клеток. Присутствие этих двух типов ооцитов наблюдается у большинства изученных видов млекопитающих: у крыс (Mandl and Zuckerman, 1952), телят (Lodde et al., 2008), обезьян (Lefe`vre et al., 1989), свиней (Crozet, 1983) и человека (Parfenov et al., 1989). Только у коз (Sui et al., 2005) и лошадей (Hinrichs and Williams, 1997) ооциты, по-видимому, представляют собой исключение, поскольку из зародышевые пузырьки не обнаруживают SN типа конфигурации хроматина (rev. Тan et al., 2009).
В яичниках взрослых мышей транскрипты Oct4 присутствуют во время всего фолликулогенеза с существенными различиями между SN и
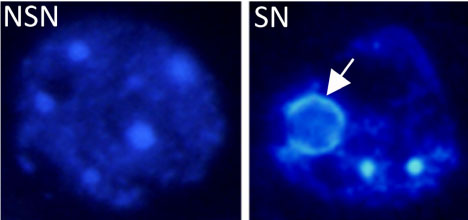 Fig. 1. Chromatin organisation in the nucleus of a non-surrounded
nucleolus (NSN) and surrounded nucleolus (SN) oocyte after Hoechst
33342 staining. The arrow indicates the ring of chromatin surrounding the
nucleolus in the SN oocyte.
Fig. 1. Chromatin organisation in the nucleus of a non-surrounded
nucleolus (NSN) and surrounded nucleolus (SN) oocyte after Hoechst
33342 staining. The arrow indicates the ring of chromatin surrounding the
nucleolus in the SN oocyte.
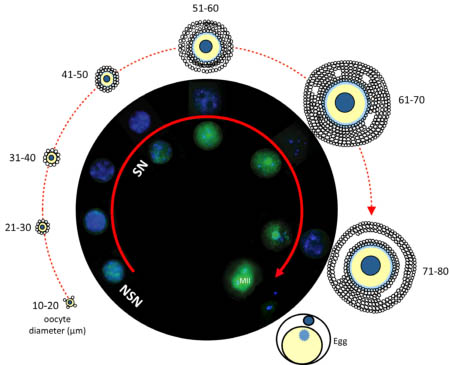 Fig. 2. OCT4 expression in the nucleus of non-surrounded nucleolus (NSN) and surrounded nucleolus (SN) oocytes during folliculogenesis. The OCT4 protein (green fluorescence) is first detected in the nucleus of NSN primordial/primary oocytes (10-20 mm), then it is down-regulated to reappear again later but only in the nucleus of SN oocytes (41-50 mm). This profile of expression is maintained throughout oocyte growth and in the derived MIINSN and MIISN oocytes. The size of the nucleus of smaller oocytes has been enlarged for illustrative purposes. Nuclei are counterstained with Hoechst 33342 (blue fluorescence).
Fig. 2. OCT4 expression in the nucleus of non-surrounded nucleolus (NSN) and surrounded nucleolus (SN) oocytes during folliculogenesis. The OCT4 protein (green fluorescence) is first detected in the nucleus of NSN primordial/primary oocytes (10-20 mm), then it is down-regulated to reappear again later but only in the nucleus of SN oocytes (41-50 mm). This profile of expression is maintained throughout oocyte growth and in the derived MIINSN and MIISN oocytes. The size of the nucleus of smaller oocytes has been enlarged for illustrative purposes. Nuclei are counterstained with Hoechst 33342 (blue fluorescence).
NSN ооцитами, хотя количество транскриптов увеличивается со стадии примордиальных и первичных ооцитов (10-20 mm) до ст. антральных ооцитов в 61-70 mm и затем снижается у полностью выросших и MII ооцитов. Вместо этого, паттерн экспрессии белка OCT4 во время роста ооцита обнаруживает заметные отличия в ооцитах двух типов. OCT4 экспрессируется в примордиальных и первичных ооцитах (10-20 mm), и затем он подавляется в ооцитах в 21-40 mm и появляется повторно, но только в SN ооцитах, когда рекрутируются фолликулы, чтобы начать свой рост (Pesce et al., 1998; Zuccotti et al., 2009). Профиль экспрессии этого транскрипционного фактора остается ограниченным SN-типа конфигурацией хроматина также во время последующих фаз созревания и вплоть до ст. полностью завершенного роста и до возникновения онтогенетически компетентных MIISN ооцитов, тогда как он подавляется в онтогенетически некомпетентных MIINSN ооцитах (Zuccotti et al., 2009) (Fig. 2). Как уже было продемонстрировано для ESCs (Boyer et al., 2005; Loh et al., 2006; Babaie et al., 2007), снижение активности OCT4 в MIINSN ооцитах затрагивает прямо или косвенно профиль экспрессии многочисленных генов, включая специфические известные OCT4-регулируемые гены. В ESCs транскрипционный фактор OCT4 соединяется непосредственно с локусом Nanog, регулируя экспрессию ряда генов плюрипотентности, среди них такие как Nanog, Stella (также известен как Dppa3), Apobec1, Gdf3 и Foxj2 (Levasseur et al., 2008). Аналогично, с момента рекрутирования фолликулов и во время последующего роста ооцитов, усиливается активность OCT4 параллельно с усилением активности белка STELLA в SN ооцитах, тогда как подавление активности соответствует снижению активности STELLA в овариальных NSN и их производных MIINSN ооцитах (Zuccotti et al., 2009). Более того, как наблюдалось в ESCs, экспрессия Foxj2 в некомпетентных к развитию MIINSN ооцитах усиливается в отсутствие OCT4; тогда как подавление Foxj2 происходит в присутствии OCT4 в компетентных к развитию MIISN ооцитах (Zuccotti et al., 2009). И STELLA и Foxj2 играют важную роль в преимплантационном развитии. STELLA, как известно, является фактором с материнским эффектом, необходимым на 1-клеточной стадии для защиты от деметилирования материнского генома и некоторых отцовских импринтированных генов (Nakamura et al., 2007); отсутствие его экспрессии ведет к аресту развития в основном на ст. 2-х клеток (Payer et al., 2003). Более того, усиление активности Foxj2 ведет к блокированию развития на 2-клеточной стадии (Martin-de-Lara et al., 2008).
Хотя непосредственная функция OCT4 на локус Nanog в ооцитах пока ещё не подтверждена, наблюдаемое поведение аналогов OCT4 в ESCs и ооцитах показывает на центральное положение этого взаимодействия на приобретение ооцитом компетентности к развитию и, как полагают, в этой связи необходимы дальнейшие исследования.
Effects of the down-regulation of OCT4 on the oocyte
transcriptome
В то время как экспрессия др. генов с материнским эффектом (напр., Npm2,
Zar1, Smarca4 и Prei3), по-видимому, не затрагивается, т.к. они одинаково экспрессируются у MIISN и MIINSN ооцитов (Zuccotti et al., 2008), снижение активности OCT4 в MIINSN ооцитах затрагивает большое количество др. генов. Сравнение, базирующееся на микромассивах всего транскриптомного профиля компетентных к развитию MIINSN в противоположность компетентным MIISN ооцитам проливает свет на группу из 380 регулируемых генов, из которых 303 усиливают свою активность и 77 снижают свою активность у MIINSN ооцитов. 25 из 380 регулируемых генов, как известно, регулируются с помощью OCT4, 18 из них (усиливают активность) предназначены для апоптоза или митохондриальной дисфункции (Zuccotti et al., 2008), демонстрируя, что подавление активности OCT4 активирует биологические пути, которые вредны для клетки. Более того, в связи с этим подходом, сравнение между MIINSN и MIIctrl овулированными ооцитами и их производными 2-cellNSN в противовес 2-cellctrl, выявило расширенную Oct4 транскрипционную сеть, состоящую из 197 генов, представленную 102 генами, экспрессирующимися исключительно в MII ооцитах, 15 генов исключительно в 2-клеточных эмбрионах и 80 генов как в MII ооцитах, так и в 2-клеточных эмбрионах (Fig. 3) (Zuccotti et al., 2011). Gene onthology enrichment анализ функции этих 197 генов приписывает им несколько основных биологических процессов, включая плюрипотентность, организацию хроматина, апоптоз, субкортикальный материнский комплекс, transcription factors-cancer, translation-cancer, оксидативное фосфорилирование, метаболизм porphyrin, обмен анионами, передача сигналов TGF-β , распределение меди, регуляция транскрипции, фосфорилирование белков, клеточный цикл, сборка белков и сигнальная трансдукция (Fig. 4).
Группа из 80 генов, которые оперируют в MII ооцитах и включает известные OCT4-регулируемые гены (названы Oct4 транскрипционной сетью, Oct4-TN), переживает массивное стирание транскрипции вследствие оплодотворения (Li et al., 2010) и экспрессируется у 2-клеточных эмбрионов. Большинство генов из Oct4-TN экспрессируется в раковых клетках, а 37 являются известными партнерами Oct4 транскриптома в ESCs (Boyer et al., 2005; Loh et al., 2006; Babaie et al., 2007) (Fig. 5). Интересно, что большинство этих генов подавляются в MIIctrl ооцитах, тогда как после оплодотворения те же самые гены активируются у 2-cellctrl эмбрионов, это поведение экспрессии подтверждается иммунологическим анализом белков из этих двух генов (DNMT3L и RSP20; Zuccotti et al., 2011).
Среди биологических процессов, которые выявляются в Oct4-TN в MII ооцитах, два заслуживают особого упоминания благодаря свой роли, которую они
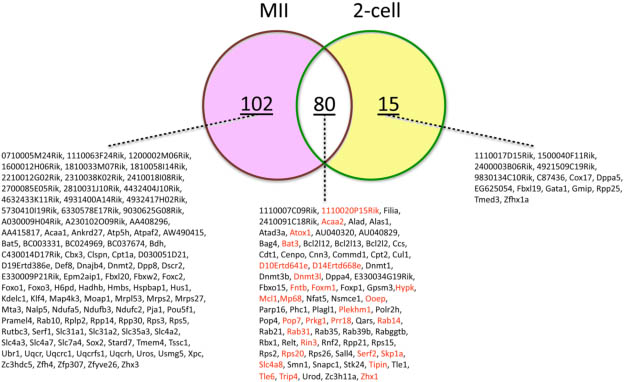 Fig. 3. Venn diagram showing the Oct4-transcriptional network genes that are expressed in MII oocytes or in 2-cell embryos and those that are
present at both developmental stages. In red, OCT4-regulated genes.
Fig. 3. Venn diagram showing the Oct4-transcriptional network genes that are expressed in MII oocytes or in 2-cell embryos and those that are
present at both developmental stages. In red, OCT4-regulated genes.
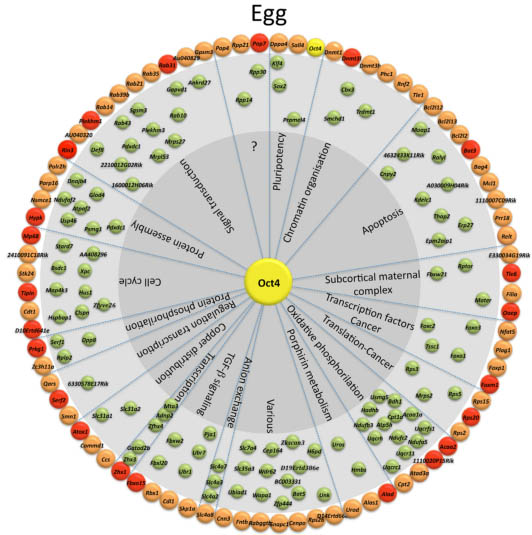 Fig. 4 (above). Distribution of the MII oocyte Oct4-transcriptional network genes in nineteen main biological processes. Green, gene transcripts detected only in MII oocytes; orange and red, genes of the Oct4-TN expressed in both eggs and 2-cell embryos; red, known OCT4-regulated genes.
Fig. 4 (above). Distribution of the MII oocyte Oct4-transcriptional network genes in nineteen main biological processes. Green, gene transcripts detected only in MII oocytes; orange and red, genes of the Oct4-TN expressed in both eggs and 2-cell embryos; red, known OCT4-regulated genes.
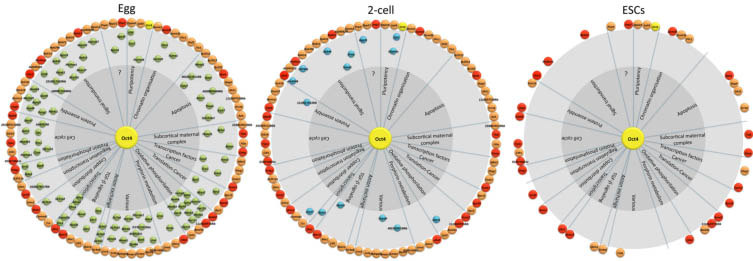 Fig. 5. Oct4-transcriptional network (Oct4-TN) expression in eggs, 2-cell embryos and embryonic stem cells. Green, gene transcripts detected
only in MII oocytes; orange and red, genes of the Oct4-TN expressed in both eggs and 2-cell embryos; red, known OCT4-regulated genes; blue, genes
expressed only in 2-cell embryos.
Fig. 5. Oct4-transcriptional network (Oct4-TN) expression in eggs, 2-cell embryos and embryonic stem cells. Green, gene transcripts detected
only in MII oocytes; orange and red, genes of the Oct4-TN expressed in both eggs and 2-cell embryos; red, known OCT4-regulated genes; blue, genes
expressed only in 2-cell embryos.
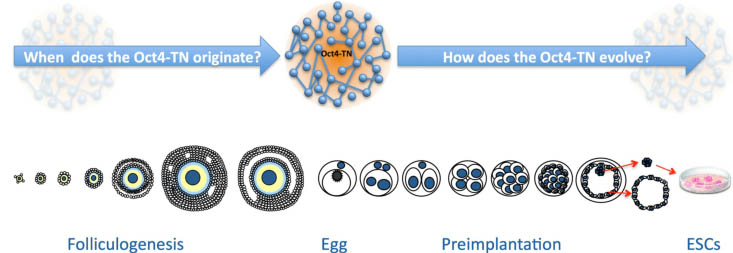 Fig. 6. Future studies of the expression profile of the Oct4-transcriptional network (Oct4-TN) during folliculogenesis, aimed at understanding when it originates during folliculogenesis, and at describing the precise changes occurring during the transition from zygote to blastocyst and in the embryonic stem cells (ESCs).
Fig. 6. Future studies of the expression profile of the Oct4-transcriptional network (Oct4-TN) during folliculogenesis, aimed at understanding when it originates during folliculogenesis, and at describing the precise changes occurring during the transition from zygote to blastocyst and in the embryonic stem cells (ESCs).
играют в процессе развития. Белки генов с материнским эффектом Mater, Tle6, Ooep и Filia, относящиеся к субкортикальным материнским комплексам (Fig. 4) (Li et al., 2008), они располагаются в субкортексе MII ооцитов и необходимы зиготами для дальнейшего прогресса после первого эмбрионального клеточного деления преимплантационного развития мыши. Во время дробления эти белки исключаются из регионов контактов между бластомерами и сегрегируют в наружные клетки морулы и бластоциста эмбриона во время дифференцировки TE/ICM. Др. группа генов, ассоциированных с 'плюрипотентностью', включает Dppa4, Sall4, Klf4 и Sox2, последние два принадлежат хорошо известным OCT4 компаньонам в поддержании самообновления и плюрипотентности в ESCs, а их избыточная экспрессия вместе с Oct4 и c-Myc вызывает дедифференцировку окончательно дифференцированных соматических клеток (напр., фибробластов) и образование
iPSCs (Yamanaka, 2007).
Further perspectives and experiments
Even though the results of these studies do not provide a
definitive answer as to the precise function played by OCT4 in
folliculogenesis, they reveal a number of evidences of a correlation
between OCT4 and the oocyte developmental competence and
of a relationship between this transcription factor and a number of
genes that are present also in the OCT4 gene regulatory network
operative in ESCs. These data indicate that Oct4-TN might be part
of the molecular signature of maternal origin on which the ESCs
molecular identity is assembled and shaped, thus providing a con-
nection between eggs, early preimplantation embryos and ESCs.
Future experiments ought now to describe the transcriptional
and translational behaviour of the Oct4-TN genes during oocyte
growth and preimplantation development, up to the implanting
blastocyst, when differentiation of the TE and ICM cell lines occurs
(Fig. 6). Also, inactivation of the Oct4 gene expression (e.g., by
RNAi or morpholino injection into the oocyte) at the time of follicle
recruitment, would give a more precise picture of the molecular
function played by OCT4 within this developmental context.
|





