Посещений:  ДИФФЕРЕНЦИРОВКА ЗАРОДЫШЕВЫХ КЛЕТОК
ДИФФЕРЕНЦИРОВКА ЗАРОДЫШЕВЫХ КЛЕТОК
Роль Reproductive homeobox 6
|
|
A possible role of Reproductive homeobox 6 in primordial germ cell differentiationCHANG LIU, PAICHI TSAI, ANA-MARIE GARCIA, BRANDON LOGEMAN and TETSUYA S. TANAKA Int. J. Dev. Biol. 55: 909-916
doi: 10.1387/ijdb.113342cl
www.intjdevbiol.com |
Rhox6 is one of the Reproductive Homeobox genes on the X chromosome (Rhox) that is expressed in the placenta and the post-migratory primordial germ cells (PGCs) in the nascent gonad. Despite its novel expression pattern, the significance of Rhox6 expression in the differentiation of these cell types remains unknown. To investigate the role that Rhox6 plays in PGCs, cDNA encoding Rhox6 and short-hairpin (sh) RNA directed against Rhox6 transcripts were introduced by unique expression vectors into a genetically engineered mouse embryonic stem cell (ESC) line. This ESC line expresses enhanced green fluorescent protein (EGFP) under the Oct3/4 promoter, thereby allowing us to monitor the presence of undifferentiated ESCs and PGCs in culture in real time. This ESC line was used to isolate clones that stably expressed Rhox6 cDNA, shRNA against Rhox6 transcripts, or controls. Quantitative RT-PCR results validated that overexpression had been achieved, as well as knockdown of Rhox6 transcripts in these ESC clones. However, these clones exhibited a normal appearance of undifferentiated ESCs and expressed EGFP . Next, these ESC clones were induced to differentiate into PGCs by generating embryoid bodies (EBs) in culture medium without leukemia inhibitory factor. Detection of EGFP expression by fluorescence microscopy and germ cell markers by RT-PCR validated the differentiation of PGCs in EBs. The Rhox6 transgene had little, if any, effect on EGFP expression in EBs, whereas Rhox6 knockdown significantly decreased EGFP expression in EBs. Thus, it is suggested with these results that Rhox6 is necessary for determination of the germ cell lineage.
|
Кластер из 12 гомеобоксных генов первоначально был идентифицирован в Х хромосоме мыши, который обладал уникальной колинеарностью в отношении своей пространственной и временной экспрессии в репродуктивных органах, таких как яичники. семенники и плацента (MacLean et al., 2005). Эти гомеобоксные гены известны как Reproductive homeobox genes on the X chromosome (Rhox) и пронумерованы в соответствии с их физической близостью к центромере (MacLean et al., 2005). Семейство Rhox сегодня включает более 30 генов (MacLean and Wilkinson, 2005). Член семейства Rhox, Rhox5, был первоначально обозначен как транскрипт, экспрессирующийся в плаценте и у эмбрионов, Pem, и экспрессируется в постмиграторных primordial germ cells (PGCs) (Daggag et al., 2008) и во внеэмбриональных клетках (Wilkinson et al., 1990; MacLean et al., 2005). У взрослых самцов мыши, Rhox5 экспрессируется в клетках Сертоли во время сперматогенеза (Pitman et al., 1998). Мыши с целенаправленной мутацией в Rhox5 обладают нормальной плодовитостью, без видимых отклонений в развитии или функции семенников (Pitman et al., 1998). Однако, более детальный анализ выявил, что мутантные самцы мышей обнаруживают повышенный апоптоз в зародышевых клетках и сниженные продукцию спермиев, подвижность спермиев и плодовитость (MacLean et al., 2005). Поэтому было предположено, что гены семейства Rhox играют важные роли в развитии репродуктивных органов.
Др. член семейства Rhox, Rhox9, был первоначально идентифицирован как гомеобоксный ген, экспрессирующийся в PGCs в формирующихся бипотентных гонадах и плаценте (также известен как Germ cell and placenta-specific homeobox, Gpbox или Placenta-specific homeobox 2, Psx2; Han et al., 2000; Takasaki et al., 2000). Сравнимые уровни транскриптов Rhox9 были первоначально обнаружены в урогенитальном гребне в начале гонадного диморфизма, тогда как позднее в эмбриональном развитии транскрипты Rhox9 накапливались в зародышевых клетках самок в большем количестве (Takasaki et al., 2000). Однако, целенаправленный мутагенез Rhox9 показал, что Rhox9-нулевые мыши фертильны и не обнаруживают явных дисфункций гонад (Takasaki et al., 2001). Важно, что 91% белок-кодирующей нуклеотидной последовательности из Rhox9 идентичен таковым Rhox6, который был первоначально обозначен как Placenta specific homeobox 1 (Psx1) и был идентифицирован при скрининге на гомеобоксные гены, участвующие в эмбриональном развитии мышей (Han et al., 1998; Chun et al., 1999). Подобно Rhox9, экспрессия транскриптов Rhox6 локализуется в плаценте (Chun et al., 1999; Tanaka et al., 2002) и PGCs в формирующихся бипотентных гонадах (Takasaki et al., 2000; Daggag et al., 2008). Следовательно, благодаря высокой гомологии последовательностей и сходному паттерну экспрессии, функция Rhox9 может быть комплементарной таковой Rhox6. Пока не было исследовано Rhox6-дефицитных мышей.
Интересно, что embryonic stem cells (ESCs) мышей поддерживаются в недифференцированном состоянии, обнаруживая флюктуирующую экспрессию Rhox6 и/или Rhox9 (Carter et al., 2008). Кроме того, мышиные ESCs могут давать зародышевые клетки in vitro при манипулировании с химическим составом культуральной среды и путем поддержания ESCs в качестве клеточных агрегатов, особенно в качестве embryoid bodies (EBs), которые воспроизводят процесс гаструляции в развивающихся эмбрионах (Geijsen et al., 2004; Young et al., 2010). Следовательно, мышиные ESCs представляют собой простую систему для оценки значения уникального паттерна экспрессии Rhox6 в ESCs и PGCs. В частности, поскольку POU-доменовый транскрипционный фактор Oct3/4 (Pou5f1) экспрессируется в недифференцированных ESCs и PGCs (Yeom et al., 1996; Yoshimizu et al., 1999; Niwa et al., 2000; Tanaka et al., 2002), поэтому использовали мышиную ESC линию, которая экспрессирует enhanced green fluorescent protein (EGFP) подконтролем Oct3/4 промотора (Walker et al., 2007; Chowdhury et al., 2010; Li et al., 2011; Tedesco et al., 2011) , это позволило нам оценить плюрипотентность ESCs и дифференцировку PGCs в реальном времени. В данном исследовании кДНК, кодирующая Rhox6, и short-hairpin (sh) РНК, направленная против Rhox6 , были внесены в ESCs, хотя и не было установлено, что они индуцируют непосредственно дифференцировку ESCs. Однако, нокдаун Rhox6 достоверно снижал эффективность поддержания Oct3/4-позитивных клеток в культуральных условиях, которые индуцировали дифференцировку PGCs. Поэтому было предположено, что Rhox6 может играть важную роль в детерминации клона зародышевых клеток.
Discussion
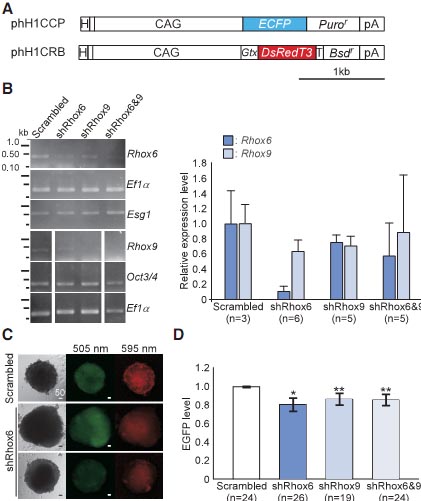 Fig. 4. Continuous knockdown of Rhox6 expression significantly impairs PGC differentiation in EBs. (A) The short-hairpin (sh) RNA expression vectors phH1CCP and phH1CRB were built in this study and used to stably express shRNA against Rhox6, Rhox9 or both Rhox6 and Rhox9 (Rhox6&9). The abbreviations used are described in Fig. 3A, except for: H, human H1 promoter; ECFP, enhanced cyan fluorescent protein; Bsd, the blasticidin resistant gene. Bar, 1 kb. (B, left) The efficiency of shRNA knockdown was evaluated by sqRT-PCR in pools of drug-resistant ESCs transfected with the shRNA expression vectors, as indicated above. “Scrambled” indicates a negative control for shRNA expression. phH1CCP was used to drive shRNA expression
in this experiment. Expression levels of genes indicated on the right were examined. Labels are
explained in Fig. 2. (B,right)Relative expression levels of Rhox6 and Rhox9 transcripts were examined by qRT-PCR in individual drug-resistant ESC clones transfected with the shRNA expression
vectors indicated on the x-axis.An averaged value for ESCs that expressed control shRNA (Scrambled)
is normalized to 1. Esg1was used as a reference. Standard errors of the means are indicated by
bars. Parentheses indicate the number of biological replicates (i.e.,independent ESC clones transfected with the shRNA expression vectors). (C)ESC clones that stably expressed
either control shRNA (Scrambled, top) or shRNA against Rhox6 (middle and bottom)were
cultured as EBs (Fig. 1A).phH1CRB was used. At day 13,expression of EGFP (505 nm) and DsRedT3 (595 nm) was examined. EGFP was not detected in the EB in the bottom panel, whereas DsRedT3 was detected in all EBs. Bars, 50 mm. (D)The “EGFP levels” (see Materials and Methods) were compared among day
13 EBs generated from 24,26, 19 or 24 independent clones expressing control shRNA, or shRNA against
Rhox6, Rhox9 or both (Rhox6&9), respectively. Pair-wise comparisons with the control were performed in statistical tests. Fig. 4. Continuous knockdown of Rhox6 expression significantly impairs PGC differentiation in EBs. (A) The short-hairpin (sh) RNA expression vectors phH1CCP and phH1CRB were built in this study and used to stably express shRNA against Rhox6, Rhox9 or both Rhox6 and Rhox9 (Rhox6&9). The abbreviations used are described in Fig. 3A, except for: H, human H1 promoter; ECFP, enhanced cyan fluorescent protein; Bsd, the blasticidin resistant gene. Bar, 1 kb. (B, left) The efficiency of shRNA knockdown was evaluated by sqRT-PCR in pools of drug-resistant ESCs transfected with the shRNA expression vectors, as indicated above. “Scrambled” indicates a negative control for shRNA expression. phH1CCP was used to drive shRNA expression
in this experiment. Expression levels of genes indicated on the right were examined. Labels are
explained in Fig. 2. (B,right)Relative expression levels of Rhox6 and Rhox9 transcripts were examined by qRT-PCR in individual drug-resistant ESC clones transfected with the shRNA expression
vectors indicated on the x-axis.An averaged value for ESCs that expressed control shRNA (Scrambled)
is normalized to 1. Esg1was used as a reference. Standard errors of the means are indicated by
bars. Parentheses indicate the number of biological replicates (i.e.,independent ESC clones transfected with the shRNA expression vectors). (C)ESC clones that stably expressed
either control shRNA (Scrambled, top) or shRNA against Rhox6 (middle and bottom)were
cultured as EBs (Fig. 1A).phH1CRB was used. At day 13,expression of EGFP (505 nm) and DsRedT3 (595 nm) was examined. EGFP was not detected in the EB in the bottom panel, whereas DsRedT3 was detected in all EBs. Bars, 50 mm. (D)The “EGFP levels” (see Materials and Methods) were compared among day
13 EBs generated from 24,26, 19 or 24 independent clones expressing control shRNA, or shRNA against
Rhox6, Rhox9 or both (Rhox6&9), respectively. Pair-wise comparisons with the control were performed in statistical tests.
В данном исследовании мы показали, что экспрессия Rhox6 регулируется во времени во время дифференцировки PGC-подобных клеток в EBs, происходящих из ESCs самцов мышей и что непрерывный нокдаун экспрессии Rhox6 нарушает процесс дифференцировки PGC-подобных клеток. Поэтому было предположено, что Rhox6 необходим для детерминации клона зародышевых клеток.
У развивающихся эмбрионов, Oct3/4 экспрессируется у преимплантационных эмбрионов во внутренней клеточной массе бластоциста, в эпибласте и зародышевой линии, это управляется с помощью его регуляторной последовательности (Yeom et al., 1996). Следовательно, как экспрессия Oct3/4, так и использование его регуляторной последовательности, являются ценными инструментами для мониторинга недифференцированного состояния ESCs (Walker et al., 2007; Chowdhury et al., 2010; Li et al., 2011) , а также дифференцировки зародышевых клеток (Yoshimizu et al., 1999; Geijsen et al., 2004; Young et al., 2010).
C др. стороны, формирование EBs воспроизводит процесс гаструляции у эмбрионов. Однако, клеточная дифференцировка в EBs обычно базируется на абсолютно случайных событиях. Чтобы увеличить выход интересующих типов клеток, часто используют генетически модифицированные линии ESC, в которых репортер, такой как EGFP, экспрессируется под действием регуляторной последовательности генетического маркера, специфичного для интересующего типа клеток. Затем, базируясь на экспрессии EGFP, интересующие дифференцированные типы клеток могут быть отсортированы от рассоединенных EBs (e.g. Nicholas et al., 2009). В данном исследовании мы использовали установленный протокол для индукции дифференцировки PGCs из ESCs (Geijsen et al., 2004). Посредством OGR1 ESC линии мы оказались способны воспроизвести процесс дифференцировки PGC in vitro, что демонстрировалось с помощью экспрессии EGFP , а также профиля экспрессии PGC маркеров. включая Oct3/4 (Figs. 1 and 2). Хотя исследованные PGC маркеры экспрессировались также в ESCs, эти маркеры не экспрессировались постоянно, а обнаруживали подавление активности после усиления активности во время образования EB (Fig. 2). Кроме того, EBs были культивированы в отсутствие LIF в течение, по крайней мере, 10 дней. Следовательно, очень вероятно, что большинство Oct3/4-позитивных клеток в EBs не остается недифференцированными ESCs, а дифференцируются в PGCs.
Данные, полученные в этом исследовании продемонстрировали, что Rhox6 экспрессируется в недифференцированных ESCs, происходящими из внутренней клеточной массы бластоциста. Мы установили, что экспрессируя Rhox6 регулируется во времени в ходе процесса дифференцировки PGC в EBs (Fig. 2A) и достигает своего максимального уровня на 6-й день после образования EB (Fig. 2B).
Базируясь на исследовании меток метилирования ДНК на по-разному метилированных регионах Igfr и H19 локусов , PGC-подобные клетки в EBs полностью теряли своё метилирование на 7-й день (Geijsen et al., 2004). В развивающихся эмбрионах очищение от метилирования ДНК родительского происхождения в PGCs происходит приблизительно на 10.5 день эмбриогенеза (Е) и заканчивается на E13.5 (Yamazaki et al., 2003). Т.о., PGC-подобные клетки дифференцируются в EBs на 7-й день и подобны постмиграторным PGCs у развивающихся эмбрионов. Экспрессия Rhox6 соответственно обнаруживается в гонадах самцов у E10.5 эмбрионов и достигает своего максимального уровня в постмиграторных PGCs E11.5 эмбрионов (Takasaki et al., 2000).
Мы показали, что конституитивный нокдаун Rhox6 существенно ингибирует дифференцировку PGC-подбных клеток в EBs (Fig. 4C). Эти данные показывают, что Rhox6 необходим для детерминации клона зародышевых клеток и экспрессируется в дифференцирующихся PGCs эмбрионов. Каждая линия ESC, выделенная в этом исследовании обладает отличающимися уровнями нокдауна или избыточной экспрессии Rhox6. Следовательно, будучи внесенными в бластоцисты хозяина в будущем исследовании, они смогут служить прекрасным инструментом для определения эффекта количественной экспрессии Rhox6
на детерминацию и дифференцировку PGC. Однако остается неясным, экспрессируется ли Rhox6 в PGCs на ст. E9.5 или раньше, когда происходит становление зародышевой линии у развивающихся эмбрионов. Обнаружение Rhox6 у эмбрионов на ст. E9.5 или более ранних стадиях довольно затруднительно из-за трудности получения зонда или антител, специфических к Rhox6 из-за высокого сходства его последовательностей с Rhox9. Вообще-то будущие исследования с использованием эмбрионов, которые экспрессируют EGFP, управляемым промотором Oct3/4, окажутся способны действительно определить полный профиль экспрессии Rhox6 в PGCs на разных стадиях путем выделения PGCs, исходя из экспрессии EGFP.
Согласно данным. полученным в этом исследовании избыточная экспрессия Rhox6 вызывает незначительные, если вообще вызывает, эффекты на дифференцировку PGC (Fig. 3D). У мышей детерминация зародышевой линии инициируется путем индукции сигнала от внеэмбриональной эктодермы к эпибласту на ст. E7.2 (Yoshimizu et al., 2001). В частности, этим сигналом является Bone morpho-
genetic protein 4 (Bmp4) (Lawson et al., 1999; Ohinata et al., 2009). Следовательно, дифференцировка PGC является скорее пассивным процессом у мышей, так что Rhox6 может не играть роли в автономном предопределении судьбы ESCs к формированию PGCs. Однако поскольку OGR1 клоны, исследованные в наших экспериментах, были изолированы в соответствии с появлением недифференцированных ESCs, то это может приводить к обогащению клонов, в которых уровни экспрессии Rhox6 выше не более, чем в три раза по сравнению с негативным контролем. Несмотря на это мы не наблюдали каких-либо специфических отличий в получении колоний с появлением дифференцированных клеток после электропортации в ESCs или Rhox6 или DsRedT3 трансгенов. Кроме того, трансгены, кодирующие Oct3/4, Gata6 и Cdx2 вносили в ESCs в отдельных экспериментах, чья экспрессия управлялась CAG промотором. Активация этих генов, как известно, индуцирует дифференцировку или примитивной энтодермы (Niwa et al., 2000; Fujikura et al., 2002) или трофобластов (Niwa et al., 2005). Как и ожидалось, мы оказались способны воспроизвести индуцированную дифференцировку ESCs (data not shown). Хотя мы не измеряли уровни транскриптов или белков от трансгенов в этих экспериментах, логические выводы привели нас к заключению, что эти трансгены достигают сходных уровней активности в ESCs , что и Rhox6 трансген. Хотя уровень экспрессии Rhox6 трансгена может быть увеличен при использовании др. систем, но Rhox6, по-видимому, не играет существенной роли в прямой индукции дифференцировки PGC.
|
Сайт создан в системе
uCoz Fig. 4. Continuous knockdown of Rhox6 expression significantly impairs PGC differentiation in EBs. (A) The short-hairpin (sh) RNA expression vectors phH1CCP and phH1CRB were built in this study and used to stably express shRNA against Rhox6, Rhox9 or both Rhox6 and Rhox9 (Rhox6&9). The abbreviations used are described in Fig. 3A, except for: H, human H1 promoter; ECFP, enhanced cyan fluorescent protein; Bsd, the blasticidin resistant gene. Bar, 1 kb. (B, left) The efficiency of shRNA knockdown was evaluated by sqRT-PCR in pools of drug-resistant ESCs transfected with the shRNA expression vectors, as indicated above. “Scrambled” indicates a negative control for shRNA expression. phH1CCP was used to drive shRNA expression
in this experiment. Expression levels of genes indicated on the right were examined. Labels are
explained in Fig. 2. (B,right)Relative expression levels of Rhox6 and Rhox9 transcripts were examined by qRT-PCR in individual drug-resistant ESC clones transfected with the shRNA expression
vectors indicated on the x-axis.An averaged value for ESCs that expressed control shRNA (Scrambled)
is normalized to 1. Esg1was used as a reference. Standard errors of the means are indicated by
bars. Parentheses indicate the number of biological replicates (i.e.,independent ESC clones transfected with the shRNA expression vectors). (C)ESC clones that stably expressed
either control shRNA (Scrambled, top) or shRNA against Rhox6 (middle and bottom)were
cultured as EBs (Fig. 1A).phH1CRB was used. At day 13,expression of EGFP (505 nm) and DsRedT3 (595 nm) was examined. EGFP was not detected in the EB in the bottom panel, whereas DsRedT3 was detected in all EBs. Bars, 50 mm. (D)The “EGFP levels” (see Materials and Methods) were compared among day
13 EBs generated from 24,26, 19 or 24 independent clones expressing control shRNA, or shRNA against
Rhox6, Rhox9 or both (Rhox6&9), respectively. Pair-wise comparisons with the control were performed in statistical tests.
Fig. 4. Continuous knockdown of Rhox6 expression significantly impairs PGC differentiation in EBs. (A) The short-hairpin (sh) RNA expression vectors phH1CCP and phH1CRB were built in this study and used to stably express shRNA against Rhox6, Rhox9 or both Rhox6 and Rhox9 (Rhox6&9). The abbreviations used are described in Fig. 3A, except for: H, human H1 promoter; ECFP, enhanced cyan fluorescent protein; Bsd, the blasticidin resistant gene. Bar, 1 kb. (B, left) The efficiency of shRNA knockdown was evaluated by sqRT-PCR in pools of drug-resistant ESCs transfected with the shRNA expression vectors, as indicated above. “Scrambled” indicates a negative control for shRNA expression. phH1CCP was used to drive shRNA expression
in this experiment. Expression levels of genes indicated on the right were examined. Labels are
explained in Fig. 2. (B,right)Relative expression levels of Rhox6 and Rhox9 transcripts were examined by qRT-PCR in individual drug-resistant ESC clones transfected with the shRNA expression
vectors indicated on the x-axis.An averaged value for ESCs that expressed control shRNA (Scrambled)
is normalized to 1. Esg1was used as a reference. Standard errors of the means are indicated by
bars. Parentheses indicate the number of biological replicates (i.e.,independent ESC clones transfected with the shRNA expression vectors). (C)ESC clones that stably expressed
either control shRNA (Scrambled, top) or shRNA against Rhox6 (middle and bottom)were
cultured as EBs (Fig. 1A).phH1CRB was used. At day 13,expression of EGFP (505 nm) and DsRedT3 (595 nm) was examined. EGFP was not detected in the EB in the bottom panel, whereas DsRedT3 was detected in all EBs. Bars, 50 mm. (D)The “EGFP levels” (see Materials and Methods) were compared among day
13 EBs generated from 24,26, 19 or 24 independent clones expressing control shRNA, or shRNA against
Rhox6, Rhox9 or both (Rhox6&9), respectively. Pair-wise comparisons with the control were performed in statistical tests.