Посещений:  ПРОФИЛИ ЭКСПРЕССИИ ГЕНОВ
ПРОФИЛИ ЭКСПРЕССИИ ГЕНОВ
В неоплодотвренных ооцитах и примордиальных зародышевых клетках
|
|
Comparative molecular portraits of human unfertilized oocytes and primordial germ cells at 10 weeks of gestationFerdinand Diedrichs, Barbara Mlody, Peggy Matz, Heiko Fuchs, Lukas Chavez, Katharina Drews and James Adjaye  Int. J. Dev. Biol. 56: 789 - 797 (2012)
doi: 10.1387/ijdb.120230ja |
Primordial germ cells (PGCs) are precursors of gametes and share several features in common with pluripotent stem cells, such as alkaline phosphatase activity and the expression of pluripotency-associated genes such as OCT4 and NANOG. PGCs are able to differ-entiate into oocytes and spermatogonia and establish totipotency after fertilization. However, our knowledge of human germ cell development is still fragmentary. In this study, we have carried out genome-wide comparisons of the transcriptomes and molecular portraits of human male PGCs (mPGCs), female PGCs (fPGCs) and unfertilized oocytes. We detected 9210 genes showing elevated expression in fPGCs, 9184 in mPGCs and 9207 in oocytes, with 6342 of these expressed in common. As well as known germ cell-related genes such as BLIMP1/PRDM1, PIWIL2, VASA/DDX4, DAZL, STELLA/DPPA3 and LIN28, we also identified 465 novel non-annotated genes with orthologs in the mouse. A plethora of olfactory receptor-encoding genes were detected in all samples, which would suggest their involvement not only in sperm chemotaxis, but also in the development of female germ cells and oocytes. We anticipate that our data might increase our meagre knowledge of the genes and associated signaling pathways operative during germ cell development. This in turn might aid in the development of strategies enabling better differentiation and molecular characterisation of germ cells derived from either embryonic or induced pluripotent stem cells. Ultimately, this would have a profound relevance for reproductive as well as regenerative medicine.
|
Промордиальные зародышевые клетки (PGCs) являются эмбриональными предшественниками гамет. Их следует рассматривать как материнские стволовые клетки благодаря их уникальной способности сохранять настоящую онтогенетическую тотипотентность. Но несмотря на многочисленные сходства с эмбриональными стволовыми клетками (ESCs), они обладают временной способностью к самообновлению и обладают определенными клон-специфическими характеристиками. Фактически, в нормальных условиях PGCs, как полагают, дифференцируются только в зародышевые клетки, которые являются ооцитами у самок и просперматогониями у самцов и в конечном итоге дают яйцеклетки и спермии, соотв. Вплоть до оплодотворения яйцеклетки обладают прирожденной программой зародышевых клеток в отношении тотипотентности.
Хотя и ограниченные в отношеении онтогенетичекого потенциала, PGCs обладают несколькими молекулярными характеристиками плюрипотентных клеток, включая высокую активность щелочной фосфатазы (Ginsburg et al., 1990; Goto et al., 1999), экспрессию ключевых генов, связанных с плюрипотентностью, таких как POU5F1/OCT4, NANOG и ESG1 (Goto et al., 1999; Western et al., 2005; Sabour et al., 2011). Кроме того, PGCs могут давать клетки эмбриональных карцином (EC), стволвые клетки тестикулярных опухолей in vivo. Помимо этого при культивировании в условиях стимулирования специфическими ростовыми факторами PGCs могут превращаться в плюрипотентные эмбриональные зародышевые (EG) клетки. Однако в отличие от EC и EG клеток, PGCs не могут быть культисированы неопределенно долго, не образуют эмбриоидных телец при культивировании и будучи инъецированы в хозяйские бластоцисты не могут заселять или соматическую или зародышевую линию (Donovan and de Miguel, 2003). PGCs трудны для изучения, поскольку они ограничены в числе, глубоко внедрены в эмбрион и, как известно, мигрируют во время развития (Ginsburg et al., 1990; McLaren and Southee, 1997), это ограничивает число эффективных исследованиий с использованием этих клеток. Предыдущие исследования продемонстрировали, что приблизительно на 7 день после оплодотворения (dpc) у мышей, PGCs могут быть обнаружены в основании алланитоиса внутри внеэмбриональной мезодермы. Эти PGCs развиваются в виде кластера из 40 – 50 клеток. На ст. 10 dpc PGCs мигрируют в генитальный гребень (Ginsburg et al., 1990; Goto et al., 1999; Anderson et al., 2000; Molyneaux et al., 2001; Saitou et al., 2002), стартует детерминация пола и заканчивается примерно на 13 dpc. Женские зародышевые клетки начинают вступать в мейоз в противопложность зародышевым клеткам самцов, которые вступаыют в паузу на митотической стадии и начинают мейоз спустя 10 после рождения (Ewing et al., 1993).
У человека PGCs идентифицируются в задней кишке на 4-й неделе беременности и затем мигрируют, чтобы колонизовать развивающиеся гонады на
7-й неделе беременности (Witschi, 1946; Gondos and Hobel, 1971; Motta and Makabe, 1986). На ~10 неделе беременности женские PGCs (fPGCs) начинают вступать в мейоз, тогда как мужские PGCs (mPGCs) продолжают делиться митотически пока они не будут арестованы в митоза на 16–18 неделе беременности (Gondos and Hobel, 1971; Goto et al., 1999).
Многие факторы контролируют миграцию, пролиферацию и организацию PGCs развивающихся гонад, а также интеграцию соматических клеток, окружающих PGCs.
Bone morphogenetic proteins (BMPs) регулируют экспрессию генов и образование PGCs (Ying et al., 2000; Ying and Zhao, 2001; Pesce et al., 2002). Недавние успешные исследования продемонстрировали, что PGCs могут происходить из плюрипотентных стволовых клеток in vitro , они могут затем дифференцироваться в ооцит-подобные клетки или сперматогония-подобные клетки (Hubner et al., 2003; Toyooka et al., 2003; Geijsen et al., 2004; Kee et al., 2006; Nagano, 2007; Qing et al., 2007; Wei et al., 2008; Panula et al., 2011).
Базируясь на сложной контрольной системе во время миграции, пролиферации и развития PGCs в гонадах многие нарушения могут возникать, если эта программа развития нарушается. Напр., разного типа germ-cell tumors (GCTs) могут возникать в результате неправильно регулируемой экспрессии ключевых, связанных с PGCs генов. GCTs являются гетерогенными
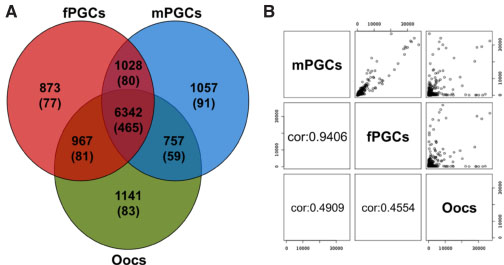 Fig. 1. Venn diagram-based analysis and cor-
relation of the transcriptome of female PGCs,
male PGCs and oocytes. (A) The Venn diagram
depicts the overlaps of genes with elevated ex-
pression levels in fPGCs, mPGCs and oocytes as
determined by microarray-based transcriptome
profiling. The numbers in brackets represent the
number of “novel” genes in each section which
have not been functionally annotated to date,
including, e.g. “LOC389936” , “C12orf12” , “FA-
M10A6” , “FLJ31568” , “KIAA0895L ” , “MGC35361” .
(B) Scatter plots depicting the correlation of
complete gene expression data sets of mPGCs,
fPGCs and oocytes. Raw data were normalized
by quantile normalization and Pearson correla-
tion coefficients (cor) calculated between the different samples.
Fig. 1. Venn diagram-based analysis and cor-
relation of the transcriptome of female PGCs,
male PGCs and oocytes. (A) The Venn diagram
depicts the overlaps of genes with elevated ex-
pression levels in fPGCs, mPGCs and oocytes as
determined by microarray-based transcriptome
profiling. The numbers in brackets represent the
number of “novel” genes in each section which
have not been functionally annotated to date,
including, e.g. “LOC389936” , “C12orf12” , “FA-
M10A6” , “FLJ31568” , “KIAA0895L ” , “MGC35361” .
(B) Scatter plots depicting the correlation of
complete gene expression data sets of mPGCs,
fPGCs and oocytes. Raw data were normalized
by quantile normalization and Pearson correla-
tion coefficients (cor) calculated between the different samples.
TABLE 1
CANONICAL PATHWAYS ENRICHED IN FEMALE PGC
AND OOCYTE TRANSCRIPTOMES
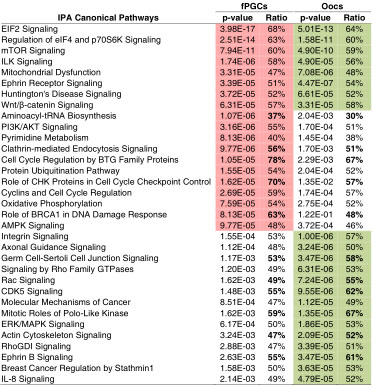 Summary of canonical pathways significantly enriched (p < 0.0001, highlighted in red (fPGCs) or green (oocytes)) in the set of genes expressed in fPGCs (9210) and oocytes (9207) as determined by IPA. The ratio describes the number of transcripts expressed in each data set that map to the pathway divided by the total number of genes that exist in the canonical pathway. To point out an additional level of enrichment bold numbers highlight differences between the fPGCs- or oocytes-specific ratios greater than or equal to 5%. The entire IPA output, including corresponding p-values and gene lists, is given in Supplementary Table 3.
Summary of canonical pathways significantly enriched (p < 0.0001, highlighted in red (fPGCs) or green (oocytes)) in the set of genes expressed in fPGCs (9210) and oocytes (9207) as determined by IPA. The ratio describes the number of transcripts expressed in each data set that map to the pathway divided by the total number of genes that exist in the canonical pathway. To point out an additional level of enrichment bold numbers highlight differences between the fPGCs- or oocytes-specific ratios greater than or equal to 5%. The entire IPA output, including corresponding p-values and gene lists, is given in Supplementary Table 3.
группами новообразований и классифицируются на 5 групп (I-V). Они возникают в яичниках и семенниках, а также в др. регионах вне гонад (Oosterhuis and Looijenga, 2005; Looijenga, 2009). В данном исследовании мы попытались получить молекулярные портреты неоплодотворенныз ооцитов, мужских и женских PGCs человека, используя мРНК, выделенные в предыдущих исследованиях (Adjaye et al., 1999; Goto et al., 1999;
Adjaye and Monk, 2000). Мы ожидали, что эти данные помогут сформировать
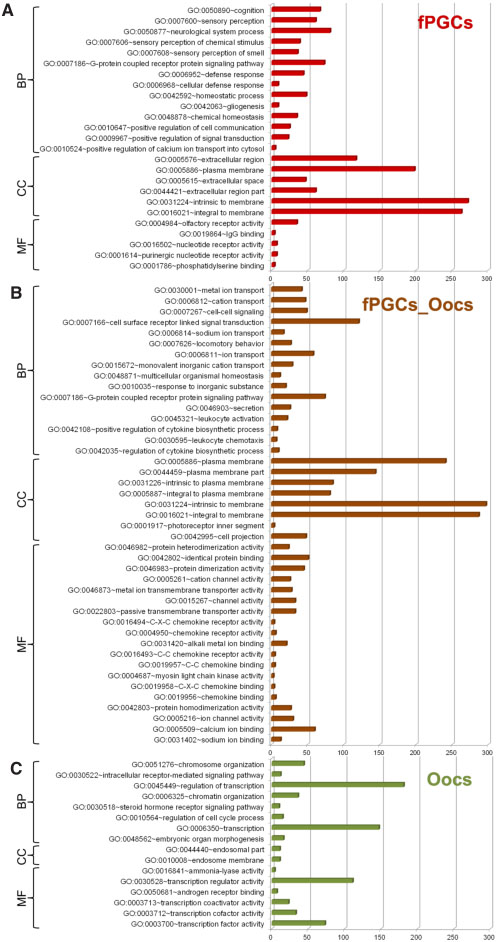 Fig. 2. DAVID analysis of female PGC- and oo-
cyte-specific genes. As shown in Fig. 1, all genes
exclusively expressed in either fPGCs (873, A) or
oocytes (1141, C) or overlapping between fPGCs
and oocytes (967 , B) were assessed for functional
enrichment of biological pathway-associated GOs
(BP), cellular component-associated GOs (CC) and
molecular function-associated GOs (MF) using the
DAVID database. Significantly enriched terms (p <
0.01) are depicted. The terms are ordered by increas-
ing p-values from top to bottom. The bars represent
the number of genes that mapped to each term. The
entire DAVID output, including corresponding p-values
and gene lists, is given in Supplementary Table 2.
Fig. 2. DAVID analysis of female PGC- and oo-
cyte-specific genes. As shown in Fig. 1, all genes
exclusively expressed in either fPGCs (873, A) or
oocytes (1141, C) or overlapping between fPGCs
and oocytes (967 , B) were assessed for functional
enrichment of biological pathway-associated GOs
(BP), cellular component-associated GOs (CC) and
molecular function-associated GOs (MF) using the
DAVID database. Significantly enriched terms (p <
0.01) are depicted. The terms are ordered by increas-
ing p-values from top to bottom. The bars represent
the number of genes that mapped to each term. The
entire DAVID output, including corresponding p-values
and gene lists, is given in Supplementary Table 2.
основу для более активного функционального исследования генов и ассоциированных путей, оперирующих в этих клетках.
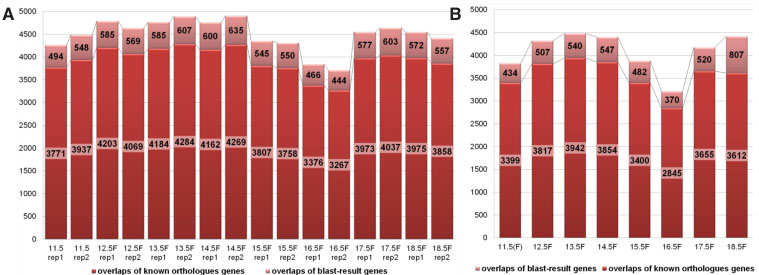
Fig. 3. Comparison of the transcriptomes of mouse and human female PGCs. Known orthologous genes (8876) and putative orthologous genes
resulting from our nucleotide BLAST search (1632) between human and mouse fPGCs (Sabour D et al., 2011) were analysed to identify overlaps. (A)
Comparison of separate mouse fPGCs samples (replicates 1 and 2) at distinct developmental stages (embryonic day 11.5 – 18.5) with our human fPGCs
gene expression data set. (B) Comparison of the intersection of mouse fPGCs replicates 1 and 2 with our human fPGCs transcriptome data.
Discussion
Кстати, in vivo происходящие транскриптомы мужских и женских PGCs были получены от мышей, у которых идентификация и выделение таких клеток легче с использованием промоторных последовательностей маркеров PGCs-клонов, таких как Oct4, Blimp1 и Prdm14 (Sabour et al., 2011; Saitou, 2009). Чтобы устранить этот недостаток в качестве моделей in vitro использовали как людские, так и мышиные (Hubner et al., 2003; Toyooka et al., 2003; Geijsen et al., 2004; Kee et al., 2006; Nagano, 2007; Qing et al., 2007; Wei et al., 2008; Hayashi et al., 2011; Panula et al., 2011) плюрипотентные стволовые клетки, базируясь на эмбриональных и индуцированных стволовых клетках. Хотя дифференцировка человеческих ESCs и iPSCs в PGCs-подобные клетки осуществлялась у мышей (Geijsen et al., 2004;
Kee et al., 2006; Panula et al., 2011) анализ транскриптома получаемых PGCs был ограничен известными PGCs-специфичными генами, такими как BLIMP1/PRDM1, c-KIT STELLA/DPPA3, VASA/DDX4 и FRAGILIS/IFITM5. Отсутствие геномного анализа транскриптома этих человеческих, происходящих из ESCs- и iPSCs-, PGCs в дальнейшем будет мешать глубокому пониманию и анализу ключевых механизмов, лежащих в основе сложных биологических процессов развития зародышевых клеток и последующего гаметогенеза человека.
В попытке преодолеть некоторые из упомянутых выше недостатки, связанные с современными in vitro моделями PGCs человека, мы осуществили в данном исследовании обширный, базирующийся на транскриптоме, сравнительный анализ молекулярного портрета SMART-сгенерированных, сцепленных с T7 промотором двунитчатых выборок кДНК, происходящих от 4 неоплодотворенных ооцитов, 200 mPGCs и 500 fPGCs полученных ранее (Adjaye et al., 1999; Goto et al., 1999). Для обогащения транскриптов, экспрессируемых в женских зародышевых клетках, мы включали mPGCs, исключив Y-сцепленные гены. Подтверждением успешности такого подхода с вычитанием является обнаружение экспрессии ZFY исключительно в mPGCs и Zona Pellucida генов ZP4 как в fPGCs, так и ооцитах, тогда как ZP1 и ZP3 обнаруживались только в ооцитах (Supplementary Table 1).
Среди хорошо охарактеризованных PGCs-специфических генов мы выявили, напр., экспрессию BLIMP1/PRDM1 и PIWIL2 только в fPGCs и mPGCs клетках, VASA/DDX4 в fPGCs и ооцитах, DAZL и STELLA/DPPA3 только в ооцитах (Supplementary Table 1). Интересно, что LIN28A экспрессируется во всех типах клеток и , как было установлено, на мышах Lin28, негативный регеулятор Let-7, является важным для развития PGCs и ассоциирует также с озлокачествлением зародышевых клеток (Rybak et al., 2008; West et al., 2009).
BMP передача сигналов, как было установлено, важны для спецификации PGCs (Ying et al., 2000; Ying and Zhao, 2001; Pesce et al., 2002) и это согласуется с обнаржужением нами экспрессии BMP2, 3, 4, 6, 7 и GDF1, 2, 3, 9 и 15 и рецепторов BMPR1A и BMPR2 (Supplementary Table 1).
Наблюдаемые изменчивые паттерны экспрессии, напр., VASA/DDX4 в fPGCs и ооцитах, DAZL и STELLA/DPPA3 в ооцитах могут быть объяснены тем, что PCR-based SMART-generated T7 promoter-linked double-stranded cDNA выборки сделаны из ограниченного количества клеток (4 unfertilized oocytes, 200 mPGCs and 500 fPGCs). Несмотря на это наш подход впервые позволил сделать снимок транскриптома этих редких клеток человека.
Сравнение транскриптомов fPGCs человека с транскриптомами PGCs, выделенными из мышиных эмбрионов на соотв. стадиях (E11.5 – E18.5) развития (Sabour et al., 2011) привело к идентификации 1632 мышиных генов ортологов с идентифицированными одинаковыми нуклеотидами внутри кодирующих регионов в пределах 100 – 22%. Наивысшее количество перекрывающихся генов было с транскриптомами от мышей на ст. E14.5 mice (Fig. 3), значение этого пока неизвестно. Более того, из 11 генов, идентифицировнных Sabour et al.,
как экспрессируемых исключтельно в мужских и женских PGCs как in vitro, так и in vivo, но не вESCs, мы идентифицировали 4 из них (4930432K21Rik, Mov10l1, Tex13, Hba-a1), как экспрессирующиеся в человеческих fPGCs, подтвердив тем самым качественность нашей базы данных, что подчеркивает консервацию ключевых генов, ассоциированных с PGCs и потенциально участвующих в развитии и спецификации PGCs у обоих видов.
Исходя из транскриптомных данных мы сможем ассоциировать экспрессируемые гены с сигнальными путями. Напр., мы идентифицировали ключевые сигнальные пути, такие как mTOR, WNT/β-catenin, ERK/MAPK, PI3K/AKT, эстрогенового рецептора и андрогенного рецептора, регуляции клеточного цикла с помощью белков семейства BTG, Rac, CDK5, Actin cytoskeleton, Ephrin B и передачу сигналов в соединениях зародышевые клетки-клетки Sertoli, как активные в fPGCs и ооцитах.
Цитологический анализ у мышей и человека подтвердил, что и женские и мужские PGCs в равной степени способны вступать в мейоз (12 dpc у мышей и 10 неделя у человека) и что выбор клеточной судьбы зародышевыми клетками, выбор между вступлением в мейоз или митоз происходит в гонадах (McLaren and Southee, 1997; Suzuki and Saga, 2008; Bowles and Koopman, 2010). Пока ещё неизвестно и спорно, вызывается ли вступление в мейоз в гонадами самок или это изначально запрограммировано в PGCs самоцов и самок и ингибируется в гонадах самцов и разрешается в гонадах самок, или это обусловлено комбинацией регуляторных факторов. В самом деле, мы наблюдали дифференциальную экспрессию транскрипционных факторов хозяина (напр., zinc finger containing transcription factors-ZNFs) в fPGCs и mPGCs, в качестве потенциальных регуляторов процесса принятия этих решений (Supplementary Table 1).
Более того, наблюдалась экспрессия некоторых генов, ассоциированных с компонентами мейотического аппарата, напр., синаптонемального комплекса (SYCP2, SYCP3, TEX11, TEX13B, TEX15), специфичных для мейоза cohesins (SMC1B, STAG3), аппарата мейотической рекомбинации (DMC1, MSH4, TRIP13), piRNA пути (PIWIL2, TDRD1, MAEL) и др. ассоциированных с мейозом генов (HSPA4L, HSF2BP, HORMAD2, INTS6, CREBL2, ATF7IP2, MTL5, ZFP473) (Su et al., 2011). Напротив в mPGCs мы выявили экспрессию NODAL, который, как было установлено, на мышах осуществляет аутокринную сигнальную роль во время спецификации мужских PGCs (Souquet et al., 2012).
Неожиданным наблюдением в нешем исследовании стала экспрессия большого количества генов, кодирующих обонятельные рецепторы в fPGCs, mPGCs
и неоплодотворенных ооцитах (Table 4). Обонятельные рецепторы (ORs) , которые являются G-protein-coupled receptors (GPCR) имеют 7-трансмембранных доменов как у многих нейротрансмиттеров и гормональных рецепторов и ответственны за распознавание и за G белком обеспечиваемую трансдукцию сигналов от пахучих веществ. В более раннем исследовании с использованием тех же fPGCs и mPGCs мРНК (differential display based-analyses) , что использовались и в данном исследовании, мы идентифицировали OR-ктдирующие гены, экспрессируемые в mPGCs клетках (Goto et al., 1999). Хотя OR-кодирующие гены уже были выявлены в mPGCs, обнаружение их экспрессии в fPGCs и ооцитах в данном исследовании не является артефактом, т.к. недавно было показано, что широко распространена экспрессия генов, связанных с обонянием в тканях столь несходных, как семенники, мышцы, печень и кожа, хотя некоторые из них могут быть псевдогенами (Feldmesser et al., 2006). Из 164 экспрессируемых OR-кодирующих генов, OR10J1, OR11A1,
OR1D2, OR52K1 и OR7A17 были выявлены, как экспрессирующиеся в семенниках человека (Feldmesser et al., 2006) из них только OR10J1 был выявлен как экспрессируемый в mPGCs (Parmentier et al., 1992). Кроме того, из 164 OR-кодирующих генов человека гены дифференциально экспрессировались в mPGCs, fPGCs и ооцитах, нами идентифицированы 33 мышиных ортолога (напр., OR51M1/Olfr78, OR4D11/Olfr1423 and OR1B1/Olfr362) выделены красным (Table
4). Хотя и неожиданно, но это первое описание большого количества OR-кодирующих генов, обнаруживающих существенное перекрывание и характерные паттерны экспрессии в необлодотворенных ооцитах человека, мужских и женских PGCs на 10-й неделе беременности. Базируясь на наших находках, выдвигается гипотеза, что гены, кодирующие OR, участвуют в хемотаксисе спермиев.
In summary, we anticipate that our current dataset will provide
insights into the design of more extensive functional studies that
might increase our meagre knowledge of the genes and associated
signaling pathways operative during germ cell development and
hence in turn lead to the development of strategies enabling better
differentiation and molecular characterisation of germ cells derived
from either ESCs or iPSCs. Ultimately, this would have a profound
relevance to reproductive as well as regenerative medicine.
|

 Summary of canonical pathways significantly enriched (p < 0.0001, highlighted in red (fPGCs) or green (oocytes)) in the set of genes expressed in fPGCs (9210) and oocytes (9207) as determined by IPA. The ratio describes the number of transcripts expressed in each data set that map to the pathway divided by the total number of genes that exist in the canonical pathway. To point out an additional level of enrichment bold numbers highlight differences between the fPGCs- or oocytes-specific ratios greater than or equal to 5%. The entire IPA output, including corresponding p-values and gene lists, is given in Supplementary Table 3.
Summary of canonical pathways significantly enriched (p < 0.0001, highlighted in red (fPGCs) or green (oocytes)) in the set of genes expressed in fPGCs (9210) and oocytes (9207) as determined by IPA. The ratio describes the number of transcripts expressed in each data set that map to the pathway divided by the total number of genes that exist in the canonical pathway. To point out an additional level of enrichment bold numbers highlight differences between the fPGCs- or oocytes-specific ratios greater than or equal to 5%. The entire IPA output, including corresponding p-values and gene lists, is given in Supplementary Table 3. 
