Посещений:  РАЗВИТИЕ КРОВЕНОСНЫХ СОСУДОВ
РАЗВИТИЕ КРОВЕНОСНЫХ СОСУДОВ
Роль кровотока и микроРНК
|
|
The role of blood flow and microRNAs in blood vessel development
DONG LIU, JANNA KRUEGER and FERDINAND LE NOBLE Int. J. Dev. Biol. 55: 419-429
doi: 10.1387/ijdb.103220dl
|
The circulatory system is the first organ system that develops during embryogenesis, and is essential for embryo viability and survival. Crucial for developing a functional vasculature are the specification of arterial-venous identity in vessels and the formation of a hierarchical branched vascular network. Sprouting angiogenesis, intussusception, and flow driven remodeling events collectively contribute to establishing the vascular architecture. At the molecular level, arterialvenous identity and branching are regulated by genetically hardwired mechanisms involving Notch, vascular endothelial growth factor and neural guidance molecule signaling pathways, modulated by hemodynamic factors. MicroRNAs are small,non-coding RNAs that act as silencers to fine-tune the gene expression profile. MicroRNAs are known to influence cell fate decisions,and microRNA expression can be controlled by blood flow, thus placing microRNAs potentially at the center of the genetic cascades regulating vascular differentiation. In the present review,we summarize current progress regarding microRNA functions in blood vessel development with an emphasis on studies performed in zebrafish and mouse models.
|
Формирование собственно разветвленной сосудистой системы является критическим для развития и жизнеспособности эмбриона. Два последовательных процесса, наз. васкулогенез и ангиогенез участвуют в образовании кровеносных сосудов во время эмбрионального развития. Васкулогенез это дифференцировка in situ ангиобластов и эндотелиальных клеток из мезенхимы и их слияние в трубочки первичного сосудистого сплетения. Процесс отвечает за за формирование центральных осевых сосудов (включая дорсальную аорту) и сети капилляров. Расширение первичной сосудистой системы, образующейся при васкулогенезе, происходит посредством разрастания и intussusception ангиогенеза. Эти самостоятельные процессы ангиогенеза ведут к ремоделированию первичного сосудистого сплетения в иерархическое сосудистое древо, состоящее из разветвленных артерий, капилляров и разветвленных вен. Генетический импринтинг артериальных и венозных качественных характеристик в эмбриональных сосудах использует передачу сигналов Notch (Lawson et al., 2002), которой противодействует COUP-TFII (Gridley, 2007; Swift and Weinstein, 2009). Установлено, что артерии и вены экспрессируют разные молекулярные маркеры, включая гены наведения нервов, подобные ephrinB2 и Unc5B, в артериях и EphB4 и neuropilin-2 в венах.
Ангиогенез разрастания участвует в отпочковании и расширении новых сегментов предсуществующих сосудов, которые врастают в до этого бессосудистые области. Основной движущей силой этого процесса являются градиенты vascular endothelial growth factor (VEGF) и гипоксия (Ruhrberg et al., 2002). Теперь установлено, что растущие ангиогенные врастания (sprout) состоят из генетически отличающихся клеточных популяций, т. наз. эндотелиальных кончиковых и стебельковых (stalk) клеток (De Smet et al., 2009; Gerhardt et al., 2003). Кончиковые клетки обладают многочисленными филоподиями, которые исследуют локальное окружение на предмет сигналов наведения. Стебельковые клетки могут пролиферировать м формировать просвет из соотв. врастания. Молекулярные ключевые игроки, участвующие в дифференцировке на кончиковые и стебельковые клетки включают передачу сигналов Notch-delta-liкe 4 (Hellstrom et al., 2007; Phng et al., 2009; Siekmann and Lawson, 2007; Suchting et al., 2007), передачу сигналов VEGF (Chappell et al., 2009; Covassin et al., 2006; Tammela et al., 2008), а также гены рецепторов наведения нервов (larrivee et al., 2009), которые вносят вклад в наведение и позиционирование растущих разрастаний. Молекулярные процессы, управляющие дифференцировкой врастаний обсуждаются детально Anne Eichman в данном номере.
После начала кровотока первичные сосудистые сплетения обнаруживают высокую степень пластичности. Сосуды с высоким кровотоком делаются шире, кровеносные сосуды с низким кровотоком регрессируют, а некоторые сосудистые сегменты отсоединяются и повторно используются, чтобы обеспечить рост др. сосудистых компартментов (Buschmann et al., 2010; le Noble et al., 2004). Поскольку кровеносные сосуды с высоким кровотоком в целом, по-видимому, имеют меньше или не имеют эндотелиальных кончиковых клеток, то увеличение кровотока ассоциирует с индукцией расщепляющего ангиогенеза, также обозначаемого как intussusception (Djonow et al., 2000; 2003) . Этот процесс вносит вклад в увеличение количества капилляров, регулировке углов ответвления сосудов в ответ на кровоток и придает отличия малым артериолам и венулам от капиллярных сплетений. Подробнее у Valentin Djonov в данном номере. Важность кровотока в регуляции артериально-венозной дифференцировки и формировании паттерна сосудов недавно показана в серии исследований с использованием рыбок данио, эмбрионов кур и мышей (Buschmann et al., 2010; le Noble et al., 2004; Lucitti et al., 2007; Nicoli et al., 2010). У эмбрионов мышей и кур отсутствие кровотока в сосудистом сплетении желточного мешка, напр., вызывает отсутствие кардиальной активности, в результате нарушается ремоделирование артерий и вен от капилляров. Более того, у эмбрионов кур воздействие на артерии венозным кровотоком аедет к подавлению артериальных маркерных генов, включая ephrinB2 и neuropilin-1 и появлению венозных маркеров, включая neuropilin-2 и COUP-TFII в прежде артериальном домене. Напротив, венты подвергнутые действию артериального кровотока теряют венозные маркеры и вместо этого начинают экспрессировать артериальные маркеры, указывая тем самым, что факторы гемодинамики могут модулировать экспрессию генов качественных особенностей артерий и вен. Поскольку мыши, мутантные по таким генам обычно обнаруживают дефекты ремоделирования сосудов во время раннего эмбриогенеза, то кровоток может вносить вклад в поддержание экспрессии этих генов, способствуя ремоделированию артерий и вен.
У мутантных Mlc2a+ мышей, которые обнаруживают избирательные эффекты сократимости сердца, не происходит собственно контроля за кардиальным выбросом и ремоделирование желточного мешка (Lecitti et al., 2007). Это может быть приписано механическим свойствам раннего кровотока, а не присутствием факторов ангиогенной циркуляции или изменениями в способности переносить кислород (Lecitti et al., 2007). Используя технику отлавливания эритробластов и инъекции синтетических сахаров с высоким мол. весом, было продемонстрировано, что механические силы, обычно передаваемые током циркулирующих эритроцитов, необходимы и достаточны, чтобы вызывать ремоделирование сосудов в желточном мешке ранних эмбрионов мыши. У мутантных neuropilin-1 мышей перфузия желточного мешка, инициируемая путем последующего образования артериально-венозной сети,тяжело нарушена, указывая тем самым, что функция активного neuropilin-1 необходима для трансдукции механических сил, оказываемых кровотоком на реакцию ремоделирования (Jones et al., 2008).
Мы недавно исследовали, какой гемодинамический сигнал, издаваемый кровотоком, может отвечать за поддержание генов качественных особенностей в развивающихся артериях сосудистого сплетения желточного мешка эмбрионов кур (Buschmann et al., 2010). мы рассматривали факторы, связанные с током крови (shear стресс), давлением (с давлением связанные циклические растяжения сосудов) и кислород. Наилучшие различия между артериями и венами получены при подсчете максимального пульсового увеличения величин shear относительно усредненного по времени величины shear в том же самом сосуде: relative pulse slope index (RPSI). RPSI достоверно выше в артериях, чем в венах. Экспериментальное снижение RPSI в предсуществующих артериолах приводило к потере артериальных маркеров и появлению венозных маркеров (Buschmann et al., 2010). Воздействие in vitro режима пульсового shear усиливало экспрессию артериальных маркеров, включая hey/hes транскрипционные факторы и ephrinB2 по сравнению с воздействием устойчивого shear. Во время раннего эмбриогенеза артериальное давление в развивающейся системе сосудов желточного мешка чрезвычайно низкое ( приблизительно 2 mmHg в артериях и менее 1 mmHg в венах) а давлением вызываемые циклические растяжения сосудов ограничены только аортой. Роль давления в ремоделируемых сосудах у взрослых хорошо известна, низкое давление в эмбриональной системе, так же как и небольшие различия в давлении между между артериями и венами, делают их уникальными на этой стадии развития, эндотелиальные клетки могут чувствовать значения выше абсолютного порога давления , после чего они начинают экспрессировать гены артериальных маркеров. Гипоксия, как известно, стимулирует экспрессию артериальных маркеров в эндотелиальных (предшественниках) клетках in vitro. неожиданно воздействие на развивающийся эмбрион глобальной гипоксии вызывает снижение образования в артериальной сети желточного мешка, скорее всего, из-за негативного ионотропного эффекта гипоксии на активность сердца (Nintu et al., 2009), приводя к снижению кардиального выброса и и доставки в вителлиновую циркуляцию.
Помимо модулирования характеристик сосудов кровоток также вносит вклад в придание формы глобальному паттерну развивающихся артериально-венозных сетей (le Noble et al., 2004). У эмбрионов кур этот ток вызывает морфологические изменения, включая: 1) ток управляет слиянием малого калибра сосудов в крупные трубки, процесс, объясняющий образование крупных вителлиновых артерий и вен, 2) избирательное разъединение эндотелиальных клеток от артериальной системы и повторное использование этих эндотелиальных клеток, чтобы обеспечить рост венозной системы, 3) shear стресс управляет ведением люминизированных сосудистых врастаний. Более того, в ответ на изменения в распределении артериального кровотока мы отмечали значительную индукцию intussusception с целью формирования паттерна артерий в направлении возбуждающего кровоток распределения. Такая уникальная пластичность паттерна артерий в ответ на кровоток может быть ограничена в раннем эмбриогенезе, а во время более поздних стадий др. сигналы, происходящие из сосудистых гладкомышечных клеток и околососудистых нервов, четко вносят вклад в регуляцию характеристик сосудов и формирование паттерна (Larrivee et al., 2009).
Хотя эмбрионы рыбок данио могут давать крупные аксиальные сосуды, подобные аорте и кардинальной вене, а также сегментные ответвления в отсутствие перфузии, недавно было показано, что течение крови важно для индукции событий разрастания в аортальной дуге, с участием активации гена kfl2, чувствительного к shear стрессам, активирующего передачу сигналов VEGF (Nicoli et al., 2010). Кроме того, кровоток, как было установлено, важен для формирования артериальной коллатеральной циркуляции, приводящей к перенаправлению кровотока вокруг стеноза аорты у мутантов gri после вдщсл рыбок данио ( Gray et al., 2007). Помимо кровотока эта реакция зависит от циркулирующих миэлоидных клеток, но происходит независимо от гипоксии или ишемии ткани.
Поскольку у взрослых сосудистая сеть в целом в покоящейся стадии, постнатальное сосудистое развитие происходит в ответ на разнообразные физиологические и патологические условия, включая тканевую ишемию, репарацию ткани, опухолевый рост и репродуктивные функции (Carmeliet, 2003). Специальный тип сосудистой адаптации наблюдается после закупорки артерии (Schaper, 2009). В этом случае закупорка провоцирует перераспределение кровотока, приводя в результате к формированию коллатеральной артериальной сети, которая обходит закупорку и направляет кровоток в нуждающуюся область.
Этот "биологический обход" критически детерминирует клинические исходы при некоторых ишемических сердечно-сосудистых заболеваниях, включая инсульт, инфаркт сердца и периферическую ишемию (Schaper, 2009). Установлено, что генез артерий, направленное наружу ремоделирование предсуществующих артериол (главным образом в проксимальной части сети)и ангиогенез (в основном в дистальной части сети) вносят вклад в восстановление кровотока и оксигенацию после ишемического инсульта. Усиление кровотока, по-видимому, является важным триггером для реакции генеза артерий (Eitenmuller et al., 2006), поскольку тканевая ишемия ассоциирует с величиной ангиогенной реакции. Интересно, что ингибирование биогенеза miRNAs ведет к тяжелому нарушению сосудистого адаптивного ответа после закупорки артерии (Suarez et al., 2008). Учитывая регуляторную роль miRNAs в выборе судьбы клетками и в контроле клеточного цикла, а также наблюдения, что кровоток может регулировать экспрессию miRNA, то miRNAs оказываются потенциально важными мишенями для подходов к терапевтическому артериогенезу.
MiRNA structure and function
MiRNAs это однонитчатые, некодирующие молекулы РНК из 18-25 нуклеотидов. Первые miRNA у животных были описаны в 1993 Lee с сотр. в лаб. Victor Ambros в качестве регуляторов времени развития у Caenorhabditis elegans (Lee et al.,1993). И вплоть до 2001 было подтверждено, что miRNAs широко распространены у разных растений и животных, включая Caenorhabditis elegans,Danio rerio, Homo sapiens и растение Arabidopsis Thaliana (Lagos-Quintana et
al., 2001; Lau et al.,2001; Lee and Ambros,2001). Поскольку механизмы, используемые miRNAs, для регуляции экспрессии генов всё ещё спорны, но общепринято, что основной функцией miRNAs является замалчивание генов. По этой причине miRNA комплементарны частично одной или нескольким мРНК. У животных miRNAs обычно комплементарны сайту 3'UTR. Экспериментальные доказательства демонстрируют разные роли miRNAs в физиологических и патофизиологических процессах. Становится ясно, что miRNA играют разные роли в фундаментальных биологических процессах, таких как пролиферация, дифференцировка, рост, апоптоз, стрессовые реакции и туморогенез. В частности, miRNAs участвуют в различных аспектах развития животных, таких как нервы, мышцы и сердечно-сосудистое развитие(Kloosterman and Plasterk, 2006; Stefani and Slack, 2008).
В данном обзоре суммируется современный прогресс нашего понимания роли miRNA в развитии кровеносных сосудов. Очевидно, что miRNAs и сигнальные пути участвуют в сосудистом развитии, координируя точность образования сложной структуированной артериально-венозной сосудистой сети и растут экспериментальные доказательства, указывающие, что miRNAs играют важные роли в регуляции экспрессии генов в развитии кровеносных сосудов и в болезнях. связанных с ангиогенезом.
MiRNA discovery, biogenesis and fundamental function
В 1993 Lee and Feinbaum установили, что C. elegans ген lin-4 не кодирует белка, но продуцирует пару коротких РНК (Lee et al., 1993). Два небольших транскрипта lin-4 приблизительно в 22 и 61 нуклеотид, как было установлено, содержат последовательности, комплементарные элементу с повторяющимися последовательностями в 3' UTR мРНК lin-14, подтвердив. что lin-4 регулирует трансляцию lin-14 посредством антисмыслового РНК-РНК взаимодействия (Lee et al., 1993;Wightman et al., 1993). Но термин microRNA стал использоваться только с 2001, когда было установлено обилие этих крошечных регуляторных РНК (Lagos-Quintana et al., 2001; Lau et al., 2001; Lee and Ambros, 2001). В настоящее время miRNAs были подтверждены у различных животных, включая C. elegans, рыбок данио, кур, мышей и человека (Cheng et al., 2007; van Rooij et al., 2006).
MiRNAs могут кодироваться независимыми генами, которые содержат свой собственный промотор гена miRNA и регуляторные единицы, но могут быть также преобразованы из различных видов РНК, включая интроны, экзоны, 3' UTRs в мРНК, длинные некодирующие РНК, snoRNAs и транспозоны (Bartel, 2004; He et al., 2008; Saraiya and Wang,2008). Около 40% генов miRNA может быть расположено в интронах белок-кодирующих генов и даже в экзонах (Rodriguez et al., 2004). Эти гены обычны в смысле ориентации и как следствие могут быть регулированы совместно с их генами хозяевами (Baskerville and Bartel,2005; Caiet al.,2004; Kim and Kim,2007; Rodriguez et al., 2004; Weber, 2005).
MiRNA гены обычно транскрибируются с помощью RNA polymerase II, но небольшое количество miRNA может быть также транскрибировано с помощью RNA polymerase III, такое, как то, что из transfer RNA (tRNA) (Faller and Guo, 2008; Lee et al., 2004). Продукты транскрипции варьируют в пределах от сотен до тысяч нуклеотидов в длину, которые значительно длиннее зрелых miRNAs. Они обычно покрываются модифицированными нуклеотидами на 5' конце и полиаденилируются (Cai et al., 2004; Lee et al., 2004). Каждый первичный транскрипт, наз. pri-miRNA преобразуется в короткую ствол-петля структуру, которая наз. pre-miRNA. После этого pre-miRNA экспортируется из ядра в цитоплазму в процессе, использующем нуклео-цитоплазматический челнок Exportin-5. Наконец, шпилька отщепляется с помощью RNase III энзима Dicer в РНК дуплекс. Затем одна из двойных нитей инкорпорируется в RNA-induced silencing complex (RISC), где путем спаривания оснований с 3'UTR своей мРНК мишени осуществляется замалчивание гена.
Механизм, используемый miRNAs для регуляции экспрессии генов всё ещё предмет споров. В самом деле растут доказательства, указывающие, что miRNAs репрессируют экспрессию белка на нескольких уровнях: (a) Деаденилирование, сопровождаемое деградацией мРНК; (b) конкуренция за eIF6/60S рибосомальные субъединицы; (c) конкуренция за связывание шапочки (cap binding); (d) блокирование циркуляризации мРНК с помощью деаденилирования; (e) преждевременное окончание трансляции (ribosome drop-off); (f) ингибирование трансляционной элонгации; и (g) ко-трансляционная деградация белка (Carthew and Sontheimer, 2009; Chekulaeva and Filipowicz, 2009; Eulalio et al., 2008). МикроРНК могут также замалчивать свои мишени путем секвестрирования мРНК в дискретных цитоплазматических фокусах, известных как мРНК преобразующие тельца или P тельца, которые не допускают использование аппарата трансляции (Eulalio et al., 2008). Кроме того, miRNAs животных могут индуцировать значительную деградацию мРНК мишеней несмотря на неточное спаривание оснований mRNA-miRNA (Behm-Ansmant et al., 2006; Giraldez et al., 2006).
Подсчитано, что около трети генов регулируется с помощью miRNAs. Сложность зависимой от miRNA экспрессии генов далее подтверждается тем фактом, что более, чем одна miRNA может кооперативно соединяться с одним и тем же 3' UTR и что каждая miRNA может регулировать сотни мишеней (Doench et al., 2003). Подобно транскрипционным факторам, miRNAs регулируют разнообразные клеточные пути и , по-видимому, регулируют большинство биологических процессов у растений и животных в пределах от функций домашнего хозяйства до реакции на средовые стрессы (Bartel and Chen, 2004; Stefani and Slack, 2008; Yekta et al., 2008). Как базовые, так и клинические исследования подтверждают, что miRNAs являются важными регуляторами клеточной дифференцировки, роста. пролиферации и апоптоза (Ambros, 2004; Hwang and Mendell, 2006; Jovanovic and Hengartner, 2006). Следовательно, miRNAs должны быть жизненно важными регуляторами нормального развития, физиологии и возникновения болезней.
MiRNA expression signature in blood vessels
Способ тканеспецифической экспрессии является одной из важнейших характеристик экспрессии miRNA. По существу, одна miRNA может экспрессироваться на высоком уровне водной ткани, но не иметь или иметь низкий уровень экспрессии в др. тканях (Lagos-Quintana et al., 2002). В настоящее время ожидается получение систематического профиля экспрессируемых miRNAs в эндотелиальных клетках, гладкомышечных клетках в разных анатомических местах или при разных ангиогенных состояниях. Недавно получены профили экспрессии 360 miRNAs человека с использованием real-time PCR в HUVECs. Но сравнительный анализ был осуществлен только для 23 miRNAs (Bonauer et al., 2009). Polisino et al. осуществили широкомасштабный анализ экспрессии miRNA в HUVECs и идентифицировали 27 высоко экспрессируемых miRNAs (Poliseno et al., 2006). Tamia A. Harris et al. измеряли экспрессию miRNA в эндотелиальных клетках. используя микромассивы. Вся РНК из HUVECs фракционировалась, метилась флюоресцентной краской и гибридизировалась на чипе для микромассива. Из 500 зондов miRNA на таком чипе идентифицировано 26 miRNA с наивысшим уровнем экспрессии в HUVECs. Наиболее частой экспрессируемой сосудистой miRNA стала miR-126 (Harris et al., 2008).
Чтобы изучить биологические функции miRNA в сосудистых заболеваниях, Ruirui Ji et al. определяли экспрессию miRNA в carotid артерии крыс путем анализа микромассивов
miRNA (Ji et al.,2007). В целом 140 miRNAs , из 180 (более 70%) проанализированных, среди них 49 обнаруживали высокую экспрессию. Сегодня около 200 miRNAs выявлено в эндотелиальных клетках человека с помощью разных методов.
Effects of interrupting miRNA biogenesis on vascular development
Конституитивная экспрессия белков Dicer и Drosha была обнаружена в цитоплазме и ядре эндотелиальных клеток, соотв. при использовании иммуно-цитохимии и Western blot (Kuehbacher et al., 2007; Suarez et al., 2007). Значение miRNAs для функции эндотелиальных клеток и развития кровеносных сосудов было установлено по нарушению функции Dicer и Drosha, двух RNase III энзимов, необходимых для биогенеза miRNA .
Истощение Dicer с использованием siRNA в эндотелиальных клетках изменяло несколько ключевых регуляторов, включая рецепторы ростовых факторов, хемокины. цитокины и некоторые др. связанные с ангиогенезом гены, такие как Tie-1, Tie-2, Id3, eNOS, IL-8, ENG (Endoglin), AKT1 и VEGFR2. Замалчивание генов Dicer и Drosha существенно снижает разрастание капилляров и пролиферацию эндотелиальных клеток. Нокдаун Dicer приводит к существенному нарушению активности по формированию сосудов в обычных условиях и после стимуляции сывороткой или VEGF в HUVECs и EA.hy.926. При методе in vivo matrigel plug структуры, подобные сосудам, существенно уменьшались в числе в Matrigel plugs с нокдауном Dicer в HUVECs. Напротив, трансфекция Drosha siRNA не существенно влияли на ангиогенез врастания в Matrigel plugs in vivo (Kuehbacher et al., 2007; Shilo et al., 2008; Suarez et al., 2007). В этом случае менее драматические эффекты нокдауна Drosha, могут быть объяснены mirtrons-short шпилечными интронами, которые составляют альтернативный источник биогенеза microRNA у животных и используют аппарат для обхода расщепления Drosha при инициальном созревании (Chan and Slack, 2007).
Полная потеря функции Dicer ведет к выраженным онтогенетическим дефектам как у рыбок данио, так и мышей. У рыбок данио строгая экспрессия материнской мРНК dicer1 и повсеместное усиление экспрессии к 2 dpf было выявлено посредством гибридизации in situ тотального препарата. Целенаправленная активация гена dicer1 у рыбок данио приводила к тому, что накопление miRNA останавливалось после нескольких дней и останавливалось развитие на 10 день (Wienholds et al., 2003).
Материнские-зигогтические мутанты dicer , которые лишены как материнских, так и зиготических Dicer, способны к формированию оси и дифференцировке множественных типов клеток, но обнаруживают аномальный морфогенез во время гаструляции, формирования головного мозга, сомитогенеза и развития сердца. Эндотелиальные и гематопоэтические клетки предшественники присутствовали, исходя из экспрессии маркеров fli-1 и scl, но экспрессия эндокардиального fli-1 снижена и циркуляция крови нарушена у MZ-dicer мутантов (Giraldez et al., 2005).
В двух независимых исследованиях было установлено, что Dicer важен для нормального развития мыши. Bernstein et al., сообщили, что потеря Dicer1 ведет к гибели в раннем развитии, при этом Dicer1-нулевые эмбрионы лишены стволовых клеток. На ст. E7.5, субнабор Dicer мутантных эмбрионов мыши выглядят маленькими и морфологически аномальными, хотя различия между эмбриональными и внеэмбриональными регионами распознаются. Было предположено, что у Dicer мутантных мышей рост арестовывается прежде, чем план тела будет сконфигурирован во время гаструляции (Bernstein et al., 2003). В др. исследовании Dicer-ex1/2 гомозиготные эмбрионы обнаруживали фенотип задержки развития и погибали между 12.5 и 14.5 днем беременности. Интересно, что было обнаружено, что образование и поддержание кровеносных сосудов у dicer-ex1/2 эмбрионов и в желточном мешке серьёзно нарушено, это указывает на возможную роль Dicer в ангиогенезе. Эти находки были подтверждены изменением экспрессии Vegf, Flt1, Kdr и Tie1 у мутантных эмбрионов. Итак. было установлено, что Dicer осуществляет свою функцию в ангиогенезе эмбрионов мыши возможно посредством своей роли в процессинге miRNA, которые регулируют уровни экспрессии некоторых критических для ангиогенеза регуляторов в клетках (Yang et al., 2005).
Чтобы преодолеть раннюю гибель, были созданы условные мутантные Dicer мыши Harfe et al. , используя условный аллель Dicer и трансгенную линию мышей, которая экспрессировала Cre в мезодерме конечностей, они осуществили инициальную характеристику роли, которую Dicer играет в развитии конечностей позвоночных (Harfe et al., 2005). Специфичная для сердца делеция Dicer приводила к быстрой прогрессирующей дилятационой кардиомиопатии, недостаточности сердца и постнатальной гибели. Было также показано, что уровень экспрессии некоторых важных белков в сердце изменен за счет потери Dicer (Chen et al., 2008). Чтобы выяснить важность специфичных для эндотелия miRNAs в постнатальном ангиогенезе, Suarez Y et al. создали две мышиные модели, которые были гомозиготные по условному floxed Dicer аллелю и экспрессировали Cre-recombinase под контролем промотора Tie2 или Tamoxifen (TMX)-индуцируемой экспрессируемой Cre-recombinase под контролем промотора сосудистого эндотелиального кадерина, чтобы вызывать специфическую инактивацию Dicer в эндотелиальных клетках.
Посредством этих моделей было показано, что снижение эндотелиальных miRNAs с помощью клеточно-специфической инактивации Dicer снижало постнатальную ангиогенную реакцию от разнообразных стимулов, включая экзогенный VEGF, опухоли, ишемию конечностей и заживление ран (Suarez et al., 2008). Делеция Dicer в сосудистых гладких мышцах (VSM) приводила к поздней эмбриональной летальности на эмбриональный день 16-17, и была связана с обширными внутренними кровоизлияниями. Потеря VSM Dicer приводила к образованию расширенных тонкостенных кровеносных сосудов в результате снижения клеточной пролиферации. Кроме того, кровеносные сосуды от VSM-deleted Dicer мышей обнаруживали нарушение сократимости из-за потери контрактильных белков (Albinsson et al., 2010).
Individual miRNAs in endothelial cell biology
Различные miRNAs, как полагают, экспрессируются тканеспецифическим образом и могут выполнять тканеспецифические роли. Тканевая специфичность является своеобразным свойством miRNAs и может иметь значение также во время ангиогенеза, для которого высоко скоординированные многоступенчатые процессы необходимы. Сегодня ряд miRNAs идентифицирован, экспрессирующихся в эндотелиальных клетках и участвующих в развитии кровеносных сосудов (Table 1).
Посредством in situ гибридизации с LNA (locked-nucleic acid) зондами, miRNA-126 была обнаружена в кровеносных сосудах и сердце рыбок данио (Wienholds et al., 2005). Затем некоторые in vitro и in vivo эксперименты показали, что miR-126 экспрессируется также в эндотелиальных клетках млекопитающих. Было установлено. что HUVECs довольно часто экспрессируют miR-126. Изучение экспрессии miR-126 в первичных эндотелиальных клетках человека и др. линиях клеток, показали, что эндотелиальные клетки из вен, артерий, кожи и головного мозга, все экспрессируют miR-126. Однако, др. клеточные линии, такие как сосудистые гладкомышечные клетки (VSMC) или линии лейкоцитарных клеток нет (Fish et al., 2008; Harris et al., 2008; Wang et al., 2008b). На сегодня miR-126, , как было установлено, играет разные роли в биологии эндотелиальных клеток и развитии кровеносных сосудов.
Трансфекция эндотелиальных клеток олигонуклеотидами, которые снижают miR-126, делает возможным
TABLE 1
MicroRNAs IN ENDOTHELIAL CELL BIOLOGY
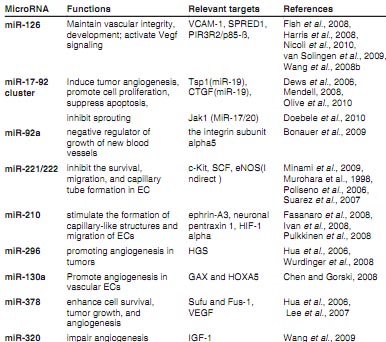
увеличение TNF-α-стимулированной экспрессии VCAM-1. Напротив, избыточная экспрессия предшественника miR-126 увеличивает уровни miR-126 и снижает экспрессию VCAM-1. Кроме того, снижение уровней эндогенной miR-126 увеличивает слипание лейкоцитов с эндотелиальными клетками (Harris et al., 2008; van Solingen et al., 2009).
Нокдаун miR-126 у рыбок данио приводит к потере сосудистой целостности и к геморрагиям во время эмбрионального развития. MiR-126 действует частично путем репрессии негативных регуляторов VEGF пути, включая sprouty-related protein SPRED1 и phosphoinositol-3 kinase regulatory subunit 2 (PIR3R2/p85-β) (Fish et al., 2008). У мышей было установлено, что miR-126 происходит из Egfl7 pre-mRNA. Целенаправленная делеция miR-126 у мышей вызывает текучесть сосудов, кровоизлияния и частичную эмбриональную летальность, обусловленные потерей целостности сосудов и дефектами пролиферации эндотелиальных клеток, миграции и ангиогенеза. MiR-126 усиливает про-ангиогенное действие VEGF и FGF и способствует формированию кровеносных сосудов путем репрессии экспрессии Spred-1 (Wang et al., 2008b). Кроме того, делеция miR-126 ингибирует VEGF-зависимую передачу сигналов Akt путем депрессии p85β субъединицы PI3 kinase (Kuhnert et al., 2008). Более того, согласно последнему сообщению с использованием двух-фотонных изображений живых эмбрионов рыбок данио, наблюдалось, что кровоток, важный для ангиогенеза во время AA развития, нуждается в miR-126. Было показано, что ангиогенное разрастание сосудов аортальных дуг нуждается в индуцируемом кровотоком генетическом пути, в котором механо-чувствительный транскрипционный фактор klf2a индуцирует экспрессию специфичной для эндотелия microRNA, miR-126, чтобы активировать передачу сигналов VEGF (Nicoli et al., 2010). Кластер miR-17-92 высоко консервативен в эволюции позвоночных и кодирует miR-17,
miR-18a, miR-19a, miR-20a, miR-19b-1 и miR-92a-1 внутри интронной области в 800 п.н. на хромосоме13 (у Homo sapiens) (Olive et al., 2010). Интересно, что не только последовательность каждой miRNA высоко консервативна у разных видов; организация этих miRNAs внутри семейства miR-17-92 также обнаруживает высокий уровень консервации. Функциональное значение такой консервации всё ещё неясно. Возможно она отражает эволюционный путь, по которому происходило удвоение генов, сопровождаемое последующей потерей индивидуальных компонентов miRNA, формирующее это полицистронное семейство miRNA (Olive et al., 2010). MiRNAs , кодируемые с помощью miR-17-92 кластера и и их паралоги, как известно, действуют как онкогены. Экспрессия этих miRNAs способствует клеточной пролиферации, супрессирует апоптоз раковых клеток и индуцирует опухолевый ангиогенез (Mendell, 2008). Эти находки в miR-17-92 показывают, что miRNAs являются интегрированными компонентами молекулярных путей, которые регулируют развитие и поддержание опухолей (Olive et al., 2010). Мощному опухолевому ангиогенезу способствует активность , приписываемая кластеру miR-17-92, который чрезвычайно не урегулирована в Myc-индуцированных опухолях. Уровни VEGF оставались неизменными под действием Myc, но усиленная неоваскуляризация скоррелирована с подавлением анти-ангиогенного thrombospondin-1 (Tsp1) и родственных белков, таких как CTGF. И Tsp1 и CTGF являются предположительно мишенями для репрессии с помощью кластера miR-17-92 miRNA. В частности, miR-18 преимущественно супрессирует экспрессию CTGF, тогда как miR-19 нацелена на мощный ингибитор ангиогенеза Tsp1 (Dews et al.,2006). Кроме того, избыточная экспрессия c-myc ведет к подавлению регуляции HIF-1a и к индукции miR-17-92, последний из которых, как полагают, обладает способностью активировать транскрипцию, указывая тем самым, что индукция miR-17-92 может играть роль, по крайней мере, частично в c-myc-обусловленной репрессии HIF-1a (Taguchi et al., 2008). Более того, Angelika et al., сообщают, что кластер miR-17-92 экспрессируется на высоком уровне в эндотелиальных клетках человека. Недавняя работа выявила существенные функции для этих miRNAs не только в ангиогенезе опухолей, но и также во время нормального развития кровеносных сосудов. MiR-92a, компонент этого кластера, был недавно идентифицирован как негативный регулятор роста новых кровеносных сосудов. Принудительная избыточная экспрессия miR-92a в эндотелиальных клетках блокирует ангиогенез in vitro и in vivo, воздействуя на мРНК соотв. некоторых проангиогенных белков, включая интегриновую субъединицу alpha5. В мышиных моделях ишемии конечностей и инфаркта миокарда, системное применение antagomir, предназначенного для ингибирования miR-92a, ведет к усиленному росту кровеносных сосудов и к функциональному восстановлению поврежденных тканей (Bonauer et al., 2009). Было продемонстрировано, что избыточная экспрессия miR-17, -18a, -19a и -20a существенно ингибирует разрастание 3D сфероидов in vitro, тогда как ингибирование miR-17, -18a и -20a усиливает формирование разрастаний эндотелиальных клеток (EC). Ингибирование miR-17 и miR-20a in vivo с использованием antagomirs существенно увеличивает количество заполненных сосудов в matrigel plugs, тогда как antagomirs, специфически нацеленные на miR-18a и miR-19a, были менее эффективны. MiR-17/20 воздействует на несколько про-ангиогенных генов, таких как Janus kinase 1 (Jak1) (Doebele et al., 2010).
Гены MiR-221 и miR-222 расположены в тесной близи на хромосоме 13.3. Они экспрессируются в, но не ограничены только эндотелиальными клетками. Было продемонстрировано, что miR-221 и miR-222 затрагивают экспрессию c-Kit и ангиогенные свойства его лиганда stem cell factor (SCF). И как следствие они ингибируют жизнеспособность, миграцию и формирование капиллярных трубок в HUVECs (Poliseno et al., 2006). Др. исследование показало, что miR-221/222
регулируют уровни endothelial nitric oxide synthase (eNOS) после замалчивания Dicer, однако miR-221/222 не были обнаружены действующими на 3' UTR в eNOS. Итак, регуляция eNOS с помощью miR-221/222 обусловлена, скорее всего, косвенным влиянием (Suarez et al., 2007). Было установлено, что eNOS, также известная как nitric oxide synthase 3 (NOS3), генерирует NO в кровеносных сосудах и участвует в регуляции формирования и функции некоторых аспектов сосудов (Murohara et al.,1998). Интересно, что исследование Minami et al., подтвердило, что физиологическая роль miR-221/222 тесно связана с пролиферацией эндотелиальных клеток. Было показано, что уровни miR-221/222 достоверно выше в CAD группе. чем в non-CAD группе и уровни miR-221/222 были слабо негативно скоррелированы с количеством Endothelial progenitor cells (EPCs) в группе CAD (Minami et al., 2009). Итак. эти сообщения подтверждают, что miR-221/222 играют анти-ангиогенную роль in vitro, хотя их функции in vivo не установлены.
Избыточная экспрессия MiR-210 в normoxic эндотелиальных клетках стимулирует образование капилляр-подобных структур на Matrigel и управляемой с помощью vascular endothelial growth factor миграции клеток. Напротив, блокада, miR210 посредством трансфекции anti-miRNA ингибирует образование капилляр-подобных структур, стимулируемое гипоксией, и снижает миграцию клеток в ответ на сосудистый эндотелиальный ростовой фактор. Избыточная экспрессия MiR-210 не влияет на рост эндотелиальных клеток как в условиях normoxia, так и гипоксии. HIF-1a индуцирует экспрессию miR210 в эндотелиальных клетках (Ivan et al., 2008). Однако трансфекция anti-miR-210 ингибирует клеточный рост и индуцирует апоптоз при normoxia и гипоксии. Ephrin-A3, как было установлено, является одной из подходящий мишеней miR-210 при гипоксии, поскольку miR-210 необходима и достаточна, чтобы подавлять его экспрессию. Более того, метод репортерной luciferase показал, что Ephrin-A3 является непосредственной мишенью miR-210. Итак, активация miR-210 является критическим элементом реакции эндотелиальных клеток на гипоксию, влияя на жизнеспособность, миграцию и дифференцировку клеток (Fasanaro et al., 2008). Активная форма HIF-1a индуцирует экспрессию miR-210, демонстрируя участие сигнального пути HIF-1 в транскрипции гена miR-210. Более того, miR-210, как было установлено, соединяется с предсказываемыми сайтами мишенями в ephrin-A3 или нейрональном pentraxin 1, обусловливая репрессию активности luciferase репортера (Pulkkinen et al., 2008).
MiR-130a локализуется на хромосоме 11 , а экспрессия этой miRNA, как было установлено, быстро усиливается в культуральных условиях с высоким содержанием сыворотки в эндотелиальных клетках in vitro. Было показано, что miR-130a регулирует экспрессию GAX и выполняет важную роль в модулировании активности GAX в эндотелиальных клетках. Гомеобоксный ген GAX ингибирует ангиогенез сосудистых эндотелиальных клеток. Поиск по всему геному др. возможных сайтов связывания miR-130a выявил сайт мишень для miR-130a в 3' UTR анти-ангиогенного гомеобоксного гена HOXA5, чья экспрессия и анти-ангиогенная активность также ингибируется с помощью miR-130a. Итак, miR-130a является регулятором ангиогенного фенотипа сосудистых эндотелиальных клеток в основном благодаря её способности модулировать экспрессию GAX и HOXA5 (Chen and Gorski, 2008). Thomas Wurdinger et al., сообщили о роли miR-296 в обеспечении ангиогенеза в опухолях. Ростовым фактором индуцированнаяmiR-296 вносит существенный вклад в ангиогенез путем прямого воздействия на мРНК hepatocyte growth factor-регулируемого tyrosine kinase substrate (HGS), приводя к снижению уровней HGS и тем самым к редукции HGS-обеспечиваемой деградации рецепторов факторов роста VEGFR2 и PDGFRβ (Hua et al., 2006; Wurdinger et al., 2008).
Предыдущее исследование показало, что miR-378 экспрессируется в ряде линий раковых клеток (Jiang et al., 2005) и участвует в экспрессии VEGF (Hua et al., 2006). Было подтверждено, что трансфекция miR-378 усиливает жизнеспособность клеток, опухолевый рост и ангиогенез путем репрессии экспрессии двух опухолевых супрессоров, Sufu и Fus-1. Опухоли, формируемые с помощью miR-378-трансфицированных клеток содержат более крупные кровеносные сосуды, чем формируемые клетками, трансфицированными только вектором. Хотя количество кровеносных сосудов на единицу поля не обнаруживало заметного увеличения, это, по-видимому, связано с тем, что общее количество кровеносных сосудов в крупных опухолях достаточно высокое, чтобы обеспечить экспансию опухоли. Образование крупных сосудов может быть важным для облегчения такой экспансии. Эти результаты согласуются с предыдущими исследованиями, показавшими, что miR-378 соединяется с VEGF 3' UTR , конкурируя с miR-125a за один и тот же seed регион и способствуя экспрессии VEGF (Lee et al., 2007).
Позитивная регуляция miRNA-320 наблюдается в MMVEC от Goto-Kakizaki (GK) крыс при использовании real-time reverse transcriptionpolymerase chain reaction (RT-PCR). Трансфекция ингибитором miR-320 клеток MMVEC от GK крыс, подтвердило, что miR-320 ухудшает ангиогенез. Пролиферация и миграция диабетических MMVEC улучшается после трансфекции ингибитором miR-320. Кроме того, miR-320 ингибитор существенно увеличивает экспрессию белка IGF-1, но не оказывает влияния на экспрессию IGF-1R. Этот результат указывает на то, что позитивная регуляция miR-320 в клетках MMVEC от GK крыс может быть ответственна за несогласованность между экспрессией белка и мРНК IGF-1 и, следовательно, связана с нарушениями ангиогенеза при диабете (Wang et al., 2009).
Individual miRNAs in smooth muscle cell biology
Сосудистая стенка состоит из двух основных типов клеток, эндотелиальных и гладкомышечных, которые тесно взаимодействуют др. с др. Сосудистые гладкомышечные клетки формируют слои внутри стенки сосудов и путем сокращения и расслабления контролируют кровяное давление и кровоснабжение органа. VSMCs способны переключаться между дифференцированными и дедифференцированными состояниями (Owens et al.,2004). В нормальных физиологических условиях VSMCs дифференцированные и контрактильные. В случае повреждения сосудов и ростовых факторов клетки VSMCs могут изменять свой фенотип в дедифференцированное состояние и начать пролиферировать. Хотя модуляция фенотипа VSMC, как полагают, существенна для репарации сосудистых повреждений, дерегуляция этого процесса может приводить к патологическим изменениям в стенке сосудов. Такое ремоделирование VSMCs часто обнаруживаются при атеросклеротических повреждениях после хронического воздействия высоким кровяным давлением или гемодинамических стрессов. Следовательно, дифференцировка VSMC является ключевым клеточным событием в патогенезе различных сосудистых болезней, включая артериогенез, атеросклероз, рестеноз и гипертензия (Doran et al., 2008; Owens et al., 2004; Rzucidlo et al., 2007).
Недавние сообщения продемонстрировали критическую роль miRNAs в дифференцировке VSMC. MiR-143 и miR-145 обильно экспрессируются в VSMCs артерий (Cheng et al., 2009; Ji et al., 2007) и сердца (Boettger et al., 2009; Cordes et al., 2009). Во время постнатального развития в сердце экспрессия подавляется. Чтобы подчеркнуть важность miR-143 и miR-145 в VSMCs, Boettger с коллегами создали мутантных мышей по microRNA кластеру miR-143/145. Анализ гомозиготных miR-143/145 мутантных мышей показал снижение контрактильности VSMCs, увеличение пролиферативных предшественников и формирование повреждений неоинтимы сосудов (Boettger et al., 2009). Контрактильное поведение в др. органах, включая подвижность ЖКТ, не изменены. Тщательно охарактеризована физиология мутантных мышей, обладающих дефектами агонистом-индуцированной контрактильности в SMC артерий. Наблюдались также изменения кровяного давления в др. исследовании (Xin et al., 2009) и angiotensin I-converting enzyme (ACE),
который участвует в стимуляции сосудистых сужений и альтерациях фенотипа VSMC путем превращения angiotensin-I в вазоактивный гормон angiotensin-II, это указывает на то, что он является потенциальной мишенью. Сравнение здоровых с поврежденными каротидными артериями мыши показало, что пониженная экспрессия miR-143 и miR-145 наблюдается при артериальной болезни (Cordes et al., 2009). Более того, обнаружено подавление miR-145 в дедифференцированных SMCs. Избыточная экспрессия miR-145 ведет к ингибированию PDGF-индуцированной пролиферации VSMC (Cheng et al., 2009). Сосудистое ремоделирование в ответ на повреждения обнаруживается также у miR-143/145-мышей от Xing. Перевязка сонной артерии у miR-145-/- мышей выявила отсутствие образование neointima, тогда как у miR-143-/- снижение её образования по сравнению с мышами дикого типа (Xin et al., 2009).
На молекулярном уровне было постулировано, что miR-145 способствует связыванию myocardin с serum response factor (SRF) и тем самым усилению транскрипции генов дифференцировки SMC. С др. стороны, miR-145/143 блокирует экспрессию Ets-like gene 1 (ELK-1) и Kruppel-like factor 4 (KLF4), транскрипционных факторов, необходимых для стимуляции пролиферации SMC (Wang et al., 2008a; Yoshida et al., 2008). Однако могут существовать дополнительные мишени (KLF-4, KLF-5) и регуляторные функции (Boettger et al., 2009) (Nagai et al., 2005). Дополнительные мишени используются для фенотипического переключения VSMC, регуляции полимеризации актина и миграции клеток, как это было показано с использованием TargetScan и PicTar алгоритмов предсказания (Xin et al., 2009), но их необходимо оценить in vivo (Xin et al., 2009). Потенциальные мишени для miR-143 и miR-145 представлены в Table 2.
Сонные артерии крыс экспрессируют miR-221 и miR-222 в сосудистой стенке (Poliseno et al., 2006). Анализ микромассивов установил активацию miR-221 и miR-222 в сосудистых стенках с повреждениями неоинтимы (Ji et al., 2007). Подобная позитивная регуляция miR-221 и miR-222 была повреждена и с помощью qRT-PCR сонных артерий крыс после ангиопластики in vivo. Кроме того, культивируемые пролиферирующие VSMCs, стимулированные с помощью PDGF или сыворотки, обнаруживали повышенную экспрессию miR-221 и miR-222 (Lin et al., 2009). Исследование Davis с коллегами (Davis et al., 2009) продемонстрировало индукцию miR-221 после воздействия PDGF на primary pulmonary artery smooth muscle cells (PASMCs) человека. Экспрессия miR-222 была слабо ингибирована после воздействия PDGF в PASMCs, подтверждая, что miR-221 и miR-222 дифференциально регулируются с помощью PDGF в PASMC (Davis et al., 2009). Нокдаун miR-221 и miR-222 антисмысловыми олигонуклеотидами приводит к снижению пролиферации VSMC in vitro и in vivo, подтверждая, что miR-221 и miR-222контролируют пролиферацию VSMC (Lin et al., 2009). MiR-221 и miR-222 имеют одну и ту же seed область и, по-видимому, имеют идентичные мишени и сходные функции. Компьютерный анализ предсказывает потенциальные мишени p27 (Kip1) и p57 (Kip2) (Felicetti et al., 2008; Fornari et al., 2008; Galardi et al., 2007; le Sage et al., 2007; Visone et al., 2007). Подходы по избыточной функции и потере функции подтвердили, что оба гена являются мишенями для miR-221 и miR-222. В пролиферативных VSMCs, p27 (Kip1) и p57 (Kip2) негативно регулируются и поэтому вряд ли участвуют в miR-221 и miR-222 опосредованном эффекте на пролиферацию VSMC (Liu et al., 2009). Однако частичное ингибирование клеточной пролиферации в p27 (Kip1) и p57 (Kip2) истощенных клетках указывает на возможную роль др. неидентифицированных генных мишеней. Мишени для miR-221 включают c-kit и p27 (Felli et al., 2005; Fornari et al., 2008; Galardi et al., 2007; le Sage et al., 2007; Visone et al., 2007). C-kit вызывает ингибирование транскрипции специфичных для SMC генов путем снижения экспрессии myocardin, тогда как p27Kip1 способствует пролиферации клеток после повреждения сосудов (Chen et al., 1997). Предполагается, что ось miR221-p27Kip1 может играть роль в формировании неоинтимы после повреждений сосудов (Liu et al., 2009).
MiR-21 экспрессируется в сосудистых гладкомышечных клетках, а также в эндотелии, кардиомиоцитах и фибробластах (Cheng et al., 2007; Ji et al., 2007; Roy et al., 2009; Suarez et al., 2007). MiR-21, по-видимому, играет критическую роль в адаптации сосудов в ответ на реактивные
TABLE 2
MicroRNAs IN SMOOTH MUSCLE CELL BIOLOGY
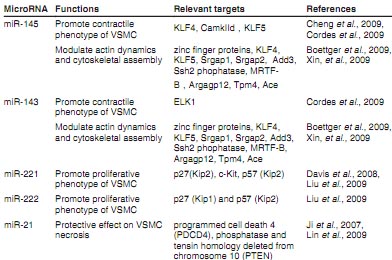
виды кислорода (ROS). Установлено, что ROS играют центральную роль в разнообразных сосудистых нарушениях, включая атеросклероз (Vandenbroucke et al., 2008). В соответствии с этим состояние гемодинамического стресса, также как и обнажение вздутий артерий ассоциированы с повышенной экспрессией miR-21 (Cordes et al., 2009; Ji et al., 2007). Нокдаун miR-21 в таких поврежденных артериях ингибировал образование повреждений неоинтимы (Ji et al.,2007). In vitro, ингибирование miR-21 увеличивало апоптоз VSMC и снижало пролиферацию. В соответствии с регуляторной ролью в адаптации к ROS, ингибирование miR-21
в H 2O 2 индуцированных VSMCs выявляет повышенный апоптоз и клеточную гибель, тогда как избыточная экспрессия miR-21 приводит к снижению апоптоза и повышению жизнеспособности клеток. Подсчеты показывают. что programmed cell death 4 (PDCD4) является потенциальным геном мишенью для miR-21. PDCD4 участвует в регуляции апоптоза VSMCs (Cheng et al., 2009; Lin et al., 2009). Избыточная экспрессия miR-21 приводит к снижению экспрессии PDCD4 в обработанных H 2O 2
VSMCs, связывание miR-21 с PDCD4 подтверждено in vitro. Более того, избыточной экспрессией miR-21 обусловленный защитный эффект в отношении апоптоза и гибели VSMC блокируется после принудительной избыточной экспрессии PDCD4 конструкции, лишенной сайта связывания miR-21, подтверждает, что PDCD4 может действовать как функциональный ген мишень для miR-21 (Lin et al., 2009). Др. потенциальным геном мишенью для miR-21 является phosphatase and tensin homology deleted на хромосоме 10 (PTEN) (Ji et al., 2007). PTEN, как известно, модулирует клеточную жизнеспособность и апоптоз, гипертрофию и контрактильность (Oudit et al., 2004).
Concluding remarks
Understanding the miRNA expression profile in developing vessels is essential and invaluable for evaluating miRNAs biological functions. At present, expression profiles of miRNA in developing blood vessels are still incomplete. Large scale miRNA expression profiling in combination with loss- and gain-of-function screens in vivo, using zebrafish and target validation are feasible approaches to help understanding the full repertoire of action of miRNAs in angiogenesis and arteriogenesis. Furthermore, miRNAs play an important role in vascular adaptation to arterial occlusion, and adverse smooth muscle cell remodeling in the context of atherosclerosis, and vascular injury. In vivo studies in mice have shown that it is possible to therapeutically target miRNA function. Aptamers with miRNA modulators attached can be designed to bind to specific proteins that are readily internalized by endothelial cells or smooth muscle cells. It is expected that such approaches will yield therapeutic levels of miRNA drugs within the vascular target cells.
|
Сайт создан в системе
uCoz увеличение TNF-α-стимулированной экспрессии VCAM-1. Напротив, избыточная экспрессия предшественника miR-126 увеличивает уровни miR-126 и снижает экспрессию VCAM-1. Кроме того, снижение уровней эндогенной miR-126 увеличивает слипание лейкоцитов с эндотелиальными клетками (Harris et al., 2008; van Solingen et al., 2009).
Нокдаун miR-126 у рыбок данио приводит к потере сосудистой целостности и к геморрагиям во время эмбрионального развития. MiR-126 действует частично путем репрессии негативных регуляторов VEGF пути, включая sprouty-related protein SPRED1 и phosphoinositol-3 kinase regulatory subunit 2 (PIR3R2/p85-β) (Fish et al., 2008). У мышей было установлено, что miR-126 происходит из Egfl7 pre-mRNA. Целенаправленная делеция miR-126 у мышей вызывает текучесть сосудов, кровоизлияния и частичную эмбриональную летальность, обусловленные потерей целостности сосудов и дефектами пролиферации эндотелиальных клеток, миграции и ангиогенеза. MiR-126 усиливает про-ангиогенное действие VEGF и FGF и способствует формированию кровеносных сосудов путем репрессии экспрессии Spred-1 (Wang et al., 2008b). Кроме того, делеция miR-126 ингибирует VEGF-зависимую передачу сигналов Akt путем депрессии p85β субъединицы PI3 kinase (Kuhnert et al., 2008). Более того, согласно последнему сообщению с использованием двух-фотонных изображений живых эмбрионов рыбок данио, наблюдалось, что кровоток, важный для ангиогенеза во время AA развития, нуждается в miR-126. Было показано, что ангиогенное разрастание сосудов аортальных дуг нуждается в индуцируемом кровотоком генетическом пути, в котором механо-чувствительный транскрипционный фактор klf2a индуцирует экспрессию специфичной для эндотелия microRNA, miR-126, чтобы активировать передачу сигналов VEGF (Nicoli et al., 2010).
увеличение TNF-α-стимулированной экспрессии VCAM-1. Напротив, избыточная экспрессия предшественника miR-126 увеличивает уровни miR-126 и снижает экспрессию VCAM-1. Кроме того, снижение уровней эндогенной miR-126 увеличивает слипание лейкоцитов с эндотелиальными клетками (Harris et al., 2008; van Solingen et al., 2009).
Нокдаун miR-126 у рыбок данио приводит к потере сосудистой целостности и к геморрагиям во время эмбрионального развития. MiR-126 действует частично путем репрессии негативных регуляторов VEGF пути, включая sprouty-related protein SPRED1 и phosphoinositol-3 kinase regulatory subunit 2 (PIR3R2/p85-β) (Fish et al., 2008). У мышей было установлено, что miR-126 происходит из Egfl7 pre-mRNA. Целенаправленная делеция miR-126 у мышей вызывает текучесть сосудов, кровоизлияния и частичную эмбриональную летальность, обусловленные потерей целостности сосудов и дефектами пролиферации эндотелиальных клеток, миграции и ангиогенеза. MiR-126 усиливает про-ангиогенное действие VEGF и FGF и способствует формированию кровеносных сосудов путем репрессии экспрессии Spred-1 (Wang et al., 2008b). Кроме того, делеция miR-126 ингибирует VEGF-зависимую передачу сигналов Akt путем депрессии p85β субъединицы PI3 kinase (Kuhnert et al., 2008). Более того, согласно последнему сообщению с использованием двух-фотонных изображений живых эмбрионов рыбок данио, наблюдалось, что кровоток, важный для ангиогенеза во время AA развития, нуждается в miR-126. Было показано, что ангиогенное разрастание сосудов аортальных дуг нуждается в индуцируемом кровотоком генетическом пути, в котором механо-чувствительный транскрипционный фактор klf2a индуцирует экспрессию специфичной для эндотелия microRNA, miR-126, чтобы активировать передачу сигналов VEGF (Nicoli et al., 2010). 