Посещений:  ЗАРОДЫШЕВЫЕ КЛЕТКИ
ЗАРОДЫШЕВЫЕ КЛЕТКИ
Генетика Развития
|
|
Genetics of germ cell development
Bluma J. Lesch and David C. Page  NATURE REVIEWS | GENETICS
VOLUME 13 | NOVEMBER 2012 | 781 doi:10.1038/nrg3294 |
The germ line represents a continuous cellular link between generations and between species, but the germ cells themselves develop in a specialized, organism-specific context. The model organisms Caenorhabditis elegans, Drosophila melanogaster and the mouse display striking similarities, as well as major differences, in the means by which they control germ cell development. Recent developments in genetic technologies allow a more detailed comparison of the germ cells of these three organisms than has previously been possible, shedding light not only on universal aspects of germline regulation, but also on the control of the pluripotent state in vivo and on the earliest steps of embryogenesis. Here, we highlight themes from the comparison of these three alternative strategies for navigating the fundamental cycle of sexual reproduction.
Zygotic Referring to a zygote, which is a one-celled embryo as the initial product of fertilization.
Germ plasm Specialized cytoplasm that contains factors that are necessary and sufficient for germ cell specification. Germ plasm may or may not have a known physical correlate in a given species.
P granules Cytoplasmic structures comprising the germ plasm in Caenorhabditis elegans.
Oocytes Female germ cells that have initiated meiosis. Because meiosis is not complete in the oocyte until fertilization, mature female gametes are oocytes.
Polar granules Cytoplasmic structures comprising the germ plasm in Drosophila melanogaster.
Epiblast A cup-shaped sheet of cells derived from the inner cell mass that will eventually form all tissues of the embryo proper.
Extra-embryonic ectoderm Ectodermal tissue that is derived from the epiblast but
does not contribute to the embryo proper. Ectoderm is one of the three primary germ
layers produced during early embryonic development.
Anterior visceral endoderm (AVE). Cell layer underlying the epiblast in the mouse embryo. It does not contribute to the embryo proper but serves important signalling functions during embryogenesis.
Primordial germ cells A term used for cells early in the germ cell lineage, before
they have initiated meiosis or begun sex-specific differentiation.
Gastrulation The process by which the three primitive germ layers are formed in the early embryo; it is one of the first major differentiation events in development.
Pre-initiation complex A protein complex made up of general transcription
factors that positions RNA polymerase II (RNAPII) at gene transcription start sites and
positions DNA in the RNAPII active site.
Polycomb A chromatin regulatory complex that represses gene expression; it is associated with deposition of the histone mark H3K27me3.
Germline stem cells (GSCs). Proliferative cells that maintain germ cell production in the adult, often by dividing to produce one self-renewing and one differentiating daughter cell.
Niche A microenvironment that promotes the maintenance of germline stem cells. The term may refer to the somatic cells that are responsible for creating this microenvironment, or to the physical location in which they reside.
Distal tip cell A specialized somatic cell comprising the germ cell niche in Caenorhabditis elegans.
Spermatocytes Male germ cells that have initiated meiosis.
Spermatogenesis Refers to the entire process of sperm generation from mitotic
precursor to mature sperm.
Oogenesis The process of oocyte generation, from mitotic precursor cell to mature
oocyte in meiotic arrest.
Eclosion The transition from pupa to adult in insects: hatching from the pupal case.
Cap cells Somatic cells that, together with terminal filament cells and escort cells, make up the germ cell niche in Drosophila melanogaster females. They directly contact germline stem cells and promote stem-cell maintenance.
Hub The cone-shaped group of somatic cells comprising the germ cell niche in Drosophila melanogaster males.
Cystoblast A germline stem cell daughter cell that has moved away from the niche and initiated differentiation.
Licensing A process permitting primordial germ cells to respond to signals promoting meiosis and male or female differentiation.
Prophase First phase of the meiotic or mitotic cell division (M phase), during which chromosomes condense. In meiosis, prophase occurs before meiosis I and is divided into the leptotene, zygotene, pachytene, diplotene, and diakinesis stages.
Residual body An anucleate cytoplasmic structure remaining after budding of Caenorhabditis elegans spermatids.
H3.3 A histone H3 variant subunit that is associated with actively transcribed genes as well as with specific heterochromatic regions such as telomeres. Unlike H3.1 and H3.2, deposition is cell-cycle-independent.
Protamines Highly basic, arginine-rich proteins that replace histones in packaging the genomes of haploid sperm. Packaging with protamines results in highly condensed genomic DNA.
Spermiogenesis The process of differentiation in haploid sperm after meiosis has been completed, involving nuclear compaction, loss of cytoplasm and generation of
a flagellum.
Leptotene The first stage of meiotic prophase. Chromosomes begin to condense.
Zygotene The second stage of meiotic prophase. Homologous chromosomes pair.
Pachytene The third stage of meiotic prophase. Homologous chromosomes are tightly held together by the synaptonemal complex, and homologous recombination (‘crossing over’) begins.
Diplotene The fourth stage of meiotic prophase. The synaptonemal complex breaks down, but homologous chromosomes are held together at sites of recombination.
Diakinesis The final stage of meiotic prophase. Chromosomes condense further, the nuclear envelope breaks down and the meiotic spindle begins to form.
Pronucleus A term for the nuclei of the male and female gametes after they have formed a single cell at fertilization, before the nuclei have fused.
Epiblast-like stem cells (EpiSCs). Stem cells that are derived from the epiblast of postimplantation embryos; they exhibit a more restricted differentiation potential than
naive embryonic stem cells.
|
Зародышевая линия это общая нить, соединяющая прошлое, настоящее и будущее вида. Соматические мутации и внешнесредовые силы могут оказывать радикальные эффекты на индивидуальные механизмы, но только информация, закодированная в зародышевой линии, будет переходить из поколения в поколение. По ходу изменений геномов и эволюции видов зародышевая линия предоставляет связь, протягивающуюся назад к общему предшественнику. Однако, чтобы обеспечить эту непрерывность клеток, которые физически передают геном от родителей потомкам - зародышевые клетки - д. реализовать сложные серии онтогенетических процессов в видоспецифическом контексте. Зародышевые клетки имеют диплоидный геном в ходе эмбриогенеза, делятся аккуратно на два полных гаплоидных генома во время мейоза и подготавливают их к комбинации со вторым гаплоидным геномом при оплодотворении, чтобы начать процесс снова.
В последние годы засвидетельствовано появление технологий и подходов, которые трансформировали биологию зародышевых клеток в основном из области эмбриологии в основательную генетику и молекулярную биологию. Высокопроизводительное секвенирование теперь делает возможной характеристику состояния экспрессии в небольших количествах ткани, тогда как всё возрастающая доступность генетических реагентов у мышей разрешает исследования на млекопитающих, приближают наше понимание к тому, что ранее было установлено на Caenorhabditis elegans и Drosophila melanogaster. Знания, которые возникают из молекулярных исследований развития зародышевых клеток, теперь интегрированы с более ранними исследованиями, которые охарактеризовали эти клетки гистологически, чтобы достичь более полного понимания это родоначальной и фундаментальной клеточной популяции. Этот переход только начинается и его значение расширяется за границы области биологии зародышевых клеток. Помимо своей роли, как передатчиков информации между поколениями, зародышевые клетки представляют in vivo клеточную популяцию, которая близко связана с активно изучаемыми in vitro моделями плюрипотентных стволовых клеток. Глубокое понимание того, как геном регулируется и защищается в зародышевых клетках сможет также информировать клиницистов относительно бесплодия и наследственных заболеваний.
Здесь мы суммируем данные по генетическому контролю развития зародышевых клеток у C. elegans, D. melanogaster и мышей, подчеркивая сходство и различия в путях, которые у этих животных обеспечивают прохождение их генома от одного поколения к следующему (FIG. 1). Мы обсудим также 4 задачи, которые общи зародышевым клеткам всех трех видов: становление клона зародышевой линии; поддержание этого клона за счет глобальной репрессии транскрипции; инициация мейоза и его взаимоотношение с детерминацией пола и гаметогенезом; и приготовление гамет для регуляции ранних зиготических процессов после оплодотворения. Мф сконцентрируемся на генетической регуляции этих процессов, оставив детальное обсуждение клеточных биологических изменений, связанных с миграцией и гаметогенезом, и запутанность мейоза для др. обзоров 1-4.
Specification of the germ line
Спецификация зародышевой линии у данного вида традиционно классифицируется как возникающая или путем 'preformation', причем предшественники зародышевых клеток специфицируются матерями откладываемыми факторами, или путем индукции, при этом зародышевые клетки рекрутируются из популяции мультипотентных эмбриональных клеток за счет передачи сигналов, возникающих в окружающей ткани5. У трех обсуждаемых организмов черви и мухи обладают преформацией, тогда как мыши используют индукцию. Важно, хотя этот раздел выпадает между позвоночными и беспозвоночными среди этих трех организмов, такое обобщение не может быть сделано. Мыши, как и все млекопитающие, генерируют свои зародышевые клетки за счет индукции. Однако др. позвоночные, такие как рыбки данио и Xenopus laevis закладывают зародышевую плазму за счет преформации, а многие беспозвоночные, включая червей, моллюсков и многих насекомых, выделяют свою зародышевую линию, используя индуктивные механизмы5.
Preformation in worms and flies. Деление на преформативную и индуктивную спецификацию зародышевых клеток зависит от того, имеется ли непрерывность цитоплазмы зародышевых клеток между одним поколением и др. Как C. elegans так и D. melanogaster поддерживают специфические цитоплазматические комплексы, наз. зародышевой плазмой, в одноклеточном эмбрионе и в клетках, которые впоследствии
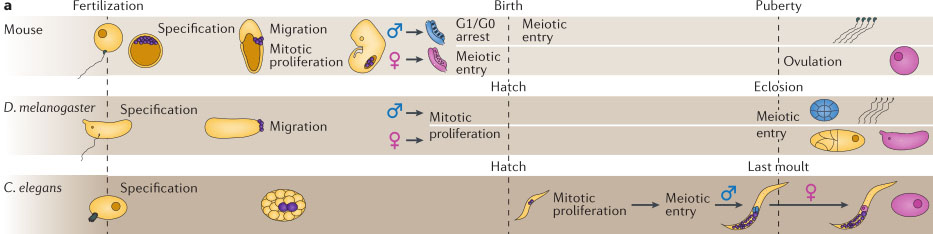
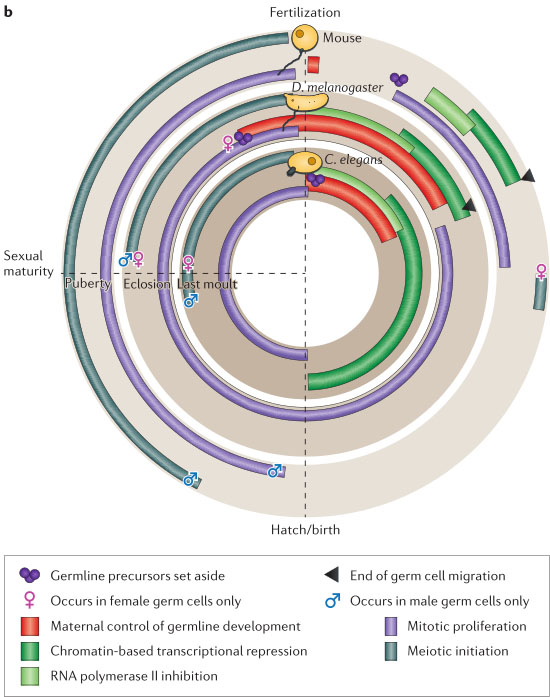 Figure 1 | Summary of germ cell development in C. elegans, D. melanogaster and the mouse. a | Germ cell development in Caenorhabditis elegans, Drosophila melanogaster and the mouse. Timescales are aligned by developmental stage rather than chronological time. Primordial germ cells before the initiation of gametogenesis are shown in purple. Differentiating female gametes are shown in pink and male gametes in blue. In the mouse, the germ line is specified from the epiblast by inductive signals from the surrounding tissue. The primordial germ cells divide mitotically throughout their early development. During gastrulation, they migrate to the gonad, where they gain the ability to enter meiosis and to undergo sex-specific differentiation. Female gametes initiate meiosis before birth, then enter meiotic arrest until ovulation, and male gametes initially arrest in a G0-like state, beginning meiotic divisions only after birth. In D. melanogaster, specialized germ plasm is set aside during oogenesis, and the germ cell precursors (pole cells) cellularize soon after fertilization. The pole cells migrate internally during gastrulation. After they reach the gonad, they divide mitotically and acquire sex-specific features. Meiosis begins in both sexes around the time of eclosion. In C. elegans, the first germline precursor is specified by the site of sperm entry at fertilization, and the two germline founder cells, Z2 and Z3, are derived from this precursor after five cell divisions. Z2 and Z3 begin to divide mitotically during the first larval stage. Meiosis begins during the third larval stage and initially produces sperm; after the end of the fourth larval stage, meiotic divisions generate oocytes. b | Conceptual overlay of the germ cell cycle in each organism with major gene-regulatory and cell-cycle events. Many of the same steps occur in all three organisms, but the timing relative to other aspects of development differs. Note that in D. melanogaster,
germline precursors are set aside and maternal control of the germ line begins during oogenesis, overlapping completion of the previous cycle of germline development.
Figure 1 | Summary of germ cell development in C. elegans, D. melanogaster and the mouse. a | Germ cell development in Caenorhabditis elegans, Drosophila melanogaster and the mouse. Timescales are aligned by developmental stage rather than chronological time. Primordial germ cells before the initiation of gametogenesis are shown in purple. Differentiating female gametes are shown in pink and male gametes in blue. In the mouse, the germ line is specified from the epiblast by inductive signals from the surrounding tissue. The primordial germ cells divide mitotically throughout their early development. During gastrulation, they migrate to the gonad, where they gain the ability to enter meiosis and to undergo sex-specific differentiation. Female gametes initiate meiosis before birth, then enter meiotic arrest until ovulation, and male gametes initially arrest in a G0-like state, beginning meiotic divisions only after birth. In D. melanogaster, specialized germ plasm is set aside during oogenesis, and the germ cell precursors (pole cells) cellularize soon after fertilization. The pole cells migrate internally during gastrulation. After they reach the gonad, they divide mitotically and acquire sex-specific features. Meiosis begins in both sexes around the time of eclosion. In C. elegans, the first germline precursor is specified by the site of sperm entry at fertilization, and the two germline founder cells, Z2 and Z3, are derived from this precursor after five cell divisions. Z2 and Z3 begin to divide mitotically during the first larval stage. Meiosis begins during the third larval stage and initially produces sperm; after the end of the fourth larval stage, meiotic divisions generate oocytes. b | Conceptual overlay of the germ cell cycle in each organism with major gene-regulatory and cell-cycle events. Many of the same steps occur in all three organisms, but the timing relative to other aspects of development differs. Note that in D. melanogaster,
germline precursors are set aside and maternal control of the germ line begins during oogenesis, overlapping completion of the previous cycle of germline development.
закладываются, чтобы сформировать зародышевую линию. Комплексы зародышевой плазмы состоят из РНК и белка; большинство белков являются РНК-связывающими факторами, которые участвуют в трансляционной регуляции мРНК зародышевой плазмы и многие из этих РНК-связывающих белков законсервированы в зародышевых клетках у многих видов 6 (TABLE 1). У червей одноклеточные эмбрионы (P0) содержат комплексы мРНК-белок (P гранулы), которые первоначально рассеяны по всей цитоплазме. Во время первых четырех делений эмбриона P гранулы специфически сегрегируют в клетки P клона. После этих 4-х делений P4 клетка (предшественник всех зародышевых клеток у взрослых животных) делится, чтобы сформировать две клетки основательницы зародышевой линии, Z2 и Z3 (REF. 7). Компоненты P гранул откладываются матерями и защищены от деградации специфически в клоне зародышевых клеток 8. Большинство белковых компонентов являются РНК-связывающими белками, включая консервативные регуляторы зародышевых клеток germline helicase 1 (GLH-1), GLH-2,
GLH-3 и GLH-4, P granule assembly proteins PGL-1, PGL-2 и PGL-3, и мейотические регуляторы OMA-1 и OMA-2 (REF. 6). Истощение или потеря мРНК или белковых компонентов Р гранул ведут к стерильности, хотя часто два или более перекрывающихся членов семейства могут не позволить достигнуть полной пенетрантности. Однако мутантные эмбрионы, которые неспособны сегрегировать асимметрично Р гранулы во время эмбриогенеза, всё ещё способны сегрегировать специфические компоненты зародышевой плазмы в клон зародышевых клеток и взрослые мутантные животные плодовиты и собирают Р гранулы только в зародышевой линии 8. Т.о., хотя компоненты зародышевой плазмы являются центральными для развития зародышевой линии, специфичная для зародышевой линии сегрегация Р гранул не нужна для развития зародышевых клеток.
Ооциты D. melanogaster содержат локализованные мРНК и белки даже до оплодотворения, стабилизируя их для сегрегации зародышевой клетки вскоре после проникновения спермия в ооцит. Полярные гранулы, эквивалентные Р гранулам C. elegans, располагаются на заднем полюсе ооцита и контролируют как формирование паттерна абдомена, так и сборку зародышевой плазмы во время эмбриогенеза 9,10. Трансплантация цитоплазмы из заднего полюса эмбриона в передний на ранней стадии дробления достаточна, чтобы индуцировать формирование как живота, так и предшественников зародышевых клеток (полярные клетки) в передней части 9. Компонент полярных гранул
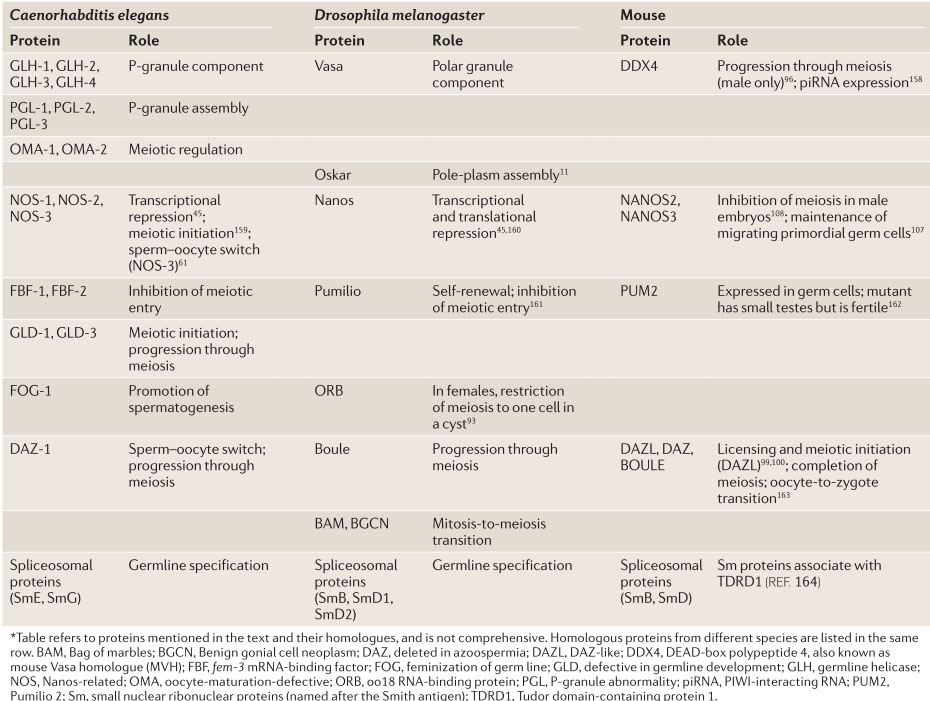
Table 1 | Selected RNA-binding proteins involved in germ cell development, and their homologues
Oskar необходим и достаточен для продукции полярных клеток у ранних эмбрионов. Количество формируемых полярных клеток зависит от количества присутствующего Oskar, а эктопическая локализация мРНК oskar рекрутирует др. компоненты полярных гранул и в результате происходит эктопическое образование полярных клеток, как и в случае трансплантации полярной плазмы 11. Предоставляемые матерями белки полярной плазмы, собираемые на заднем полюсе с помощью Oskar - такие как Vasa, Tudor и Valois - регулируют локализацию и трансляцию мРНК, таких как nanos и polar granule
component (pgc, see below), которые необходимы для образования, спецификации и функции полярных клеток 10-14. Кроме того, Sm белки, которые являются РНК-связывающими белками, которые продуцируют сплайсесомы, обладают и независимой от сплайсинга ролью в спецификации зародышевой линии у D. melanogaster и C. elegans15-17. Induction of the germ line in the mouse. У мышей все клетки в эмбрионе способны вносить вклад в зародышевую линию вплоть до ст. после образования бластоциста, демонстрируя, что отсутствует специфический клон зародышевых клеток, который предетерминируется с помощью наследуемых от матерей цитоплазматических факторов. Точное время, когда специфицируются впервые предшественники зародышевой линии, неизвестно; самые ранние из известных маркеров зародышевых клеток PR- and SET-domain-containing гены Prdm1 (также известный как Blimp1) и Prdm14, экспрессируются независимо др. от др. приблизительно в шести клетках в проксимальной задней части эпибласта вблизи внеэмбриональной эктодермы, приблизительно на 6.25 день эмбриогенеза (E6.25)18,19.
Эти немногие клетки, рекрутируемые из большой популяции клеток, которые компетентны, но не предназначены для образования зародышевой линии, и эти клетки могут быть идентифицированы по экспрессии трансмембранного белка IFITM3 (также известного как Fragilis)20,21. Рекрутирование и последующая индукция предшественников зародышевых клеток зависят от позиции: клетки, трансплантированные из дистальных регионов эпибласта в проксимально-заднюю область оказываются способны формировать предшественников зародышевых клеток практически с одинаковой эффективностью, как и нативные клетки проксимальной части эпибласта22. В области индукции, происходящий из эпибласта, WNT3 сигнал наделяет клетки способностью отвечать на диффундирующий сигнальный пептид bone morphogenetic protein 4 (BMP4), который продуцируется во внеэмбриональной эктодерме и индуцирует состояние предшественников зародышевых клеток23. Всё ещё неспецифицированный антагонистический сигнал от передней висцеральной энтодермы предупреждает клетки передней части эпибласта от внесения вклада в клон зародышевых клеток. Дополнительные члены семейства BMP, BMP8B и BMP2, исходящие из внеэмбриональной эктодермы, противодействуют ингибирующему переднему сигналу, закладывая градиент ингибирования и поддержки индукции зародышевых клеток в задней части эпибласта20,24-26. В это время экспрессия ассоциированных с плюрипотентностью генов Oct4, Sox2 и Nanog прогрессивно ограничивается зародышевой линией и становится специфичной для зародышевых клеток на ст. E8.0 (REFS 27-29).
Способ, с помощью которого ограниченный субнабор клеток первоначально выбирается из большого количества компетентных клеток, которые занимают правильную позицию в задней части эпибласта, неизвестен. Из генов, которые, как известно, регулируют качественные особенности зародышевых клеток во время спецификации, ни один не соответствует необходимым критериям, чтобы служить в качестве селектора зародышевых клеток. Prdm14 и Prdm1 не нужны для спецификации18,19. У мутантов Prdm1 компетентные клетки эпибласта инициируют транскрипционную программу, которая сходна с таковой для предшественников зародышевых клеток -известных как примордиальные зародышевые клетки - но эти клетки эпибласта неспособны развиваться после ранних стадий спецификации и в конечном итоге погибают18. У мутантов Prdm14, клетки эпибласта продвигаются дальше по пути развития в качестве примордиальных зародышевых клеток, но эти клетки также в конце концов погибают19. Маркер ранних зародышевых клеток developmental pluripotency-associated 3 (DPPA3; также известен как stella) впервые обнаруживается в популяции предшественников зародышевых клеток на ст. E7.0. Экспрессия DPPA3 специфична для клона зародышевых клеток, но не нужна для спецификации зародышевых клеток, поскольку развитие зародышевых клеток у Dppa3-нокаутных мышей не нарушено30.
LIN28, негативный регулятор микроРНК (miRNA) let-7, необходим для экспрессии PRDM1 в развивающихся предшественниках зародышевых клеток, а нокаут LIN28 приводит к уменьшению количества зародышевых клеток. Однако, LIN28 экспрессируется в презумптивных мезодермальных клетках в проксимальной части эпибласта, а также в предшественниках зародышевых клеток, так что LIN28 недостаточен для спецификации судьбы зародышевых клеток31. Сходным образом, OCT4 необходим для формирования DPPA3-экспрессирующих примордиальных зародышевых клеток, но он экспрессируется в клетках вне предполагаемого клона зародышевых клеток во время спецификации29,32.
Несмотря на деление на преформацию и индукцию, существует фундаментальное сходство в спецификации зародышевых клеток у червей, мух и мышей. Каждый вид не принимает во внимание предназначенный набор предшественников зародышевых клеток - P4 у C. elegans; полярные клетки у D. melanogaster; и PRDM1+, PRDM14+ клетки предшественники у мышей - во время довольно короткого временного окна во время развития. Основное различие между видами заключается во времени, во время которого открывается и закрывается окошко компетентности: у червей поляризация зигот при оплодотворении закладывает клон зародышевых клеток; у мух цитоплазма будущих зародышевых клеток детерминируется в ооците до оплодотворения; а у мышей спецификация происходит только после начала эмбриогенеза.
Requirement for transcriptional repression
Вследствие спецификации предшественники зародышевых клеток у всех трех видов зависят от строгой регуляции экспрессии генов для предупреждения инициации соматических транскрипционных программ и преобразуют сигналы спецификации в длительно длящиеся онтогенетические состояния. Строгий транскрипционный контроль особенно важен в интервале, непосредственно следующем за спецификацией, во время которого эмбрион начинает гаструляцию и зародышевые клетки подвергаются действию мощных индуктивных сигналов, которые участвуют в спецификации соматических тканей. Зародышевые клетки у мышей и у D. melanogaster (но не у C. elegans) также расходуют этот период на миграцию на длительные расстояния по эмбриону, на путешествие от их места спецификации в регион развивающихся гонад (reviewed in REF. 1). Они д. быть устойчивы к постоянно меняющемуся набору внешних сигналов, в то же время д. оставаться в недифференцированном состоянии1,33,34. Чтобы поддерживать состояние зародышевых клеток все три организма используют базирующиеся на хроматине механизмы репрессии, а C. elegans и D. melanogaster также используют стратегию универсальной направленной транскрипционной репрессии посредством ингибирования RNA polymerase II (RNAPII).
Regulation of RNA polymerase II. Предшественники зародышевых клеток у C. elegans транскрипционно молчащие с момента оплодотворения вплоть до стадии примерно в 100 клеток после начала гаструляции35. Унаследованный от матери белок Р гранул, PIE-1, необходим для этого транскрипционного молчания: у эмбрионов, происходящих от pie-1 мутантов, зиготические транскрипты аберрантно присутствуют в предшественниках эмбриональных зародышевых клеток и зародышевая линия не развивается35,36. Обычно киназный комплекс positive
transcription elongation factor b (PTEFb), распознает и связывает RNAPII carboxy-terminal domain (CTD), фосфорилирует serine 2 из CTD, чтобы управлять транскрипционной элонгацией (FIG. 2a). PIE-1 имеет С-терминальную последовательность, сходную с таковой RNAPII и конкурирует за связывание PTEFb. Когда присутствует PIE-1, то PTEFb, как полагают, удаляется прочь с RNAPII, препятствуя тем самым фосфорилированию Ser2 и ингибируя транскрипционную элонгацию37,38 (FIG. 2b). Кроме того, PIE-1 использует иной, но всё ещё неидентифицированный механизм предупреждения фосфорилирования Ser5 из CTD, ингибируя тем самым формирование пре-иниационного комплекса и инициацию трансляции39.
Транскрипция репрессирована в ранней зародышевой линии D. melanogaster с помощью механически сходного, но независимо управляемого механизма. Как у C. elegans, полярные клетки транскрипционно инактивированы вплоть до средины эмбриогенеза, ген с материнским эффектом pgc необходим для поддержания транскрипционного молчания40. У эмбрионов, происходящих от самок, лишенных функционального гена pgc, зиготическая транскрипция не репрессирована в полярных клетках и они начинают дегенерировать приблизительно во время, когда начинается зиготическая экспрессия в окружающих соматических клетках, приводя в конечном итоге к потере зародышевой линии41,42. Подобно PIE-1, белок PGC взаимодействует с PTEFb, ингибируя его способность соединяться с и фосфорилировать С-терминальный хвост RNAPII43 (FIG. 2c). У мышей уровни фосфорилирования serines 2 и 5 в RNAPII CTD также редуцированы в примордиальных зародышевых клетках, что соответствует редукции RNAPII-зависимой транскрипции, хотя в отличие от их гомологов у червей и мух, эти клетки сохраняют некоторую транскрипционную активность. Происходят ли редуцированные уровни фосфорилирования Ser2 и Ser5, наблюдаемые в примордиальных зародышевых клетках мыши, также в результате глобального ингибирования PTEFb, остается неизвестным44.
Regulation of chromatin. Развивающиеся зародышевые клетки у всех трех видов используют также базирующуюся на хроматине репрессию. У C. elegans и D. melanogaster, репрессивные конфигурации хроматина перенимаются от PIE-1-based или PGC-based глобального ингибирования транскрипции приблизительно во время гаструляции, когда уровни белков PIE-1 или PGC снижаются45. Хроматин клеток основательниц зародышевой линии C. elegans, Z2 и Z3, оказывается более конденсированным, чем тот, что в окружающих соматических клетках. Z2 и Z3 имеют более низкие уровни модификаций, активирующих гистоны, di- и tri-метилированного лизина 4 гистона H3 (H3K4me2 и H3K4me3) и ацетилированного лизина 8 гистона H4 (H4K8ac), и слегка более высокие уровни репрессивных модификаций H3K27me3 (REFS 45,46).
Комплекс белков с материнским эффектом, включая Polycomb group ортологи MES-2 и MES-6, необходим для отложения репрессивной метки H3K27me3 в зародышевых клетках: черви, лишенные какого-либо из этих компонентов комплекса, имеют потомков, которые неспособны развивать зародышевую линию 46-48. Сходным образом потеря C. elegans spr-5 - гомолога LSD1 млекопитающих (также известного как KDM1) гистоновой деметилазы - приводит к прогрессивной неспособности деметилировать H3K4, к нарушению репрессии транскрипции и к совокупной стерильности в течение множественных поколений. Более того, отсутствие у C. elegans nos-1
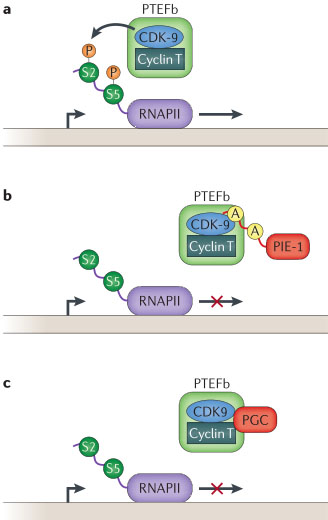 Figure 2 | Mechanism of transcriptional repression by PIE-1 and PGC. a | Promotion of transcription initiation and elongation by the positive transcription elongation factor b (PTEFb) complex. PTEFb (light green rectangle) binds to the carboxy-terminal tail of RNA polymerase II (RNAPII), and the cyclin-dependent kinase 9 (CDK-9) subunit phosphorylates serine 2 (green circle) of the tail, allowing transcriptional elongation. b | Proposed mechanism for inhibition by PIE-1 in Caenorhabditis elegans. PIE-1 (red rectangle) has a carboxy-terminal tail sequence similar to that of RNAPII and competes for PTEFb, thereby inhibiting PTEFb binding to RNAPII and phosphorylation of serines 2 and 5. The PIE-1 carboxy-terminal tail contains alanines (yellow circles) instead of serines at the CDK-9 phosphorylation sites and cannot be phosphorylated, potentially preventing the dissociation of PTEFb from PIE-1 and sequestering PTEFb away from RNAPII. c | Inhibition by polar granule component (PGC) in Drosophila melanogaster. PGC interacts with both the CDK9 and cyclin T1 components of PTEFb and sequesters the complex away from RNAPII. It is not known whether it acts by a competition mechanism similarly to PIE-1.
Figure 2 | Mechanism of transcriptional repression by PIE-1 and PGC. a | Promotion of transcription initiation and elongation by the positive transcription elongation factor b (PTEFb) complex. PTEFb (light green rectangle) binds to the carboxy-terminal tail of RNA polymerase II (RNAPII), and the cyclin-dependent kinase 9 (CDK-9) subunit phosphorylates serine 2 (green circle) of the tail, allowing transcriptional elongation. b | Proposed mechanism for inhibition by PIE-1 in Caenorhabditis elegans. PIE-1 (red rectangle) has a carboxy-terminal tail sequence similar to that of RNAPII and competes for PTEFb, thereby inhibiting PTEFb binding to RNAPII and phosphorylation of serines 2 and 5. The PIE-1 carboxy-terminal tail contains alanines (yellow circles) instead of serines at the CDK-9 phosphorylation sites and cannot be phosphorylated, potentially preventing the dissociation of PTEFb from PIE-1 and sequestering PTEFb away from RNAPII. c | Inhibition by polar granule component (PGC) in Drosophila melanogaster. PGC interacts with both the CDK9 and cyclin T1 components of PTEFb and sequesters the complex away from RNAPII. It is not known whether it acts by a competition mechanism similarly to PIE-1.
и nos-2 - гомологов D. melanogaster nanos - вызывает преждевременное повторное накопление H3K4me2 и H3K4me3 в эмбриональной зародышевой линии и соотв. неспособность зародышевой линии и стерильность 45,49. У D. melanogaster предшественники зародышевых клеток, лишенные nanos или spr-5 и LSD1 гомолога гистоновой деметилазы Suppressor of variegation 3-3 (Su(var)3-3) также обнаруживают повышенные уровни H3K4me2 и неспособны соотв. поддерживать репрессию онтогенетических генов 45,50. У мышей вызов конфигурации репрессивного хроматина является одним из самых ранних событий в клоне зародышевых клеток. PRDM1, ранний маркер примордиальных зародышевых клеток, необходим для репрессии соматических онтогенетических регуляторов 51. PRDM1 ассоциирует с arginine methyltransferase PRMT5, которая обеспечивает деметилирование аргинина 3 гистона H2A. Это репрессивная модификация, а ассоциация с PRMT5 необходима, по крайней мере, для некоторых примеров PRDM1-обеспечиваемой репрессии транскрипции 52. У мутантов Prdm1предшественники, подобные зародышевым клеткам, специфицируются почти в нормальном количестве, но эти клетки несоответствующим образом экспрессируют Hox гены и др. онтогенетические транскрипционные факторы, неспособны пролиферировать и в конечном итоге погибают 18. Однако Prdm1 мутанты сохраняют экспрессию активно транскрибируемых генов зародышевых клеток, включая Oct4 и Sox2 (REF. 51). Уровни репрессивной H3K27me3 гистоновой модификации решительно увеличиваются в мигрирующих зародышевых клетках мышей приблизительно на ст. E9.0, вследствие потери фосфорилирования Ser2 и Ser5 в RNAPII, и остаются высокими и когда повторно накапливается фосфорилирование RNAPII. Повышенное образование этой метки репрессивного хроматина может служить для поддержки состояния репрессированной транскрипции в примордиальных зародышевых клетках, хотя непосредственная потребность в повышенных уровнях H3K27me3 для поддержания транскрипционной репрессии в этом контекста не была продемонстрирована44.
Meiotic initiation and germ cell sex-determination Вступление в первую стадию гаметогенеза нуждается в выходе из состояния защиты от транскрипции, которое характерно для ранних зародышевых клеток, это сопровождается принятия решения по инициации пол-специфической (в яйцеклетки или спермии)дифференцировки и подготовки к мейотическим клеточным делениям. Детерминация пола и инициация мейоза регулируются многими из тех же самых генов и иногда спутаны по времени; степень, с которой они механистически отделимы, область активных исследований.
Meiotic initiation and sex determination in C. elegans. У C. elegans, две клетки предшественницы зародышевой линии, Z2 и Z3, начинают делиться митотически около средины первой личиночной стадии, продуцируя пул germline stem cells (GSCs), и первые GSCs вступают в мейоз в начале третьей личиночной стадии (L3)53. Решение о вступлении в мейоз детерминируется с помощью расстояния от соматической 'ниши', дистальной кончиковой клетки. Дистальная кончиковая клетка продуцирует Delta-like сигнал, LAG-2, который ингибирует вступление в мейоз и способствует миотической пролиферации (FIG. 3a). LAG-2 передает сигналы посредством GLP-1, Notch рецептора на GSCs54,55. У мутантов, которые дефицитны по glp-1, GSCs вступают в мейоз в ранней L3 стадии и неспособны поддерживать пролиферативный пул зародышевых клеток; напротив, мутации с избыточной функцией glp-1 вызывают опухоль-подобную экспансию зародышевой линии54,56. Вступление в мейоз также регулируется с помощью набора РНК-связывающих белков,
Pumilio and FBF (PUF) семейства белков FBF-1 и FBF-2. Эти белки ингибируют вступление в мейоз путем предотвращения трансляции генов. способствующих мейозу GLD-1, репрессора трансляции, и GLD-3, активатора трансляции, которые действуют вместе с poly(A) polymerase GLD-2 и Nanos гомологом NOS-3, чтобы скоординировать инициацию мейоза57-59. GLD-3 и NOS-3 ингибируют функцию FBF-1 и FBF-2, поддерживая тем самым мейотическое состояние как только оно инициируется60,61.
Гермафродиты C. elegans продуцируют мужские и женские гаметы последовательно: сначала немного раундов мейоза, продуцирующего сперматоциты, а остальные GSCs затем переопределяются на продукцию ооцитов в течение оставшейся части жизни животного. Как результат время вступления в мейоз в жизненном цикле у C. elegans привязано к половой детерминации гамет. FOG-1, cytoplasmic poly(A) element binding (CPEB) белок и FOG-3, a Tob/BTG
регулятор транскрипции и трансляции, способствуют сперматогенезу; они ингибируются с помощью FBF белков и с помощью TRA-1, консервативного транскрипционного фактора, который способствует спецификации самок или гермафродитов в соматической ткани62-68. TRA-1 ингибируется с помощью FEM-3, который действует вместе с дополнительными факторами FEM-1 и FEM-2 , чтобы толкнуть зародышевые клетки в направлении продолжения сперматогенеза69,70.
FEM-3 противостоит РНК-связывающему белку DAZ-1, который способствует переключению на оогенез71. DAZ-1 также способствует транскрипции мРНК fbf-1 и fbf-2, а FBF-1 и FBF-2 белки репрессируют трансляцию em-3; как результат FBF белки действуют как ингибиторы мейоза и способствуют вступлению в оогенез71,72.
Meiotic initiation and sex determination in D. melanogaster. Полярные клетки переносятся из заднего конца эмбриона вовнутрь во время гаструляции и затем мигрируют в развивающиеся соматические гонады73. В это время они транскрипционно молчат и арестованы в G2 фазе митотического цикла74.
Транскрипция немногих генов начинается непосредственно перед вступлением полярных клеток в формируемые гонады; дальнейшее увеличение транскрипции совпадает с возобновлением митотических клеточных циклов после вступления в гонады75. Переход к гаметогенезу у мух, следовательно, представлен переходом от онтогенетической программы в основном под материнским контролем к настоящей (bona fide) эмбриональной программе. В отличие от C. elegans, детерминация пола и вступление в мейоз разделены во времени у D. melanogaster. Детерминация пола происходит у эмбрионов. Зародышевые клетки самцов и самок начинают пол-специфическую дифференцировку вскоре после вступления в предшественники гонад под водительством как соматических сигналов, так и автономных сигналов зародышевых клеток. Sex lethal (SXL), который является основным детерминантом соматической половой принадлежности, временно экспрессируется в примордиальных зародышевых клетках у самок, но не у самцов и необходим клеточно автономно для характеристик зародышевых клеток самок76 (FIG. 3b). Дополнительные факторы, включая ovarian tumour protein (OTU) и OVO-B изоформу OVO транскрипционного фактора, также экспрессируются специфическим для самок способом в зародышевых клетках и действуют, чтобы способствовать характеристикам самок77-79. Разные присущие клеткам сигналы, стоящие ниже сигнального пути JAK-STAT, необходимы для характеристик самцовых зародышевых клеток, но они остаются в основном неидентифицированы80. У обоих полов мейоз начинается значительно позднее, примерно во время окукливания: зрелые спермии присутствуют при вылете из куколки, а зрелые яйцеклетки вскоре после этого81,82.
Инициация и прогрессия мейоза контролируется структурой гонад. Передача сигналов от соматической ниши поддерживает митотических предшественников: у самок, cap клетки продуцируют BMP сигналы Decapentaplegic (DPP) и Glass bottom boat (GBB), а у самцов ступица (hub) продуцирует цитокин-подобный лиганд Unpaired (UPD) (FIG. 3b). РНК-связывающие белки Pumilio и Nanos являются присущими клеткам, необходимы GSCs для поддержания пролиферации и предупреждения дифференцировки 83,84. GSCs делятся, чтобы продуцировать одну клетку в качестве замены GSC и один цистобласт. Цистобласт теряет свое физическое прикрепление к соматической нише, подвергается воздействию пониженных уровней происходящих из ниши сигналов самообновления и делает возможным вступление на путь мейоза 85-87. Оба пола нуждаются в bag-of-marbles (bam) и benign gonial cell neoplasm (bgcn) для осуществления перехода от GSC к цистобласту и для контроля перехода от митозов к мейозу. BAM и BCGN действуют совместно как регуляторы трансляции; потеря функции любого из генов приводит к опухоле-подобному избыточному росту митотических GSCs 88-90 (FIG. 3b). У обоих полов цистобласты делятся митотически 4 раза с неполным цитокинезом, чтобы генерировать 16 связанных дочерних клеток, которые вместе называются цистой 91,92. У самцов все клетки цисты вступают в мейоз и созревают как спермии
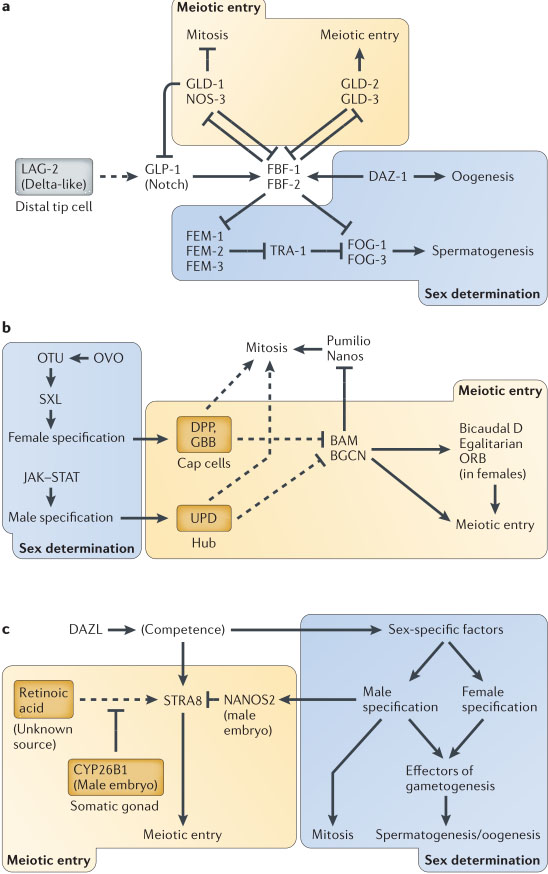 Figure 3 | Genetic pathways controlling germ cell
sex-determination and meiotic entry. Diagrams
show central aspects of each regulatory pathway that
are discussed in the main text but do not include all the
gene products that have been implicated in these
pathways. Gene products in yellow boxes are involved
in meiotic entry and those in blue boxes are involved in
sex determination. Dotted lines indicate diffusible
extracellular signals that weaken when distal to the
signal source. a | In Caenorhabditis elegans, a
Notch-Delta signalling pathway promotes mitotic
proliferation and germline stem cell (GSC)
self-renewal, and entry into meiosis is initiated when
GSCs migrate far enough away from the source of the
LAG-2 signal. Exit from self-renewal and entry into
meiosis at the last (L4) larval stage leads to male
(sperm) differentiation, whereas the same process
during adulthood results in female gametes (oocytes).
The daz-1 and tra-1 genes are both required for the
spermatogenesis-to-oogenesis switch. b | In Drosophila
melanogaster, the sex of the germ cells is determined
early in development and specifies the signals that
promote self-renewal in GSCs: that is, bone
morphogenetic protein (BMP) signals in females
(namely, Decapentaplegic (DPP) and Glass bottom boat
(GBB)) and signalling through the ligand Unpaired
(UPD) in males. The transition to meiosis occurs when
the cells leave the somatic niche. In both sexes,
Bag-of-marbles (BAM) and Benign gonial cell neoplasm
(BGCN) promote cystoblast differentiation and meiotic
entry. c | In mice, deleted in azoospermia-like (DAZL)
makes germ cells competent to enter both sex
differentiation and meiotic pathways. Sex specification
is determined by signals from somatic cells in the
gonad, whereas the induction of stimulated by retinoic
acid gene 8 (Stra8) by retinoic acid promotes meiotic
initiation. Female germ cells are able to respond to
retinoic acid in the embryo, whereas male germ cells
are prevented from doing so by CYP26B1 and by
NANOS2. In adult males, mitotic self-renewal is
promoted154. In males and females, various shared
effector genes are involved during gametogenesis155-157.
FBF, fem-3 mRNA-binding factor; FOG, feminization of
germ line; GLD, defective in germline development;
JAK, janus kinase; NOS, Nanos-related; ORB, oo18
RNA-binding protein; OTU, ovarian tumour protein;
STAT, signal transducer and activator of transcription;
SXL, Sex lethal; TRA-1, transformer protein 1.
Figure 3 | Genetic pathways controlling germ cell
sex-determination and meiotic entry. Diagrams
show central aspects of each regulatory pathway that
are discussed in the main text but do not include all the
gene products that have been implicated in these
pathways. Gene products in yellow boxes are involved
in meiotic entry and those in blue boxes are involved in
sex determination. Dotted lines indicate diffusible
extracellular signals that weaken when distal to the
signal source. a | In Caenorhabditis elegans, a
Notch-Delta signalling pathway promotes mitotic
proliferation and germline stem cell (GSC)
self-renewal, and entry into meiosis is initiated when
GSCs migrate far enough away from the source of the
LAG-2 signal. Exit from self-renewal and entry into
meiosis at the last (L4) larval stage leads to male
(sperm) differentiation, whereas the same process
during adulthood results in female gametes (oocytes).
The daz-1 and tra-1 genes are both required for the
spermatogenesis-to-oogenesis switch. b | In Drosophila
melanogaster, the sex of the germ cells is determined
early in development and specifies the signals that
promote self-renewal in GSCs: that is, bone
morphogenetic protein (BMP) signals in females
(namely, Decapentaplegic (DPP) and Glass bottom boat
(GBB)) and signalling through the ligand Unpaired
(UPD) in males. The transition to meiosis occurs when
the cells leave the somatic niche. In both sexes,
Bag-of-marbles (BAM) and Benign gonial cell neoplasm
(BGCN) promote cystoblast differentiation and meiotic
entry. c | In mice, deleted in azoospermia-like (DAZL)
makes germ cells competent to enter both sex
differentiation and meiotic pathways. Sex specification
is determined by signals from somatic cells in the
gonad, whereas the induction of stimulated by retinoic
acid gene 8 (Stra8) by retinoic acid promotes meiotic
initiation. Female germ cells are able to respond to
retinoic acid in the embryo, whereas male germ cells
are prevented from doing so by CYP26B1 and by
NANOS2. In adult males, mitotic self-renewal is
promoted154. In males and females, various shared
effector genes are involved during gametogenesis155-157.
FBF, fem-3 mRNA-binding factor; FOG, feminization of
germ line; GLD, defective in germline development;
JAK, janus kinase; NOS, Nanos-related; ORB, oo18
RNA-binding protein; OTU, ovarian tumour protein;
STAT, signal transducer and activator of transcription;
SXL, Sex lethal; TRA-1, transformer protein 1.
тогда как у самок только некоторые клетки цисты начинают экспрессировать мейотические гены и только одна из них выбирается для полного развития в ооцит; остальные 15 клеток, наз. питающими клетками, вносят вклад в цитоплазматический ресурс ооцита и в конечном итоге погибают при завершении оогенеза 91. Мутации в генах Bicaudal D, egalitarian и orb нарушают выбор ооцита и ведут к образованию цист без ооцита 93. Meiotic initiation and sex determination in the mouse. Примордиальные зародышевые клетки мышей путешествуют от места их спецификации в проксимальной части эпибласта через развивающуюся кишку и вступают в предшественники гонад в середине эмбриогенеза. Подобно мигрирующим полярным клеткам D. melanogaster они обнаруживают низкую транскрипционную активность, но в отличие от полярных клеток они продолжают делиться митотически в течение всего этого интервала. Примордиальные зародышевые клетки начинают достигать развивающихся гонад приблизительно на ст. E10.5 (REF. 94). В течение следующих 48 ч, примордиальные зародышевые клетки
обоих полов быстро теряют метилирование цитозина в ДНК и инициируют экспрессию немногих общих переходных генов 95-98. Во время этого переходного периода примордиальные зародышевые клетки подвергаются лицензированию, это означает, что они теряют свою плюрипотентность, миграторное состояние и приобретают компетенцию инициировать половую дифференцировку и вступают в мейоз (FIG. 3c). Лицензирование зависит от РНК-связывающего белка deleted in azoospermia-like (DAZL): Dazl мутанты неспособны экспрессировать маркеры дифференцировки самцов или самок и неспособны инициировать мейоз 99,100. Затем зародышевые клетки самок вступают в мейотическую профазу (FIG. 4a) и начинают дифференцироваться как ооциты, тогда как зародышевые клетки самцов арестовываются в G0-подобном состоянии вплоть до рождения 101. Как и у C. elegans, сигналы, которые запускают вступление в мейоз у самцов и самок сходны, но смещены по времени (FIG. 3c): презумптивные ооциты у мышей получают эти сигналы у эмбриона, тогда как сперматогенные предшественники защищены от них вплоть до полового созревания. Вступление в мейоз у обоих полов нуждается в helix-loop-helix (HLH) белке, стимулируемым retinoic acid gene 8 (STRA8) 102,103. У самок, Stra8 экспрессируется в зародышевых клетках в ответ на действие ретиноевой кислоты, начиная с E12.5-E13.5, и мейотическая профаза начинается вскоре после этого 104. У пренатальных самцов cytochrome P450 энзим CYP26B1 деградирует ретиноевую кислоту и тем самым предупреждает индукцию Stra8 (REFS 105,106). Nanos2
специфически экспрессируется в плодных зародышевых клетках самцов и функционирует также как ингибитор мейоза 107,108. Постнатально Cyp26b1 репрессируется в гонадах самцов, так что сперматогенетические предшественники самцов приобретают способность отвечать на ретиноевую кислоту и экспрессировать Stra8 и они начинают инициировать мейоз регулярными волнами 103,105,106. Детерминация пола зародышевых клеток и вступление в мейоз, следовательно, скоординированы во времени у млекопитающих и часто сплавлены. Однако, хотя инициация мейоза на ст. E13.5 рассматривается как эквивалентная спецификации у самок, профили транскрипции в зародышевых клетках самцов и самок на ст. E12.5 подчеркивают умеренный уровень пол-специфической транскрипции за один день до инициации мейоза у самок 109. Вопрос, являются ли инициация мейоза и спецификация пола самок в плодных зародышевых клетках идентичными процессами или они просто близко родственны, остается без ответа.
Preparation for embryogenesis
Зрелые гаметы в конечном итоге приобретают физические способности, которые необходимы для нахождения др. др., объединения и формирования нового диплоидного генома, а также для направления первых стадий эмбриогенеза. Развивающиеся спермии завершают мейоз, конденсируют свой хроматин, отделываются от большей части цитоплазмы и генерируют специализированный аппарат подвижности. Напротив, развивающиеся ооциты тщательно регулируют ход мейоза, вызывая паузу в специфическое время, чтобы скоординировать завершение мейоза с оплодотворением. Они также поддерживают высокую транскрипционную активность и увеличивают объем своей цитоплазмы в 500 раз, т.к. они накапливают мРНК и белки, чтобы использовать их во время раннего развития эмбриона110.
Preparation for embryogenesis in C. elegans. Сперматогенетические предшественники C. elegans завершают мейоз во время последней личиночной стадии. Они отпочковывают остаток residual тела, выводя его за пределы свой цитоплазмы и они приобретают способность к передвижению ползком, что зависит от цитоскелетного компонента major sperm protein (MSP)111,112. Хотя ядра сперматид конденсируются, как и у др. видов, высокие уровни варианта гистона H3.3 и низкие уровни канонического гистона H3.1 сохраняются в зрелых спермиях в виде паттернов H3K4 метилирования, которое было установлено на ранних стадиях гаметогенеза; некоторые из этих конфигураций хроматина переносятся в зиготы после оплодотворения113-115. После последней личиночной стадии зрелые спермии сохраняются в сперматеках, а все остальные предшественники зародышевых клеток переходят к оогенезу. Развивающиеся ооциты инициируют мейоз и затем арестовываются в диакинезе ступени мейоза I, в течение этого времени они растут в размере и накапливают материнские РНК и белки, которые необходимы для раннего эмбриогенез (FIG. 4b). Некоторые гены. включая gld-1 и daz-1, необходимы дл продолжения с этого момента; daz-1-мутантные ооциты арестовываются в пахитене мейоза I и в конечном итоге подвергаются апоптозу, тогда как ооциты мутантов gld-1 выходят из мейоза и повторно вступают в митотический клеточный цикл116,117. Дикого типа ооциты освобождаются от ареста в профазе I с помощью MSP, который действует гормонально когда ооциты приближаются к семяприемнику, чтобы запустить овуляцию и переход к анафазе мейоза I114.
После вступления ооцита в сперматеку оплодотворение позволяет завершиться мейозу118. Место проникновения спермия становится задним полюсом эмбриона, делая оплодотворение первым поляризующим сигналом в эмбриогенезе C. elegans119.
Preparation for embryogenesis in D. melanogaster. Сперматоциты D. melanogaster завершают мейоз, конденсируют свои ядра, замещают гистоны на протамины, элиминируют большую часть своей цитоплазмы и продуцируют длинный жгутик. Завершение мейоза в спермиях и аспекты спермиогенеза нуждаются в boule, который является гомологом C. elegans daz-1 и мышиного Dazl120. Между тем развивающиеся ооциты D. melanogaster подготавливают свою цитоплазму для утонченного контроля за инициальной стадией эмбриогенеза. Ооцит арестовывается в диплотене мейоза I и остается транскрипционно активным, когда он проходит через оварии; в это время он активно нагружается мРНК и белками, которые синтезируются питающими клетками 2 (FIG. 4c). Ооциты поляризуются вдоль дорсо-вентральной и передне-задней оси с помощью передачи сигналов от покрывающих их фолликулярных клеток посредством epidermal growth factor receptor (EGFR) лиганда Gurken. Эта поляризация позиционирует градиенты мРНК bicoid и oskar для трансляции после оплодотворения,

Figure 4 | Meiotic arrest in developing oocytes. a | Overview of the stages of meiotic prophase. In leptotene, chromosomes begin to condense; in zygotene, pairing between homologous chromosomes occurs and the synaptonemal complex holding them together is formed; in pachytene, homologous recombination ('crossing over') begins; in diplotene, the synaptonemal complex breaks down and homologous chromosomes are held together only at sites of recombination; and in diakinesis, the meiotic spindle begins to form and chromosomes condense further in anticipation of the first meiotic division. In all three species, the first meiotic arrest occurs during a specific step in meiotic prophase.
b | Meiotic arrest in Caenorhabditis elegans. Oocytes, shown in light blue, arrest in diakinesis and are released by the hormonal signal major sperm protein (MSP). They then arrest briefly in anaphase I, but enter the spermatheca quickly afterwards, are fertilized and complete meiotic division. c | Meiotic arrest in Drosophila melanogaster. The cyst consists of the 16 cells that are produced from four mitotic divisions of the founding precursor cell. One of these cells becomes the oocyte, while the remaining 15 cells are supporting nurse cells. The first meiotic arrest occurs in diplotene, and the
oocyte remains arrested at this stage for much of oogenesis. Just before ovulation, this arrest is released by an unknown signal and the oocyte then arrests again at metaphase I. This second arrest is relieved by rehydration and mechanical pressure during ovulation. d | Meiotic arrest in the mouse. The first arrest occurs in diplotene during embryogenesis and lasts until after puberty, when a hormonal surge during each menstrual cycle triggers ovulation, and ovulated oocytes re-enter the meiotic cycle. During the first meiotic arrest, the oocyte is surrounded by supporting cells and is organized into a follicle. A few of these cells remain with the oocyte immediately after ovulation. Following ovulation, oocytes arrest at metaphase II, and this second arrest is released by fertilization.
которое должно установить эмбриональную передне-заднюю ось и позволить быстрый прогресс ранних стадий эмбриогенеза 121. Ближе к концу оогенеза неизвестные сигналы индуцируют переход от ареста в диплотене профазы I к метафазе I, затем происходит второй арест. После прохождения ооцитом яйцеводов повторная гидратация и давление запускают прохождение через последнюю стадию мейотического деления; в противовес C. elegans и мышам, оплодотворение не нуждается в завершении мейоза в ооцитах D. melanogaster2.
После оплодотворения отцовский пронуклеус быстро декомпактируется и накапливает вариант гистона H3.3 , тогда как протамины удаляются. Если это замещение не происходит, то эмбрион не выживает, показывая, что быстрая распаковка пронуклеуса самца является критической для раннего эмбриогенеза122.
Preparation for embryogenesis in the mouse. У мышей, как и у мух, сперматогенные клетки завершают мейоз, конденсируют свои ядра и замещают гистоны на протамины, элиминируют цитоплазму и генерируют жгутик. Эти процессы происходят исключительно во время постнатальной жизни, после того как сперматогенные предшественники самцов освобождаются от ареста в G0-подобное состояние. Ооциты арестовываются в диплотене мейоза I во время эмбриогенеза и остаются транскрипционно активными, генерируя хранилища из белков и мРНК, чтобы управлять ранним развитием зиготы (FIG. 4d). У половозрелых самцов, гормонально запускаемая овуляция позволяет ооцитам переходить от профазы I к метафазе II, с сопутствующими паузой в транскрипции и редукцией в трансляции 110. При оплодотворении яйцеклетки заканчивают мейоз, а женский пронуклеус остается в репрессированном состоянии. Напротив протамины мужского пронуклеуса быстро замещаются сильно ацетилированными гистонами, продуцируя состояние открытого хроматина 123. Как у червей и мух мужской пронуклеус преимущественно включает вариант гистона H3.3. В то время как женский пронуклеус остается транскрипционно молчащим, деконденсированный мужской пронуклеус продуцирует немногие транскрипты в одноклеточной зиготе 123. Накопленные материнские мРНК и белки абсолютно необходимы для оплодотворения и для первых клеточных делений; они затем активно деградируют во время инициальных стадий дробления эмбриогенеза, как только начинается зиготическая транскрипция 124,125.
Perspectives
Слияние двух клеток, двух ядер и двух геномов в один нуждается в подготовке в течение всей жизни. Изучение признаков, которые помогают гарантировать реальность и воспроизводимость этого процесса должны благоприятствовать нашему пониманию основных механизмов развития и наследования и могут приводить к важному клиническому использованию.
Регуляция экспрессии генов как на транскрипционном, так и трансляционном уровне является центральной для развития зародышевых клеток и может помочь в поддержании гибкого клеточного состояния (TABLE 1). Пост-транскрипционный контроль в зародышевой линии оперирует посредством нескольких механизмов, включая (но не ограничиваясь) рекрутированием мРНК на рибосомы, модуляцию длины поли(А) хвоста и стабильность транскрипта, ограничивая трансляцию специфическими регионами внутри клетки и сборку РНК и белков в цитоплазматические гранулы126. Одиночная РНК зародышевой линии может быть предметом нескольких таких стратегий регуляции. Напротив, многие РНК-связывающие белки выполняют множественные роли в ходе развития зародышевых клеток, это усложняет цель четкого вычленения специфической роли для каждого из таких белков на данной стадии развития. Функция большинства из этих РНК-связывающих белков остается неизвестной и причины обогащения белками этого класса зародышевой линии сегодня спекулятивны. Прогресс в этой области нуждается в утонченных подходах к бесстрастным исследованиям взаимодействий РНК-белок в клетках и в способности осуществить это на небольших популяциях клеток. Недавнее вторжение в эту область у C. elegans открыло способ подобных исследований у др. организмов127,128. Малые РНК, включая микроРНК и PIWI-взаимодействующие РНК (piRNAs), по-видимому, играют дополнительную роль в поддержании баланса между репрессией и гибкой экспрессией генов в зародышевой линии (rev. REF. 129). Сходным образом, многочисленные варианты гистонов и регуляторы хроматина являются специфичными для зародышевой линии, но их функции в основном неизвестны130.
Молекулярная характеристика эпигенетического состояния зародышевой линии необходима для понимания недавних сообщений, связанных с 'эпигенетическим' наследованием (BOX 1).
| | |
|
Box 1 | Transgenerational epigenetic inheritance
Several recent, high-profile studies have called attention to transgenerational
epigenetic inheritance in Caenorhabditis elegans, Drosophila melanogaster and
mammals. In these systems, traits induced by the environment and not directly
encoded in the genome (that is, epigenetic) are passed from the exposed parent to
the F1 offspring and sometimes later generations.
In worms, mutations in the histone demethylase gene spr-5 (a homologue of
mammalian LSD1) cause a weak sterility phenotype that is passed on and becomes
progressively more severe in subsequent generations, despite no further changes in
the spr-5 coding and promoter DNA sequence49. Meanwhile, mutations in three
genes encoding a histone methyltransferase complex, ash-2, wdr-5 and set-2,
increase longevity through several generations of offspring, even when only the
founding parental animal carries the mutant allele140. In D. melanogaster, an osmotic
or heat-stress stimulus can disrupt both the activity of the transcription factor ATF2
and the deposition of the repressive histone modification H3K9me2, and this
disruption can be transmitted to the next generation in a non-Mendelian manner141.
In mice, F1 offspring of males that have been fed a low-protein diet exhibit altered
liver gene expression profiles, and F1 female offspring of male rats that have been
fed a high-fat diet have impaired glucose tolerance and insulin secretion despite
being indistinguishable by genotype142,143. One historical cohort study in humans has
also suggested a transgenerational effect of paternal nutrition on the metabolic
status of children and grandchildren144,145.
These effects are intriguing, but a mechanism for their transmission between
generations is often lacking from these studies. To be validated, they will require a
germ-cell-based mechanism for transmission, and understanding epigenetic
regulation and genome organization throughout germ cell development will
provide insights into such a mechanism. For example, the white-spotting
phenotype of Kittm1Alf-mutant mice was found to be transmitted by abnormally
retained mRNAs in sperm, thus providing a mechanistic basis for this case of
non-Mendelian inheritance146. However, our current understanding of the
regulation of the germ cell epigenome is insufficient to provide true insight into
the means by which the effects that have been described in many of these studies
might be mediated. A deeper understanding of how DNA methylation, histone
modifications and other aspects of chromatin state are regulated in the
developing germ line of each of these model organisms is required to fully
understand the meaning of these effects. |
|
Др. сходством между видами - это поддержание пролиферативного пула стволовых клеток зародышевой линии, который сохраняется и у взрослых. Каждый из трех видов, описанных здесь, использует этот пролиферативный пул по-разному (FIG. 1): у гермафродитных червей продукция спермиев ограничена во времени и пролиферативные клетки зародышевой линии у взрослых становятся ооцитами; у мух зародышевые линии и самцов и самок содержат похожие на стволовые клетки предшественники; а у мышей продукция ооцитов ограничена во времени, а спермии постоянно продуцируются у взрослых самцов. У всех трех организмов эти пролиферативные пулы поддерживаются в ответ на передачу сигналов от соматической ниши81,131-133. Благодаря этим свойствам и поскольку они содержат потенциал вклада во все ткани эмбриона, зародышевые клетки часто концептуально связывают со стволовыми клетками; однако взаимоотношения между зародышевыми клетками и стволовыми клетками сложные. Одно заметное различие в том, что зародышевые клетки не плюрипотентны в своем естественном окружении: они являются унипотентными клетками, которые способны дифференцироваться в гаметы. Только после оплодотворения они способны формировать полностью нового индивида.
Несмотря на это имеются важные параллели между зародышевыми клетками и плюрипотентными клетками: зародышевые клетки являются единственными клетками эмбриона, которые будут вносить вклад в тотипотентные зиготы во время естественного цикла жизни; у млекопитающих примордиальные зародышевые клетки экспрессируют некоторые ассоциированные со стволовыми клетками транскрипционные факторы, включая OCT4 и SOX2, которые не экспрессируются в любой др. ткани; и ранние эмбриональные зародышевые клетки млекопитающих способны генерировать плюрипотентные стволовые клетки (известные как embryonic germ (EG) клетки) в культуре28,29,134. Примордиальные зародышевые клетки могут также давать опухоли, наз. тератомами, которые продуцируют ткани из всех трех зародышевых листков, что определяет признак плюрипотентности135. Сравнение зародышевых клеток и стволовых клеток поэтому обещает улучшить наше понимание природу и границы плюрипотентности и тотипотентности, путем создания in vivo ориентира для исследований in vitro. Новые молекулярные маркеры субпопуляций внутри пулов зародышевых клеток у взрослых предоставляют информацию о балансе между плюрипотентностью и дифференцировкой в этих клетках (BOX 2).
Возможность генерации функциональных зародышевых клеток in vitro, особенно от пациентов получаемых induced plurpotent stem cells (iPSCs), интересно медицинскому сообществу как способ преодоления бесплодия. Совсем недавно in vitro полученные спермии, как было установлено, продуцируют здоровое, плодовитое потомство у мышей136-139. Чтобы достичь этого клетки, подобные сперматогенным, были получены из embryonic stem cells (ESCs) и iPSCs посредством промежуточного состояния, наз. epiblast-like stem cells (EpiSCs), затем они были трансплантированы в семенники взрослых мышей, истощенных по зародышевым клеткам138. Необходимость проведения через онтогенетически соотв. промежуточные состояния подчеркивает важность понимания регуляторных механизмов in vivo чтобы получать наибольшую выгоду от технологий in vitro. Функциональные ооциты, с их наиболее высоко регулируемым мейотическим циклом, массивным ростом цитоплазмы и потребностью в плодном контексте для инициации мейоза, пока не могут быть получены in vitro137.
Зародышевые клетки уникальны по своей способности подвергаться мейозу и реализовывать слияние двух гаплоидных геномов в один. Молекулярное понимание генетической системы, лежащей в основе развития зародышевой линии, начинает проявляться и увеличение знаний в этой области обещает продвинуть область биологии зародышевых клеток вперед в новом и неожиданном направлении и открыт дверь для важных медицинских вмешательств.
| |
|

Box 2 | Spermatogonial stem cells in mammals
In male mammals, germ cells enter a G0-like arrested state embryonically. After birth, they resume mitotic proliferation, and a subset of cells begins progression along a defined differentiation pathway leading to meiosis and spermiogenesis. This process produces sperm cyclically throughout adult life. The ability to recruit new spermatogenic cells throughout life implies the presence of a self-renewing pool of precursor cells, referred to as the spermatogonial stem cells (SSCs)147,148. The presence of SSCs in adult testes has been established by transplant experiments in mice, in which labelled testicular cells are transferred to a recipient testis that has been depleted of germ cells, and are able to re-establish ongoing spermatogenesis. However, the precise identity of the SSCs within the seminiferous tubule, and the means by which they regulate the decision to self-renew or to proceed on a path towards meiosis, are a matter of lively debate.
Spermatogenic precursor cells in the testes have been classified histologically and by a limited set of marker genes, and the path along which they progress from mitotic
precursors to haploid spermatids has been well mapped (see the figure for a schematic
representation). Single mitotic precursor cells, called Asingle (As) spermatogonia, divide
with incomplete cytokinesis to become a joined pair of cells, called Apaired (Apr). These
pairs then divide synchronously between one and three times to become linearly
conjoined chains of 4–16 cells, called Aaligned (Aal). Following the Aal stage, spermatogonia are considered to be ‘differentiating’ and pass through A1, A2, A3, A4, intermediate, B and preleptotene stages before entering the leptotene phase of meiosis I147,148.
Until recently, it was assumed that As spermatogonia constituted the SSC pool.
However, studies over the past 10 years have shown that this assumption is, at best,
oversimplified. First, the testis-wide pool of As cells is heterogeneous, with some subsets
of As cells expressing markers that are associated with differentiating spermatogonia
and some expressing markers that are thought to be associated with self-renewal149.
Long-term lineage-tracing experiments indicate that there are more As cells than are
required to maintain a testis-wide pool of precursor cells150. By contrast, there are not
enough As cells to provide the numbers of Apr cells that are found in the seminiferous
tubule at any given time point151. In partial explanation, it now seems that Apr pairs, and possibly longer Aal chains, can break up into As-type cells with the potential to function as SSCs (as shown by the question mark in the figure)152. One remaining question is whether these breakages occur only during periods of insult and germ cell depletion, when they have primarily been observed, or in steady-state as well.
Recent studies have begun to delineate the molecular characteristics of As, Apr and other spermatogonial cells, and this genetic knowledge will be enormously helpful in isolating and studying putative SSC populations. For example, the recently identified inhibitor of DNA binding 4 (ID4), a transcriptional repressor, is expressed in a subpopulation of A2 cells and is required to maintain a pool of undifferentiated spermatogonia during adulthood153. Therefore, ID4 is a good candidate marker for the SSCs in adult testes. |
Сайт создан в системе
uCoz
 Figure 1 | Summary of germ cell development in C. elegans, D. melanogaster and the mouse. a | Germ cell development in Caenorhabditis elegans, Drosophila melanogaster and the mouse. Timescales are aligned by developmental stage rather than chronological time. Primordial germ cells before the initiation of gametogenesis are shown in purple. Differentiating female gametes are shown in pink and male gametes in blue. In the mouse, the germ line is specified from the epiblast by inductive signals from the surrounding tissue. The primordial germ cells divide mitotically throughout their early development. During gastrulation, they migrate to the gonad, where they gain the ability to enter meiosis and to undergo sex-specific differentiation. Female gametes initiate meiosis before birth, then enter meiotic arrest until ovulation, and male gametes initially arrest in a G0-like state, beginning meiotic divisions only after birth. In D. melanogaster, specialized germ plasm is set aside during oogenesis, and the germ cell precursors (pole cells) cellularize soon after fertilization. The pole cells migrate internally during gastrulation. After they reach the gonad, they divide mitotically and acquire sex-specific features. Meiosis begins in both sexes around the time of eclosion. In C. elegans, the first germline precursor is specified by the site of sperm entry at fertilization, and the two germline founder cells, Z2 and Z3, are derived from this precursor after five cell divisions. Z2 and Z3 begin to divide mitotically during the first larval stage. Meiosis begins during the third larval stage and initially produces sperm; after the end of the fourth larval stage, meiotic divisions generate oocytes. b | Conceptual overlay of the germ cell cycle in each organism with major gene-regulatory and cell-cycle events. Many of the same steps occur in all three organisms, but the timing relative to other aspects of development differs. Note that in D. melanogaster,
germline precursors are set aside and maternal control of the germ line begins during oogenesis, overlapping completion of the previous cycle of germline development.
Figure 1 | Summary of germ cell development in C. elegans, D. melanogaster and the mouse. a | Germ cell development in Caenorhabditis elegans, Drosophila melanogaster and the mouse. Timescales are aligned by developmental stage rather than chronological time. Primordial germ cells before the initiation of gametogenesis are shown in purple. Differentiating female gametes are shown in pink and male gametes in blue. In the mouse, the germ line is specified from the epiblast by inductive signals from the surrounding tissue. The primordial germ cells divide mitotically throughout their early development. During gastrulation, they migrate to the gonad, where they gain the ability to enter meiosis and to undergo sex-specific differentiation. Female gametes initiate meiosis before birth, then enter meiotic arrest until ovulation, and male gametes initially arrest in a G0-like state, beginning meiotic divisions only after birth. In D. melanogaster, specialized germ plasm is set aside during oogenesis, and the germ cell precursors (pole cells) cellularize soon after fertilization. The pole cells migrate internally during gastrulation. After they reach the gonad, they divide mitotically and acquire sex-specific features. Meiosis begins in both sexes around the time of eclosion. In C. elegans, the first germline precursor is specified by the site of sperm entry at fertilization, and the two germline founder cells, Z2 and Z3, are derived from this precursor after five cell divisions. Z2 and Z3 begin to divide mitotically during the first larval stage. Meiosis begins during the third larval stage and initially produces sperm; after the end of the fourth larval stage, meiotic divisions generate oocytes. b | Conceptual overlay of the germ cell cycle in each organism with major gene-regulatory and cell-cycle events. Many of the same steps occur in all three organisms, but the timing relative to other aspects of development differs. Note that in D. melanogaster,
germline precursors are set aside and maternal control of the germ line begins during oogenesis, overlapping completion of the previous cycle of germline development. 
 Figure 2 | Mechanism of transcriptional repression by PIE-1 and PGC. a | Promotion of transcription initiation and elongation by the positive transcription elongation factor b (PTEFb) complex. PTEFb (light green rectangle) binds to the carboxy-terminal tail of RNA polymerase II (RNAPII), and the cyclin-dependent kinase 9 (CDK-9) subunit phosphorylates serine 2 (green circle) of the tail, allowing transcriptional elongation. b | Proposed mechanism for inhibition by PIE-1 in Caenorhabditis elegans. PIE-1 (red rectangle) has a carboxy-terminal tail sequence similar to that of RNAPII and competes for PTEFb, thereby inhibiting PTEFb binding to RNAPII and phosphorylation of serines 2 and 5. The PIE-1 carboxy-terminal tail contains alanines (yellow circles) instead of serines at the CDK-9 phosphorylation sites and cannot be phosphorylated, potentially preventing the dissociation of PTEFb from PIE-1 and sequestering PTEFb away from RNAPII. c | Inhibition by polar granule component (PGC) in Drosophila melanogaster. PGC interacts with both the CDK9 and cyclin T1 components of PTEFb and sequesters the complex away from RNAPII. It is not known whether it acts by a competition mechanism similarly to PIE-1.
Figure 2 | Mechanism of transcriptional repression by PIE-1 and PGC. a | Promotion of transcription initiation and elongation by the positive transcription elongation factor b (PTEFb) complex. PTEFb (light green rectangle) binds to the carboxy-terminal tail of RNA polymerase II (RNAPII), and the cyclin-dependent kinase 9 (CDK-9) subunit phosphorylates serine 2 (green circle) of the tail, allowing transcriptional elongation. b | Proposed mechanism for inhibition by PIE-1 in Caenorhabditis elegans. PIE-1 (red rectangle) has a carboxy-terminal tail sequence similar to that of RNAPII and competes for PTEFb, thereby inhibiting PTEFb binding to RNAPII and phosphorylation of serines 2 and 5. The PIE-1 carboxy-terminal tail contains alanines (yellow circles) instead of serines at the CDK-9 phosphorylation sites and cannot be phosphorylated, potentially preventing the dissociation of PTEFb from PIE-1 and sequestering PTEFb away from RNAPII. c | Inhibition by polar granule component (PGC) in Drosophila melanogaster. PGC interacts with both the CDK9 and cyclin T1 components of PTEFb and sequesters the complex away from RNAPII. It is not known whether it acts by a competition mechanism similarly to PIE-1.  Figure 3 | Genetic pathways controlling germ cell
sex-determination and meiotic entry. Diagrams
show central aspects of each regulatory pathway that
are discussed in the main text but do not include all the
gene products that have been implicated in these
pathways. Gene products in yellow boxes are involved
in meiotic entry and those in blue boxes are involved in
sex determination. Dotted lines indicate diffusible
extracellular signals that weaken when distal to the
signal source. a | In Caenorhabditis elegans, a
Notch-Delta signalling pathway promotes mitotic
proliferation and germline stem cell (GSC)
self-renewal, and entry into meiosis is initiated when
GSCs migrate far enough away from the source of the
LAG-2 signal. Exit from self-renewal and entry into
meiosis at the last (L4) larval stage leads to male
(sperm) differentiation, whereas the same process
during adulthood results in female gametes (oocytes).
The daz-1 and tra-1 genes are both required for the
spermatogenesis-to-oogenesis switch. b | In Drosophila
melanogaster, the sex of the germ cells is determined
early in development and specifies the signals that
promote self-renewal in GSCs: that is, bone
morphogenetic protein (BMP) signals in females
(namely, Decapentaplegic (DPP) and Glass bottom boat
(GBB)) and signalling through the ligand Unpaired
(UPD) in males. The transition to meiosis occurs when
the cells leave the somatic niche. In both sexes,
Bag-of-marbles (BAM) and Benign gonial cell neoplasm
(BGCN) promote cystoblast differentiation and meiotic
entry. c | In mice, deleted in azoospermia-like (DAZL)
makes germ cells competent to enter both sex
differentiation and meiotic pathways. Sex specification
is determined by signals from somatic cells in the
gonad, whereas the induction of stimulated by retinoic
acid gene 8 (Stra8) by retinoic acid promotes meiotic
initiation. Female germ cells are able to respond to
retinoic acid in the embryo, whereas male germ cells
are prevented from doing so by CYP26B1 and by
NANOS2. In adult males, mitotic self-renewal is
promoted154. In males and females, various shared
effector genes are involved during gametogenesis155-157.
FBF, fem-3 mRNA-binding factor; FOG, feminization of
germ line; GLD, defective in germline development;
JAK, janus kinase; NOS, Nanos-related; ORB, oo18
RNA-binding protein; OTU, ovarian tumour protein;
STAT, signal transducer and activator of transcription;
SXL, Sex lethal; TRA-1, transformer protein 1.
Figure 3 | Genetic pathways controlling germ cell
sex-determination and meiotic entry. Diagrams
show central aspects of each regulatory pathway that
are discussed in the main text but do not include all the
gene products that have been implicated in these
pathways. Gene products in yellow boxes are involved
in meiotic entry and those in blue boxes are involved in
sex determination. Dotted lines indicate diffusible
extracellular signals that weaken when distal to the
signal source. a | In Caenorhabditis elegans, a
Notch-Delta signalling pathway promotes mitotic
proliferation and germline stem cell (GSC)
self-renewal, and entry into meiosis is initiated when
GSCs migrate far enough away from the source of the
LAG-2 signal. Exit from self-renewal and entry into
meiosis at the last (L4) larval stage leads to male
(sperm) differentiation, whereas the same process
during adulthood results in female gametes (oocytes).
The daz-1 and tra-1 genes are both required for the
spermatogenesis-to-oogenesis switch. b | In Drosophila
melanogaster, the sex of the germ cells is determined
early in development and specifies the signals that
promote self-renewal in GSCs: that is, bone
morphogenetic protein (BMP) signals in females
(namely, Decapentaplegic (DPP) and Glass bottom boat
(GBB)) and signalling through the ligand Unpaired
(UPD) in males. The transition to meiosis occurs when
the cells leave the somatic niche. In both sexes,
Bag-of-marbles (BAM) and Benign gonial cell neoplasm
(BGCN) promote cystoblast differentiation and meiotic
entry. c | In mice, deleted in azoospermia-like (DAZL)
makes germ cells competent to enter both sex
differentiation and meiotic pathways. Sex specification
is determined by signals from somatic cells in the
gonad, whereas the induction of stimulated by retinoic
acid gene 8 (Stra8) by retinoic acid promotes meiotic
initiation. Female germ cells are able to respond to
retinoic acid in the embryo, whereas male germ cells
are prevented from doing so by CYP26B1 and by
NANOS2. In adult males, mitotic self-renewal is
promoted154. In males and females, various shared
effector genes are involved during gametogenesis155-157.
FBF, fem-3 mRNA-binding factor; FOG, feminization of
germ line; GLD, defective in germline development;
JAK, janus kinase; NOS, Nanos-related; ORB, oo18
RNA-binding protein; OTU, ovarian tumour protein;
STAT, signal transducer and activator of transcription;
SXL, Sex lethal; TRA-1, transformer protein 1. 
