Посещений:  transgenerational эпигенетическое наследование
transgenerational эпигенетическое наследование
Роль длинных некодирующих РНК
|
|
Lamarck and the Missing LncKevin V. Morris  The Scientist October 1, 2012 |
Epigenetic changes accrued over an organism’s lifetime may leave a permanent heritable mark on the genome, through the help of long noncoding RNAs.
|
В своей 1809 г. публикации Philosophie Zoologique, Жан-Баптист Ламарк описывал жирафа, чья привычка дотягиваться до зеленых листьев высоких деревьев "привела в результате к тому . . . передние конечности животного становились длиннее, чем задние конечности, а его шея удлинилась до такой степени, что жираф без вставания на свои задние конечности . . . достигал высоты в шесть метров."
Хотя биологи в целом рассматривали идеи Ламарка, как содержащие столько же правды, как и сказки Киплинга о хоботе слоненка, ростки в области эпигенетики позволили некоторым из нас пересмотреть наши насмешки. Поскольку нет биологов, верящих, что организмы могут умышленно изменять свою физиологию в ответ на окружающую их среду и передавать потомству приобретенные изменения, но некоторые доказательства показывают, что внешняя среда может вызывать устойчивые изменения в геноме посредством эпигенетических механизмов-изменений, которые могут передаваться будущим поколениям.
Epigenetics: genome gatekeeper
Эпигенетические изменения могут варьировать в пределах от химических модификаций гистоновых белков-таких как ацетилирование и метилирование-до модификаций, производимых в самой ДНК. Такие изменения обычно вызывают уплотнение хроматина, это ограничивает способность RNA polymerase II транскрипционного комплекса достижения ДНК, что в конечном итоге приводит к снижению выхода мРНК и белка. Многие рассматривают эпигенетику как аннотацию или редактирование генома, что предопределяет, какие гены будут замалчиваться чтобы модернизировать продукцию белков или подавлять нежелательную избыточность. Такие аннотации, уверяют они, не делают и не могут постоянно изменять оригинальный манускрипт (т.e., ДНК), а в основном обращаются к манускрипту.
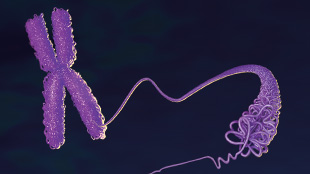
Infographic: The Epigenetic Lnc
View full size JPG | PDF
Как только эпигенетика получила признание в научном сообществе в целом, ученые начали сообщать о наблюдениях вновь идентифицированного феномена, наз. через поколения эпигенетическое наследование (transgenerational epigenetic inheritance), или передача эпигенетических изменений от родителей к их потомству. Недавняя экспериментальные работы на мышах, червях и свиньях получили доказательства, что определенная степень transgenerational эпигенетического наследования может иметь место.[1. B.T. Heijmans et al., "Persistent epigenetic differences associated with prenatal exposure to famine in humans," PNAS, 105:17046-49, 2008.],[2. T.B. Franklin et al., "Epigenetic transmission of the impact of early stress across generations," Biol Psychiatry, 68:408-15, 2010.],[3. O. Rechavi et al., "Transgenerational inheritance of an acquired small RNA-based antiviral response in C. elegans," Cell, 147:1248-56, 2011.],[4. M. Braunschweig et al., "Investigations on transgenerational epigenetic response down the male line in F2 pigs," PLoS ONE, 7: e30583, 2012.] Очаровательное исследование 2008, которое анализировало людей, рожденных во время Датской Голодной Зимы (Dutch Hunger Winter) в 1944-1945, намекает на возможность, что transgenerational эпигенетическое наследование может происходить и у людей.1 Взрослые, которые были зачаты во время голода, имеют характерные эпигенетические метки, которых не содержат их братья-сестры, рожденные после голода. Эти метки снижают продукцию insulin-like growth factor 2 (IGF2) и влияют на рост зачатых во время голода детей. Важно, что эти метки оказались сохраненными в течение нескольких декад у затронутых индивидов. Поскольку эти наблюдения подтверждают возможность transgenerational эпигенетического наследования, то модификации должны также возникать in utero как результат голодных условий скорее, чем наследоваться зародышевой линией. Следовательно, имеет ли место такой явственный феномен у человека, предстоит ещё определить.
Однако в модельных экспериментальных системах имеются строгие доказательства transgenerational эпигенетического наследования. 2,3,4 В одном исследовании, проведенном на мышах, средовой стресс, который вызывал агрессивное поведение у самцов, вызывал такое же поведение у потомства.[5. T.B. Franklin, I.M. Mansuy, "Epigenetic inheritance in mammals: evidence for the impact of adverse environmental effects," Neurobiol Dis, 39:61-65, 2010.] Очевидно, что потомство имеет изменения в паттернах метилирования ДНК определенных генов. Итак, эти и др. transgenerational исследования подкрепляют мнение, что избирательное давление может быть оказано внешней средой и передано дочерним клеткам и потомкам.
Controlling epigenetics
Поскольку эпигенетические модификации генома хорошо изучены, но менее известно о том, как определенные эпигенетические метки управляют ими затронутыми локусами. Очевидно, что кое-что осуществляет модификации, которые, по-видимому, дифференциально распределены в результате определенных стрессов, индуцированных в клетках или организме. Недавние исследования подтвердили, что эпигенетические изменения и возможно transgenerational эпигенетическое наследование, могут быть объяснены с помощью несколько неожиданного молекулярного игрока: длинных некодирующих РНК.

Infographic: A Mechanism for Targeted Change
View full size JPG | PDF
Long noncoding RNAs (lncRNAs) являются транскриптами, обычно экспрессируемые с регионов "мусорной" ДНК, которые, как известно, не кодируют белков. Подсчеты количеств lncRNA колеблются в пределах от 70 до 98 % транскриптов, присутствующих в клетке и некоторые имеют длину в несколько тысяч пар оснований.[6. T.R. Mercer et al., "Long non-coding RNAs: insights into functions," Nat Rev Genet, 10: 155-59, 2009.] В отличие от коротких некодирующих РНК, таких как короткие interfering РНК, которые заставляют молчать гены путем разрезания мРНК в цитоплазме, lncRNAs, по-видимому, соединяются с транскриптами в ядре, когда они сходят с репликационной вилки ДНК и рекрутируют ферментативные комплексы, чтобы индуцировать эпигенетические изменения этих локусов.[7. K.V. Morris, "Long antisense non-coding RNAs function to direct epigenetic complexes that regulate transcription in human cells," Epigenetics, 4:296-301, 2009.] Некоторые из этих lncRNAs связывают транскрипты с белок-кодирующих генов во время нормального транскрипционного процесса.[8. K.V. Morris et al., "Bidirectional transcription directs both transcriptional gene activation and suppression in human cells," PLoS Genet, 4: e1000258, 2008.],[9. W. Yu et al., "Epigenetic silencing of tumour suppressor gene p15 by its antisense RNA," Nature, 451:202-06, 2008.],[10. P.G. Hawkins, K.V. Morris, "Transcriptional regulation of Oct4 by a long non-coding RNA antisense to Oct4-pseudogene 5," Transcr, 1:165-75, 2010.] Ассоциированные хроматин ремоделирующие белки затем модифицируют локальный хроматин и ДНК, супрессируя экспрессию гена. Одной из таких модификаций является метилирование ДНК, которое, по-видимому, происходит, когда lncRNAs управляет энзимами такими как DNA methyltransferase DNMT3a, чтобы целенаправленно создаь точки в геноме. Альтернативно, lncRNAs могут управлять модификациями ближайших гистонов, обычно в форме метилирования гистоновых хвостов.
Метилирование ДНК само по себе может передаваться от клетки к дочерним клеткам.[11. M.S. Weinberg et al., "The antisense strand of small interfering RNAs directs histone methylation and transcriptional gene silencing in human cells," RNA, 12:256-62, 2006.] Кроме того, как было установлено, в течение некоторого времени, что такие модификации могут также приводить к устойчивым изменениям в генетическом коде. Метилирование cytosine (C), напр., может приводить к тому, что нуклеиновая кислота изменится в thymine (T) посредством деаминирования или удаления аминогруппы. Почти 80% мест метилирования в геноме человека приходится на цитозин, за которым следует гуанин в CpG последовательности. Деаминирование происходит, когда метилированный цитозин подвергается реакции гидролиза, приводя к образованию аммиака, сопровождаемое превращением цитозина в тимин в этой точке последовательности ДНК. Т.к. эта C-to-T конверсия рассматривается случайной, а спонтанное деаминирование метилированных CpGs обнаруживается в два раза быстрее, чем конверсии C-to-T в неметилированных CpG последовательностях,[12. J.C. Shen et al., "The rate of hydrolytic deamination of 5-methylcytosine in double-stranded DNA," Nucleic Acids Res, 22:972-76, 1994.], то предполагается пристрастие в отношении CpG регионов в процессе деаминирования.
Хотя эти идеи ещё не подтверждены полностью экспериментальными доказательствами, можно представить себе модель того, как эта система может работать-механизм, с помощью которого эпигенетические изменения, управляемые с помощью lncRNAs, будут создавать устойчивые наследуемые изменения в геноме. В самом деле такая, базирующаяся на lncRNA- система редактирования ДНК может управлять некоторыми аспектами генетической изменчивости и может объяснить широко распространенное возникновение полиморфизмов одиночных нуклеотидов внутри видов. Если это верно, то д. быть чудом такая роль управления с помощью lncRNA метилированием ДНК в эволюции генома.
Driving diversity
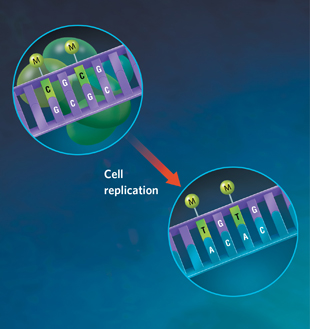 НАПРАВЛЕННАЯ ЭВОЛЮЦИЯ: Эпигенетические модификации наиболее часто д. происходить в cytosines (C), которые сопровождаются гуанином (G) (top). Такие метилированные цитозины наиболее вероятно будут подвергаться химической реакции, которая превращает C в тимин (T), постоянно изменяя генетическую последовательность. Когда такая измененная последовательность реплицируется во время клеточного деления, то вновь генерируемая комплементарная (matching) нить будет копировать эту измененную последовательность (внизу), давая следующее поколение слегка измененного геномного манускрипта. Этот новый манускрипт д. изменять структуру кодируемого белка или изменять гомологичную последовательность мРНК для связывания lncRNA, делая lncRNA неспособной соединяться и супрессировать этот ген, позволяя тем самым этой измененной последовательности транскрибироваться снова.
НАПРАВЛЕННАЯ ЭВОЛЮЦИЯ: Эпигенетические модификации наиболее часто д. происходить в cytosines (C), которые сопровождаются гуанином (G) (top). Такие метилированные цитозины наиболее вероятно будут подвергаться химической реакции, которая превращает C в тимин (T), постоянно изменяя генетическую последовательность. Когда такая измененная последовательность реплицируется во время клеточного деления, то вновь генерируемая комплементарная (matching) нить будет копировать эту измененную последовательность (внизу), давая следующее поколение слегка измененного геномного манускрипта. Этот новый манускрипт д. изменять структуру кодируемого белка или изменять гомологичную последовательность мРНК для связывания lncRNA, делая lncRNA неспособной соединяться и супрессировать этот ген, позволяя тем самым этой измененной последовательности транскрибироваться снова.
Интересно, что значительная частота целенаправленных C-to-T изменений будет также приводить к всеобщей потере комплементарности между последовательностью и lncRNA, которая воздействует на неё. В результате скорее инициация супрессии гена мишени, чем изменение будет приводить к обновленной транскрипции в последующих генерациях. В то же самое время этот процесс будет делать возможной укладку транскрипта мишени в др. конформацию, позволяя тем самым появление др. субнаборов ?lncRNA взаимодействий в несколько отличных локусах. Альтернативно, изменения в самих lncRNAs могут приводить к потере ассоциаций между lncRNA и белком, приводя к тому, что др. клеточный аппарат (machinery) будет локализован в определенных локусах мишенях. Т.о., избыточная активность одной из lncRNA будет обрекать эту lncRNA на потерю функции, но одновременно приводить к эволюции новой регуляторной сети lncRNA с потенциально иными нижестоящими эффектами.
Более того, места часто затрагиваемые (targeted) с помощью lncRNAs будут, скорее всего, содержать большую пропорцию T:A связей между нитями ДНК, благодаря событиям деаминирования. Такие перманентные и наследуемые изменения в генетическом коде д. менять форму кодируемого белка, его функцию или его способность транскрибироваться в целом.
Можно представить себе, как вариации внешней среды путем, побуждаемые эпигенетическими изменениями, смогут повысить сложность организма, предоставляя тем самым популяции более значительные шансы для выживания в новых и постоянно угрожающих условиях внешней среды. Др. словами, эпигенетика скорее, чем случайные генетические точковые мутации будут предоставлять отсутствующую связь между давлением окружающей среды и возникающей в результате генетической изменчивостью, которая генерирует выносливость вида.
Наверняка, если такой путь существует в клетках человека, то следует ожидать он будет неуловим просто благодаря истинной сложности процесса-с использованием lncRNAs, эпигенетический изменений, метилирования ДНК и деаминирования. Т.о., это не из области невозможного, что такой механизм существует, но до сих пор не выявлен наукой.
Внутренняя молекулярная работа клетки крайне сложна и появление возможности, что lncRNAs являются активными модуляторами транскрипции генов и эпигенетических состояний только осложняет картину. Ясно, чем больше появится данных в этой области исследований, тем больше появится дополнительных слоёв регуляции, необходимых для дополнения центральной догмы молекулярной биологии. Хотя организм не может передавать специфическую информацию о своём собственном опыте-жираф будет неспособен помочь своему потомству доставать до верхушек деревьев, вытягивая свою собственную шею-он может предоставить последующим поколениям шансы на успех в др. условиях, наделяя их слегка измененным арсеналом генетических инструментов.
|
 Infographic: The Epigenetic Lnc
View full size JPG | PDF
Infographic: The Epigenetic Lnc
View full size JPG | PDF
 Infographic: A Mechanism for Targeted Change
View full size JPG | PDF
Infographic: A Mechanism for Targeted Change
View full size JPG | PDF
 НАПРАВЛЕННАЯ ЭВОЛЮЦИЯ: Эпигенетические модификации наиболее часто д. происходить в cytosines (C), которые сопровождаются гуанином (G) (top). Такие метилированные цитозины наиболее вероятно будут подвергаться химической реакции, которая превращает C в тимин (T), постоянно изменяя генетическую последовательность. Когда такая измененная последовательность реплицируется во время клеточного деления, то вновь генерируемая комплементарная (matching) нить будет копировать эту измененную последовательность (внизу), давая следующее поколение слегка измененного геномного манускрипта. Этот новый манускрипт д. изменять структуру кодируемого белка или изменять гомологичную последовательность мРНК для связывания lncRNA, делая lncRNA неспособной соединяться и супрессировать этот ген, позволяя тем самым этой измененной последовательности транскрибироваться снова.
НАПРАВЛЕННАЯ ЭВОЛЮЦИЯ: Эпигенетические модификации наиболее часто д. происходить в cytosines (C), которые сопровождаются гуанином (G) (top). Такие метилированные цитозины наиболее вероятно будут подвергаться химической реакции, которая превращает C в тимин (T), постоянно изменяя генетическую последовательность. Когда такая измененная последовательность реплицируется во время клеточного деления, то вновь генерируемая комплементарная (matching) нить будет копировать эту измененную последовательность (внизу), давая следующее поколение слегка измененного геномного манускрипта. Этот новый манускрипт д. изменять структуру кодируемого белка или изменять гомологичную последовательность мРНК для связывания lncRNA, делая lncRNA неспособной соединяться и супрессировать этот ген, позволяя тем самым этой измененной последовательности транскрибироваться снова.