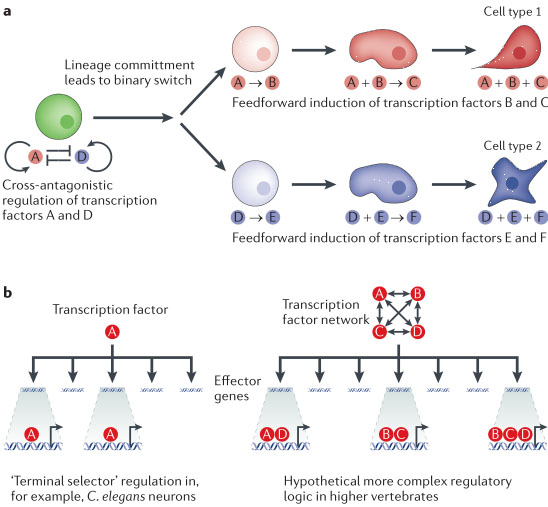
делает возможными генетические исследования, которые выявляют механизмы, лежащие в основе развития нейронов, а также механизмы, которые важны для поддержания свойств нейронов. В развивающихся клонах нервных клеток последовательно действуют регуляторные импульсы, инициирующие экспрессию специфичных для типа нейронов транскрипционных факторов, которые иногда обозначаются как терминальные селекторы, чья экспрессия поддерживается в течение всей жизни зрелых нейронов (rev. REF. 44) (FIG. 1b). Транскрипционные факторы могут быть эффективными индукторами клеточных характеристик благодаря своей способности контролировать экспрессию различных генов (которые здесь обозначены как эффекторные гены), которые скоординировано вызывают фенотипы определенных типов клеток. Терминальные селекторы поддерживают свою собственную экспрессию путем авторегуляции, тем самым гарантируя стабильное сохранение клеточных характеристик. Напр., сенсорные нейроны (ASE neurons) поддерживаются таким способом с помощью CHE-1, транскрипционного фактора, который регулирует ASE-специфические гены путем соединения с 'ASE-мотивами'
. У
che1-нулевых мутантов, ASE нейрональные признаки теряются, тогда как сохраняются всеобщие нервные характеристики без очевидного приобретения альтернативной нейрональной судьбы. Это указывает, что хотя терминальный селекторный ген che-1 постоянно необходим для поддержания ASE-нейрон-специфичных фенотипов, более характерных для определенного класса, клеточные признаки, которые общи с др. нейронами, не поддерживаются терминальными селекторами. Поддержание др. нейрон-специфичных характеристик следует сходной логике: напр., в механосенсорных и AIY промежуточных нейронах, которые зависят от постоянной активности MEC-3-UNC-86 и TTX-3-CEH-10 гетеродимеров. соотв.
. Признаки холинергических двигательных нейронов контролируются специфической цис-регуляторной сигнатурой и непрерывной экспрессией транскрипционного фактора UNC-3 (REF. 53). исходя из этих и др. примеров становится очевидным, что качественные особенности нейронов
преимущественно поддерживаются за счет простой регуляторной логики, которая зависит от постоянной инструктивной активности немногих ключевых транскрипционных факторов, которые специфически экспрессируются в разных типах клеток (FIG. 1b).
Transcription factor combinatorial codes.
Действуют ли сходные принципы у более сложных организмов, таких как млекопитающие, которые обладают нервной системой, состоящей из нескольких сотен разных типов клеток? Интересно, что многие гены, которые специфически экспрессируются в фоторецепторах сетчатки мыши, контролируются за счет непосредственного связывания гомеодоменового транскрипционного фактора CRX, указывая. что этот транскрипционный фактор может быть определен как терминальный селектор у млекопитающих54. Напротив, др. наблюдения у высших позвоночных указывают на более сложную регуляцию. Несмотря на то, что C. elegans специфичные для допаминовых нейронов признаки контролируются с помощью AST-1 (REF. 55), экспрессия генов допаминового пути у мыши не зависит от его аналога у млекопитающих ETV1 (REF. 56). Вместо этого, по-видимому, значительно большая панель транскрипционных факторов контролирует дифференцировку у млекопитающих57,58, в частности, используя сложное и ещё плохо изученное комбинаторное кодирование, причем субнаборы эффекторных генов контролируются разными комбинациями транскрипционных факторов; только когда транскрипционные факторы экспрессируются совместно они могут индуцировать полный репертуар соотв. генов дифференцировки (FIG. 1b). Это может быть расширением простого комбинаторного кодирования, которое наблюдается для некоторых типов клеток у C. elegans: напр., TTX-3-CEH-10 и MEC-3-UNC-86 гетеродимерные пары совместно регулируют гены дифференцировки в AIY и механосенсорных нейронах, соотв. 49-51.
Коды транскрипционных факторов могут возникать из простой упреждающей (feedforward) индукции, как показано на FIG. 1a. Пептидергические подтипы нейронов у
Drosophila melanogaster предоставляют подходящий пример. Эти типы клеток специфицируются за счет упреждающей индукции за счет индукции транскрипционных факторов, которые создают родственные, но уникальные коды транскрипционных факторов с разным объемом информации в дифференцирующихся постмитотических нейронах
59. Интересно, что неправильная экспрессия факторов, определяющих один из этих клеточно-специфичных кодов ведет к драматической эктопической активации нейропептидергических генов в большом количестве нейронов, независимо от их онтогенетической истории, демонстрируя тем самым, что определенная комбинация транскрипционных факторов может быть достаточной для инструктирования генома по изменению репертуара эффекторных генов
59. Важно, что при условном устранении, как недавно было установлено, эти онтогенетические транскрипционные факторы постоянно необходимы в зрелых нейронах для поддержания своей качественной особенности
60. Т.о., регуляторные каскады, которые участвуют в развитии, по-видимому, генерируют окончательные состояния имеющихся сетей транскрипционных факторов, которые сами по себе способны предоставить полный и достаточно инструктивный 'код' для поддержания программ специфичной для типа клеток экспрессии генов в дифференцированных клетках.
Control of labile differentiated states
Guardians of differentiated cell identity in mammals.
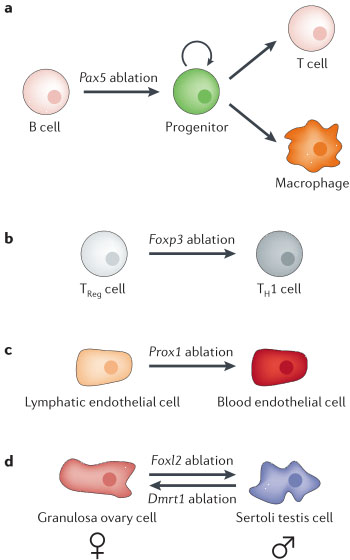
Недавно были проведены исследования для выяснения степени, с которой транскрипционные факторы участвуют в спецификации клеточных характеристик, необходимые постоянно для поддержания этих качественных особенностей. Эти исследования помогли путем увеличения доступности линий мышей, которые были преобразованы, чтобы экспрессировать Cre рекомбиназу, используя тканеспецифические промоторы. Эти линии включали и те, что экспрессировали tamoxifen-индуцибельный Cre-ERT2 для эксцизии LoxP-flanked генов мишеней в необходимый временной момент61. Эти модели сделали возможной устранение гена в дифференцирующихся тканях мышей, тем самым сделав возможными эксперименты, которые могут отличать между дефектами, возникающими в результате разрушения онтогенетических в противоположность поддерживающим механизмам. Устранение некоторых транскрипционных факторов в дифференцирующихся клетках млекопитающих приводило к драматической потере фенотипа, что сопровождалось приобретением альтернативной судьбы62-69, демонстрируя существование индивидуальных транскрипционных факторов, которые критически участвуют в обеспечении дифференцированного состояния (FIG. 2). Как они выполняют такую фундаментальную роль и что они выявляют относительно типов клеток, в которых они экспрессируются?
Детерминация и дифференцировка B клеточного клона нуждается в paired-box транскрипционном факторе PAX5 (REF. 70). Условное устранение Pax5 в детерминированных развивающихся pro-B клетках превращает их в недетерминированные клетки предшественники с потенциалом дифференцироваться в макрофаги или T клетки71. Интересно, что у животных, которые истощены в отношении незрелых B клеток, условное устранение Pax5 специфически в зрелых B клетках приводит к потере характеристик зрелых B клеток. Эти дедифференцированные Pax5-истощенные B клетки сильно напоминают нормальных недетерминированных предшественников и обладают потенциалом генерировать множественные типы гематопоэтических клеток62. Впечатляющим результатом этих экспериментов стала демонстрация, что изолированные и очищенные зрелые Pax5-дефицитные B клетки способны восстанавливать лимфопоэз у T-cell-дефицитных Rag2-/- мышей. Более того, эти клетки были также способны, несмотря на низкую частоту, дифференцироваться в более удаленный миэлоидный клон и дифференцироваться в макрофаги. PAX5 обычно способствует дифференцировке B клеток в результате непосредственного связывания и активации многочисленных B клеточных эффекторных генов72. Точные регуляторные мишени, которые ответственны за репрограммирование зрелых B клеток у Pax5-дефицитных мышей, остаются неизвестными, но некоторые гены, которые или непосредственно или косвенно репрессированы с помощью PAX5 в
pro-B клетках были идентифицированы, как кодирующие белки, такие как рецепторы клеточной поверхности, которые безразличны для дифференцировки B клеток72. Т.о., эти впечатляющие наблюдения четко демонстрируют, что Pax5 критическим не только для обеспечения развития B клеток, но и также для поддержания качественных особенностей дифференцированных B клеток62.
Др. пример это удаление prospero-related homeobox 1 (Prox1), который кодирует транскрипционный фактор, важный для детерминации судеб лимфатических эндотелиальных клеток73. Если активность этого гена внезапно удалена с помощью активации тамоксифеном Cre-ERT2 или в незрелых или взрослых лимфатических сосудах, то происходит быстрый переход, ведущий к активации маркеров кровеносных эндотелиальных клеток и к супрессии маркеров лимфатических эндотелиальных клеток. Др. гистологические свойства также указывают, что существенное репрограммирование происходи как результат устранения Prox1. В противовес результатам устранения Pax5 в дифференцированных В клетках, потеря Prox1 ведет к непосредственному превращению в кровеносные эндотелиальные клетки без прохождения состояния незрелых предшественников64.
Ещё одно переключение фенотипа, которое фундаментально меняет половые характеристики, описано после устранения гена транскрипционного фактора forkhead box L2 (Foxl2) во взрослых овариях мышей. Foxl2 способствует дифференцировке гонад самок в нормальном развитии74,75. Удивительно, устранение Foxl2 у взрослых ведет к быстрому репрограммированию клонов клеток granulosa и theca в клетки Sertoli и тестостерон-продуцирующие клетки Leydig65. Лишь спустя 3 недели после устранения обнаруживаются крупные гистологические изменения, которые затрагивают почти всю гонаду. Уровни тестостерона в сыворотке таких мышей сравнимы с таковыми у нормальных самцов мыши и наблюдаются значительные вторичные изменения на реверсию пола в тканях мишенях, реагирующих на повышенные уровни тестостерона. Анализ геномного транскриптома выявляет крупные изменения в программе экспрессии генов, одно из них связано со значительным сходством с гонадами самцов, чем самок после удаления Foxl2. Важно, что быстрый и почти полный переход строго указывает на то, что устранение Foxl2 вызывает трансдифференцировку скорее, чем дедифференцировку, что сопровождается нормальным развитием типов клеток, подобных гонадам самцов. FOXL2 непосредственно репрессирует экспрессию транскрипционного фактора, кодируемого геном SRY-box containing gene 9 (Sox9), который является первичной мишенью детерминирующего пол самцов SRY транскрипционного фактора.
Т.о., FOXL2 ответственен за непрерывное поддержание характеристик гонад у самок мышей как во время развития, так и у взрослых65. Интересно, что соотв. ситуация доказана и у самцов. Соответственно удаление у взрослых самцов doublesex and mab-3 related transcription factor 1 (Dmrt1), который экспрессируется в гонадах самцов, ведет к активации Foxl2 и трансдифференцировке клеток Sertoli в клетки, похожие на гранулёзные, приводя к частичной феминизации. DMRT1 непосредственно репрессирует экспрессию Foxl2, демонстрируя, что эти два фактора являются центральными компонентами в лабильном балансе контроля поддержания гонад самцов и самок в ходе взрослой жизни69. Соотв. роль DMRT1 недавно описана у рыб medaka, у которых сначала образуются гонады самцов, но затем трансдифференцируются в гонады самок у Dmrt1-мутантных рыбок76.
Клональное переключение ассоциировано с внутренне присущей пластичностью дифференцированной судьбы клеток. Указывают ли эти и др. редкие примеры клонального переключения клеток у взрослых млекопитающих на существование механизмов, которые защищают от приобретения альтернативных клеточных судеб в большинстве или даже во всех дифференцированных типах клеток? Хотя это остается возможным, но трудно исключить, что, по-видимому, подобные примеры драматического превращения клонов отражают физиологическую потребность в высокой степени клеточной пластичности определенных типов клеток. В самом деле, полностью дифференцированные B клетки в норме пластичны, это доказывается, когда учитывается то, что стимуляция антигеном В клеточных рецепторов запускает переключение фенотипа с Pax5-экспрессирующих B клеток на секретирующие антитела плазматические клетки, которые не экспрессируют Pax5 (REF. 77). В этом контекста интересно отметить, что гены, репрессируемые с помощью PAX5, не обнаруживают обогащения Polycomb group (PcG)-mediated гистоном H3, триметилированного по лизину 27 (H3K27me3), метке, которая обычно ассоциирует с репрессированным хроматином, это вообще-то отражает потребность в быстрой активации супрессируемых генов вследствие снижения экспрессии Pax572. Такая гибкость дифференцированного состояния может также объяснить способность, с помощью которой зрелые B клетки могут быть репрограммированы в макрофаги после неправильной экспрессии CCAAT/enhancer binding protein-α (C/EBPα) и C/EBPβ, которые супрессируют активность Pax578. Др. клеточные типы клона лимфоцитов также могут быть необычно пластичными, как это подтверждается наблюдением, что зрелые регуляторные T клетки превращаются в helper T клетки после устранения гена транскрипционного фактор forkhead box P3 (Foxp3)67,68 и что после устранения гена транскрипционного фактора Bcl11bнекоторые типы зрелых Т клеток превращаются в клетки, подобные естественным киллерам66.
Происходящие из энтодермы панкреатические и печеночные клетки являются дополнительными примерами довольно лабильного дифференцированного состояния с наследуемой способностью изменять фенотип. Интересно, что острое устранение панкреатических β-клеток у взрослых мышей запускает превращение глюкагон-продуцирующих α-клеток в инсулин-продуцирующие
β-клетки79. Снова, хотя молекулярные события остаются неясными, этот пример указывает на существование впечатляющей пластичности, которая была адаптирована под физиологический механизм клеточного замещения.
Наконец, потребность регулировать дифференцированное состояние типов клеток гонад самок и самцов может быть связана с эволюционно законсервированной потребностью постнатального превращения пола, которая широко распространена у низших позвоночных. В самом деле, взаимные антагонистические взаимоотношения между Sox9 и Foxl2 доказаны для низших позвоночных и, следовательно, эволюционно законсервированный механизм детерминации пола.
Control of stable differentiated states
Как упоминалось ранее, широко распространенным наблюдением является то, что транскрипционные факторы, которые существенны для спецификации и дифференцировки ранних типов клеток, продолжают экспрессироваться в клетках, которые приобрели полностью дифференцированный фенотип. Более того, многие такие онтогенетически важные транскрипционные факторы соединяются непосредственно с большой пропорцией соотв. эффекторных генов, как продемонстрировано в исследованиях по связыванию транскрипционных факторов72,80-82. Является ли такая устойчивая экспрессия и непосредственное связывание со многими эффекторными генами способом продолжения экспрессии этих транскрипционных факторов, и необходима ли она для поддержания клеточных характеристик инструктивно? Возможно отчасти counter-intuitively, некоторые исследования условных нокаутов у мышей продемонстрировали относительно умеренные фенотипы, когда гены ключевых транскрипционных факторов, которые участвуют в ранней дифференцировке, устранены во взрослых тканях. Напр., PC12 ETS domain-containing transcription factor 1 (PET1; также известный как FEV) и LIM homeobox transcription factor 1β (LMX1β) являются транскрипционными факторами, которые играют ключевые роли в развитии serotonergic (5-HT) нейронов в ЦНС. Оба фактора поддерживаются во взрослых постмитотических 5-HT нейронах83-85. В то время как ранние нокауты этих факторов приводят к тяжелой потере всех или почти всех (для Pet1) дифференцированных 5-HT нейронов86,87, устранение Lmx1b или Pet1 в головном мозге с взрослых мышей ведет только к поведенческим аномалиям и подавлению некоторых маркеров 5-HT нейронов83,88. Однако клетки сохраняются и крупные гистологические признаки выглядят нормальными. Более того, некоторые гены, которые зависят от Pet1 или Lmx1b в раннем развитии остаются активными после устранения этих генов у взрослых мышей.
Имеются ещё примеры всё более и боле умеренных фенотипов, когда гены подвергаются нокауту поздно во время дифференцировки у мышей. Сюда входит Nurr1 (также известен как Nr4a2), который кодирует ключевой транскрипционный фактор, который необходим для дифференцировки dopaminergic нейронов58. У Nurr1-нулевых мышей полный блок дифференцировки dopamine нейронов приводит к полному отсутствию этих нейронов у новорожденных мышей, тогда как устранение у взрослых приводит к подавлению некоторых маркеров dopamine нейронов, но клетки сохраняются и выглядят морфологически нормальными58. Кроме того, Foxa1 и Foxa2
обладают уникальными и перекрывающимися функциями в морфогенезе тканей, происходящих из энтодермы, включая поджелудочную железу89,90
(rev. REF. 91). Комбинированный условный нокаут Foxa1 и Foxa2 у взрослых приводит к аномальной функции β-островковых клеток и к неправильной регуляции генов дифференцировки, но клетки поддерживаются и сохраняется крупная тканевая морфология92.
Стабильные нижестоящие сети могут лежать в основе надежности дифференцированных клеточных характеристик. Возможны несколько объяснений, почему позднее устранение ключевых онтогенетических транскрипционных факторов является менее разрушительным. Напр., родственные транскрипционные факторы, которые совместно экспрессируются с данным транскрипционным фактором могут быть перекрывающимися в поздний, но не в ранний момент развития. Более того, некоторые из этих транскрипционных факторов могут выполнять ранние роли: напр., в бинарных механизмах клеточной спецификации в популяциях пролиферирующих предшественников, как показано на FIG. 1a. Нулевые мутации зародышевой линии, следовательно, нарушают события клеточной спецификации, которые не связаны с функцией по регуляции соотв. эффекторных генов в дифференцированных клетках. Однако относительно легкие фенотипы, которые возникают после устранения в зрелых клетках также могут отражать то, что определенный тип клеток является более стабильным, чем те, что описаны выше, когда транскрипционные факторы, по-видимому, существуют как ключевые узловые точки. Трудно исключить, что такие узловые точки будут в конечном итоге идентичными для всех типов клеток, но более вероятна гипотеза, что умеренные фенотипы, которые возникают после разрушения ключевых онтогенетических транскрипционных факторов, отражают то, как сети транскрипционных факторов стабилизируются со временем за счет перекрывающихся функций с помощью близких или более удаленных транскрипционных факторов. Принципиальное различие между лабильным и стабильным состоянием дифференцировки д. зависеть частично от стабильности соотв. сети транскрипционных факторов, как показано на FIG. 3. Изучение транскрипционных факторов, экспрессирующихся в развивающихся и зрелых гепатоцитах демонстрирует эту точку зрения.
Hepatocyte nuclear factor 4 фосфорилирование (HNF4α) безразлично для печёночной спецификации, но эмбриональный нокаут Hnf4a ведет к нарушению дифференцировки гепатоцитов93,94. Позднее устранение специфичного для гетпатоцитов Hnf4a вызывает изменение экспрессии генов, но не общую потерю качественных особенностей гепатоцитов95. Сходным образом инактивация др. транскрипционных факторов гепатоцитарного клона, как было установлено, изменяет экспрессию генов, не приводя к потере общих характеристик клеток печени96.
Эти результаты могут быть поняты, если учесть, как формируется сложная сеть транскрипционных факторов гепатоцитов со временем. HNF4α, как было установлено, соединяется с промоторами более 40% всех экспрессирующихся в печени генов, которые обычно корегулируются с помощью др. специфичных для печени транскрипционных факторов
82. Во время ранней дифференцировки устанавливаются, по-видимому, простые каскады положительной обратной связи ко-экспрессирующихся транскрипционных факторов, которые всё более становятся взаимосвязаны в сложную сеть транскрипционных факторов (FIG. 1a). Интересно, что хотя устранение специфического для гепатоцитов взрослых Hnf4a лишь слегка нарушает экспрессию др. экспрессируемых печенью генов транскрипционных факторов, нокаут зародышевой линии более разрушителен из-за менее сложной сети транскрипционных факторов в развивающихся гепатоцитах
97,98. Эта тенденция тесно коррелирует с всеобщей тяжелой потерей печеночных генов транскрипционных факторов, когда Hnf4a устраняется рано, но не поздно во время дифференцировки гепатоцитов.
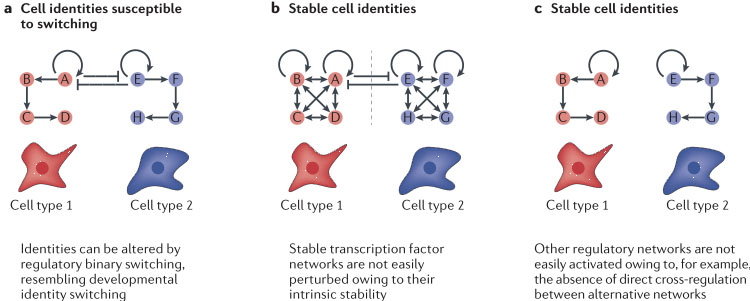 Figure 3 | Models for how transcription factor networks might control the stability of the differentiated state. a | In cells endowed with intrinsic high plasticity - for example, stem and progenitor cells or mature B cells - the transcriptional networks that govern distinct phenotypes are characterized by labile transcription factor networks and active cross-inhibition sets the stage for binary switching between cell types 1 and 2, respectively. This can occur even in a mature cell if transcription factor A is ablated. Forkhead box L2 (FOXL2) and other 'guardians' of the differentiated state seem to represent such key transcription factors. b | It seems likely that stably differentiated cell types are controlled by more elaborate transcription factor networks, illustrated by more cross-regulatory interactions (arrows) and autoregulation. As a consequence, even if factors A and E are involved in a cross-inhibitory regulation of each other, the stability of each respective network will prevent a switching between cell types 1 and 2 (symbolized by the vertical dotted line) even in the event of transcription factor ablation. c | Other transcription factor regulatory networks may not be accessible in more stable differentiated cells owing to, for example, absence of direct cross-regulation or more permanent silencing of alternative networks. Thus, in such situations, genetic ablation of a transcription factor may be sufficient to disrupt an existing network but may not necessarily lead to activation of other lineage-specific factors expressed in other cell types.
Figure 3 | Models for how transcription factor networks might control the stability of the differentiated state. a | In cells endowed with intrinsic high plasticity - for example, stem and progenitor cells or mature B cells - the transcriptional networks that govern distinct phenotypes are characterized by labile transcription factor networks and active cross-inhibition sets the stage for binary switching between cell types 1 and 2, respectively. This can occur even in a mature cell if transcription factor A is ablated. Forkhead box L2 (FOXL2) and other 'guardians' of the differentiated state seem to represent such key transcription factors. b | It seems likely that stably differentiated cell types are controlled by more elaborate transcription factor networks, illustrated by more cross-regulatory interactions (arrows) and autoregulation. As a consequence, even if factors A and E are involved in a cross-inhibitory regulation of each other, the stability of each respective network will prevent a switching between cell types 1 and 2 (symbolized by the vertical dotted line) even in the event of transcription factor ablation. c | Other transcription factor regulatory networks may not be accessible in more stable differentiated cells owing to, for example, absence of direct cross-regulation or more permanent silencing of alternative networks. Thus, in such situations, genetic ablation of a transcription factor may be sufficient to disrupt an existing network but may not necessarily lead to activation of other lineage-specific factors expressed in other cell types.
Разумно предположить, что сходное становление во все более и более сложную и стабильную сеть транскрипционных факторов в созревающих клетках широко распространено. Напр., экспрессия PET1, потерянная в ранних, но не поздних Lmx1b условно нокаутных клетках, подтверждает, что она становится 'защищенной' за счет перекрывающихся взаимодействий по ходу развития
83,86,87. Предполагается, что стабильность таких сетей также связана со стабильностью фенотипа, так что долго живущие клетки, такие как нейроны, зависит от более сложных и перекрывающихся перекрестно-регуляторных взаимодействий.
DNA and chromatin modifications may add stability to
differentiated identities. Эксперименты, описанные выше, включая мощное репрограммирование, наблюдаемое у гетерокарионов, четко согласуются с мнением, что большинство активных генов нуждается в присутствии инструктивных связанных с ДНК транскрипционных факторов, которые д. постоянно экспрессироваться в дифференцированных клетках. Однако дифференцированные состояния могут быть в принципе стабильными, поскольку др. регуляторные сети недоступны, как показано на FIG. 3c, или, напр., они могут быть стабилизированы путем становления модификаций ДНК или гистонов, которые не нуждаются в постоянных инструктивных факторах для поддержания. Регуляция качественных особенностей сегментов тела личинок D. melanogaster тому пример. Характеристики сегмента зависят от собственно экспрессии homeobox (Hox) и engrailed генов. Их первоначальная экспрессия диктуется с помощью нескольких рано экспрессируемых транскрипционных факторов; собственно паттерн экспрессии
Hox генов поддерживается даже тогда, когда развитие осуществляется после того, как рано экспрессируемые транскрипционные факторы более не присутствуют. Поддержание, но не становление экспрессии соответствующих Hox и engrailed генов зависит от белков Trithorax group (TrxG) и PcG, которые вносят, интерпретируют и умножают активирующие и репрессирующие метки метилирования гистонов99,100 (rev. REFS 101-103). Недавние исследования подтвердили, что некодирующие РНК также участвуют в поддержании экспрессии генов Hox. Напр., в фибробластах кожи взрослого человека некодирующая РНК HOTAIR, как было установлено, регулирует кластер HOXD путем рекрутирования репрессивных PcG белков104,105. PcG белки также необходимы для собственно замалчивания сотен генов, участвующих в детерминации клеточных судеб106-111. Как модификации клеточной ДНК и гистонов могут влиять на постоянную потребность в инструктивных транскрипционных факторах и на поддержание экспрессии генов принципиально проиллюстрировано на FIG. 4.
Прогрессивное замалчивание генов альтернативных клеточных судеб диктуется инструктивными транскрипционными факторами и ассоциирует с репрессивными гистоновыми модификациями замалчиваемых генов
111-113. Повышенное отложение репрессивных гистоновых модификаций может способствовать метилированию ДНК
114-117 и сжиманию хроматина с помощью ремодельеров хроматина
118,119. Такие условия, репрессирующие хроматин, могут т.о., служить в качестве стабильной конечной точки, которая может замалчивать аберрантную транскрипцию без необходимости в постоянном присутствии транскрипционных факторов, которые инициировали репрессию, как показано на FIG. 4c. Доказательством такой персистирующей 'памяти' предыдущих инструктивных событий могут служить эксперименты по репрограммированию с помощью SCNT
120 (rev. REF. 9) или по получению iPSCs
121. Хотя клетки полностью удовлетворяют критериям плюрипотентности
122, память о
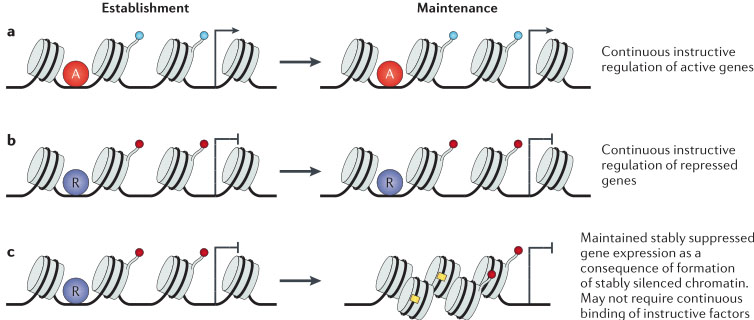 Figure 4 | Dependency of instructive factors in the regulation of the chromatin state is distinct for active versus repressed genes. a | An activating transcription factor (A) is important for the induction of expression of a gene. Gene activation is associated with several modifications in chromatin structure (shown by the blue circles). As exemplified by numerous studies in this Review, the same or other instructive transcription factors are continuously required for the maintained expression of active effector genes also in mature cells. b | Induced repression of expression of a gene is illustrated. The binding of a transcriptional repressor (R) is associated with repressive chromatin modifications (red circles). In one scenario, continued repression depends on continuous binding of a transcriptional repressor to maintain the repression. c | Alternatively, the initial repressive chromatin modifications (red circles; for example, histone modifications) are followed by additional repressive chromatin or DNA modifications (yellow boxes; for example, 5-methyl cytosine methylation of promoter DNA) or chromatin compaction, thus leading to a more permanently silenced state that may not require continuous presence of instructive transcriptional repressors. Presumably, several layers of suppressive chromatin modifications stabilize the differentiated state and provide a
barrier against transdifferentiation or reprogramming into the pluripotent state. In some reprogrammed cells, such suppressed chromatin is retained as a 'memory' of their cellular origin.
Figure 4 | Dependency of instructive factors in the regulation of the chromatin state is distinct for active versus repressed genes. a | An activating transcription factor (A) is important for the induction of expression of a gene. Gene activation is associated with several modifications in chromatin structure (shown by the blue circles). As exemplified by numerous studies in this Review, the same or other instructive transcription factors are continuously required for the maintained expression of active effector genes also in mature cells. b | Induced repression of expression of a gene is illustrated. The binding of a transcriptional repressor (R) is associated with repressive chromatin modifications (red circles). In one scenario, continued repression depends on continuous binding of a transcriptional repressor to maintain the repression. c | Alternatively, the initial repressive chromatin modifications (red circles; for example, histone modifications) are followed by additional repressive chromatin or DNA modifications (yellow boxes; for example, 5-methyl cytosine methylation of promoter DNA) or chromatin compaction, thus leading to a more permanently silenced state that may not require continuous presence of instructive transcriptional repressors. Presumably, several layers of suppressive chromatin modifications stabilize the differentiated state and provide a
barrier against transdifferentiation or reprogramming into the pluripotent state. In some reprogrammed cells, such suppressed chromatin is retained as a 'memory' of their cellular origin.
состоянии соматической клетки сохраняется, по крайней мере, в некоторых iPSC линиях. Как следствие, iPSCs, которые генерируются из панкреатических β-островковых клеток и из разных гематопоэтических типов клеток, которые более тесно связаны с источником клеточных типов
121,123,124.
Кроме того, многие линии iPSC сохраняют паттерны метилирования ДНК и модификаций гистонов, напоминающих таковые из их клеток источников
123-125, и такие модификации появляются также сделать дифференцированные клетки более устойчивыми к репрограммированию
126 (rev. REF. 9). Хорошо известные феномены, такие как инактивация и импринтинг Х-хромосомы, представляют дополнительные примеры репрессированных состояний, которые, по-видимому, персиститруют пассивно в хроматине и 'запоминают' даже клеточный контекст, в котором др. аллель активен (rev. REFS 127,128).
DNA and histone marks are often referred to as epigenetic modifications. Однако термин 'эпигенетический' понимается неправильно в этом контексте. Т.к. трудно доказать, что модификации хроматина устанавливаются во время развития и пассивно сохраняются, инструктивные связывающие ДНК регуляторы пока ещё не найденные, как взаимодействующие с данной регуляторной областью, могут быть фактически ответственными за это. Важно также отметить, что клеточная память, возникающая в результате инициальных инструктивных событий, не обязательно использует модификации ДНК и гистонов, которые пассивно сохраняются. Такая регуляция может быть объяснена регуляцией с помощью простой прямой обратной связи, при этом инициирующий транскрипционный фактор ведет к экспрессии др. фактора, который затем поддерживается с помощью ауторегуляции.
Maintenance of phenotype in disease
Интересен вопрос, как транскрипционный контроль поддержания клеток связан с болезнями. Некоторые исследования выявили корреляцию между степенью злокачественности опухоли и экспрессией транскрипционных факторов, которые ассоциированы с плюрипотентностью и усиленным самообновлением эмбриональных стволовых клеток10,11. Т.о., разумно предположить, что факторы, защищающие от повторного вступления в недифференцированное, пролиферативное состояние, д. обладать способностью супрессии опухолей. В самом деле, одним из последствий делеции Pax5 в зрелых B клеток мышей является развитие агрессивных лимфом62, и PAX5, по-видимому, является опухолевым супрессором острой лимфобластной лейкемии у человека, на что указывают мутации моноаллельной потери функции в большой пропорции таких раковых опухолей129. Потеря факторов, которые необходимы для поддержания зрелого и не пролиферативного состояния в уже дифференцированных клетках д. играть сходные роли в защите против др. типов раковых опухолей.
Как обсуждалось выше, Foxp3 является критическим для поддержания фенотипа регуляторных Т клеток и поэтому он защищает от избыточной иммунореактивности. Мыши с условным нокаутом по Foxp3
67 или даже лишь с ослабленной экспрессией
Foxp3 (REF. 68) обнаруживают тяжелую аутоиммунную патологию, а нарушение регуляции Foxp3 ассоциирует с различными аутоиммунными заболеваниями у человека
130,131. Транскрипционные факторы, обозначенные выше, как защитники дифференцированного состояния, ассоциируют с болезнями, что кажется очевидным. Однако это также похоже на то, что транскрипционный контроль более стабильных клеточных состояний д. быть также целью процессов, способствующих болезни. Напр., потребность в поддержании нейронов интактными в течение многих декад указывает на то, что клеточные дисфункции, приводящие к трудностям поддержания фенотипов нейронов могут быть ассоциированы с нейродегенеративными болезными. В самом деле, ранние симптомы при некоторых нейродегенеративных нарушениях, скорее всего, вызываются потерей функции нейронов скорее, чем клеточной гибелью
132. В подтверждение этого мнения, нарушение регуляции и полиморфизмы затрагиваемых генов, которые кодируют транскрипционные факторы dopaminergic нейронов, такие как NURR1, PITX3 и LMX1B, оказались ассоциированными с болезнью Паркинсона и шизофренией, подтверждая, что нарушение инструктирующих механизмов, которые поддерживают допаминергические фенотипы, могут усиливать чувствительность к болезни
133,134. Кроме того, др. признак указывает, что нейродегенеративные заболевания могут быть ассоциированы с затруднениями в обеспечении дифференцированного состояния это наблюдения повторного вступления в клеточный цикл нейрональных клеток, в частности при болезни Алцгеймера. При этих патологических условиях нейроны способны синтезировать ДНК (т.е. , проходить через S фазу), но не вступают в митоз. Как это влияет на прогрессирование болезни, непонятно, но вполне возможно, что это вносит вклад в дегенеративный процесс
135.
Conclusions and future directions
As emphasized by studies described in this Review, in some cells requiring a high degree of plasticity, there is a dependency on finely balanced binary switching mechanisms that are similar to those that are fundamental in cell fate specification during development. By contrast, in more stably differentiated cells, we hypothesize that labile binary relationships have either been eliminated or stabilized by redundant cross-regulation involving a sufficient number of additional transcription factors and/or regulatory RNAs; these networks are stable so that even in the event of ablation of single key factors, the overall differentiated state is not easily perturbed. In addition, repressive histone modifications and DNA methylation also contribute to the stability of the differentiated cell identity.
Our understanding of how transcription factors and chromatin-modifying processes are integrated in regulating the differentiated state in mammals remains limited, and it will be important in future studies to elucidate how regulatory network architectures can accommodate stringent requirements that balance stability versus flexibility. Such studies are now feasible through mouse models for conditional gene ablation in differentiated cells and chromatin immunoprecipitation followed by next-generation sequencing (ChIP–seq) techniques for the genome-wide mapping of transcription factor binding sites and DNA and histone modifications. Moreover, focusing on how other gene regulatory mechanisms contribute to the stability of the differentiated state will be important. For example, it seems to be likely that differentiated cells, which are generally postmitotic, depend on a strict control to prevent cell cycle re-entry. It will be interesting to understand to what extent cell cycle control mechanisms are interlinked with the control of the differentiated state. For example, in the D. melanogaster eye, the expression of the retinoblastoma tumour suppressor protein (RB) homologue rbf, in combination with components of the Hippo tumour suppressor pathway, is necessary to maintain the differentiated identity of retinal photoreceptor cells136, but it does not seem to be required for preventing cell cycle re-entry. By contrast, in differentiated horizontal interneurons of the mouse retina, members of the RB family are required to prevent re-entry into the cell cycle, but intriguingly both structural and functional features of differentiated horizontal interneurons are retained when RB family functions are lost137. Thus, these studies that focus on known tumour suppressor pathways seem to indicate that the control of cell cycle exit and differentiation are not always inextricably linked. In addition to the cell-intrinsic mechanisms for maintenance discussed in this Review, it is also important to point out that extrinsic signalling can provide instructive cues that are necessary for identity maintenance. For example, the maintenance of specific neuron identities depends on the continuous secretion of bone morphogenic protein from surrounding tissue138,139. Little is understood about such regulation in other cell types, but it is an important area for further investigation.
The intense recent interest in reprogramming emphasizes the importance of understanding how cells normally secure their identities in stably differentiated cells, because studies focusing both on how differentiated states are maintained and on how they can be directly reprogrammed seem to constitute two sides of the same coin. With increasing understanding of how the differentiated state is stably maintained, it may eventually become possible to interfere with these processes in ways that may facilitate the generation of iPSCs and other deliberate cell lineage conversions that may be clinically relevant. Moreover, and as discussed above, it is also anticipated that mechanisms controlling the differentiated state will be relevant in future attempts to treat cancer and cell degenerative diseases.
Сайт создан в системе
uCoz