Посещений:  МОЛОЧНЫЕ ЖЕЛЕЗЫ
МОЛОЧНЫЕ ЖЕЛЕЗЫ
Роль IGFs и IGFBPs
|
|
Insulin-like growth factor binding proteins and mammary gland development
ANGARA SURESHBABU, ELIZABETH TONNER and DAVID J. FLINT
 Int. J. Dev. Biol. 55: 781-789 doi: 10.1387/ijdb.113364as
|
Mammary gland development is dependent upon insulin-like growth factors (IGFs)
as survival factors. The actions of the IGFs are modulated by a family of IGF-binding proteins (IGFBP1-6). Expression of the IGFBPs is both time-dependent and cell-specific during both the developmental phases and the involution of the mammary gland. Although studied extensively in vitro, understanding the roles of IGFBPs in vivo has been difficult, largely due to the fact that IGFBP knock-out mice have no dramatic phenotypes. This review examines the evidence from in vitro studies and the attempts to examine in vivo actions utilising models with IGFBP deficiency or over-expression. In vitro studies demonstrate that IGFBPs can act by inhibition of the survival effects of IGFs, as well as by enhancing the effects of IGFs. Because the IGFBPs are found associated with the extracellular matrix, a role for IGFBPs as a reservoir of IGFs or, alternatively as a potential barrier to IGFs, thereby restricting their entry into particular tissues or cellular compartments was postulated. We also provide evidence with respect to the IGF-independent actions of the IGFBPs which include receptors, nuclear localization, and interaction with the extracellular matrix and cell surface proteins including integrins. We believe that recent findings place some of the IGFBPs in a larger family of extracellular proteins, the secreted cysteine-rich protein (CCN) family, which have similar structural domains (involved in binding to IGFs, extracellular matrix and integrins) and are heavily implicated in tissue re-modeling and morphogenesis.
|
Insulin-like growth factor binding proteins: an overview
Существуют 6 IGF binding proteins (IGFBPs) которые варьируют по длине в пределах 201-289 остатков. Они связывают IGFs с высоким сродством (K D ~ 10 -10 M) , более 95% IGFs в сыворотке и др. биологических жидкостях соединяются с IGFBPs. Сродство IGFBPs к IGFs обычно в 10 раз выше, чем типа I IGF-рецептора и поэтому IGFs соединяются с IGFBPs и тем самым ограничивают доступ к рецепторам клеточной поверхности. Однако, IGFBPs также связывают внеклеточного матрикса (ECM) glycosaminoglycans (GAGs) и др. ECM белки (Arai et al., 1994), это может снижать сродство связывания IGF-IGFBP и потенциально увеличивать биодоступность IGFs. IGF ось также включает IGFBP протеазы, которые действуют, расщепляя IGFBPs, это также приводит к сильному снижению сродства между IGFBPs и IGFs. Помимо прямого взаимодействия IGFBPs с IGFs, IGFBPs обнаруживает IGF-независимые эффекты в той же ткани (Mohan et al., 1995). Как следствие, IGFBPs выполняет роли, которые выходят за пределы простого носительства и распределителя IGFs.
Mammary gland development: an overview
Развитие молочных желез сложный процесс, состоит из серии динамических и уникальных онтогенетических свойств. В отличие от большинства тканей помимо эмбрионального развития молочные железы обнаруживают существенную и дополнительную фазу развития при половозрелости, беременности и лактации. Существует также пост-лактационная фаза, связанная с существенной клеточной гибелью и ремоделированием тканей. Тот факт, что многие из этих процессов являются постнатальными, это делает их более пригодными для манипуляций и по этой причине молочные железы очень популярный орган для изучения этих процессов.
Молочные железы являются экзокринными железами, содержащими как трубчатые, так и альвеолярные структуры. Они состоят из трех тканей: эпителиальной или паренхимной ткани, жировой и соединительной ткани. Пока описаны определенные аспекты адипоцитов и их роли в морфогенезе молочных желез, роли как жировой, так и соединительной ткани изучены меньше, чем паренхимные аспекты. Однако это начинает меняться, т.к. активная роль стромы в развитии ткани стала проясняться. Эпителий молочных желез крыс представлен непрерывными ветвящимися протоками, ведущими от соска к небольшим мелким протокам, которые заканчиваются терминальными концевыми зачатками (TEBs), зачатками на тупых концах или альвеолами.
Уникальный набор клеточных и молекулярных механизмов дифференцировки возникает во время каждой стадии развития молочных желез и использует гормоны, ростовые факторы и внеклеточный матрикс. Внутренние просветные или секреторные клетки отделены от базальной мембраны наружным миоэпителиальным слоем. Миоэпителиальные клетки секретируют базальную мембрану, которая отделяет эпителий от стромального компартмента. Группа ацинусов, возникающая из окончания протока известна как terminal duct lobular unit (TDLU) и в целом рассматривается как функциональная единица молочных желез.
Insulin-like growth factors play an important role in mammary gland development
IGFs были открыты благодаря свой способности увеличивать сульфатирование хряща и замещать "sulfation factor activity" гормона роста (GH). Фактически, очевидно, что 2 основных лактогенных гормона, Prolactin (PRL) и GH осуществляют свое действие на функцию молочных желез, влияя на разные компоненты оси IGF. Поскольку PRL, по-видимому, действует непосредственно на ткани молочных желез, эффекты GH в целом рассматриваются как непрямые, использующие стимуляцию продукции IGF-I. Напр., воздействие GH treatment увеличивает концентрацию в сыворотке IGF-I и экспрессию печеночной и молочных желез IGF-I мРНК. Во время ветвления протоков и развития альвеол пролактин и гормон роста индуцируют IGF-II мРНК, которая в свою очередь индуцирует insulin receptor substrate-1 (IRS-1) и IRS-2. Хотя действие IGF-I хорошо изучено, передача сигналов IGF-II рецепторов в развитии молочных желез всё ещё неясна. Экзогенные IGFs являются митогенами и факторами жизнеспособности для нормальных и туморогенных эпителиальных клеток молочных желез в культуре. Митогенные эффекты IGFs преимущественно обеспечиваются посредством IGF-I рецептора. Однако, существуют также типа II IGF рецепторы и гибридные типа I IGF/insulin рецепторы. Будучи имплантированным в молочные железы грызунов, IGF-I увеличивает рост протоков и может действовать совместно с эстрогеном, чтобы способствовать развитию terminal end bud (TEB) и удлинению протоков у hypophysectomized-ovariectomized крыс. Базируясь на этих наблюдениях, было предположено, что IGF-I, продуцируемый в строме под действием GH, синергично действует с эстрогеном, чтобы воздействовать на паренхимную ткань и способствовать образованию TEB и росту протоков. В подтверждение, избыточная экспрессия IGF-I у трансгенных мышей приводит к преждевременному развитию альвеол, сходные результаты получены с избыточной экспрессией IGF-II, с использованием специфичного для молочных желез промотора, β-lactoglobulin. Более того, избыточная экспрессия IGF-II ведет к опухолям молочных желез после ряда беременностей.
Природа развития молочных желез означает, что происходит также значительная потеря эпителиальных клеток с экстенсивной протеолитической деградацией и ремоделированием внеклеточного матрикса в конце лактации. Потеря клеток происходит в отсутствие классического воспаления благодаря процессу запрограммированной клеточной гибели или апоптоза. Для возникновения апоптоза, по-видимому, необходима супрессия IGF-обеспечиваемой клеточной жизнеспособности, т.к. избыточная экспрессия IGF-I у мышей может задерживать инволюцию. Эти результаты подтверждают предположение, что IGFs способствуют жизнеспособности эпителиальных клеток молочных желез и предоставлют дополнительные доказательства роли IGF в пролиферации эпителия молочных желез (Flint et al., 2008).
IGFBP expression in the embryo
Все 6 IGFBPs экспрессируются сложным способом в раннем постимплантационном и последующем эмбриональной развитии. Каждый из IGFBPs обнаруживает свой собственный паттерн экспрессии как в пространстве, так и во времени, но часто ко-экспрессируются. Они активируются во время критических периодов морфогенеза ткани, напр., в печени (IGFBP-1), тогда как IGFBP-2 и IGFBP-4 мРНК и IGF-II экспрессия часто связаны, указывая, что эти IGFBPs могут быть важными для модулирования действия IGF-II. мРНК IGFBP-3 и IGFBP-5 (2 очень близко родственные структурно IGFBPs) часто ко-локализуются. IGFBP-5 экспрессируется в местах развития нервов и мышц, напр., во время дифференцировки эктодермального (напр., нейрального) и мезодермального (напр.. остеобласты и миобласты) клонов. IGF-обеспечиваемые ремоделирование ткани или клеточная гибель в местах апоптоза у эмбрионов могут испытывать влияние со стороны IGFBP-5. мРНК IGFBP-6 экспрессируется повсеместно с середины беременности, но на относительно низком уровне. Функция этого связывающего белка остается неясной. Исследования белка IGFBP с помощью иммуноцитохимии показало существенное перекрывание с паттернами экспрессии мРНК, хотя IGFBPs являются секретируемыми молекулами и не удивительно, что обнаруживаются также в местах, удаленных от места продукции. Дополнительные косвенные доказательства роли IGFBPs в развитии получены благодаря их хромосомному взаимоотношению с гомеобоксными (Hox) генами, которые, как известно, выполняют важные функции во время эмбрионального развития. Каждый из человеческих IGFBP генов присутствует в той же самой хромосомной области, что и Hox гены и это может , скорее всего, быть объяснено ко-эволюцией из одного родоначального генетического локуса посредством удвоения и транслокации хромосом (Allan et al., 2001, Flint et al., 2008).
Паттерны экспрессии IGFBPs согласно их природе указывают на их важность для процессов развития. Наилучшие надежды возлагаются на понимание роли IGFBPs в развитии молочных желез в постнатальном циклическом развитии.
IGFBP expression in postnatal mammary development
Самостоятельные паттерны экспрессии мРНК IGFBPs в IGFBP в молочных железах происходят также во время половозрелости и беременности, как в отношении временных паттернов, так и локализации в эпителиальных и стромальных компартментах. Прогресс затрудняется тем фактом, что существуют межвидовые различия (Flint et al., 2000). Грызуны исследованы наиболее в отношении экспрессии IGFBP в молочных железах (Wood et al., 2000). Наиболее обильным из IGFBPs является IGFBP-5, который экспрессируется на высоком уровне в эпителии в течение постнатального роста, хотя мРНК иногда обнаруживается и в строме. IGFBP-3 также экспрессируется как в эпителии, так и строме, присутствуя в наружных эпителиальных клетках TEB, что согласуется с экспрессией в cap клетках, тогда как мРНК IGFBP-5 в центре TEB, где происходит клеточная гибель, что позволяет возникать просвету. Эти находки согласуются с апоптической ролью IGFBP-5, которая была также предположена в in vitro исследованиях культур телячьих mammosphere, где образованию просвета предшествует увеличение секреции IGFBP-5. Однако IGFBP-5 экспрессируется также на высоком уровне в развивающемся эпителии протоков во время половозрелости и беременности.
IGFBP-3 локализуется в наружном слое эпителиальных клеток протоков. В противоположность мРНК IGFBP-2 и -4 преимущественно экспрессируются в строме, а экспрессия IGFBP-2 коррелирует с макрофагами проксимальнее TEBs. Интересно, что экспрессия IGFBP-4 согласуется с ролью в поддержании тканевых границ, процесс, который имеет отношение к нарушению гранаиц, которое происходит во время метастазирования.
Уровни IGFBP в молочных железах снижаются во время лактации за исключением IGFBP-3. Это указывает на то, что IGFBPs д. быть уменьшены, чтобы позволить чувствительности к IGFs поддерживаться настолько высоко, насколько возможно, чтобы гарантировать жизнеспособность клеток и оптимум продукции молока в этот критический период для новорожденных (Flint et al., 2008). Когда молочные железы прекращают продукцию молока, то они подвергаются значительной клеточной гибели, при этом железы возвращаются к состоянию, напоминающему железы не беременных. Во время этого процесса у крыс происходит увеличение мРНК IGFBP-2 (4-кратно), IGFBP-4 (6-кратно) и драматически увеличиваются уровни IGFBP-5 мРНК и белка (50-кратно), с течение двух дней после прекращения кормления грудью. Увеличение IGFBP-5 также происходит у мышей, свиней и молочных коров. Т.о., во время апоптоза в молочных железах происходит общее увеличение экспрессии IGFBP, хотя количественно увеличение IGFBP-5 наиболее значительно, достигая концентраций 50-100µg/ml в молочных железах во время инволюции. Наиболее очевидным объяснением д. быть то, что увеличение IGFBPs служит для предотвращения эффектов IGFs на жизнеспособность, это согласуется с ролью IGFBPs как ингибиторов действия IGF (Flint et al., 2005, Flint et al., 2008).
IGFBP production: is local or systemic the most important?
Источник IGFBPs в молочных железах неопределенен за исключением IGFBP-5, который действительно не обнаруживается в сыворотке (строго указывая, что существенна его локальная продукция) и для IGFBP-1, где может быть верно обратное. Однако экспрессия в молочных железах и концентрации в сыворотке IGFBP-1 были связаны обратно пропорционально, указывая, что локально продуцируемый IGFBP-1 всё ещё может быть основным детерминантом концентраций в молочных железах или может иметь дополнительную или специфическую роль для IGFBP-1, происходящего из сыворотки (Wood et al., 2000).
What is the biological role of IGFBPs in the mammary
gland?
Доказательства, что IGFBPs играют роль в ингибировании действия IGF в молочных железах во время лактации и после лактации получены с помощью косвенных доказательств, напр., GH и prolactin, действуют совместно, чтобы синтез IGF-I (с помощью GH) в то время как продукция IGFBP-5 (с помощью prolactin) была ингибирована (Flint et al., 2008)) (Flint et al., 2000). Prolactin также увеличивает продукцию IGF-II в молочных железах и экспрессию мРНК IGFBP-5 молочных желез, пониженные у CAATT-enhancer binding protein-b_ko мышей, которые обнаруживают повышенную экспрессию prolactin рецептора. Хотя это предполагает механизм, который должен усиливать до максимума эффекты IGF, но отсутствует причинное взаимоотношение. Прямые доказательства, однако, получены, в исследованиях, в которых экзогенные IGFBP-5 или IGFBP-3 ингибируют IGF-I-обеспечиваемую жизнеспособность эпителиальных клеток молочных желез, увеличивают апоптоз и снижают фосфорилирование Akt и forkhead transcription factor, FKHRL1. В соответствии с драматическим увеличением экспрессии IGFBP-5 в молочных железах во время инволюции, применение in vivo IGFBP-5 во время поздней беременности нарушает развитие молочных желез и снижает инвазию в жировые подушки молочных желез. Исследования на трансгенных мышах, экспрессирующих
IGFBP-5 в молочных железах, показали, что IGFBP-5 ведет к снижению содержания ДНК в молочных железах, усилению активности про-апоптической молекулы caspase-3 и увеличению активности plasmin вместе со снижением концентраций двух молекул, способствующих жизнеспособности, Bcl-2 и Bcl-xL. Эти изменения согласуются с проапоптическим эффектом IGFBP-5. Обусловлено ли это действие IGFBP-5 ингибированием действия IGF или некоторого IGF-независимого действия, неясно из этого исследования, но инволюция была ингибирована у трансгенных мышей с избыточной экспрессией IGF-I и у трансгенных мышей с избыточной экспрессией IGFBP-5, воздействие IGF-аналогом, который слабо связывается с IGFBP-5, частично преодолевает эффекты IGFBP-5, указывая тем самым, что IGFBP-5 действует, по крайней мере, частично ингибируя действие IGF.
Впоследствии было показано, что Igfbp5 нулевые мыши обнаруживают задержку апоптоза молочных желез, что ещё больше подкрепляет апоптическую роль IGFBP-5. Несмотря на отсутствие каких-либо прямых доказательств роли IGFBPs помимо IGFBP-5 в функционировании молочных желез, специфические паттерны экспрессии IGFBPs и обстоятельные доказательства их роли в процессах развития в целом, делают вполне допустимым, что др. IGFBPs выполняют специфические роли в развитии молочных желез и ремоделировании.
IGFBPs and stroma
Хотя основное внимание к IGFBPs было сфокусировано на паренхимной ткани, роль IGFBPs в строме всё больше привлекает внимание. Прежде всего это связано с адипоцитами, которые играют важную роль в стромальной инструктировании развития паренхимы. О IGFBPs в жировой ткани см. Baxter and Twigg (2009). Короче, жировая ткань секретирует, по крайней мере, IGFBPs1-5 , а в случае IGFBP-5, уровни экспрессии могут быть очень высокими. Пока все IGFBPs теоретически могут ингибировать действие IGF-I (главного стимула дифференцировки адипоцитов) IGFBP-3, как было установлено, является основным ингибитором дифференцировки адипоцитов посредством IGF-независмого способа и может действовать сочетано с TGFβ1 и с connective tissue growth factor (CTGF). Это действие может быть критической частью ограничения дифференцировки адипоцитов молочных желез, которое очевидно во время лактации, вообще-то предваряя конкуренцию за питательные вещества, когда потребность является высокой для синтеза лактозы из глюкозы, а жирные кислоты необходимы для синтеза липидов молока. Вторая серия исследований уместности IGFBPs в строме исходит из недавних публикаций, в которых сцеплен insulin-like growth factor binding protein-5 (IGFBP-5) с метастазированием и фибротическими болезнями, включая склеродерму и идиопатический легочный фиброз. Повышенная экспрессия IGFBP-5 ассоциирует с плохим исходом во время метастазирования молочных желез (Huynh, 1998, McGuire et al., 1994, Mita et al., 2007, Pekonen et al., 1992). IGFBP-5 также стимулирует легочные, кожные и печеночные фибробласты, вызывая фибротическую реакцию, сходную с той, что на TGFβ1 (Pilewski et al., 2005, Yasuoka et al., 2009a, Yasuoka et al., 2006a, Yasuoka et al., 2009b, Yasuoka et al., 2006b). Оказалось несколько неожиданным, что при высоких концентрациях IGFBP-5 вызывает апоптоз эпителиальных клеток молочных желез in vitro и in vivo (Marshman et al., 2003, Tonner et al., 2002) и существует IGFBP, который увеличивается драматически во время инволюции молочных желез (Clarkson and Watson, 2003, Stein et al., 2004) В согласии с апоптической функцией, два недавних исследования показали, что снижение экспрессии IGFBP-5 ассоциирует с повышенным туморогенезом в остеосаркомы (Su et al., 2011) и рак груди, индуцируемые воздействием на плода алкоголем (Polanco et al., 2010).
Однако, возможно примирить эти кажущиеся противоречивыми результаты, приняв во внимание др. аспекты действия IGFBPs. Напр., при высоких концентрациях IGFBPs ингибируют действие IGFs, тогда как при низких, обычно эквимолярных концентрациях, они могут усиливать действие IGF. Т.к. они являются секретируемыми белками, то обладают потенциалом продуцировать градиент концентраций IGFBP, при этом клетки, продуцирующие высокие уровни, подвергаются апоптозу, но соседние клетки (где концентрации IGFBP ниже) могут выживать и даже их жизнеспособность повышается с помощью IGFs. Недавно было показано, что IGFBP-5 может, в самом деле, повышать жизнеспособность эпителиальных клеток и делает это путем усиления их адгезии с субстратом (Allan et al., 2008) (Fig. 1). Помимо усиления их адгезии с субстратом IGFBP-5 также поддерживает экспрессию E-cadherin и ингибирует эпителиальную миграцию. Это может быть частью репаративного механизма, с помощью которого соседние клетки поддерживают целостность эпителия (барьерная функция, электрическая резистентность) во время процесса удаления апоптических клеток. Если IGFBP-5 выполняет такую защитную роль для эпителия, почему он пытается активировать фибробласты с потенциалом нарушения эпителиальной функции посредством фибротических рубцов? И снова эти кажущиеся противоречивыми находки могут быть примирёны предположением, что после повреждения IGFBP-5 стимулирует мезенхимную реакцию (фиброз), чтобы повлиять на быструю репарацию , одновременно усиливая жизнеспособность и разрастание эпителия, чтобы ограничить фибротическую реакцию мезенхимным компартментом. Даже если мы покажем, что IGFBP-5 действует на фибробласты, его действия являются фенотипически отличными от действия TGFβ1 (Fig. 2). В то время как TGFβ1 индуцирует расположение и организацию фибробластов в завихрения, IGFBP-5 заставляет эти клетки мигрировать в группы, в которых адгезия с субстратом, по-видимому, снижена. Понимание точного механизма действия IGFBP-5 на фибробласты необходимо, чтобы лучше понять его точную роль.
Активация мезенхимного компартмента во время поддержания эпителиально-мезенхимной границы может быть важной частью тканевого ремоделирования, которое происходит в конце лактации. Т.о., если даже увеличивается экспрессия matrix metalloprotease и происходит множественная клеточная гибель (Clarkson and Watson, 2003, Stein et al., 2004, Tonner et al., 1997), некоторые клетки протоков выживают, окружаются с помощью мезенхимных клеток в результате фибротической реакции (O'Brien et al., 2010). Такое ремоделирование задерживается у IGFBP-5 ko мышей (Ning et al., 2007). Этот процесс инкапсуляции может гарантировать, что остаточный эпителий протоков не будет чрезмерно разрушен с помощью фибротической реакции, при этом будут повышены перспективы успешного повторного развития желез в последующие беременности (O'Brien et al., 2010). Реакция хозяина на опухоли, где незатронутая ткань проксимальнее опухоли экспрессирует набор для заживления ран, включая усиление экспрессии коллагена и фибронектина и повышенную экспрессию IGFBP-5 (Akkiprik et al., 2008) , может быть хорошим аналогом такой реакции. Т.о., ассоциация IGFBP-5 и метастазов (Huynh, 1998, McGuire et al., 1994, Mita et al., 2007, Pekonen et al., 1992) может быть реакцией хозяина, предназначенной, чтобы ограничить скорее, чем способствовать метастазированию. Мы получили доказательства. подтверждающие это в экспериментах по совместному культивированию, в которых IGFBP-5 может ограничивать инвазию фибробластов в эпителиальные монослои (Fig. 3) и противодействовать действию TGFβ1. Более того, IGFBP-5 является одним из главных секретируемых продуктов Senescence Messaging Secretome (SMS), как полагают, является реакцией опухолевого супрессора (Adams, 2009) и это должно согласовываться с ролью опухолевого супрессора, продемонстрированной для IGFBP-5 (Polanco et al., 2010, Su et al., 2011).
Demonstrating causality in IGFBP function
Наше понимание действия и роли IGFBPs всё ещё неполно. Степень перекрывания или несущественные функции IGFBPs не помогает процессу наделения физиологического значения для многих исследований, которые описывают механистические действия IGFBPs. Сегодня используются некоторые подходы и потенциальные значения для понимания действия IGFBPs в молочных железах.
i) IGFBP deficiency
Описаны нокауты от IGFBP-1 до -6 и, что неожиданно, по существу они фенотипически нормальны, даже если
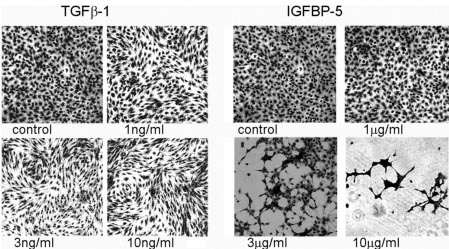 Fig. 1. IGFBP-5 increases adhesion but decreases migration. (Upper
panel) MCF-7 cells form spheroids, with limited adhesion to the substra-
tum, in serum-free conditions. IGFBP-5 induces epithelial cell adhesion and
spreading, whilst maintaining E-cadherin expression (green). Nuclei are
stained with DAPI (blue). (Lower panel) In the presence of serum, MCF-7
cells migrate from the wound edge. IGFBP-5 potently inhibits this migration.
Fig. 1. IGFBP-5 increases adhesion but decreases migration. (Upper
panel) MCF-7 cells form spheroids, with limited adhesion to the substra-
tum, in serum-free conditions. IGFBP-5 induces epithelial cell adhesion and
spreading, whilst maintaining E-cadherin expression (green). Nuclei are
stained with DAPI (blue). (Lower panel) In the presence of serum, MCF-7
cells migrate from the wound edge. IGFBP-5 potently inhibits this migration.
подверглись нокауту более одного IGFBP. Это подтверждает перекрывание внутри IGFBPs. Несмотря на это, существуют специфические фенотипы. включая Igfbp5 нулевых мышей, у которых задержка апоптоза молочных желез, что согласуется с апоптической ролью IGFBP-5, и умеренная непереносимость к глюкозе и повышенная тучность. Igfbp4 нулевые мыши, которые обнаруживают ингибирование роста, и Igfbp1 нулевые мыши. которые обнаруживают аномальную репарацию печени. Нулевые мыши igfbp-2 обнаруживают фенотипические отклонения костей, это может быть результатом как IGF-зависимого, так и IGF-независмого действия (Flint et al., 2008).
ii) IGFBP treatment
Описаны генетически модифицированные мыши, избыточно экспрессирующие IGFBPs (Silha and Murphy, 2002, Wolf et al., 2005). Избыточная экспрессия IGFBP-1 ведет к метаболическим дефектам, согласующимися с предполагаемой их ролью по использованию глюкозы, приводящей к резистентности к печеночному инсулину (Rajkumar et al., 1995, Rajkumar and Murphy, 1999), и к некоторой задержке роста (Gay et al., 1997). Избыточная экспрессия Igfbp2 также вызывает умеренную редукцию веса тела (Hoeflich et al., 2000). Интересно, что задержка роста также выявлена у Igfbp3 трансгенных мышей, но это не подтверждается, когда IGFBP-3 является мутантным, чтобы ингибировать связывание IGF-I (Silha et al., 2005, Silha et al., 2006). Это демонстрирует, что IGFBPs могут служить в качестве ингибиторов IGFs in vivo. Резистентная к протеазе форма IGFBP-4 уменьшает вес тканей, содержащих гладкие мышцы, (Zhang et al., 2002), в то время как мыши, избыточно экспрессирующие Igfbp4 в лимфоидной ткани, обнаруживают уменьшение размера тимуса (Salih et al., 2004, Zhou et al., 2004). Мыши с избыточной экспрессией Igfbp5 обнаруживают сильную задержку роста, и обнаруживают болезненность новорожденных и пониженную плодовитость (Salih et al., 2005). Даже если это согласуется с ингибированием действия IGF, избыточная экспрессия IGFBP-5, вызывает фенотип, который отличается от такового у Igf1, Igf2 или Igf1r нулевых мышей, подтверждая. что эффекты IGFBP-5 не могут быть объяснены исключительно ингибированием действия IGF. Экспрессия IGFBP-5 в молочных железах нарушает их развитие (Tonner et al., 2002). Мыши, избыточно экспрессирующие Igfbp6 с помощью промотора глиального белка (Bienvenu et al., 2004), обнаруживают уменьшение размера мозжечка, увеличение IGFBP-6 в кровообращении и уменьшение веса тела и размера выводков. Т.о., эффекты IGFBPs in vivo постоянно ингибирующие и это контрастирует со многими исследованиями in vitro, в которых демонстрируется усиление действия IGF.
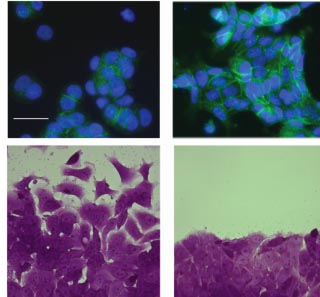 Fig. 2. TGFb1 induces fibroblast activation whereas IGFBP-5 induces de-adhesion. TGFb1 induces a dose-dependent phenotypic response in fibroblasts with a characteristic alignment and swirling pattern. IGFBP-5, in contrast, induces cells to migrate into small groups with decreased cell-substratum adhesion.
Fig. 2. TGFb1 induces fibroblast activation whereas IGFBP-5 induces de-adhesion. TGFb1 induces a dose-dependent phenotypic response in fibroblasts with a characteristic alignment and swirling pattern. IGFBP-5, in contrast, induces cells to migrate into small groups with decreased cell-substratum adhesion.
Это может просто отражать тот факт. что избыточная экспрессия скорее всего мало пригодный инструмент и что если IGFBPs продуцируются в избыточных количествах, то модели скорее всего будут отражать фенотипы, которые могут быть объяснены ингибированием действия IGF. Определение действия IGFBPs в физиологических концентрациях т.о . остается важным вызовом и препятствием нашего понимания их роли in vivo.
Mechanisms of action of IGFBPs
i) Influencing the actions of IGFs
Наиболее изучено действие IGFBPs,связанное с IGFs. Однако, продолжаются дебаты относительно их эффектов на связывание IGFs. IGFBPs может ингибировать действие IGF, предупреждая связывание с IGF рецепторами или, если связаны с внеклеточным матриксом, то они могут служить в качестве питающего "резервуара", усиливая действие IGF. По крайней мере четыре из IGFBPs соединяются с поверхностью клеток или внеклеточным матриксом, используя RGD последовательность и heparin связывающие домены.
IGFBP-3 b IGFBP-5 также соединяются с type I collagen, vitronectin и fibronectin (Pilewski et al., 2005). IGFBPs, будучи секретированными, уязвимы для протеолитического расщепления и деградируются некоторыми протеазами, в то время как связывание IGFBP с ECM может защитить IGFBPs от протеолитической деградации, что удлиняет их биодоступность. IGFBP связывание с внеклеточным матриксом или с клеточной поверхностью зависит также от состояния фосфорилирования или протеолитического расщепления (Beattie et al., 2006). Каждое из
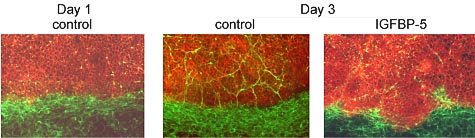 Fig. 3. Co-culture of epithelial cells (stained red for E-cadherin) with
fibroblasts (stained green for collagen). The formation of a boundary
is evident after 1 day. After 3 days, the fibroblasts migrate beyond the bound-
ary, but this is inhibited by IGFBP-5.
Fig. 3. Co-culture of epithelial cells (stained red for E-cadherin) with
fibroblasts (stained green for collagen). The formation of a boundary
is evident after 1 day. After 3 days, the fibroblasts migrate beyond the bound-
ary, but this is inhibited by IGFBP-5.
этих изменений в структуре IGFBP д. усиливать действие IGF за счет увеличения биодоступности IGF in vivo.
ii) Direct effects of IGFBPs
Клеточной поверхности "рецепторы" были предположены для IGFBP-3 и IGFBP-5, хотя эти исследования необходимо ещё подтвердить. IGF-независимые действия были предположены для IGFBP-3 в эпителиальных клетках молочных желез. IGFBP-3 оказывает анти-пролиферативные эффекты на эпителиальные клетки молочных желез и индуцируется членами семейства TGF-β, включая TGF-β1 в клетках рака груди. IGFBP-3 соединяется с высоким сродством в типа V TGF-β рецептором, подтверждая возможность, что индукция синтеза IGFBP-3 с помощью TGF-β1 может быть позитивной петлей для дальнейшего ингибирования роста эпителия молочных желез. Вообще-то наиболее сильным подтверждением механизма действия, независимого от IGF-I явилось исследование, которое показало, что, несмотря на сходство их последовательностей, действие IGFBP-3 и -5 на жизнеспособность клеток часто противоположное. Этого невозможно ожидать, если они оба действуют, ингибируя действия IGFs. Описаны ERK активация с помощью IGFBP-5 и p38MAPK-зависимые действия IGFBP-5 и способность IGFBP-5 активировать p44/p42MAPK (Yasuoka et al., 2009b). Всё ещё предмет спора, осуществляют ли IGFBPs внутриклеточные действия, в том числе в ядре. Новые пути потребления клетками были продемонстрированы для IGFBP-3, обеспечиваемые с помощью C-терминальных щелочных остатков, с использованием рецепторов caveolin и transferrin. Необходимы более детальные исследования внутриклеточных эффектов для выяснения их физиологического значения (Beattie et al., 2006). Помимо предполагаемых их непосредственных действий на клетки, IGFBPs также обнаруживают внеклеточные взаимодействия, не связанные с секвестрацией IGFs. Напр., plasminogen некстати активируется во время развития молочных желез у IGFBP-5 трансгенных мышей (Tonner et al., 2002) и это было подтверждено in vitro, где IGFBP-5, как было установлено, непосредственно активирует tPA, но не uPA (Sorrell et al., 2006). Некторые члены из семейства секретируемых cysteine-rich (CCN) белков, которые включают connective tissue growth factor (CTGF), CYR61 и Nov, название которого было изменено на IGFBP8-10 из-за структурного сходства. Семейство CCN обладает интегриновыми "рецепторами" и рассматривается как осуществляющее свое действие внеклеточно посредством взаимодействия с интегринами, ECM и ростовыми факторами. Напр., CTGF соединяется с VEGF (Inoki et al., 2002) и ингибирует его действия, в то же время он соединяется с и усиливает действие TGFβ1 (Abreu et al., 2002). Мы полагаем, что , по крайней мере, IGFBP-5, может быть наиболее подходящим, чтобы рассматривать его как члена семейства CCN, т.к. он обладает свойствами ростового фактора и свойством связывания интегринов, а также он взаимодействует посредством своего heparin-связывающего домена с разными молекулами внеклеточного матрикса. Это, в свою очередь, указывает. что IGFBPs могут действовать косвенно, внеклеточно, способом, сходным с таковым у CTGF. CTGF действует иерархически ниже TGF-β1 (Nguyen and Goldschmeding, 2008), а IGFBP-3 является нижестоящей мишенью TGF-β1 и соединяется с типа V TGFβ рецептором. TGF-β1 активирует ADAM-12, который протеолитически расщепляет IGFBP-5. Эти находки связывают IGFBPs с TGF-β1, известным ингибитором пролиферации эпителиальных клеток и активатором мезенхимных клеток. Помимо этой связи семейство CCN и IGFBPs входят в состав более крупного семейства секретируемых богатых цистеином белков, наз. TIC, которое представлено семействами Twisted gastrulation (TSG), IGFBP и CCN (Pell et al., 2005). Все они содержат характерных законсервированный 5' N-терминальный домен, неконсервативный линкерный регион и 3' богатый цистеином домен. Семейства TSG и CCN выполняют важные роли в развитии. Напр., TSG участвует в формировании паттерна эмбрионов мух, тогда как семейство CCN участвует в дифференцировке, адгезии и миграции. Тот факт, что TSG и CCN белки выполняют важные функции в развитии, еще более подтверждает, что IGFBPs участвуют в выполнении сходных ролей. IGFBPs являются примитивными молекулами, обнаруживаемыми у всех изученных позвоночных, и описан IGFBP-родственный белок у Drosophila (Alic and Partridge, 2008, Honegger et al., 2008).
iii) IGFBP proteolysis
Значительный интерес к протеолизу IGFBP был проявлен 10 тому назад. Однако трудности в определении физиологического значения этих исследований привели к незначительным успехам этой области. Первые сообщения были о протеолизе IGFBP в сыворотке на поздних стадиях беременности у женщин, на примере IGFBP-3, в дальнейшем он был продемонстрирован в сыворотке беременных мышей и крыс, в амниотической жидкости человека и семенной плазме. Определенные протеиназы (напр., MMPs и PAPP-A), по-видимому, деградируют IGFBP-IGF комплексы, по-видимому, вблизи клеточной поверхности, высвобождая интактные, биологически активные IGFs, способные соединяться со своими рецепторами на клеточной поверхности (Beattie et al., 2006) сохраняется интерес к этим протеазам (Conover et al., 2010).
Это может представлять собой гомеостатическое состояние, но оно может становиться более существенным, если протеиназы, деградирующие IGFBP становятся более активны (такие как MMPs при опухолевом росте). Др. IGFBP-деградирующие протеиназы, такие как cathepsins, могут служить роли инактивации IGFs и IGFBPs во внеклеточных условиях. Было также предположено, что IGFBP протеазы могут осуществлять важное действие по продукции новых биоактивных фрагментов.
Наконец, способность IGFBPs влиять на действие IGF также может быть модифицирована с помощью IGF протеаз, продуцирующих укороченные по N-концу формы IGF-I, такие как des(1-3) IGF-I, которые обладают слабым сродством в отношении IGFBPs. Такие укороченные IGF-I формы обнаруживают биологическую активность, но неизвестно имеет ли этот процесс важной физиологическое значение
(Beattie et al., 2006).
Conclusions
IGFBP expression in the mammary gland is complex, tissue- and stage-specific. However, their expression in the embryo and their chromosal linkage to Hox genes makes it tempting to speculate that they play important developmental roles in the mammary gland. The fact that IGFs do, indeed, play critical roles in mammary development, and the fact that the IGFBPs can clearly influence IGF actions, adds further weight to this proposal. Indeed, their ability to bind to IGFs has been the main focus of attention in terms of understanding their mechanism of action. Transgenic models involving over-expression of IGFBPs supports this role and suggest predominantly inhibitory effects of IGFBPs on IGF actions. In vivo studies, achieving physiological concentrations of IGFBPs, are, however, required before firm conclusions can be made about their roles in distinct physiological processes. Such an inhibitory role is surely not the explanation for the presence of high concentrations of the IGFBPs in the circulation, where they would more likely be considered as a latent store of IGFs. In addition, the activation of pregnancy-associated proteases in serum, perhaps to allow greater delivery of IGFs, adds further, albeit circumstantial, evidence to support this proposal.
The enhancing effects of IGFBPs are typically demonstrated when IGFs and IGFBPs are in approximately equimolar concentrations and, although these effects have been consistently demonstrated, their physiological relevance still remains uncertain. In such studies, IGFBPs may artefactually increase the half-life of IGFs by preventing their degradation in the culture medium or their adsorption to plastic. On the other hand, in support of such enhancing actions, IGFBPs also bind to the ECM, involving their RGD sequences or heparin-binding domains, and this can lead to a reduction in the affinity of IGFBPs for IGFs. Such a role would be consistent with increased bioavailability of IGFs and thereby enhanced IGF action. However, studies utilising more physiological conditions, perhaps involving perfusion, to simulate the kinetics of clearance in the extracellular environment, will be required to provide more compelling evidence. In this respect, comparatively little is known about tissue clearance and pericellular concentrations of IGFBPs, although there are some reports (Xu et al., 1996, Xu et al., 1997). The secretion of IGFBPs into the extracellular environment might also serve as a barrier to limit access of IGFs to cellular receptors, and such a proposal has been made for the mammary gland for IGFBP-4 (Allar and Wood, 2004) and IGFBP-5 (Flint et al., 2000).
Mammary development is a complex process involving several major cell types and with specific requirements for proliferation and apoptosis in different cellular compartments (Wood et al., 2000). Recognition of this compartmentalisation of the gland and the expression patterns of the IGFBPs is crucial if we are to understand their precise functions in the mammary gland. It is now evident that IGFBPs can act independently of the IGFs but their relevance/importance in vivo has also been difficult to demonstrate. The absence of major phenotypes in mice, even when several IGFBPs had been deleted, suggests a degree of redundancy of their actions, although there have been no reports of compensatory increases in the secretion of other IGFBPs to explain this. Nevertheless, IGFBP knockout mice are now beginning to identify tissue-specific phenotypes (DeMambro et al., 2008, Leu et al., 2003, Ning et al., 2007). Additional studies, involving the use of conditional knockouts, and the use of the cleared mammary fat pad technique using tissue from knockout animals should improve our understanding of their roles in vivo. This has already been successfully developed for IGF-I, where deletion of either IGF-I or the IGF-IR are lethal or result in animals that are reproductively compromised. Transplantation of prenatal mammary epithelium from the IGF-IR null mouse into cleared fat pads of wild-type mice has also been used to identify an important role for IGFs in mammary development (Hadsell and Bonnette, 2000) and, in animals with an IGF-I deletion, post-natal survivors exhibited impaired mammary ductal growth (Kleinberg et al., 2000). For the moment it seems that our understanding of the in vivo role of these proteins will continue to depend upon circumstantial evidence. Demonstrating a role for IGFBPs in mammary gland development requires that the effective IGFBP concentration changes during a particular process (eg apoptosis) and that increasing the concentration of IGFBP by transgenesis (within physiological limits) or knockdown of the gene, influences the process in a predictable fashion. To date, for the mammary gland, this has only been achieved for IGFBP-5, strongly implicating it in apoptotic events associated with involution.
More recently it has become evident that the IGFBPs can act independently of the IGF axis. The structural similarities of the IGFBPs with other secreted cysteine-rich proteins, which do not bind IGFs, supports the concept that IGFBPs have IGF-independent actions. Many of the CCN proteins, for example, influence various growth factor actions extracellularly without utilising specific receptors of their own. The CCNs were re-named as IGFBPs but it may be more appropriate to consider the IGFBPs to be part of the CCN family. If so, the complexity of the extracellular environment will provide a significant challenge to reductionist approaches designed to understand the mechanisms of action of the larger TIC family to which the IGFBPs belong. IGFBPs undoubtedly play important roles in the development of the mammary gland, based upon their expression patterns and the transgenic and knockout animal models, although functional evidence is strongest for IGFBP-5 and IGFBP-3. A better understanding of the mechanisms of action of IGFBPs is required to provide a better assessment of their potential to influence mammary development. Perhaps the close similarities of the IGFBPs with the CCN and TSG families, which definitely have important developmental roles, will mean that an understanding of one family will provide clues as to the role of the others, particularly with respect to the mechanisms involved in the IGF-independent actions of the IGFBPs. The IGFBPs may ultimately prove to be of much greater significance because of their IGF-independent actions, rather than via the specific action which led to their name.
|
Сайт создан в системе
uCoz Fig. 1. IGFBP-5 increases adhesion but decreases migration. (Upper
panel) MCF-7 cells form spheroids, with limited adhesion to the substra-
tum, in serum-free conditions. IGFBP-5 induces epithelial cell adhesion and
spreading, whilst maintaining E-cadherin expression (green). Nuclei are
stained with DAPI (blue). (Lower panel) In the presence of serum, MCF-7
cells migrate from the wound edge. IGFBP-5 potently inhibits this migration.
Fig. 1. IGFBP-5 increases adhesion but decreases migration. (Upper
panel) MCF-7 cells form spheroids, with limited adhesion to the substra-
tum, in serum-free conditions. IGFBP-5 induces epithelial cell adhesion and
spreading, whilst maintaining E-cadherin expression (green). Nuclei are
stained with DAPI (blue). (Lower panel) In the presence of serum, MCF-7
cells migrate from the wound edge. IGFBP-5 potently inhibits this migration.  Fig. 2. TGFb1 induces fibroblast activation whereas IGFBP-5 induces de-adhesion. TGFb1 induces a dose-dependent phenotypic response in fibroblasts with a characteristic alignment and swirling pattern. IGFBP-5, in contrast, induces cells to migrate into small groups with decreased cell-substratum adhesion.
Fig. 2. TGFb1 induces fibroblast activation whereas IGFBP-5 induces de-adhesion. TGFb1 induces a dose-dependent phenotypic response in fibroblasts with a characteristic alignment and swirling pattern. IGFBP-5, in contrast, induces cells to migrate into small groups with decreased cell-substratum adhesion.  Fig. 3. Co-culture of epithelial cells (stained red for E-cadherin) with
fibroblasts (stained green for collagen). The formation of a boundary
is evident after 1 day. After 3 days, the fibroblasts migrate beyond the bound-
ary, but this is inhibited by IGFBP-5.
Fig. 3. Co-culture of epithelial cells (stained red for E-cadherin) with
fibroblasts (stained green for collagen). The formation of a boundary
is evident after 1 day. After 3 days, the fibroblasts migrate beyond the bound-
ary, but this is inhibited by IGFBP-5.