Посещений:  МОЛОЧНЫЕ ЖЕЛЕЗЫ
МОЛОЧНЫЕ ЖЕЛЕЗЫ
ИНВОЛЮЦИЯ
|
|
Remodeling mechanisms of the mammary gland
during involution
CHRISTINE J. WATSON* and PETER A. KREUZALER
 Int. J. Dev. Biol. 55: 757-762
doi: 10.1387/ijdb.113414cw
|
The process of post-lactational regression, or involution, of the mammary gland is a complex event characterised by extensive death of the secretory epithelium coupled with remodelling of the extracellular matrix and adipogenesis to regenerate the fat pad. Associated with these events is an inflammatory cascade and acute phase response. The critical signalling pathways that regulated involution have been defined and a wide variety of genes have been shown to modulate the various processes involved, including cell death, phagocytosis, tissue remodelling and innate immune response.
|
Первичная функция молочных желез заключается в предоставлении питания в форме молока для новорожденных млекопитающих. Молоко также предоставляет пассивную защиту от инфекции и у высших млекопитающих грудной ребёнок способствует связи (Oftedal, 2002). Однако, эта жизнью навязанная роль имеет обратную сторону, т.к. грудь чрезвычайно чувствительна к раку (Bray et al., 2004). Хотя было установлено, что ранняя срочная беременность предоставляет некоторую защиту от рака груди (Albrektsen et al., 1994; Lambe et al., 1994), имеются неотразимые эпидемиологические доказательства, что беременность увеличивает риск рака груди в ближайшей перспективе (Lambe et al., 1994) , а недавно экспериментальные доказательства подтвердили, что процесс постлактационной регрессии предоставляет опухолям стимулирующие условия (McDaniel et al., 2006).
Развитие молочных желез происходит в три разных фазы: во время эмбриогенезе, половозрелости и беременности. Рудиментарная структура генерируется у эмбриона и в плоть до половозрелости не происходит экстенсивной элонгации протоков, достигающей кульминации заполнением жировой подушки активно ветвящимся эпителием приблизительно на 8-10 неделе. В ответ на беременность происходит образование третичных веточек и лобулярно-альвеолярных структур, инициируемое сочетанно с де-дифференцировкой адипоцитов в жировой подушке. Молочные железы затем становятся органом, продуцирующим молоко, после рождения потомства и вследствие вскармливания грудью, при этом излишние lobuloalveolar клетки погибают за счёт тонко контролируемого процесса клеточной гибели, связанной с ремоделированием ткани и повторным появлением заполненных липидами адипоцитов. Железы возвращаются к почти к состоянию до беременности и этот цикл беременности, лактации и инволюции повторяется с каждой последующей беременностью.
The process of involution
Процесс инволюции сложен, нуждается не только в инициации обширной клеточной гибели для удаления эпителиальных клеток, продуцирующих молоко, но и также в контролируемом притоке макрофагов и др. типов иммунных клеток для удаления погибших клеток, остатков молока и дебриса. Эти события связаны с разрывами внеклеточного матрикса, ремоделированием кровеносных сосудов и повторной дифференцировкой адипоцитов для регенерации жировой подушки.
В последнюю декаду наше понимание молекулярных и клеточных событий, которые происходят при инволюции молочных желез мышей существенно усилилось, прежде всего в результате исследований с генетически модифицированными мышами и исследованиями глобальных профилей транскрипции, которые предоставили детальный анализ первых 4 - 6 дней инволюции. В большинстве этих исследований синхронная инволюция индуцировалась или отнятием детенышей от вскармливания или застоя молока за счет запечатывания соска. Интересно, что инволюция протекала в виде двух дискретных фаз. Первая фаза длится приблизительно 48 ч у мышей и обратима, тогда как вторая фаза инициирует программу ремоделирования, которая возвращает железу к состоянию до беременности (Lund et al., 1996). Вполне вероятно, что эта ранняя обратимость необходима, чтобы позволить возобновить лактацию потомства. Так, у морских котиков лактация может быть возобновлена спустя три недели, так как матери питаются в открытом море (Sharp et al., 2006). Первая фаза инволюции характеризуется протеканием, появлением погибающих клеток внутри просвета альвеол, которые становятся расширенными из-за скопившегося молока. В это время происходит также инфильтрация нейтрофилами. Использование закупорки соска у мышей продемонстрировало, что первая фаза регулируется локальными факторами, а не циркулирующими гормонами (Li et al., 1997; Marti et al., 1997).
Во второй фазе клеточная гибель сопровождается усилением активности matrix metalloproteinases (MMPs), которые важны для ремоделирования окружающей стромы, это сопровождается повторным заполнением адипоцитами, притоком макрофагов и активного плазматического kallikrein, который регулирует дифференцировку адипоцитов и ремоделирование стромы (Lilla et al., 2009). Эта фаза зависит от факторов циркуляции и может быть задержана воздействием глюкокортикоида (Feng et al., 1995; Lund et al., 1996), который может действовать путем поддержания плотных соединений (Zettl et al., 1992). Функция MMP заблокирована в первой фазе за счет экспрессии tissue inhibitors of metalloproteinases (TIMPs)(Green and Lund, 2005).
Данные по получению профиля транскрипции в дальнейшем были подразделены по этим двум функциональным фазам на 4 дискретных транскрипционных события (Clarkson et al., 2004; Stein et al., 2004), маркированных 4 кластерами генов, которые обладают самостоятельными временными паттерами экспрессии. Субнабор генов драматически индуцируется в течение 12 ч вынужденной инволюции с экспрессией быстро снижающейся после этого. Это может указывать, что др. механизмы запускают клеточную гибель в первой фазе инволюции, по сравнению со второй. Существуют ли действительно 4 самостоятельные фазы процесса инволюции скорее, чем две, описанные морфологически, пока неясно. Поэтому в любом исследовании инволюции важно учитывать эти ранние сигнальные события и тот факт, что гибель клеток, по-видимому, стохастический процесс. Также важно учитывать не эпителиальные клетки желез, такие как адипоциты и сосудистую сеть, которые драматически модифицируются во время инволюции и фагоцитоза (both professional and nonprofessional) и являются существенными для очистки железы от клеточнго дебриса и компонентов молока.
Важные сигнальные пути, которые инициируют инволюцию, были идентифицированы с использованием сложных генетических подходов. Хотя существенное количество генов участвует в регуляции клеточной гибели во время инволюции, многие из них могут быть нижестоящими компонентами этих сигнальных путей и поэтому могут иметь минимальную роль в течение общего процесса. Очевидно, что инволюция очень сложный процесс, в котором все аспекты тонко регулируются.
Cell death during involution – how is it initiated?
Застой молока, по-видимому, является первичным триггером инволюции и клеточной гибели (Li et al., 1997). Существует несколько предположений, как застой молока может инициировать инволюцию, включая механические растяжения эпителия альвеол из-за удержания молока в просвете (Quaglino et al., 2009) или действие секретируемых факторов молока. Plasma membrane calcium-ATPase 2 (PMCA2), которая транспортирует 60–70% кальция молока, драматически усиливает свою активность во время лактации, чтобы столь же драматически снизить свою активность во время инволюции. Недавно было показано, что PMCA2 регулируется изменениями в форме эпителиальных клеток молочных желез (VanHouten et al., 2010). Более того, мыши, обладающие нулевой мутацией в гене Atp2b2 (кодирующем PMCA2), обнаруживают преждевременную клеточную гибель на 18 день беременности и это сопровождается активацией Stat3. Скорее всего, что секретируемые факторы, такие как LIF (Kritikou et al., 2003; Schere-Levy et al., 2003), serotonin (Matsuda et al., 2004), и TGFβ-3 (Nguyen and Pollard, 2000) также важны для индукции клеточной гибели,ь т.к. мыши, дефицитные по LIF обнаруживают задержку инволюции (Kritikou et al., 2003), тогда как направленная экспрессия TGFβ-3 в альвеолярном эпителии лактирующих мышей вызывает апоптоз без ремоделирования ткани. Serotonin супрессирует экспрессию гена β-casein и приводит альвеолы молочных желез к усадке.
Значительное количество генов участвует в инволюции. Они суммированы в Table 1. Многие из этих данных были получены от генетически измененных мышей, а фенотипические отклонения инволюции часто едва различимы, указывающие, что важно взаимодействие между путями. Наиболее драматическая задержка в инволюции наблюдалась, когда транскрипционный фактор Stat3 условно делетировался в эпителии молочных желез. Клеточная гибель и ремоделирование ткани полностью отсутствовали у Stat3 (Chapman et al., 1999) и обратимая фаза инволюции увеличивалась, по крайней мере, на 6 дней после вызванной инволюции (Humphreys et al., 2002). Ряд генов, которые
TABLE 1
FACTORS THAT REGULATE INVOLUTION
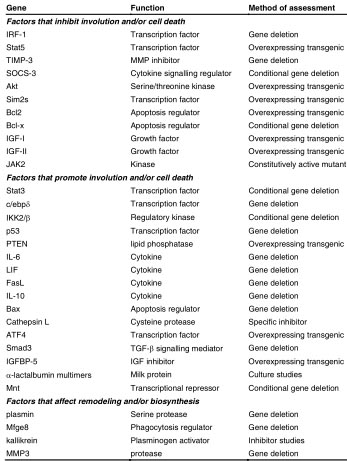
регулируются с помощью Stat3, такие как c-ebpu61540, OSMR и IGFBP-5, также являются регуляторами клеточной гибели и инволюции (Thangaraju et al., 2005). Сходная задержка наблюдалась, когда вышестоящий регулятор NF-kB путей, IKKβ, был делетирован условно (Baxter et al., 2006), подтверждая. что взаимодействие между этими сигнальными путями необходимо для процесса инволюции и что каждый путь необходим, но не достаточен, чтобы запустить клеточную гибель. Компоненты апоптических путей также включают лиганды рецепторов гибели, такие как FasL (Song et al., 2000), которые важны для апоптоза на 24 ч инволюции, и TRAIL, который активируется с помощью IL-10 во время инволюции (Sohn et al., 2001) в дополнение к членам семейства Bcl2 регуляторов апоптоза, таких как Bax, который способствует клеточной гибели, т.к. делеция Bax приводит к умеренному снижению апоптоза в первой фазе, а Bcl2, который способствует жизнеспособности эпителия в трансгенной модели избыточности функции (Schorr et al., 1999). Потеря анти-апоптического Bcl-xL ускоряет инволюцию (Walton et al., 2001). Во время второй фазы инволюции клеточная гибель происходит по соседству с ремоделируемой тканью и довольно трудно разглядеть задержку инволюции. Однако, удаление погибающих клеток и остатков молока является критическим для инволюции для продолжения и дальнейшей успешной лактации, т.к снижение фагоцитоза в отсутствии шунтирующей молекулы MFGE8 приводит к воспалению и образованию рубцовой ткани и последующей неспособности к кормлению грудью (Atabai et al., 2005; Hanayama and Nagata, 2005).
Каков же механизм клеточной гибели во время инволюции?
Вплоть до недавнего времени предполагалось, что механизмом, ответственным за деструкцию секреторного эпителия во время инволюции является апоптоз, форма запрограммированной клеточной гибели, которая возникает у всех многоклеточных организмов, термин апоптоз (греч. ‘falling leaves’) предложен Kerr, Wyllie и Currie в 1972 (Kerr et al., 1972).
Генетику и биохимию апоптоза активно исследовали (Danial and Korsmeyer, 2004). Однако сегодня очевидно, что существуют множественные пути клеточной гибели и около 10 запрограммированных путей клеточной гибели, которые проявляются в разных ситуациях и в ответ на разные стимулы (Melino et al., 2005). Морфология гибнущих клеток, которые отсоединяются от альвеолярной стенки и осыпаются в просвет, не является классической апоптической (Fig. 1). Отпадающие клетки выглядят набухшими, имеют два гиперконденсированных ядра и полное отсутствие вспучивания мембраны. Они не обнаруживают признаков энтоза (entosis), недавно описанной формы запрограммированной клеточной гибели в эпителиальных клетках молочных желез in vitro (Overholtzer et al., 2007). Более того, TdT-mediated dUTP nick end labelled (TUNEL) позитивные клетки не обнаруживаются в течение первых 24 ч инволюции, хотя они очевидны на 72
ч инволюции. Однако палачи каспазы всё ещё активированы во время инволюции и впрямь расщепляющая caspase 3 часто используется для измерения клеточной гибели во время инволюции. Недавно удалось открыть причину такой необычной морфологии. Stat3 , как было установлено, индуцирует лизосомный путь клеточной гибели (lysosomal pathway of cell death (LM-PCD)), который не зависит от палачей каспаз, которые безразличны для инволюции (Kreuzaler et al.). Интересно, что Stat3 усиливает экспрессию лизосомных энзимов cathepsin B и cathepsin L, тогда как подавляет экспрессию их эндогенный ингибитор Spi2a. Cathepsins истекают из лизосом во время инволюции и инициируют клеточную гибель, приводя к отпдению клеток в просвет, где расщепляются caspases 3 и 6, возможно в ответ на anoikis, возникающий в результате отторжения от соседних альвеолярных клеток. Впервые было продемонстрировано, что лизосомный путь клеточной гибели происходит в нормальной физиологическом контексте in vivo. Было бы интересно определить, вносят ли вклад др. сигнальные пути в LM-PCD во время инволюции. Это открытие нуждается в переоценке предыдущих данных по инволюции. Медиаторы LMP приведены на Fig. 2.
Определенно возможно, что макрофагия также происходит во время инволюции. Это механизм выживаемости, обычно инициируемый клетками во время голодания, чтобы использовать клеточные компоненты (Kroemer and Levine, 2008). Аутофагия д. предоставлять механизм, который гарантирует обратимость первой фазы инволюции. Кстати, имеются скудные доказательства аутофагии во время инволюции, хотя генетические модели сегодня доступны, а определённо отвечающие на это вопрос будут доступны в скором будущем. В этом контексте стоит отметить, что полностью функциональные лизосомы необходимы для аутофагии
How is the mammary gland remodelled during involution?
Хотя наблюдается обширная клеточная гибель во время инволюции, архитектура молочных желез не меняется заметно во время первых 48 ч. Однако, переход ко второй фазе запускает обширное ремоделирование приводящее к удалению оставшегося эпителия одновременно с возобновлением дифференцировки адипоцитов. Эта фаза характеризуется заметной протеазной активностью, которая ремоделирует внеклеточный матрикс. Неясно, что запускает переход ко второй фазе,
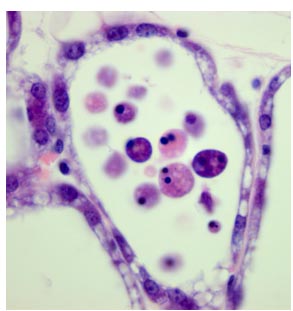 Fig. 1. Cell death during mammary gland involution does not resemble apoptosis. A single alveolus from a 24 h involution mammary gland tissue section showing numerous cells shed into the alveolar lumen. Note the highly condensed nuclei and swollen appearance of the cells with no evidence of membrane blebbing.
Fig. 1. Cell death during mammary gland involution does not resemble apoptosis. A single alveolus from a 24 h involution mammary gland tissue section showing numerous cells shed into the alveolar lumen. Note the highly condensed nuclei and swollen appearance of the cells with no evidence of membrane blebbing.
 Fig. 2. Inducers of Lysosomal Membrane Permeabilisation (LMP). Schematic overview of selected inducers of LMP relevant to mammary gland involution. LMP can be induced downstream of death receptors either directly or through the involvement of Caspase 8. Furthermore TNF can activate neutral sphingomyelinase, which ultimately leads to the production of sphingosine and LMP . Damaged mitochondria produce ROS and activate caspase 3, both of which are implicated in LMP . Calcium activated calpains, lysosomal cathepsins and the PI3K pathway can all affect LMP . Metallothionein 2 can protect
lysosomes from excessive free iron.
Fig. 2. Inducers of Lysosomal Membrane Permeabilisation (LMP). Schematic overview of selected inducers of LMP relevant to mammary gland involution. LMP can be induced downstream of death receptors either directly or through the involvement of Caspase 8. Furthermore TNF can activate neutral sphingomyelinase, which ultimately leads to the production of sphingosine and LMP . Damaged mitochondria produce ROS and activate caspase 3, both of which are implicated in LMP . Calcium activated calpains, lysosomal cathepsins and the PI3K pathway can all affect LMP . Metallothionein 2 can protect
lysosomes from excessive free iron.
но это может быть то, что изменяет системные гормоны, приводя к индукции экспрессии протеаз, такие как MMPs, которые деградируют внеклеточный матрикс (ECM), и сериновые протеазы, которые активируют plasminogen. Первичным источником MMPs являются стромальные клетки, а экспрессия MMP-2, MMP-3, MMP-9 и MMP-11усиливается во время инволюции. MMPs расщепляют различные субстраты, такие как collagen IV, chemokines и E-cadherin, которые д. облегчать отсоединение клеток. Т.о., клетки, которые выживают в первой фазе инволюции, могут быть понуждены к гибели вследствие anoikis (гибели клеток, вызванной отделением), позволяющим MMPs экспрессироваться и активироваться. Естественным следствием этого является то, что MMPs д. быть ингибированы во время первой фазы инволюции и это достигается с помощью TIMPs. Ингибитор MMP-2, TIMP-3, особенно важен, т.к. инволюция протекает быстрее в TIMP-3 дефицитных молочных железах и теряется обратимость первой фазы (Fata et al., 2001). избыточная экспрессия TIMP-1 или потеря stromelysin, приводит к ускоренной дифференцировке адипоцитов, но не оказывает эффекта на клеточную гибель (Alexander et al., 2001). Это указывает на то, что MMPs не прямо влияют на клеточную гибель, а в первую очередь участвуют в ремоделировании стромального окружения.
Inflammatory signalling and immune cells in involution
Активация путей передачи сигналов Stat3 и NF-kB показывает, что передача воспалительных сигналов также может быть важной во время инволюции. Это мнение подкрепляется данными исследования микромассивов, упомянутых выше, которые идентифицировали иммунный каскад и острую фазу реакции во время инволюции (Clarkson et al., 2004; Stein et al., 2004). Важно, что как про-, так и анти-воспалительные гены экспрессируются, возможно. чтобы гарантировать, что избыточное воспаление не будет происходить. Наблюдаемый приток иммунных начинается с нейтрофилов на первый день инволюции, затем следуют макрофаги, эозинофилы, плазматические клетки (плазмациты) и B-лимфоциты около 4-го дня (Stein et al., 2004). Эти клетки часто обнаруживаются вокруг протоков, но иммунные клетки не обнаруживаются в молоке овец и коров во время инволюции, указывая тем самым, что они переходят в просвет протоков (Tatarczuch et al., 2000).
Фагоциты очень важны для процесса инволюции, как упоминалось выше. Во время ранней инволюции, эта роль выполняется с помощью жизнеспособного эпителия, использующего те же самые молекулы распознавания, что и профессиональные фагоциты. Рецептор мусора, CD14, строго индуцируется во время инволюции Stat3-зависимым способом, а эпителиальные клетки молочных желез, как было установлено, экспрессируют calreticulin, CD91 и CD36 (Monks et al., 2005). Заглатывание вызывает продукцию противовоспалительных цитокинов, таких как TGFβ (Monks et al., 2002), существенных для гарантии осуществления инволюции без воспаления.
Экспрессия генов острой фазы реакции является др. характеристикой инволюции, вообще-то неудивительно, т.к. многие из этих генов регулируются с помощью Stat3 и/или NF-kB. Одним из них является uterocalin, lipocalin который индуцирует апоптоз нейтрофилов и др. лейкоцитов. Uterocalin может защищать эпителиальные клетки молочных желез от повреждающих свободных радикалов и протеаз, испускаемых лейкоцитами и макрофагами. Среди наиболее сильно позитивно регулируемых генов находятся orosomucoids 1 и 2, которые действуют как носители основных и нейтрально заряженных липофильных соединений, включая стероиды и протеазные ингибиторы. Serum amyloid A белки, предшественники с воспалением ассоциированного реактивного амилоидоза, могут соединяться с высокой плотностью липопротеинами, кальцием, ламинином и heparin/heparan-sulfate, и участвуют в индукции миграции лейкоцитов.
Conclusion
Steady progress has been made in investigating the mechanisms of mammary gland involution. Analyses of changes in gene expression during the involution process have highlighted roles for immune cells and the inflammatory/acute phase responses. A role for mammary epithelia cells as phagocytes has highlighted the plasticity of these cells. Recent insights have been obtained into the mechanism of cell death which will provide the basis for much future research. However, several outstanding questions remain and could be the focus for future work. Is the initiating signal for apoptosis mechanical or biological? How is the transition from the reversible to irreversible phase controlled? How are the stem cells protected from cell death? These are challenging questions to address and, despite our progress, we still lack a detailed understanding of the involution process.
|
Сайт создан в системе
uCoz
 Fig. 1. Cell death during mammary gland involution does not resemble apoptosis. A single alveolus from a 24 h involution mammary gland tissue section showing numerous cells shed into the alveolar lumen. Note the highly condensed nuclei and swollen appearance of the cells with no evidence of membrane blebbing.
Fig. 1. Cell death during mammary gland involution does not resemble apoptosis. A single alveolus from a 24 h involution mammary gland tissue section showing numerous cells shed into the alveolar lumen. Note the highly condensed nuclei and swollen appearance of the cells with no evidence of membrane blebbing.  Fig. 2. Inducers of Lysosomal Membrane Permeabilisation (LMP). Schematic overview of selected inducers of LMP relevant to mammary gland involution. LMP can be induced downstream of death receptors either directly or through the involvement of Caspase 8. Furthermore TNF can activate neutral sphingomyelinase, which ultimately leads to the production of sphingosine and LMP . Damaged mitochondria produce ROS and activate caspase 3, both of which are implicated in LMP . Calcium activated calpains, lysosomal cathepsins and the PI3K pathway can all affect LMP . Metallothionein 2 can protect
lysosomes from excessive free iron.
Fig. 2. Inducers of Lysosomal Membrane Permeabilisation (LMP). Schematic overview of selected inducers of LMP relevant to mammary gland involution. LMP can be induced downstream of death receptors either directly or through the involvement of Caspase 8. Furthermore TNF can activate neutral sphingomyelinase, which ultimately leads to the production of sphingosine and LMP . Damaged mitochondria produce ROS and activate caspase 3, both of which are implicated in LMP . Calcium activated calpains, lysosomal cathepsins and the PI3K pathway can all affect LMP . Metallothionein 2 can protect
lysosomes from excessive free iron.