миоэпителиальные клетки
Посещений:  МОЛОЧНЫЕ ЖЕЛЕЗЫ
МОЛОЧНЫЕ ЖЕЛЕЗЫ
Миоэпителиальные Клетки
|
|
The mammary myoepithelial cell
Авторы  Int. J. Dev. Biol. 55: 763-771
doi: 10.1387/ijdb.113385mm
|
Over the last few years, the discovery of basal-type mammary carcinomas and the association of the regenerative potential of the mammary epithelium with the basal myoepithelial cell population have attracted considerable attention to this second major mammary lineage. However, many questions concerning the role of basal myoepithelial cells in mammary morphogenesis, functional differentiation and disease remain unanswered. Here, we discuss the mechanisms that control the myoepithelial cell differentiation essential for their contractile function, summarize new data concerning the roles played by cell-extracellular matrix (ECM), intercellular and paracrine interactions in the regulation of various aspects of the mammary basal myoepithelial cell functional activity. Finally, we analyze the contribution of the basal myoepithelial cells to the regenerative potential of the mammary epithelium and tumorigenesis.
|
Функциональность дифференцированных молочных желез заключается в секреторных альвеолах, организованных в дольки и соединенных с ветвящимися протоками, ведущими на поверхность тела. Наиболее важная часть развития молочных желез происходит постнатально. Лишь немногие протоки формируются в позднем эмбриональном развитии и при рождении молочные железы остаются рудиментарными. Интенсивный рост и морфогенез ветвления происходит во время полового созревания и ведет к становлению системы протоков молочных желез. Секреторные ткани, альвеолы молочных желез, развиваются во время беременности. Железы достигают полностью дифференцированного состояния при кормлении грудью.
Эпителий молочных желез состоит из двух слоёв клеток, просветного и базального миоэпителиального. Во время лактации клетки, образующие просвет, продуцируют и секретируют молоко, тогда как миоэпителиальные клетки, сокращаясь, выталкивают молоко из тела. Морфогенез и дифференцировка молочных желез контролируются системными гормонами, растворимыми ростовыми факторами, межклеточными и клетка-ECM взаимодействиями. В эпителии молочных желез гормональные рецепторы существенны для развития и гомеостаза желез, такие как estrogen receptor-α (ERα), progesterone receptor (PR) и prolactin receptor экспрессируются в основном просветными клетками скорее, чем базальными миоэпителиальными клетками (Brisken and
O'Malley 2010). Однако миоэпителиальные клетки молочных желез отвечают на гормональные стимулы in vivo. Кроме того, эти клетки экспрессируют различные рецепторы для растворимых и ассоциированных с поверхностью клеток сигнальных молекул. Они также продуцируют большинство компонентов базальной мембраны и участвуют в в постоянных реципрокных взаимодействиях с соединительной тканью, окружающей эпителий молочных желез.
Миоэпителий организуется по-разному в протоках и альвеолах. Миоэпителиальные клетки протоков расположены в виде более или менее непрерывного монослоя, тогда как альвеолярные миоэпителиальные клетки являются звездчатой формы и не образуют непрерывного слоя между секреторным эпителием и окружающей базальной мембраной (Fig. 1). Дифференцированные миоэпителиальные клетки являются контрактильными клетками с ультраструктурой, напоминающей гладкомышечные. Миоэпителиальные клетки содержат большие количества микрофиламент и плотные бляшки и экспрессируют специфичные для гладких мышц цитоскелетные и контрактильные белки. Миоэпителиальные клетки формируют десмосомы и полудесмосомы и они отделяются от соединительной ткани с помощью базальной мембраны, специального типа ECM. Однако следует иметь в виду, что в отличие от гладких мышц, которые происходят из мезодермальных предшественников и клеток нервного гребня, миоэпителиальные клетки молочных желез и просветные клетки происходят из эктодермы. Помимо обладания фенотипическими признаками клеток гладких мышц, миоэпителиальные клетки имеют все характеристики базальных клеток стратифицированного эпителия. В частности, они экспрессируют базального типа цитокератины 5, 14 (K5 и K14, соотв.) и цитокератин 17, P-cadherin и высокие уровни DNp63.
Два открытия последних лет подтвердили, что базальные эпителиальные клетки молочных желез могут играть ключевую роль в нормальном развитии молочных желез и при туморогенезе. Во-первых, определение транскрипционных профилей карцином молочных желез выявило субнабор опухолей, экспрессирующих маркеры базальных клеток и характеризующихся особенно печальными клиническими исходами (Gusterson 2009; Foulkes et al., 2011 and references
therein). Во-вторых, несколько сообщений описали выделение и частичную характеристику стволовых клеток и клеток предшественников из взрослых молочных желез мышей, а линии эпителиальных клеток молочных желез, показали, что эти клетки могут располагаться в базальном компартменте эпителия молочных желез (Deugnier et al., 2006; Shackleton et al., 2006; Stingl et al., 2006; Sleeman et al., 2007).
Здесь мы сконцентрируемся в основном на аспектах функциональной активности миоэпителиальных клеток, исследованных нашей группой. Рассмотрим исследования, связанные с контролем дифференцировки миоэпителиальных клеток, обсудим роль межклеточных и клетка-ECM взаимодействий с участием базальных миоэпителиальных клеток в развитии молочных желез и, наконец, суммируем современные знания, касающиеся вклада миоэпителиальных клеток в регенеративный потенциал эпителия молочных желез и туморогенез. Важным физиологическим свойством миоэпителиальных клеток является их опухоль-супрессирующий потенциал (Barsky and Karlin 2006; Panday et al., 2011).
Развитие и патология молочных желез не идентичны у разных видов млекопитающих. Известно, что покоящиеся молочные железы грызунов состоят только из разветвленных протоков, представленных малыми боковыми третичными веточками, которые дают альвеолы при беременности, тогда как молочные железы взрослых женщин даже в отсутствие беременности содержат варьирующие количества долек-альвеол (Anbazhagan et al., 1998; Naccarato et al., 2000). Др. важным различием между молочными железами грызунов и человека это строма, соединительная ткань, окружающая эпителий молочных желез. У мышей и крыс строма является жировой, богатой адипоцитами, тогда как молочные железы женщин содержат значительно больше фиброзной соединительной ткани. Однако в целом организация паренхимы молочных желез на клеточном уровне сходна у грызунов и человека и данные, полученные на модельных грызунах, предоставляют важную информацию, касающуюся развития и болезней молочных желез человека.
Differentiation of mammary myoepithelial cells
Базальные и просветные клетки из псевдостратифицированного эпителия Differentiation of mammary myoepithelial cells функционально и фенотипически отличны. Расхождение двух эпителиальных компартментов Differentiation of mammary myoepithelial cells начинается во время эмбрионального развития. В зачатках молочных желез E15 эмбрионов мышей, в большинстве своём, если не все клетки, экспрессируют базальный цитокератин K5, многочисленные клетки окрашиваются позитивно как на K5, так и просветный цитокератин 8 (K8), тогда как экспрессия маркера базальных клеток p63 уже ограничивается 2-3 слоями базальных клеток (Fig. 2 A,B). На ст. E18, экспрессия K5, наивысшая в базальных клетках и низкая в клетках, сконцентрированных в будущей просветной части протоков, K8 обнаруживает противоположный паттерн экспрессии, а p63 ограничивается слоем базальных клеток (Fig. 2 C,D). Лишь немногие базальные клетки молочных желез от эмбрионов мыши на ст. E18 экспрессируют первый специфический для гладких мышц белок, α-smooth muscle actin (α-SMA) (Fig. 2E). У новорожденных мышей молочные железы, как было установлено, содержат эпителиальные клетки, позитивные по α-SMA и calponin, тогда как др. сократительный белок, caldesmon, отсутствует в эпителии молочных желез новорожденных мышей и обнаруживается в миоэпителиальных клетках только у мышей в возрасте трех недель (Fig. 2F and data not shown). У эмбрионов крыс на ст. E15 и E18, клетки базального эпителия из рудиментов молочных желез окрашиваются негативно на гладкомышечные маркеры. α-SMA и гладкомышечный миозин впервые обнаруживаются в базальных клетках эпителия молочных желез у новорожденных самок крыс (Deugnier et al., 1995). Т.о., у грызунов базальные клетки из эмбриональных зачатков молочных желез не экспрессируют гладкомышечные маркеры, а дифференцировка миоэпителиальных клеток начинается во время перинатального периода. У человеческого плода молочные железы обнаруживают первый гладкомышечный маркер, α-SMA, в базально расположенных клетках протоков после 22 - 23 недель беременности (Anbazhagan et al., 1998; Friedrichs et al., 2007). На этой ст. развития слои просветных и базальных клеток могут быть четко различены благодаря различиям в экспрессии K8, транскрипционного фактора AP2-α, и транскрипционного фактора AP2-γ и HER1, первые два из этих маркеров ограничены просветными клетками, а последние две базальными клетками (Friedrichs et al., 2007).
Дифференцированный фенотип с индукцией и позитивной регуляцией специфических гладкомышечных контрактильных и цитоскелетных белков, приобретается постепенно миоэпителиальными клетками, особенно во время постнатального развития молочных желез. Изменения в системе адгезии, включая репертуар интегринов и продукцию компонентов ECM, сопровождает созревание миоэпителиальных клеток молочных желез (Deugnier et al., 1995).
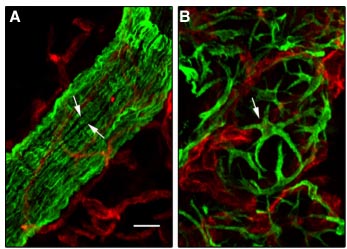 Fig. 1. Morphology of ductal and alveolar myoepithelial cells. Double
immunofluorescence labelling of sections through 10-week-old virgin
(A) and 2-day-lactating (B) mouse mammary glands with the antibodies
against cytokeratin 5 (K5, green) and CD31 (red). Arrows indicate elongated
ductal (A) and stellate-shaped alveolar (B) myoepithelial cells. CD31 reveals
capillaries. Bar, 10 mm.
Fig. 1. Morphology of ductal and alveolar myoepithelial cells. Double
immunofluorescence labelling of sections through 10-week-old virgin
(A) and 2-day-lactating (B) mouse mammary glands with the antibodies
against cytokeratin 5 (K5, green) and CD31 (red). Arrows indicate elongated
ductal (A) and stellate-shaped alveolar (B) myoepithelial cells. CD31 reveals
capillaries. Bar, 10 mm.
В растущих половозрелых молочных железах мышей cap клетки с зачатков терминальных концов дают новые миоэпителиальные клетки протоков (Williams and Daniel 1983). Зачатки терминальных концов это луковицеобразные структуры, обнаруживаемые на растущих кончиках протоков молочных желез, проникающих в жировую подушку, при этом cap клетки формируют монослой по фронту. Кончиковые (cap) клетки пролиферируют и по мере врастания протоков в строму, они прогрессивно перемещаются в подлежащую часть протока, где они дифференцируются в миоэпителиальные клетки (Williams and Daniel 1983). Cap клетки обладают особым фенотипом: они экспрессируют α-SMA, P-cadherin и p63, но окрашиваются очень слабо на базального типа цитокератины K5 и K14. Кроме того, недавнее исследование идентифицировало специфический маркер cap клеток, s-SHIP, белок с неизвестной биологической
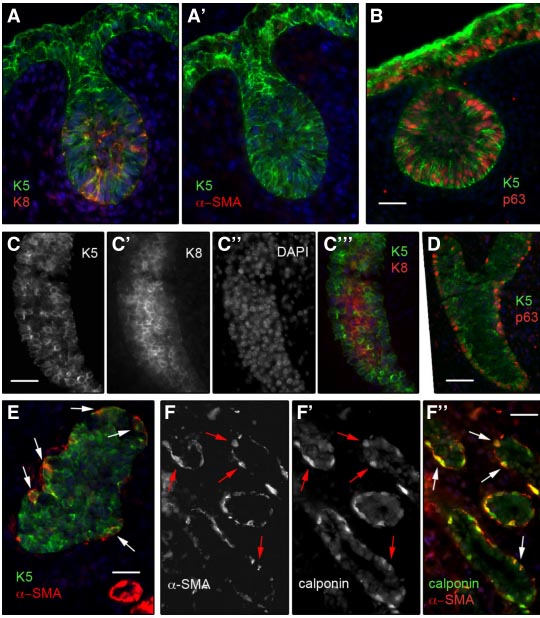 Fig. 2. Distribution of epithelial and smooth muscle markers in developing mouse mammary gland. Double immunofluorescence labelling of sections through developing mammary glands from mouse embryo (A-E) and newborn female mouse (F) with antibodies against K5, K8, p63, a-SMA and calponin. The nuclei were stained with DAPI. (A,A'), serial sections through a mammary bud from E15.5 embryo, (B) section through another bud from the same embryo. (C-E), sections through a mammary rudiment from an E18 female embryo. C''' shows merged C, C' and C'' images. F'' shows merged F and F' images. The arrows in E indicate basal cells positive for K5 and a-SMA, those in F , F' and F" , indicate basal cells positive for a-SMA and calponin. Tissues were fixed in paraformaldehyde, embedded in paraffin, sectioned and processed for immunolabelling as described elswhere (Taddei et al., 2008). Bars, 45 mm.
Fig. 2. Distribution of epithelial and smooth muscle markers in developing mouse mammary gland. Double immunofluorescence labelling of sections through developing mammary glands from mouse embryo (A-E) and newborn female mouse (F) with antibodies against K5, K8, p63, a-SMA and calponin. The nuclei were stained with DAPI. (A,A'), serial sections through a mammary bud from E15.5 embryo, (B) section through another bud from the same embryo. (C-E), sections through a mammary rudiment from an E18 female embryo. C''' shows merged C, C' and C'' images. F'' shows merged F and F' images. The arrows in E indicate basal cells positive for K5 and a-SMA, those in F , F' and F" , indicate basal cells positive for a-SMA and calponin. Tissues were fixed in paraformaldehyde, embedded in paraffin, sectioned and processed for immunolabelling as described elswhere (Taddei et al., 2008). Bars, 45 mm.
функцией структурно близкий SHIP1, SH2-containing inositol 5'-phosphatase (Bai and Rohrschneider 2010). Зачатки терминальных концов присутствуют только в быстро растущих молочных железах в период половозрелости, популяции клеток, сходные с cap клетками могут существовать на оконечностях всех растущих зачатков на разных стадиях развития. Экспрессия гладкомышечных маркеров миоэпителиальными клетками не только регулируется во времени в ходе развития, но и регулируется пространственно. В покоящихся молочных железах взрослых женщин специфический вариант caldesmon участвует в регуляции гладкомышечных сокращений, он экспрессируется миоэпителиальными клетками крупных протоков и образующих молоко синусов, но отсутствует в междольковых малых протоках и ацинусах (Lazard et al., 1993). Сходным образом в лактирующих молочных железах крыс миоэпителиальные клетки протоков и альвеол отличаются своим паттерном экспрессии контрактильных и цитоскелетных гладкомышечных маркеров (Deugnier et al., 1995). По крайней мере, частично эта гетерогенность может отражать преходящие различия в степени созревания миоэпителиальных клеток, расположенных в разных частях древа молочных желез или различия в функциональных свойствах миоэпителиальных клеток протоков и альвеол, таких как сократимость. Напр., вполне возможно, что экспрессия сократительных белков позитивно регулируется в альвеолярных миоэпителиальных клетках лактирующих молочных желез. Jolicoeur (2005) предположил, что гетерогенность миоэпителиальных клеток "may reflect an innate ability of the mammary basal myoepithelial lineage to adapt to a wide range of environments", предполагая, что эти клетки адекватно обеспечивают эпителиально-стромальные взаимодействия.
Contractile function and the control of mammary myoepithelial cell differentiation
Прирожденная контрактильная активность миоэпителиальных клеток существенна для их физиологической функции. В лактирующих молочных железах сокращения миоэпителиальных клеток вызываются пульсирующими высвобождениями oxytocin гипофизом. Oxytocin соединяется с разнородными G protein-coupled рецепторами на клеточной поверхности миоэпителиальных клеток (reviewed in Reversi et al., 2005). Как и в гладкомышечных клетках сокращения миоэпителиальных клеток регулируются с помощью myosin light chains (MLC). Фосфорилирование MLC индуцирует активность myosin ATPase, связывая миозин с актином и сокращением (Hartshorne et al., 1989). Последующее дефосфорилирование MLC с помощью специфической фосфатазы ведет к реляксации. Мы недавно показали, что добавление phospholipase C/Ca2+/MLC пути (Reversi et al., 2005), сигнальный каскад RhoA/ROCK оказывается важным для контракций миоэпителиальных клеток, индуцируемых oxytocin (Raymond et al., 2011). Мы установили, что ингибирование ROCK полностью предупреждает сократительную реакцию миоэпителиальных клеток на oxytocin. Контрактильная активность миоэпителиальных клеток нуждается в экспрессии гладкомышечных белков и соотв. клетка-ECM взаимодействиях. Подобно гладкомышечным клеткам дифференцировка миоэпителиальных клеток зависит от serum response factor (SRF), транскрипционного фактора, который связывает последовательность ДНК, известную как CArG бокс, ассоциированную с гладкомышечными структурными генами, такими как α-SMA и гены гладкомышечных тяжелых цепей миозина. SRF взаимодействует с членами семейства myocardin транскрипционных ко-активаторов, которые усиливают экспрессию SRF-зависимых генов (see references in Pipes et al., 2006). Myocardin сам по себе экспрессируется специфически в кардиальных и гладкомышечных клетках, тогда как миоэпителиальные клетки молочных желез экспрессируют myocardin-родственные транскрипционные факторы Mkl1 и Mkl2 (see references in Pipes et al., 2006).
Молочные железы MKL1-дефицитных мышей развиваются нормально, но мутантные самки неспособны вскармливать всё свое потомство из-за нарушений контрактильных функций миоэпителиальных клеток. В отсутствие MKL1, миоэпителиальные клетки молочных желез содержат лишь очень низкие количества белков, важных для сокращений, таких как гладкомышечные варианты актина, тяжелых цепей миозина, tropomyosin, transgelin, caldesmon и myosin light chain kinase. Mkl2 активируется в мутантной ткани, но не может заместить MKL1 (Pipes et al., 2006).
В отличие от myocardin, который локализуется в клеточном ядре, myocardin-related белки ассоциируют с цитоплазматическим мономерным G-actin. Rho GTPases позитивно регулируют экспрессию специфичного для гладких мышц гена мишени Srf, благодаря своей способности индуцировать полимеризацию F-actin, приводящую к высвобождению цитоплазматического MKL1. Последующее накопление в ядре MKL1 позволяет белку действовать SRF ко-активатор, способствующий дифференцировке гладких мышц (Pipes et al., 2006). α-SMA является наиболее многочисленной изоформой актина в миоэпителиальных клеток молочных желез. Недавнее исследование показало, что α-SMA необходим для контрактильной функции миоэпителиальных клеток и для генерации контрактильных сил, необходимых для выдавливания молока. Мыши, лишенные α-SMA обнаруживают неспособность к лактации, несмотря на нормальное развитие их молочных желез (Haaksma et al., 2011). Эксперименты in vitro
что сократительная реакция на oxytocin миоэпителиальных клеток, лишенных α-SMA нарушена. Экспрессия др. контрактильных белков не анализировалась в этом исследовании, но авт. полагают, что отсутствие α-SMA может изменять динамику актина, приводя к накоплению G-actin, тем самым снижая транскрипционную активность MKL1 и экспрессию др. гладкомышечных сократительных белков.
Др. известный регулятор экспрессии специфичный для гладких мышц это TGF-β. Транскрипционный регулятор, активируемый с помощью TGF-β, SMAD3, взаимодействует с MKLs, тем самым контролирует дифференцировку гладкомышечного клона (reviewed in Pipes et al., 2006). Помимо своей роли в регуляции специфичных для гладких мышц SRF мишеней, MKL1 и SMAD3 участвуют в контроле экспрессии Slug (Morita et al., 2007), транскрипционного фактора, существенного для эпителиально-мезенхимного перехода. В эпителии молочных желез Slug участвует в контроле фенотипа базальных клеток. Этот белок обнаружен только в слое базальных миоэпителиальных клеток (Mani et al., 2008; Proia et al., 2010).
Путь Notch, как полагают, вносит вклад в контроль гладкомышечного фенотипа (Morrow et al., 2008) и участвует в амплификации миоэпителиальных предшественников молочных желез (Dontu et al., 2004). Влияние передачи сигналов Notch на контроль баланса пролиферации и дифференцировки гладкомышечных (и, возможно, миоэпителиальных) клеток зависит от контекста. С одной стороны, передача сигналов Notch непосредственно активирует транскрипцию генов, специфичных для гладких мышц, а , с др. стороны, нижестоящих мишеней, действующих сочетанно с др. сигнальными путями, это может ингибировать экспрессию гладкомышечных маркеров, индуцируя дедифференцировку (Morrow et al., 2008). Недавнее сообщение подтвердило роль сигнального пути EGFR-ERK1/2 по контролю распространения популяции базальных клеток молочных желез (Pasic et al., 2011) . Однако, эффекты EGFR лигандов на экспрессию специфичных для гладких мышц белков, не были изучены в этом исследовании.
Myoepithelial cell-ECM interactions
Взаимодействия клетка-ECM играют важные роли в контроле различных аспектов функциональной активности эпителиальных клеток молочных желез. Эпителий молочных желез окружен базальной мембраной, состоящей в основном из collagen IV, различных вариантов laminin и nidogen (reviewed in Muschler and Streuli 2010). Благодаря своим непосредственным контактам с базальной мембраной, миоэпителиальные клетки особенно богаты integrins. Ранние иммуногистохимические исследования выявили экспрессию различных димеров integrin, включая коллагеновые рецепторы α1β1, α2β1 и рецепторы fibronectin α5β1, αvβ3 integrin и высокие уровни ламининовых рецепторов α3β1, α6β1 и α6β4, в миоэпителиальных клетках молочных желез грызунов и человека (see references in Taddei et al., 2003 and in Muschler and Streuli 2010). Мыши, лишенные α1 bkb α2 цепочки интегрина жизнеспособны. Делеция в зародышевой линии гена α1 integrin не оказывает эффекта на развитие молочных желез, тогда как устранение гена a2 integrin приводит к легкому снижению сложности ветвления протоков молочных желез у девственных самок (reviewed in Hynes 2002). Отсутствие α3β1 или α6β4 интегринов ведет к перинатальной летальности (reviewed in Hynes 2002). Поэтому была использована техника трансплантаций для изучения роли этих интегринов в развитии молочных желез. Эпителий молочных желез, дефицитный по α3 или α6 интегриновой цепи (т.e. истощенный по α3β1 или α6β1 и α6β4 димерам интегринов), будучи трансплантированным в очищенные жировые подушки молочных желез мышей, продуцируют протоки и альвеолы, сходные с теми. что развиваются в контрольной ткани, указывая тем самым, что эти интегрины безразличны для морфогенеза молочных желез. Одним из возможных объяснений этих результатов является функциональное перекрывание интегринов α3β1, α6β1 и α6β4.
Для изучения роли, выполняемой интегринами, экспрессирующимися в развивающихся миоэпителиальных клетках молочных желез, мы использовали условные делеции генов с участием Cre-Lox подхода. Мы получили мутантных мышей с делециям и интегриновых цепочек β1 или α3 в популяции базальных (K5-позитивных) клеток. Экспрессия Cre управлялась базальными эпителиальными клетками с помощью K5 промотора (Taddei et al., 2008; Raymond et al., 2011). Делеция β1 integrin из базальных миоэпителиальных клеток затрагивает морфогенез ветвления молочных желез у девственных самок и лобуло-альвеолярное развитие при беременности (Taddei et al., 2008). Мутантный эпителий был охарактеризован в основном как сильно дезорганизованный характер ветвления с немногими боковыми веточками. Лобуло-альвеолярное развитие достоверно задержано и секреторные альвеолы развиваются только во время поздней беременности после 14.5 p.c. из integrin-позитивных клеток предшественников, находящихся в просветном слое. Однако, делеция β1 integrins из базального компартмента миоэпителиальных клеток не затрудняет рост или дифференцировку протоков из двух основных клонов молочных желез, миоэпителиального и просветного. Более того, мутантный эпителий, лишенный β1 integrin меняет ориентацию оси делений базальных клеток, а потомство от β b1 integrin-истощенных базальных клеток, идентифицированное по генетическим маркерам, как было установлено, обнаруживается в просветном компартменте, в противоположность тому, что наблюдается в контрольной ткани. Эти наблюдения привели к заключению, что в развивающихся протоках базальные эпителиальные клетки молочных желез делятся параллельно базальной мембране, тогда как базальные клетки, лишенные β1 integrin избегают этого правила. В этом случае ориентация плоскостей делений базальных клеток, по-видимому, случайна, так что часть потомства локализуется в просветном компартменте и дифференцируется в просветные клетки. Эти данные показывают, что взаимодействия между базальными клетками и ECM могут вносить вклад в принятие решений о судьбе клеток эпителия молочных желез.
Эксперименты по серийным трансплантациям выявили, что делеция β1 integrin из базального слоя миоэпителиальных клеток устраняет регенеративный потенциал эпителия молочных желез. Неизвестно, как взаимодействия клетка-ECM обеспечиваются с помощью β1 integrins, внося вклад в поддержание популяции стволовых клеток молочных желез, и затрагивает ли делеция β1 integrin стволовые клетки прямо или косвенно, модифицируя их жизнеспособность или способность самообновления или распределение ниш стволовых клеток. Многочисленные исследования показали, что адгезия клетка-ECM играет существенную роль в разных нишах стволовых клеток (Raymond et al., 2009).
Условная делеция рецептора laminin, a3b1 интегрина в миоэпителиальных клетках не вмешивается в целостность или функциональную дифференцировку эпителия молочных желез, но ведет к снижению скорости выделения молока из-за нарушений контрактильности миоэпителиальных клеток (Raymond et al., 2011). Это исследование показало, что в миоэпителиальных клетках молочных желез α3β1 integrin-обусловленные взаимодействия с ECM играют существенную роль в контроле активации пути FAK-Rac-PAK , участвуя тем самым в регуляции миоэпителиальными клетками реляксации после сокращения. В молочных железах лактирующих мышей в присутствии делеции α3β1 integrin мы наблюдали устойчивое фосфорилирование MLC, низкие уровни FAK активации/фосфориляции и измененный баланс Rho/Rac. Культивируемые миоэпителиальные клетки молочных желез, истощенные по α3β1 сокращаются в ответ на oxytocin, но оказываются неспособными к состоянию реляксации после сокращений. Экспрессия постоянно активного Rac или его эффектора PAK, или воздействие
MLC-kinase ингибитором восстанавливают способность к реляксации мутантных клеток, строго указывая, что α3β1-обусловленная стимуляция пути Rac/PAK необходима для ингибирования активности MLC-kinase, это позволяет миоэпителиальным клетками завершать цикл контракция/реляксация и последующую лактацию. Это исследование впервые предоставляет доказательства об участии передачи сигналов integrin в контроле контрактильной функции миоэпителиальных клеток.
Intercellular and paracrine interactions involving myo-
epithelial cells
Подобно др. эпителиальным клеткам базальные миоэпителиальные клетки молочных желез формируют соединительные комплексы, включая десмосомы и слипчивые соединения между собой и с просветными клетками. Интересно, что многочисленные молекулы межклеточной адгезии экспрессируются дифференциально в базальных и просветных клетках эпителия молочных желез. Runswick с сотр. предоставили доказателтьсва, что десмосомы играют важную роль в становлении и поддержании двухслойной организации (Runswick et al., 2001). Десмосомные cadherins, desmocolin 3 и desmoglein 3 ограничены миоэпителием. Пертурбации межклеточных взаимодействий используют эти специфичные для миоэпителия молекулы, связанные со специфичным для типа клеток позиционированием просветных и базальных эпителиальных клеток молочных желез. Cadherins являются компонентами слипчивых соединений, важными для поддержания архитектуры эпителиальных тканей. P-cadherin экспрессируется в слоях базальных клеток стратифицированного и псевдостратифицированного эпителиев. В молочных железах P-cadherin ограничивается слоем базальных клеток, включая миоэпителиальные клетки протоков и альвеол и cap клетки и терминальных концов зачатков. Дефицитные по P-cadherin мыши приводят к незапланированному лобуло-альвеолярному развитию (Radice et al., 1997). Сходные с альвеолами структуры, сходные с теми, что обнаруживаются при ранней беременности, развиваются у мутантных девственных самок, а просветные клетки обнаруживают признаки лактогенной дифференцировки. Позднее в жизни дефицитные по P-cadherin мыши обнаруживают гиперпластические и диспластические повреждения (Radice et al., 1997). Это исследование подтверждает, что делеция P-cadherin, адгезивной молекулы, экспрессирующейся в базальных клетках, затрагивает популяцию просветных клеток.
Молекулярные механизмы, которые контролируют экспрессию P-cadherin, остаются плохо изученными. Используя линии эпителиальных клеток молочных желез и мышиных мутантов из нашей лаб. мы показал, что путь передачи сигналов Wnt/β-catenin участвует в регуляции экспрессии P-cadherin независимо от транскрипционных факторов Lef/Tcf (Faraldo et al., 2007). Высокие уровни P-cadherin были обнаружены в молочных железах трансгенных мышей с конституитивной активностью передачи сигналов β-catenin в базальных миоэпителиальных клетках (Faraldo et al., 2007).
Новая информация о природе межклеточных взаимодействий в эпителии молочных желез получена в лаб. Hinck's. Эта группа впервые использовала молекулы нейрального ведения в адгезии и взаимодействии между базальными и просветными клетками. В эпителии молочных желез Netrin1, секретирует сигнальную молекулу просветными клетками, тогд как его рецептор, Neurogenin присутствует на поверхности cap и дифференцированных миоэпителиальных клеток. Мутации потери функции в генах, кодирующих Netrin1 и Neurogenin, приводят к дезорганизации зачатков терминальных концов (Srinivasan et al., 2003). Др. молекула наведения нервов Slit2 экспрессируется в обоих слоях эпителиальных клеток молочных желез, тогда как её рецептор, Robo1 ограничивается популяцией базальных клеток, cap и миоэпителиальных клеток.
Делеция Slit2 или Robo1 в эпителии молочных желез вызывает фенотип. сходный с тем, что индуцируется при пертурбациях Netrin1/Neurogenin сцепка и, отсутствие слипчивости между слоями просветных и cap клеток (Strickland et al., 2006). Более того, одновременные мутации потери функции slit2 и ntn1 генов приводят к усилению фенотипических отклонений с разделенными слоями просветных и базальных клеток в протоках молочных желез, это указывает на синергию между Slit2 и Netrin 1 во время морфогенеза протоков. Недавнее сообщение из той же лаб. указывает на участие передачи сигналов Slit/Robo1 в контроле морфогенеза ветвления молочных желез (Macias et al., 2011). Авт. предполагают, что базальные миоэпителиальные клетки контролируют образование новых веточек протоков посредством продукции митогенов для просветных клеток. Macias с сотр. установили, что TGF-β1-индуцированная экспрессия Robo1 в базальных миоэпителиальных клетках и взаимодействие Slit2 с Robo1 ингибируют передачу сигналов β-catenin, ограничивая пролиферацию базальных клеток и предупреждая образование новых веточек (Macias et al., 2011).
Др. примеры дифференциального распределения лиганда и рецептора между слоями базальных и просветных клеток, включают сигнальные пути Ephrin и Notch. Several studies подтвердили функциональную важность такого паттерна экспрессии для развития молочных желез. Рецептор ephrin, EphB4, строго экспрессируется в миоэпителиальных клетках, тогда как его лиганд , Ephrin 2, ограничивается просветными клетками. Эктопическая экспрессия EphB4 в просветном компартменте нарушает контроль пролиферации жизнеспособности в эпителии молочных желез (Andres and Ziemiecki 2003). Путь Notch преимущественно активен в компартменте просветных клеток эпителия молочных желез, а экспрессия Notch мишеней, Hey1 и Hey2 характерна для просветных предшественников (Bouras et al., 2008). Напротив, Notch лиганды Jag1 и 2 и Dlt1 экспрессируются в базальных клетках молочных желез. Т.о., непосредственные взаимодействия между базальными и соседними просветными клетками могут вносить вклад в контроль экспансии популяции просветных предшественников (Bouras et al., 2008).
В свою очередь просветные клетки также влияют на гомеостаз популяции базальных клеток. Передача сигналов Wnt существенна для пролиферации и функциональной активности стволовых клеток молочных желез, расположенных в базальном компартменте (reviewed in Incassati et al., 2010). Пока гены, кодирующие некоторые лиганды Wnt (Wnt4, Wnt5a, Wnt7b) были обнаружены, экспрессирующимися просветными клетками, экспрессия рецепторов и ко-рецепторов, ассоциирующая с передачей сигналов Wnt/β-catenin (Frizzled 1, 2, 3, 7 и 8, Lrp5 и 6), была локализована в компартменте базальных миоэпителиальных клеток, указывая на паракринные взаимодействия (Kendrick et al., 2008).
В покоящихся молочных железах девственных мышей миоэпителиальные клетки не пролиферируют. Напротив, стимуляция овариальными гормонами или в экспериментальных (инъекции гормона), или физиологических условиях (во время беременности или течки), индуцирует амплификацию базальных миоэпителиальных клеток и экспансию популяции стволовых клеток молочных желез посредством паракринных механизмов, использующих Wnt и RANK пути (Brisken and O'Malley 2010; Incassati et al., 2010; Asselin-Labat et al., 2010; Joshi et al., 2010). Wnt4 индуцируется после стимуляции эпителия молочных желез с помощью прогестерона (see references in Brisken and O'Malley 2010). Большинство гормональных рецепторов экспрессируется просветными клетками, а базальные миоэпителиальные клетки не экспрессируют ERa вовсе, но гены, ассоциированные с передачей сигналов Wnt/ β-catenin, включая мишени и рецепторы, как было установлено, активируются в популяции базальных клеток молочных желез после стимуляции инъекциями estrogen/progesterone (Joshi et al., 2010). Более того, овариальные гормоны индуцируют экспрессию RANKL в просветных клетках и экспрессию его рецептора, RANK, в просветных и особенно в базальных клетках (Asselin-Labat et al., 2010; Joshi et al., 2010).
Крупномасштабный анализ микромассивов паттернов экспрессии генов в различных популяциях эпителиальных клеток молочных желез, осуществленный на только что изолированных клетках от девственных мышей и из молочных желез женщин выявил многочисленные гены, дифференциально экспрессирующиеся в базальных и просветных клетках (Stingl et al., 2006; Kendrick et al., 2008; Lim et
al., 2010). Эти исследования предоставили важную информацию для будущих работ по выявлению молекулярных механизмов, лежащих в основе взаимодействий между двумя основными компартментами эпителия молочных желез, базальными и просветными компартментами. Данные микроанализа дополняют функциональные исследования и указывают на сигнальные пути, потенциально вовлеченные в паракринные или прямые межклеточные взаимодействия между базальными и просветными клетками и выявили несколько транскрипционных регуляторов, характеризующихся специфичным для типа клеток паттерном экспрессии.
Mammary myoepithelium and stem cells
Исследования, осуществленные на линии клеток молочных желез CommaD1b, обладающих морфогенетическим потенциалом, и с диссоциированными эпителиальными клетками молочных желез строго подтвердили, что регенеративная способность эпителия молочных желез, оцениваемая методом трансплантации, ассоциирует с компартментом базальных клеток (Deugnier et al., 2006; Shackleton et al., 2006; Stingl et al., 2006; Sleeman et al., 2007). Популяции клеток, обогащенные стволовыми клетками, могут быть выделены из только что диссоциированного эпителия молочных желез с помощью проточной цитометрии, благодаря строгой экспрессии α6 или β1 интегринов (Shackleton et al., 2006; Stingl et al., 2006). Интересно, что относительно высокие уровни экспрессии integrin характерны для всей базальной популяции клеток молочных желез, представленных в основном дифференцированными миоэпителиальными клетками, тогда как стволовые клетки, как полагают, обладают фенотипическими характеристиками, отличающимися от тех, что у дифференцированных клеток. Соответственно, популяция морфогенетических клеток, выделенная из CommaD1b линии клеток, экспрессирует базальные клеточные маркеры, такие как щелочные цитокератины, P-cadherin и DNp63, но негативны по белкам. характерным для гладких мышц (Deugnier et al., 2006).
Предполагаемые стволовые клетки молочных желез физически не отделены от дифференцированных миоэпителиальных клеток, основной клеточной популяции в базальном компартменте молочных желез. Stingl и сотр. сообщили, что активность по репопулции ассоциирована с небольшой фракцией с высокими уровнями α6 integrin, чем остальная популяция базальных миоэпителиальных клеток. Однако, сравнительный анализ транскриптома показал, что отсутствуют достоверные отличия в экспрессии генов между этими двумя субнаборами базальных клеток (Stingl et al., 2006). Специфические для гладких мышц сократительные и цитоскелетные белки присутствуют в сходных количествах в обеих популяциях. Слой миоэпителиальных клеток является гетерогенным, но недифференцированные клетки, негативные в отношении гладкомышечных маркеров, не были пока четко идентифицированы in vivo, в слое базальных эпителиальных клеток грызунов и человека
В соответствии с данными по трансплантации, экспериментами по отслеживанию клонов на мышиной репортерной линии Rosa 26 было сделано заключение, что весь эпителий молочных желез происходит из стволовых клеток и клеток предшественников, экспрессирующих базальные кератиноциты K5/K14 (Choi et al., 2009; Moumen and Faraldo, unpublished data). Однако отсутствуют экспериментальные доказательства, подтверждающие, что мультипотентные стволовые клетки локализуются в слое базальных клеток молочных желез и вносят вклад в компартмент просветных клеток во время роста протоков при половозрелости и при лобуло-альвеолярном развитии во время беременности. Эти результаты экспериментов по отлеживанию клонов согласуются с гипотезой, что мультипотентные стволовые клетки с базальными характеристиками (K5/K14-позитивные) дают базальные миоэпителиальный и просветных клеток клоны во время ранних стадий развития молочных желез и что как только образуется система разветвленных протоков, популяция базальных клеток не вносит больше вклада в слой просветных клеток.
Т.о., всё ещё неясно, существует ли популяция недифференцированных стволовых клеток в половозрелых и взрослых молочных железах. Предстоит также определить, являются ли клетки с регенеративным потенциалом, выявляемые методом трансплантаций, фенотипически отличными от окружающих дифференцированных миоэпителиальных или, по крайней мере, некоторые из миоэпителиальных клеток могут дедифференцироваться и приобретать свойства стволовых клеток после трансплантации.
Хотя дифференцированные миоэпителиальные клетки от взрослых животных могут быть лишены активности стволовых клеток, они очень возможно вносят вклад в ниши стволовых клеток молочных желез, продуцируя необходимые ростовые факторы или компоненты ECM components. Недавний анализ паттернов генной экспрессии в базальных и просветных популяциях клеток, выделенных из эпителия молочных желез человека и мыши подтвердил, что базальные клетки экспрессируют многочисленные ECM белки в больших количествах, включая большинство составляющих базальной мембраны молочных желез, таких как laminins, collagens, fibronectin, heparan sulphate proteoglycans и SPARC (Kendrick et al., 2008; Lim et al., 2010).
Contribution of myoepithelial cells to mammary tumorigenesis
Миоэпителиомы молочных желез редкие злокачественные опухоли, как полагают, возникающие из миоэпителиальных клеток. Эти опухоли характеризуются высоким уровнем экспрессии маркеров базальныъ эпителиальных клеток, в некоторых случаях, экспрессией белков, специфичных для гладких мышц (Buza et al., 2010 and references therein). Крупномасштабный анализ генной экспрессии карцином груди женщин привел к открытию субнабора опухолей, характеризующихся экспрессией маркеров базальных эпителиальных клеток, отсутствием ER- и PR-позитивных клеток и отсутствием избыточной экспрессии HER2. Эти опухоли обычно относят к базальному типу или трижды негативному типу (reviewed in Gusterson 2009; Foulkes et al., 2011). Эти опухоли первоначально считались как происходящие из стволовых клеток и клеток предшественников. Однако недавние исследования предоставили доказательства, которые, по крайней мере, частично противоречат этой гипотезе. Наследственные карциномы молочных желез, ассоциированные с мутацией гена brca1, относятся к базальному субтипу. Было продемонстрировано, что просветные предшественники амплифицируются в эпителии молочных желез носителей мутации brca1, указывая, что эта популяция клеток может быть источником базального типа BRCA1 карцином молочных желез (Lim et al., 2009).
Интересно, что популяция базальных клеток заметно увеличивается в эпителии молочных желез таких индивидов (Lim et al., 2009). Далее, эксперименты с использованием мышиных моделей канцерогенеза молочных желез продемонстрировали, что делеция гена brca1 из слоя просветных клеток эпителия молочных желез мышей, гетерозиготных по p53, ведет к развитию опухолей, фенотипически сходных с BRCA1-ассоциированными карциномами человека (Molyneux et al., 2010). Делеция brca1 из слоя базальных миоэпителиальных клеток ведет к развитию adenomyoepitheliomas и сквамозных метапластических карцином. Хотя опухоли, развивающиеся после нарушения экспрессии гена brca1 в слое базальных клеток, были базального субтипа, исходя из их транскрипционных профилей, их гистологические характеристики отличались от BRCA1 опухолей человека (Molyneux et al., 2010). Наконец, исследования из лаб. Kuperwasser показали, что репрессор транскрипции Slug накапливается в BRCA1-ассоциированных раках груди и может быть ответственным за базальные фенотипические характеристики опухолевых клеток (Proia et al., 2010).
Сигнальный путь Wnt/β-catenin активируется в базального типа карциномах молочных желез (Khramtsov et al., 2010). Мы исследовали роль этого пути в развитии молочных желез и туморогенезе путем генерации трансгенных мышей, экспрессирующих в слое базальных эпителиальных клеток "активированный" (N-терминально укороченный и тем самым стабилизированный) β-catenin под контролем K5-промотора (трансгенная линия K5-DNbcat). K5-DNbcat мыши имели аномальный фенотип молочных желез, включая преждевременные ответвления боковых веточек при беременности, ассоциированные с увеличением пролиферации и снижением апоптоза просветных эпителиальных клеток и ускоренной постлактационной инволюцией (Faraldo et al., 2005). В возрасте от 12
до 16 мес. 75% K5-DNbcat нерожавших самок обнаруживали гиперплазию молочных желез, содержащих K5-позитивные (базальные) клетки, негативные по маркерам просветных и миоэпителиальных клеток. Большинство нерожавших K5-DNbcat мышей обнаруживали инвазивные карциномы молочных желез, состоящие исключительно из недиффернцированных базальных эпителиальных клеток или обнаруживающие признаки дифференцировки в направлении эпидермального клона (Faraldo et al., 2005). Предполагается, что активация передачи сигналов β-catenin в базальных эпителиальных клетках молочных желез вызывает амплификацию базального типа предшественников и что базального типа стволовые клетки и клетки предшественников могут вносить вклад в развитие субнабора базального типа карцином молочных желез, метапластические повреждения, характеризующиеся экспрессией маркеров эпидермального клона.
Conclusions and perspectives
Myoepithelial cells are no longer considered to be a second-class mammary cell population of almost no interest. In addition to its contractile function, which is essential for lactation, the basal cell layer harbors the regenerative potential of the mammary epithelium. Basal myoepithelial cells modulate the proliferation and differentiation of luminal cells, and affect the surrounding stroma. Various aspects of myoepithelial cell biology therefore merit further investigation.
Recent studies have shed light on the nature of the reciprocal paracrine and adhesion-mediated regulatory signals between the basal and luminal compartments of the mammary epithelium. However, our knowledge of these complex interactions is still limited, and detailed descriptions and analysis of the basal-luminal cell crosstalk are required to define the roles played by the myoepithelial cells in normal development and tumorigenesis. Several of the studies discussed above suggested that triple-negative breast tumors might originate from luminal progenitors (Lim et al., 2009; Molyneux et al., 2010; Proia et al., 2010). However, some of the signals essential for the maintenance of this cell population are thought to be provided by basal cells (Bouras et al., 2008) implying that the question of the contribution of the mammary basal cell compartment to tumorigenesis is still open.
A particularly important subject for further studies is to define the effects of the myoepithelium on the stroma during development and in disease. One aspect of the myoepithelium-stroma crosstalk yet to be unraveled is the contribution of the mammary myoepithelial cells to the establishment of the vascular network in the connective tissue surrounding the epithelium. As discussed elsewhere (Barsky and Karlin 2006), myoepithelial cells are considered to exhibit the anti-angiogenetic properties, however, they express VEGFa, and its deletion from the basal cell layer significantly attenuated the angiogenesis accompanying mammary development (Rossiter et al., 2007).
Another intriguing issue is the relationships between myoepithelial and stem/progenitor cells. It is not known yet whether upon transplantation, rare undifferentiated cells possessing stem cell properties give rise to mammary epithelial outgrowths, or, alternatively, all or a subset of myoepithelial cells can dedifferentiate and acquire the repopulating potential. We therefore believe that the phenotypic heterogeneity of the basal myoepithelial cell population in quiescent and hormone-stimulated glands, and control of the smooth muscle differentiation program in the myoepithelium merit further investigation.
|
Сайт создан в системе
uCoz Fig. 1. Morphology of ductal and alveolar myoepithelial cells. Double
immunofluorescence labelling of sections through 10-week-old virgin
(A) and 2-day-lactating (B) mouse mammary glands with the antibodies
against cytokeratin 5 (K5, green) and CD31 (red). Arrows indicate elongated
ductal (A) and stellate-shaped alveolar (B) myoepithelial cells. CD31 reveals
capillaries. Bar, 10 mm.
Fig. 1. Morphology of ductal and alveolar myoepithelial cells. Double
immunofluorescence labelling of sections through 10-week-old virgin
(A) and 2-day-lactating (B) mouse mammary glands with the antibodies
against cytokeratin 5 (K5, green) and CD31 (red). Arrows indicate elongated
ductal (A) and stellate-shaped alveolar (B) myoepithelial cells. CD31 reveals
capillaries. Bar, 10 mm. 