Посещений:  МЕЙОЗ В ЗАРОДЫШЕВЫХ КЛЕТКАХ
МЕЙОЗ В ЗАРОДЫШЕВЫХ КЛЕТКАХ
Регуляция
|
|
Regulation of germ cell meiosis in the fetal ovary
CASSY M. SPILLER, JOSEPHINE BOWLES and PETER KOOPMAN
 Int. J. Dev. Biol. 56: 779-787 (2012)
doi: 10.1387/ijdb.120142pk
|
Fertility depends on correct regulation of meiosis, the special form of cell division that gives rise to haploid gametes. In female mammals, germ cells enter meiosis during fetal ovarian development, while germ cells in males avoid entering meiosis until puberty. Decades of research have shown that meiotic entry, and germ cell sex determination, are not initiated intrinsically within the germ cells. Instead, meiosis is induced by signals produced by the surrounding somatic cells. More recently, retinoic acid (RA), the active derivative of vitamin A, has been implicated in meiotic induction during fetal XX and postnatal XY germ cell development. Evidence for an intricate system of RA synthesis and degradation in the fetal ovary and testis has emerged, explaining past observations of infertility in vitamin A-deficient rodents. Here we review how meiosis is triggered in fetal ovarian germ cells, paying special attention to the role of RA in this process.
|
Жизнь млекопитающих начинается с объединения двух клеток, спермия и ооцита, возникновение и созревание которых тщательно контролируется в ходе плодной и репродуктивной жизни. У эмбрионов спецификация и миграция зародышевых клеток в формирующиеся гонады одинаковы у самцов и самок. Когда примордиальные гонады начинают дифференцироваться в яичники или семенники, то пути развития зародышевых клеток расходятся, приводя или к оогенезу у самок или сперматогенезу у самцов. Во вновь специфицированных яичниках зародышевые клетки вступают в первую фазу мейоза-специальную форму клеточного деления, уникальную для зародышевых клеток, которые позволяет им продуцировать гаплоидные клетки, необходимые для полового воспроизведения.
В яичниках плодов вступление в мейоз является первым указанием на то, что зародышевые клетки начинают оогенез (McLaren 1984). Во вновь специфицированных семенниках зародышевые клетки вступают в период миотического молчания и остаются в таком состоянии вплоть до полового созревания, когда и начинается мейоз (Hilscher 1974).
Безусловно половая дифференцировка представляет собой критическую развилку на пути развития зародышевых клеток и важна для понимания того, как выбирается правильный путь. Несколько неожиданно, что внутренне присущее содержание половых хромосом в зародышевых клетках (XX или XY) не принимает участия в этом решении, вместо этого зародышевые клетки инструктируются молекулярными сигналами от окружения семенников или яичников (Evans et al., 1977; Ford et al., 1975; Palmer and Burgoyne 1991). В последнюю декаду открыта природа некоторых из этих сигналов.
Generating germ cells: a brief history
Зародышевые клетки возникают из первичной полоски внеэмбриональной эктодермы на 6.25 days post coitum (dpc) у эмбрионов мышей (Lawson 1999; Ying et al., 2000; Ying and Zhao 2001). В это время, bone morphogenetic protein (BMP) сигнальные факторы BMP2 и BMP4 испускаются внеэмбриональной эктодермой и висцеральной энтодермой, чтобы индуцировать маркеры зародышевых клеток внутри когорты приблизительно в 40 клеток на ст. 7.25 dpc (Ohinata et al., 2005;
Saitou et al., 2002). Соотв., потеря передачи сигналов BMP ведет к уменьшению популяции зародышевых клеток основателей (Ying et al., 2000). В соответствии с плюрипотентной природой популяции зародышевых клеток их транскрипционный профиль характеризуется экспрессией генов плюрипотентности, включая Oct3/4 и Sox2 (Ohinata et al., 2005; Scholer et al., 1990; Yabuta et al., 2006), а репрессией соматических маркерных генов под влиянием BLIMP1 (Hayashi et al., 2007; Ohinata et al., 2005). Подробнее см. в обзоре (Saitou 2009). По ходу развития зародышевые клетки пролиферируют и мигрируют из эктодермы и собственно в эмбрион. Здесь они становятся подвижными в ответ на направляющие сигналы, испускаемые из окружающих соматических клеток, включая происходящий из стромы фактор 1. Это изменение в подвижности коррелирует с морфологическими изменениями зародышевых клеток, такими как поляризация и выпускание цитоплазматических выпячиваний (Anderson et al., 2000). С 8.5 - 10.5 dpc зародышевые клетки мигрируют кпереди через заднюю кишку в направлении вновь формируемых генитальных гребней (Lawson and Hage 1994; Molyneaux et al., 2001); обзор (Richardson and Lehmann 2010). Оказавшись в генитальном гребне теряется подвижность и поляризация зародышевых клеток, они становятся крупными округлым с характерными ядрышками и окружены кольцеобразным цитозолем (Baillie 1964; Donovan et al., 1986).
Изменения в архитектуре хроматина также происходят после вступления в генитальный гребень; в зародышевых клетках стирается всё метилирование генома (Hajkova et al., 2002; Sato et al., 2003; Szabo et al., 2002) и теряются репрессивные гистоновые модификации (Hajkova et al., 2008; Seki et al., 2005). Инактивированная до этого Х хромосома в XX зародышевых клетках также реактивируется (Monk and McLaren 1981; Tam et al., 1994).
Cross-roads: oogenesis or spermatogenesis?
Достигнув генитального гребня, окружающие их соматические клетки становятся ответственными за питание клона зародышевых клеток во время всех последующих стадий развития. Помимо поддержания жизнеспособности зародышевых клеток, наиболее критическая роль соматических клеток заключается в выборе зародышевыми клетками оогенеза или сперматогенеза. Во время спецификации, миграции и колонизации генитального гребня поведение XX и XY зародышевые клетки идентичны; только когда происходит половая дифференцировка гонадных соматических клеток зародышевые клетки выбирают мужскую или женскую половую судьбу (McLaren and Southee 1997). В XY генитальном гребне экспрессия гена Sry с 10.5 dpc в предшественниках поддерживающих клетках запускает дифференцировку клеток Сертоли и последующий каскад развития семенников (Koopman et al., 1991). Зародышевые клетки в среде семенников плодов оказываются заключены внутри развивающихся тяжей семенников и направляются к вступлению в G1/G0 фазу митоза с 12.5 dpc, это, по-видимому, маркирует их детерминацию к сперматогенезу (Hilscher 1974). У самцов зародышевые клетки инициируют мейоз постнатально. В XX генитальном гребне в отсутствие Sry, возникает экспрессия Rspo1, Wnt4 и Foxl2 в предшественниках поддерживающих клеток и запускает развитие оварий (rev. (Liu et al., 2010)).
Зародышевые клетки в овариях плодов обнаруживаются вступающими в первую фазу мейоза со ст. 12.5 - 13.5 dpc, это безусловно маркирует их детерминацию к оогенезу (McLaren and Southee 1997).
Meiosis: mechanics and markers
Мейоз состоит из двух раундов клеточных делений, сначала (Meiosis I)
и второй (Meiosis II) без репликации ДНК. Имея множество сходств с митозами
каждое деление прерывается на стадии профазы, анафазы и телофазы. Определяющим свойством мейоза во время профазы I это наблюдаемый кроссинговер хромосом (между материнской и отцовской путем образования разрывов двойной нити, в результате происходит обмен генетической информацией. Кроссинговер нуждается в специализированном клеточном каркасе, наз. синаптонемальным комплексом (SC), который формируется вдоль каждой сестринской хроматиды, связывая их вместе (синапсис), чтобы облегчать генетический обмен.
Поскольку SC уникален для мейоза, то белки, которые составляют эту структуру, пригодны для распознавания начала мейоза, в частности, synaptonemal complex protein 3 (SYCP3) и 1 (SYCP1) , которые образуют часть латерального элемента SC (распространяющегося вдоль длины хромосомы) и центральный элемент, соотв. (Dobson et al., 1994; Heyting et al., 1988; Klink et al., 1997). Др. маркеры включают факторы, участвующие в образовании разрывов и репарации двойной нити: SPOII (Spo11 мейотический белок ковалентно соединяющийся с DSB гомолог [S. cerevisiae]), gH2AX (H2A семейства гистонов член X), Rad51 (Rad51 гомолог [S. cerevisiae]) и DMC1 (супрессор дозы, гомолог mck1, meiosis-specific homologous recombination) (Keeney et al., 1997; Pittman et al., 1998; Yoshida et al., 1998). Эти белки помимо структуры и гомологии хромосом рассматриваются как реальные признаки вступления в мейоз, тогда как экспрессия гена Sycp3 считается маркером зародышевых клеток, готовых к мейозу скорее, чем вступления в мейоз (Novak et al., 2006).
Entry into meiosis: a role for retinoic acid
Многие годы оставалось неясным являются ли зародышевые клетки от природы запрограммированы вступать в мейоз или они отвечают на сигналы от окружающих соматических клеток. Доказательства клеточной автономности мейоза обнаруживаются в некоторых экспериментальных ситуациях: когда зародышевые клетки мигрируют в эктопические места, такие как надпочечники или мезонефросы, где они лишены тестикулярной или овариальной ниши, то некоторые зародышевые клетки вступают в мейоз (McLaren 1983; Upadhyay and Zamboni 1982; Zamboni and Upadhyay 1983). Сходным образом, когда зародышевые клетки культивируются совместно в др. тканями, такими как эмбриональные легочные клетки, то также наблюдалось вступление в мейоз (McLaren and Southee 1997). Эти находки подтверждают, что вступление в мейоз является внутренне присущим для развивающихся зародышевых клеток скорее, чем результат соматических сигналов (Donovan et al., 1986).
В противоположность этим работам, при разных наборах экспериментальных условий становится ясно, что зародышевые клетки подталкиваются к вступлению в мейоз некоторыми экзогенными факторами. Совместное культивирование тестикулярной и овариальной тканей выявляет способность соматических клеток яичников индуцировать мейоз XY зародышевых клеток (Byskov and Saxen 1976). Далее было установлено, что мезонефросы и особенно тубулярная сеть, которая образует сеть в яичниках и семенниках, являются источником сигналов, индуцирующих мейоз, поскольку в их отсутствии мейоз не происходит (Byskov 1974; Byskov and Saxen 1976). Теперь мы знаем, что фактор, продуцируемый мезонефросами это ретиноевая кислота (RA); RA продуцируется также многими тканями вне гонад (включая легкие и надпочечники), предположительно это объясняет, поему эктопические зародышевые клетки вступают в мейоз в этих местах.
Fine-tuning retinoid levels: synthesis vs. degradation
Ретиноевая кислота, происходящая из retinol (витамина A), является липофильной молекулой, синтезируемой во многих тканях. Имеются две ступени синтеза RA: во-первых, ретинол обратимо превращается в retinal с помощью энзима семейства алкоголь дегидрогеназы и короткоцепочечной dehydrogenase/reductase. Во-вторых, в присутствии retinal dehydrogenase (RALDH) , retinal необратимо окисляется в RA. RA является активным метаболитом передачи ретиноидных сигналов и лигандом для ядерных рецепторов, которые контролируют транскрипцию генов. Рецепторы ретиноевой кислоты (RARs) образуют гетеродимеры с retinoid-X receptors (RXRs); в отсутствие RA комплекс RAR/RXR соединяется с retinoic acid response elements (RAREs), обнаруживаемыми в промоторах генов, а рекрутирование корепрессоров вызывает репрессию транскрипции. Корепрессорные комплексы часто представлены nuclear receptor co-repressor (NCOR2) и histone deacetylases (HDACs). Соединение RA с RAR/RXR комплексом меняет домен связывания лиганда в RAR так, что рекрутируются коактиваторы, включая nuclear receptor co-activator (NCOA), CREB binding protein (CBP) и p300 и это способствует транскрипции (rev. (Niederreither and Dolle 2008)). Идентифицировано более 500 генов, которые реагируют на RA, считается, что, скорее всего, большинство из них являются вторичными мишенями (Balmer and Blomhoff 2002). RA способна к разложению с помощью энзимов семейства cytochrome P450, которые превращают RA первоначально в метаболиты, включая 4-oxo-RA, 4-OH-RA и 18-OH-RA. В P450 семействе имеются три CYP26 изоформы: CYP26A1, B1 и C1, которые обладают лишь 42-51% aa гомологичными последовательностями (Taimi et al., 2004; White et al., 2000a). Предпочтительным субстратом для CYP26A1 и B1 является all-trans-RA, тогда как CYP26C1 предпочитает 9-cis-RA. CYP26A1 обладает наивысшей каталитической активностью, а CYP26B1 наивысшим сродством к all-trans-RA, соотв. (Topletz et al., 2012). Имеются противоречивые сообщения относительно того, являются ли метаболиты, продуцируемые во время окисления RA биологически активными; некоторые окислительные метаболиты in vitro, как было установлено, способны связывать RARs и обладают фармакологической активностью (Idres et al., 2002). Далее, дифференцировка и пролиферация стимулируются некоторыми метаболитами в сперматогониях у мышей, дефицитных по витамину A (Gaemers et al., 1996) и эпителиальная дифференцировка клеток кишечника in vivo (McCormick et al., 1978). В противоположность этим взрослым тканям, очевидно, что оксидативные метаболиты RA не нужны для эмбрионального развития мышей; генетическое устранение гена, кодирующего RA-продуцирующий энзим RALDH2, устраняет эффекты потери функции Cyp26a1 у мышей (Niederreither et al., 2002).
Количества RA, которые воздействуют на определенные клетки или ткани, тонко регулируются, будучи контролируемыми на множественных уровнях (rev. (Niederreither and Dolle 2008; Pennimpede et al., 2010)). Во-первых, доступность retinol во время эмбрионального развития зависит от материнской диеты. Во-вторых, RA-продуцирующие энзимы превращают retinol в all-trans-RA с разной эффективностью; поэтому концентрация RA предопределяется какую retinal dehydrogenase (RALDH1, 2 или 3) экспрессируется определенная ткань. В-третьих, RA-деградирующие энзимы деградируют RA в полярные метаболиты с разной эффективностью; следовательно, концентрация RA зависит от того, какой энзим деградации (CYP26A1, B1, C1) экспрессируется в ткани. В-четвертых, ядерные рецепторы для RA (RARs a,b,g; RXRs) каждый обладает разной чувствительностью как к RA , так и их кофакторам (как к репрессорам, так и активаторам); это предопределяет чувствительность клеток в присутствии или отсутствии RA. Кроме того, каждый RAR обнаруживает тканеспецифическую экспрессию, это делает возможной ещё более тонкую настройку внутриклеточных реакций на RA.
Is retinoic acid necessary for meiosis?
Ещё до выявления пути метаболизма RA в 1960s (Dowling and Wald 1960), vitamin A deficiency (VAD) у крыс подчеркивал важность этого пищевого компонента для репродукции как самцов, так и самок (Evans 1928; Wolbach and Howe 1925). Позднее было установлено, что добавление с пищей VAD крысам или витамина А или RA устраняло блок мейоза и восстанавливало плодовитость самцов (Morales and Griswold 1987; Van Pelt and De Rooij 1990). Исследования VAD самок крыс показало, что прием 40- 230 mcg/rat/day RA достаточен для овуляции, оплодотворения, имплантации и последующего развития эмбриона: наивысшие дозы, необходимы, начиная с середины беременности (Kaiser et al., 2003; See et al., 2008; White et al., 2000b; White et al., 1998). Эти исследования выявили важную роль RA для многих аспектов развития (Clagett-Dame and Knutson 2011).
В отношении развития зародышевых клеток плода RA впервые была описана в этой системе, как фактор, способствующих жизнеспособности и пролиферации в культуре зародышевых клеток in vitro на ст. 8.5, 11.5 и 13.5 (Koshimizu et al., 1995; Morita and Tilly 1999) , а зародышевые клетки самок, как было установлено, экспрессируют RARs на ст. 13.5 dpc (Morita and Tilly 1999). В яичниках крыс RA и RARa агонист были найдены, как ускоряющие прохождение зародышевых клеток через мейоз (Livera et al., 2000). Позднее скрининг экспрессии в целых гонадах выявил специфичную для самцов экспрессию RA-деградирующего энзима Cyp26b1 (Bowles et al., 2006; Menke and Page 2002) и специфичную для самок экспрессию чувствительного к RA гена Stra8 (Bowles et al., 2006; Menke et al., 2003). Эти наблюдения представили первые указания, что уровни RA могут выступать как инструктивные сигналы для зародышевых клеток самок. Стимулируемый с помощью ретиноевой кислоты ген Stra8, как указывает его название, впервые был идентифицирован как непосредственно ранний, чувствительные к RA ген из P19 клеток эмбриональной карциномы (EC): RA индуцирует экспрессию Stra8 в этих клетках самое малое через 2 ч (Bouillet et al., 1995; Oulad-Abdelghani et al., 1996). Были идентифицированы два предполагаемые RAREs в промоторе Stra8 , а мутационный анализ подтвердил необходимость его RA индуцированной экспрессии в F9 клетках (Wang and Tilly 2010). Поскольку структура и точная функция STRA8 остается неизвестной, его экспрессия ограничивается премейотическими зародышевыми клетками (во время оогенеза и сперматогенеза) и после стимуляции с помощью RA, эмбриональными стволовыми (ES) клетками и EC клеточными линиями P19 и F9 (Bouillet et al., 1995; Oulad-Abdelghani et al., 1996). Важно, что при использование генетической делеции у мышей было показано, что Stra8 важен для инициации в зародышевых клетках мейоза у обоих полов (Anderson et al., 2008; Baltus et al., 2006); в его отсутствии зародышевые клетки неспособны подвергаться премейотической репликации ДНК и последующей конденсации, когезии, синапсу и рекомбинации мейотических хромосом. Как уже упоминалось экспрессия Stra8 в зародышевых клетках самок, вместе с экспрессией Cyp26b1 в семенниках подтверждает механизм регуляции мейоза в развивающихся гонадах: RA присутствует в овариях плода, чтобы индуцировать Stra8 (и инициировать мейоз) и этот сигнал д. активно деградировать в семенниках (чтобы избежать мейоза) (Fig. 1). Это мнение затем проверялось во многих ex vivo культуральных экспериментах, а также на генетических моделях. Обработка семенников плода или изолированных XY зародышевых клеток экзогенной RA, RAR агонистами (BMS-194753, BMS-213309, BMS-270394) или CYP26B1 ингибиторами (ketoconazole, R115866) индуцировала экспрессию многих премейотических и мейотических маркеров в XY зародышевых клетках, включая Stra8, Sycp3, Dmc1 и gH2AX (Bowles et al., 2010; Bowles et al., 2006; Koubova et al., 2006; MacLean et al., 2007; Naillat et al., 2010; Trautmann et al., 2008). Важно, что в культурах эксплантов фармакологическое ингибирование как CYP26B1 (для увеличения уровней RA), так и RARs (BMS204493, AGN193109; чтобы предупредить клетки от реакции на RA) не вызывало увеличения экспрессии Stra8 (Koubova et al., 2006), указывая тем самым, что CYP26b1 д. функционировать, чтобы деградировать RA в этой системе. Напротив, в гонадах XX добавление RAR антагонистов супрессирует экспрессию Stra8 относительно контрольного дикого типа (Bowles et al., 2006; Koubova et al., 2006), как делает это ингибирование RALDH в яичниках мышей и человека при использовании citral (Bowles et al., 2006; Le Bouffant et al., 2010).
В моделях in vivo, в которых сигнальный каскад RA прерывается на разных уровнях, установлена роль передачи сигналов ретиноидов в мейозе зародышевых клеток. Потеря Cyp26b1 у мышей ведет к трехкратному увеличению уровней RA в семенниках плодов; в дальнейшем XY зародышевые клетки экспрессируют маркеры мейоза (Stra8, Scp3, SpoII, Dmc1, gH2AX) и некоторые проходят пахитену мейоза I на ст. 16.5 dpc (Bowles et al., 2010; Bowles et al., 2006; MacLean et al., 2007). Интересно, что XX зародышевые клетки Cyp26b1 -/- яичников также экспрессируют высокие уровни Stra8 по сравнению с зародышевыми клетками дикого типа (Bowles et al., 2010). Эта находка, скорее всего, объясняется наблюдением, что перед его увеличением в семенниках на ст. 12.5 dpc, Cyp26b1 экспрессируется на низких уровнях как в XX, так и XY гонадах на ст. 11.5 dpc. Cyp26b1 экспрессия в это время д. преимущественно гарантировать, что зародышевые клетки, прибывающие в генитальный гребень, не будут подвергнуты непосредственно воздействию RA. При нокауте Cyp26b1 воздействие RA на этой ранней стадии, как было установлено, индуцирует преждевременное вступление в мейоз (Bowles et al., 2010). Поскольку эксперименты с использованием Cyp26b нокаутных модельных мышей подтверждают, что XY зародышевые клетки способны реагировать на RA (точно также как XX зародышевые клетки) в этой искусственной ситуации, более прямые доказательства инструктивной роли RA's во время естественного мейоза XX зародышевых клеток получены
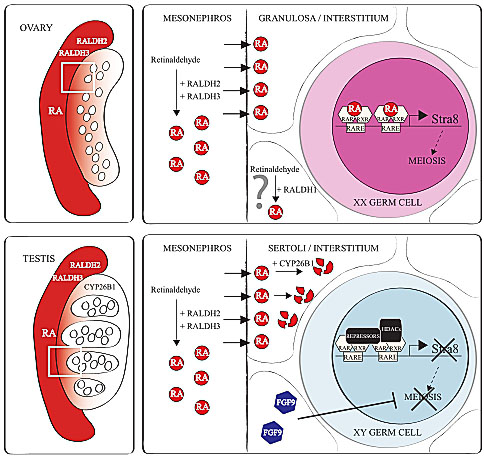 Fig. 1. Regulation of germ cell meiosis by retinoic acid. The mesonephros attached to the
ovary or the testis expresses the retinoic acid (RA) synthesizing enzymes RALDH2 and RALDH3, resulting in the production of high levels of RA. RA produced in the mesonephros diffuses into the ovary where it acts directly on germ cells. RA binds RAR/RXRs on both identified RAREs of the Stra8 promoter to induce transcription. Meiosis then progresses in ovarian germ cells. The granulosa and interstitial cells express RALDH1 at low levels, perhaps also contributing to the local production of RA within the ovary. In the testis, Sertoli and interstitial cells express the RA-degrading enzyme CYP26B1, preventing RA from stimulating Stra8 transcription and subsequent meiosis in testicular germ cells. In the absence of RA, repressor co-factors including HDACs bind the RAREs of the Stra8 promoter to repress transcription. Additionally, FGF9 produced by
the Sertoli cells acts directly on testicular germ cells to inhibit meiosis.
Fig. 1. Regulation of germ cell meiosis by retinoic acid. The mesonephros attached to the
ovary or the testis expresses the retinoic acid (RA) synthesizing enzymes RALDH2 and RALDH3, resulting in the production of high levels of RA. RA produced in the mesonephros diffuses into the ovary where it acts directly on germ cells. RA binds RAR/RXRs on both identified RAREs of the Stra8 promoter to induce transcription. Meiosis then progresses in ovarian germ cells. The granulosa and interstitial cells express RALDH1 at low levels, perhaps also contributing to the local production of RA within the ovary. In the testis, Sertoli and interstitial cells express the RA-degrading enzyme CYP26B1, preventing RA from stimulating Stra8 transcription and subsequent meiosis in testicular germ cells. In the absence of RA, repressor co-factors including HDACs bind the RAREs of the Stra8 promoter to repress transcription. Additionally, FGF9 produced by
the Sertoli cells acts directly on testicular germ cells to inhibit meiosis.
при анализе развития VAD яичников. У эмбрионов крыс с высоким дефицитом витамина A (матерям скармливали 1.5mg all-trans RA на грамм диеты) большинство XX зародышевых клеток оставались недифференцированными и не экспрессировали Stra8 и не вступали в мейоз (Li and Clagett-Dame 2009). Этот эффект зависит от дозы: количество мейотических зародышевых клеток снижалось у эмбрионов с легкой степенью VAD (fed 12mg all-trans RA per gram of diet) по сравнению с контролем (30% по сравнению 75%), и точно таким же был уровень экспрессии Stra8 в этих яичниках (Li and Clagett-Dame 2009). В этом исследовании количество зародышевых клеток оставалось неизменным между VAD и контрольными яичниками, демонстрируя, что прием с пищей витамина A позитивно скоррелирован со вступлением в мейоз плодных XX зародышевых клеток у грызунов. Отметим, что индукция мейоза с помощью RA, по-видимому, не ограничена развитием яичников у плодов грызунов. Недавно экспрессия RA синтеза энзимов (RALDH1, 2 and 3) вместе с экспрессией RAR была обнаружена в яичниках плодов человека (Childs et al., 2011; Le Bouffant et al., 2010). Используя систему культивирования органов плода человека, было обнаружено, что RALDH1 экспрессируется на наивысших уровнях во время инициации мейоза и его ингибирование с помощью citral снижает количество мейотических зародышевых клеток. Напротив, добавление экзогенной RA к этой системе увеличивает количество мейотических зародышевых клеток по сравнению с контролем (Childs et al., 2011). Метаболизм RA был также изучен у кур: у них RALDH2, по-видимому, преобладающий RA синтезирующий энзим, который запускает экспрессию Stra8 перед вступлением в мейоз (Nekrasova et al., 2011; Smith et al., 2008; Yu et al., 2012). Культивирование яичников и семенников видов амфибий, Pleurodeles waltl, с RA также подчеркивает консервативную роль RA-зависимого мейоза у позвоночных (Wallacides et al., 2009).
В отличие от ситуации в развивающихся овариях тестикулярные зародышевые клетки инициируют мейоз непосредственно перед половым созреванием, которое у грызунов происходит на 1-2 неделе постнатального развития. У VAD мышей модуляция передачи сигналов RA как зародышевыми клетками, так и поддерживающими клетками Сертоли, как было установлено, ответственна за синхронные циклы дифференцировки зародышевых клеток (Sugimoto et al., 2012). Данные о том, используют ли семенники человека или семенники др. позвоночных сходным образом регуляцию RA для этой цели, на сегодня отсутствуют (Hogarth et al., 2011).
Where does the retinoic acid come from?
Поскольку инициальный сигнал, который RA использует в мейозе зародышевых клеток, это овариальная экспрессия Stra8 и тестикулярная экспрессия Cyp2b1, то сформирована более общая картина, согласно которой клетки в развивающихся гонадах отвечают на RA и как, когда и где она деградирует. Но что является источником RA? Как упоминалось, очень ранние работы установили, что мезонефросы необходимы для индукции мейоза в XX зародышевых клетках (Byskov 1974; Byskov and Saxen 1976); эта способность безусловно не ограничивается XX мезонефросами, поскольку мезонефросы обоих полов могут в равной степени индуцировать мейоз у XY зародышевых клеток (Byskov and Saxen 1976; O and Baker 1976). Неудивительно тогда установить, что Raldh2 экспрессируется на высоких уровнях в мезонефрических протоках и канальцах, которые физически соединены с передним концом гонад обоих полов (Bowles et al., 2006; Byskov 1974). Raldh3 был также обнаружен в мезонефросах на ст. 10.5 dpc (Zhao et al., 2009). Используя два трансгенных подхода, при которых экспрессия LacZ управляется с помощью RARβ промотора, чтобы обеспечить считывание продукции RA в F9 RARE репортерных клетках (Wagner et al., 1992) и RARE-lacZ мышиной линии (Rossant et
al., 1991), то мезонефрические клетки запускали сильную реакцию β-galactosidase в обеих моделях, демонстрируя, что высокие уровни RA способны продуцироваться из этой ткани (Bowles et al., 2006). Следовательно, можно предположить, что мезонефросы являются источником RA, которая проникает в соседние гонады у обоих полов, чтобы индуцировать мейоз в XX зародышевых клетках, но деградирует в семенниках, экспрессирующих Cyp26b1
(Bowles et al., 2006)(Fig. 1). Недавнее исследование 11.5 dpc яичников, культивируемых без мезонефросов обнаруживало некоторое количество XX зародышевых клеток. вступающих в мейоз, тогда как присутствие мезонефросов и/или RA ускоряет мейотическую прогрессию (Guerquin et al., 2010). Это довольно неожиданно с точки зрения независимых исследований, которые подтверждают необходимость мезонефросов (Kumar et al., 2011); вообще-то отличающиеся культуральные условия, включая среду и сыворотку и время этих исследований могут объяснить расхождения. Кроме того, поскольку яичники сами по себе экспрессируют,
Raldh1 (Bowles et al., 2009), тем не мене низкие уровни возможны так что присутствие достаточных количеств RA в этой культуральной системе позволяет некоторым зародышевым клеткам вступать в мейоз. RALDH1, как известно, наименее эффективен в генерации all-trans RA и был идентифицирован в местах, где низкие уровни RA необходимы для морфогенеза (Haselbeck et al., 1999). Как показано на Fig. 1, экспрессия RALDH1 в яичниках может стать др. источником RA в нормальных условиях, как, по-видимому, это имеет место в яичниках женщин (Childs et al., 2011).
How much retinoic acid?
Локальная концентрация RA не была измерена для гонад или мезонефросов, но концентрации в др. сайтах на ст. 13.5 dpc мышиных эмбрионов описаны между 10-40nM (Horton and Maden 1995). Т.к. экзогенная RA первоначально применялась в индукции мейоза зародышевых клеток в органной культуре с использованием более высоких концентраций (0.7-1mM; (Bowles et al., 2006; Koubova et al., 2006), более недавние исследования продемонстрировали, что значительно более низкие уровни (уровня 1nM) достаточны для не только активации Stra8, но и также для индукции функционального мейоза (Bowles et al., 2010; Chen et al., 2012; Ohta et al., 2010; Zhou et al., 2008). Далее in vitro высокие дозы RA являются вредными для жизнеспособности зародышевых клеток семенников и яичников (Best and Adams 2009). Следовательно, скорее всего, что очень низкие уровни эндогенной RA достаточны для индукции мейоза в ситуации in vivo.
Challenging the retinoic acid theory
Недавно исследование Kumar et al., 2011, изучавшее мейотическую индукцию в отсутствие Raldh2 и Raldh3 выдвинуло теорию, что мейотическая индукция зависит от RA. Три вывода вытекают из этого исследования: Во-первых, в отсутствие RA-продуцирующих энзимов RALDH2 и RALDH3, экспрессия Stra8 обнаруживается в овариях плодов на ст. 13.5 dpc, это привело авт. к заключению, что RA не обязательна для индукции мейоза. Во-вторых, экспрессия Stra8 наблюдается в семенниках плодов, когда CYP26b1 химически ингибирован с помощью ketoconazole, но только в присутствии мезонефросов, что привело авт. к предположению существования CYP26B1-чувствительного фактора, продуцируемого мезонефросами, который не является RA, и обязателен для мейотической индукции. В-третьих, используя ChIP, предполагаемые RARE элементы промотора Stra8 были обнаружены связанными с помощью антител к RAR очень слабо, это привело к заключению, что Stra8 вряд ли регулируется с помощью RA in vivo. Принимая во внимание убедительные доказательства, подчеркивающие тонко настроенный механизм передачи сигналов RA, контролирующей мейоз зародышевых клеток, находки Kumar et al., 2011 неожиданны. Однако альтернативные объяснения этого заключения представлены ниже ( rev.(Griswold et al., 2012)).
Анализируя двойных мутантных эмбрионов Raldh2-/-;Raldh3-/- не выявлено активности RA
в гонадах или мезонефросах, используя репортерную линию RARE-LacZ , которая позволила авт. показать чувствительность к 25nM RA и выше (Kumar et al., 2011). Как уже упоминалось, зародышевые клетки отвечают усилением активности Stra8 в присутствии очень низких уровней RA in vitro (минимум на 1nM; (Bowles et al., 2010; Chen et al., 2012; Ohta et al., 2010; Zhou et al., 2008)). Кроме того, была описана перекрываемость с семейством RALDH в тканях таких как дорсальная часть сетчатки (Fan et al., 2003) и возможно, что RALDH1 экспрессируется в яичниках, продуцируя достаточные количества RA в отсутствие RALDH2 и RALDH3, чтобы индуцировать мейоз, даже если не достаточно высокий, чтобы выявить экспрессию репортера RARE-LacZ.
Следовательно, биохимическое определение количественно уровней RA у мутантов Raldh2-/-; Raldh3-/- д.б. найдено прежде, чем исключить роль RA в индукции мейоза. Используя ChIP анализ в ткани гонад, найдены два предположительно RARE сайта в промоторе Stra8 только с очень слабым связыванием с RAR антителами (Kumar et al., 2011), что привело авт. к предположению, что RA не соединяется с и не стимулирует экспрессию Stra8 in vivo. Чрезвычайно низкая концентрация Stra8-экспрессирующих зародышевых клеток в этом подходе, однако, без сомнения тенденциозно трактует этот результат, отражая ситуацию в соматических клетках гонад. Мы полагаем, что слабое связывание RARβ с наиболее проксимальным RARE (Kumar et al., 2011) может вместо этого может быть очень существенным позитивным результатом, учитывая низкое количество зародышевых клеток: относительно соматических клеток на ст. 13.5 dpc. Наконец, RA является единственным известным субстратом для CYP26B1, делая предположение о происходящем из мезонефросов, non-RA, CYP26B1-деградирующего фактора ответственным за индукцию мейоза, не приемлемым на сегодня.
Meiotic competence: what makes germ cells so special?
Хотя RA управляет дифференцировкой и формированием паттерна во многих эмбриональных тканях, только клон зародышевых клеток реагирует на этот морфоген вступлением в мейоз. Что же делает зародышевые клетки чувствительными к RA таким уникальным способом? Основной ключ к разгадке заключается в эпигенетическом состоянии зародышевых клеток, находящихся в генитальных гребнях.
В отличие от остальных соматических клеток в развивающемся эмбрионе, зародышевые клетки подвергаются деметилированию всего генома (Hajkova et al., 2002; Sato et al., 2003; Szabo et al., 2002). Метилированные регионы промотора в целом ассоциируют с молчанием генов, а гипометилированные регионы с транскрипцией генов; Ddx4, Dazl, Gcna1 и Scp3 являются широко распространенными генами зародышевых клеток, которые становятся гипометилированными и поэтому экспрессируются после вступления в гонады (Maatouk et al., 2006). Гипометилирвоание в основном происходит на ст. 12.5 dpc для большинства исследованных генов (Guibert et al., 2012; Hajkova et al., 2002; Henckel et al., 2012; Szabo et al., 2002; Szabo and Mann 1995) и женские зародышевые клетки обнаруживают менее глобальное метилирование, чем мужские зародышевые клетки на ст. 13.5 dpc (Popp et al., 2010). Пол-специфическое повторное метилирование необходимо во время поздних стадий беременности и перинатально для мужских и женских зародышевых клеток (Davis et al., 2000; Li et al., 2004; Ueda et al., 2000).
Помимо глобального деметилирования зародышевые клетки также теряют репрессивные гистоновые модификации, включая H3K27me3 и H3K9me3, и оказываются позитивными в отношении активных гистоновых модификаций H3K9ac (Abe et al., 2011; Hajkova et al., 2008; Seki et al., 2005). Эти метки указывают на слабые взаимодействия между гистонами и ДНК и вместе с глобальными гипометилированием ДНК и деконденсированием хромосом (Hajkova et al., 2008), хроматин зародышевых клеток рассматривается как 'открытое' состояние. Без сомнения такая конфигурация хроматина, должна иметь отношение к набору генов, которые реагируют на воздействие RA; однако имеется мало исследований, которые был тестировали эту гипотезу непосредственно.
Один фактор, потенциально связывающий организацию хроматина с чувствительностью к RA, это chromobox homologue 2 (CBX2). CBX2 является белком группы polycomb, участвующим в ремоделировании хроматина и в определении промежутка времени чувствительности к RA для экспрессии Hox генов во время раннего эмбриогенеза (Bel-Vialar et al., 2000). XY зародышевые клетки, лишенные Cbx2, обнаруживают преждевременный мейоз, подтверждая, что реконструкция хроматина с помощью CBX2 необходима для избегания RA стимуляции мейоза в этих клетках (Baumann and De La Fuente 2011). Как упоминалось, HDACs находятся среди множества кофакторов, с которыми ассоциируют RARs, чтобы негативно регулировать транскрипцию (Hong et al., 1997). В премейотических зародышевых клетках HDACs, как было установлено, с помощью ко-иммунопреципитации ,непосредственно взаимодействует с RARγ (Wang and Tilly 2010). Когда ацетилирование гистонов (репрессия) искусственно устраняется с использованием HDAC ингибиторов trichostatin-A (TSA) и suberoylanilide hydroxamic acid (SAHA), то мейотические маркеры STRA8 и SYCP3 обнаруживаются в немногих XY зародышевых клетках, как в случае, когда они были подвергнуты воздействию RA (Wang and Tilly
2010). В F9 премейотических клетках, ингибирование HDAC с помощью TSA умножало RA-вызываемую активацию промотора Stra8. Используя мутационный анализ, показано, что область примерно в 920bp выше точки старта транскрипции Stra8 необходима для HDAC-обусловленной репрессии in vitro (Wang
and Tilly 2010). Имеет ли место такой механизм в развитии зародышевых клеток in vivo ещё предстоит определить: как же упоминалось, премейотические зародышевые клетки уже обладают 'открытым' и доступным хроматином.
Conclusions
Although vitamin A deficiency was associated with infertility
several decades ago (Dowling and Wald 1960), it is only recently
that we have begun to unravel how RA metabolism directs meiosis
during fetal ovarian development and postnatal testis development.
A complex picture of RA metabolism and catabolism is emerg-
ing: RA is synthesised in the mesonephros of both sexes but is
catabolised in the developing mouse testis to prevent germ cells
from responding to the morphogen. In the fetal mouse ovary, RA
induces Stra8 expression in germ cells and they subsequently enter
meiosis. This paradigm appears to hold true for multiple species,
including human, chicken and amphibian.
But can we conclude that RA is necessary and sufficient for
meiotic entry? Certainly, when RA levels are reduced through
insufficient dietary intake of vitamin A, meiosis is compromised in
a dose-dependent fashion. Similar effects are observed in vitro
when RA synthesis is antagonised, indicating that RA is neces-
sary for correct entry into meiosis for XX germ cells. Exogenous
addition of RA, either chemically or genetically, induces XY germ
cells to aberrantly enter meiosis, confirming that RA is sufficient
for meiotic entry. Given the importance of correctly differentiating
the germ cell lineage for fertility, it is unlikely that RA alone would
regulate the process of meiotic entry. Indeed, we now know that,
in addition to degrading RA with expression of CYP26B1, the fetal
testis re-enforces the male differentiation pathway by expressing
fibroblast growth factor 9 (FGF9), which is inhibitory to meiosis
induction in XY germ cells (Barrios et al., 2010; Bowles et al.,
2010). Future studies will likely uncover additional regulators of
meiosis (both positive and negative) in this system, where germ
cell fate cannot be left to chance.
|
 Fig. 1. Regulation of germ cell meiosis by retinoic acid. The mesonephros attached to the
ovary or the testis expresses the retinoic acid (RA) synthesizing enzymes RALDH2 and RALDH3, resulting in the production of high levels of RA. RA produced in the mesonephros diffuses into the ovary where it acts directly on germ cells. RA binds RAR/RXRs on both identified RAREs of the Stra8 promoter to induce transcription. Meiosis then progresses in ovarian germ cells. The granulosa and interstitial cells express RALDH1 at low levels, perhaps also contributing to the local production of RA within the ovary. In the testis, Sertoli and interstitial cells express the RA-degrading enzyme CYP26B1, preventing RA from stimulating Stra8 transcription and subsequent meiosis in testicular germ cells. In the absence of RA, repressor co-factors including HDACs bind the RAREs of the Stra8 promoter to repress transcription. Additionally, FGF9 produced by
the Sertoli cells acts directly on testicular germ cells to inhibit meiosis.
Fig. 1. Regulation of germ cell meiosis by retinoic acid. The mesonephros attached to the
ovary or the testis expresses the retinoic acid (RA) synthesizing enzymes RALDH2 and RALDH3, resulting in the production of high levels of RA. RA produced in the mesonephros diffuses into the ovary where it acts directly on germ cells. RA binds RAR/RXRs on both identified RAREs of the Stra8 promoter to induce transcription. Meiosis then progresses in ovarian germ cells. The granulosa and interstitial cells express RALDH1 at low levels, perhaps also contributing to the local production of RA within the ovary. In the testis, Sertoli and interstitial cells express the RA-degrading enzyme CYP26B1, preventing RA from stimulating Stra8 transcription and subsequent meiosis in testicular germ cells. In the absence of RA, repressor co-factors including HDACs bind the RAREs of the Stra8 promoter to repress transcription. Additionally, FGF9 produced by
the Sertoli cells acts directly on testicular germ cells to inhibit meiosis.