Посещений:  МЕТИЛИРОВАНИЕ ДНК
МЕТИЛИРОВАНИЕ ДНК
Растущие ооциты
|
|
DNA methylation establishment during oocyte growth:
mechanisms and significanceSHIN-ICHI TOMIZAWA, JOANNA NOWACKA-WOSZUK and GAVIN KELSEY  Int. J. Dev. Biol. 56: 867-875 |
NA methylation in the oocyte has a particular significance: it may contribute to gene regulation in the oocyte and marks specific genes for activity in the embryo, as in the case of imprinted genes. Despite the fundamental importance of DNA methylation established in the oocyte, knowledge of the mechanisms by which it is conferred and how much is stably maintained in the embryo has remained very limited. Next generation sequencing approaches have dramatically altered our views on DNA methylation in oocytes. They have revealed that most methylation occurs in gene bodies in the oocyte. This observation ties in with genetic evidence showing that transcription is essential for methylation of imprinted genes, and is consistent with a model in which DNA methyltransferases are recruited by the histone modification patterns laid down by transcription events. These findings lead to a new perspective that transcription events dictate the placing and timing of methylation in specific genes and suggest a mechanism by which methylation could be coordinated by the events and factors regulating oocyte growth. With these new insights into the de novo methylation mechanism and new methods that allow high resolution profiling of DNA methylation in oocytes, we should be in a position to investigate whether and how DNA methylation errors could arise in association with assisted reproduction technologies or in response to exposure to environmental toxins.
|
Эпигенетические модификации ДНК (метилирование цитозина, гидроксиметилирование цитозина) или хроматина (посттрансляционные модификации гистонов) предоставляют дополнительный слой информации о ДНК, которая влияет на доступность нуклеотидных последовательностей в таких ядерных процессах, как транскрипция генов. Эпигеном - это сумма эпигенетических модификаций генома - является фундаментальным компонентом механизма, с помощью которого организуется, адаптируется и интерпретируется геномная информация. Some epigenetic особенно метилирование цитозина, могут распространяться на дочерние клетки с помощью репликации ДНК, чтобы обеспечить долговременную память более ранним решениям, напр., события или активации или репрессии во время спецификации клонов, в то время как др. более динамично контролируются в ответ на внешние сигналы. Эпигенетические модификации т.о. диктуют функции геному, а также предоставляют маркеры истории развития, восприятия или изменений внешних условий, которые инструктируют или понуждают к более поздним реакциям. Эпигенетическая информация имеет особое значение для зародышевых клеток. Зрелые ооциты и спермии обладают уникальным эпигеномом, отражающим их статус высоко дифференцированных и фенотипически отличающихся клеток, но некоторая их эпигенетическая информация перекладывается на эмбрион стабильным способом, так что эпигенетические метки, установленные в гаметах, могут влиять на активность генов в течение жизни потомства. Напр., в случае импринтируемых генов у млекопитающих это также может происходить, но в разной степени в др. последовательностях ДНК. Поскольку эпигенетические решения или ошибки, приобретенные гаметами, могут передаваться эмбриону, это обязывает нас понять процесс, который устанавливает и поддерживает формирование эпигенетического паттерна гамет и идентифицирует в чем может заключаться уязвимость.
Principles of DNA methylation
Метилирование ДНК является исконной эпигенетической меткой (Jones, 2012). У млекопитающих метилирование ДНК обнаруживается по цитозину прежде всего в контексте CpG динуклеотидов. Поскольку метилирование ДНК обычно происходит в цитозинах обеих нитей ДНК в CpGs то часто обозначается как симметричное. Важно, что симметричное метилирование может поддерживаться и после репликации ДНК, поскольку 'полуметилированная' ДНК образуется так, что оказывается безупречной матрицей для поддержания ДНК метилтрансферазы Dnmt1, чтобы добавлять метильную группу к цитозину зарождающейся нити, противостоящей метилированному цитозину родительской нити. Этот самопроизвольный процесс поддержания обладает потенциалом умножать состояние метилирования ДНК в течение бесчисленного количества событий репликации ДНК, так что метилирование ДНК может обеспечивать долговременную эпигенетическую память. Метилирование ДНК может также происходить вне CpGs, в этом случае оно обозначается как не-CpG или асимметричное метилирование. Хотя первоначально оно рассматривалось как отсутствующее или редкое в ДНК млекопитающих, но растут доказательства, что не-CpG метилирование ДНК присутствует с ощутимой частотой в избранных типах клеток, особенно в таких как эмбриональные стволовые клетки (Lister et al., 2009), которые обладают высокими уровнями активности de novo ДНК метилтрансфераз Dnmt3a и Dnmt3b, поскольку эти энзимы метилируют не исключительно цитозины в CpGs. Однако функциональная роль не-CpG метилирование ДНК остается в основном неясной, в частности, из-за того, что не-CpG метилирование не может быть скопировано непосредственно в дочерние нити ДНК после репликации с помощью Dnmt1. Не-CpG метилирование ДНК особенно обильно в ДНК ооцитов (Tomizawa et al., 2011; Kobayashi et al., 2012), где оно может рассматриваться как результат накопления активности не-CpG метилирования de novo метилтрансферазами, действующими в нереплицирующихся клетках. Имеет ли это какое-либо функциональное значение неясно: отсутствуют доказательства, что выдающиеся сайты не-CpG метилирования в ооцитах сохраняют высокие уровни метилирования после оплодотворения в преимплантационных эмбрионах (Tomizawa et al., 2011; Kobayashi et al., 2012).
В геноме млекопитающих в целом большинство сайтов CpG метилировано. Сюда входят CpGs, расположенные внутри генов и между генами и в большинстве вкрапленных повторяющихся элементов. Один класс элементов, который избегает общего гиперметилирования, это CpG островки (Deaton and Bird, 2011). Существуют короткие сегменты ДНК от нескольких сотен пар оснований до нескольких тысяч оснований в длину, в которых CpGs особенно часты (или правильнее, не истощаются в связи с составом оснований генома). Многие промоторы, располагающиеся в CpG островках и даже в тех CpG островках, которые не картируются в канонических сайтах старта транскрипции, могут обозначать альтернативные промоторы (Illingworth et al., 2010). В то время как значительное большинство CpG островков постоянно не метилировано в соматических клетках, заметное исключение составляют CpG островки на неактивной X хромосоме самок и CpG островки в контролирующих регионах импринтированных генов, которые метилируются в одном из родительских аллелей. Кроме того, около 10% CpG островков метилируются тканеспецифично. Эти свойства делают эпигенетический статус CpG островков особенно важным. Помимо CpG островков идентифицированы активные промоторы и др. предполагаемые регуляторные последовательности, которые сохраняют низкий уровень метилирования клеточно-специфическим образом (Stadler et al., 2011). Хотя паттерн метилирование ДНК может отличаться в деталях между разными типами соматических клеток, в целом же принцип, скорее всего, тот же самый. Ооциты, однако, по-видимому, имеют отличающийся профиль метилирования, при котором метилирование ДНК происходит преимущественно в телах генов (Kobayashi et al., 2012).
Метилирование ДНК может быть устранено с помощью механизмов, т. наз. пассивного и активного деметилирования. Пассивное деметилирование связано с неспособностью метилировать зарождающуюся нить ДНК после репликации, так что состояние полуметилирования сохраняется и последующих репликациях ДНК и клеточных делениях, состояние метилирования со временем прогрессивно разбавляется. Механизмы, ответственные за активное деметилирование, которое происходит вне контекста репликации ДНК, остаются спорными, но в недавней работе была подчеркнута роль оксидативного превращения 5-methylcytosine в 5-hydroxymethylcytosine и последующие производные, катализируемое членами семейства белков ten-eleven translocation (Tet) (Ficz et al., 2011). Помимо того факта, что предсуществующий профиль метилирования ДНК стирается во время ранней спецификации зародышевых клеток, неясно существует ли какой-либо активный оборот метилирования ДНК в ооцитах, как только начинает устанавливаться паттерн метилирование. Члены семейства Tet (Tet3) экспрессируются на высоком уровне в ооцитах, но возможно, что они функционируют только после оплодотворения, чтобы вносить вклад в репрограммирование метилирования генома у зигот и во время ранних делений дробления (Gu et al., 2011).
Из-за выраженного эффекта метилирование ДНК может сказываться на том, как будет считываться последовательность ДНК транскрипционными регуляторами и поэтому паттерны метилирования ДНК могут копироваться при репликации ДНК, и метилирование в ооцитах имеет особое значение. Оно может оказывать непосредственное влияние на то, как гены будут экспрессироваться в ооцитах и метилирование ДНК будет сказываться на генах в ооцитах, влияя на то, как гены будут экспрессироваться у эмбрионов. Это очевидно в случае импринтированных генов (Ferguson-Smith, 2011). Существуют гены, у которых только один аллель обычно экспрессируется из-за их контрольных регионов (ICRs) метилированных в одном из родительских аллелей. Такое моноаллельное метилирование возникает в гаметах (отсюда альтернативное название germline differentially methylated region, gDMR) и большинство импринтированных gDMRs метилированы в ооцитах, но не в спермиях (Tomizawa et al., 2011). Импринтированные гены представляют собой уникальный класс генов, в котором различия в метилировании ДНК между ооцитами и спермиями полностью поддерживаются после оплодотворения и в течение всей жизни потомства. Эта комбинация различий в метилировании гамет и в точном поддержании parent-of-origin метилирования в преимплантационном эмбрионе в то время, когда большая часть остального генома всеобъемлюще теряет наборы метилирований импринтированных генов. Хотя только очень небольшая фракция нашего генома импринтирована (представлена ~100 генами и 19 охарактеризованными импринтированными gDMRs), импринтинг представляет собой прецедент, что функционально важное эпигенетическое состояние может передаваться от родителя потомкам. Возможно, что эпигенетическое состояние помимо классических импринтируемых генов может передаваться от матерей потомкам и оно будет включать эпигенетическую изменчивость, вызываемую генетическими факторами или пищевыми или внешнесредовыми факторами, но существование и степень такого эпигенетического наследования между поколениями ещё предстоит доказать. Как мощь импринтинга, так и возможность трансмиссии приобретенного эпигенетического состояния, являются жизненно важными.
Хотя метилирование ДНК всё ещё наиболее изученный эпигенетический признак, оно не может рассматриваться в отдельности от др. эпигенетических признаков, таких как посттранскрипционные модификации гистонов. Множественные гистоновые модификации сегодня охарактеризованы (acetylation, methylation, phosphorylation, ubiqitination, etc.) и установлено, как они распределены между активными и неактивными генами и их регуляторные свойства. Однако, степень, с которой гистоновые модификации проходят через репликацию ДНК, неясна, как и механизмы, которые обеспечивают память о состоянии гистоновых модификаций (Margueron and Reinberg, 2010). Тогда как началось новое поколение секвенирования для выяснения с большей точностью мест метилирования ДНК в геноме ооцита (Smallwood et al., 2011; Kobayashi et al., 2012; Smith et al., 2012), подобная информация почти полностью отсутствует для гистоновых модификаций, поскольку картирование гистоновых модификаций всё ещё нуждается в большем количестве клеток, чем количество ооцитов, которое может быть получено. Однако очень возможно, что гистоновые модификации играют главную роль в детерминации размещения метилирования цитозина в геноме ооцита (as detailed below), так что необходимо понять распределение гистоновых модификаций и факторов, которые определяют их в ооцитах. Такж возможно, что гистоновые модификации, присутствующие в хроматине ооцитов могут быть сохранены на материнских хромосомах после оплодотворения и воздействия активности генов в зиготе и ранних эмбрионах (Kelsey and Feil, 2013), поэтому знание организации хроматина в ооцитах важно.
The mechanistic basis of de novo DNA methylation in
oocytes
Гаметогенез у млекопитающих характеризуется обширным эпигенетическим репрограммированием, при котором сначала стирается предшествующий эпигенетический профиль соматических клеток, после чего зародышевые клетки специфицируются у ранних эмбрионов, а затем тщательно разрабатываются эпигенетические паттерны зрелых гамет (Smallwood and Kelsey, 2012). Т.о., со временем примордиальные зародышевые клетки мигрируют в генитальный гребень, считается, что они в основном лишены метилирования ДНК (Guibert et al., 2012). В зародышевой линии самок мышей период метилирования ДНК устанавливается повторно после рождения во время роста ооцитов (Fig. 1). Т.о., это происходит в ооцитах, которые вступают в мейоз и останавливаются на ст. диплотены профазы мейоза I. Многие исследования использовали gDMRs импринтированных генов у мышей в качестве модели метилирования de novo (исходя из предположения, что метилирование gDMR может быть довольно специфическим механизмом). Эти исследования установили, что начало метилирования gDMR совпадает с переходом от первичного ко вторичному фолликулу и зависит от размера ооцита, так что начало метилирования обнаруживается в ооцитах, как только они достигают в диаметре, по крайней мере, ~50mm и завершается в зародышевой пузырьке (GV) , когда ооциты становятся транскрипционно молчащими (Lucifero et al., 2004; Hiura et al., 2006; Denomme et al., 2012).
Довольно ограниченный анализ, который проводился на ооцитах человека, показал. что метилирование gDMR происходит на сходной стадии и в ооцитах человека (Sato et al., 2007). По крайней мере, у мышей отсутствуют доказательства существенного избытка метилирования на поздней ст . созревания ооцитов. Недавние геномные исследования подтвердили заключение, что основная фаза метилирования de novo происходит в растущих ооцитах и что до начала роста ооцита геном обладает очень низким уровнем метилирования (Smallwood et al., 2011). С позиции последовательностей, gDMRs могут рассматриваться как элементы. подобные CpG островкам, каждый представлен несколькими сотнями CpG динуклеотидов, занимающих до нескольких тысяч нуклеотидов ДНК и где каждый CpG оказывается метилированным ко времени завершения роста ооцита (Tomizawa et al., 2011). Интересно, что de novo метилирование gDMRs может быть не синхронным, получены доказательства, что разные gDMRs начинают приобретать метилирование в популяциях ооцитов разных размеров (Lucifero et al., 2004; Hiura et al., 2006; Denomme et al., 2012). Это наблюдение на молекулярном уровне согласуется с элегантным исследованием ядерного переноса, которое предоставило доказательства, что по-разному импринтированные домены приобретают компетентность становиться импринтированными в разное время роста ооцитов (Obata and Kono 2002).
De novo ДНК метилтрансфераза, повсеместно ответственная за метилирование gDMR в ооцитах, это Dnmt3a (Kaneda et al., 2004); сестринский белок Dnmt3b, по-видимому, не нужен для метилирование ДНК в ооцитах (Kaneda et al., 2010). Метилирование gDMR также нуждается в присутствии Dnmt3L (Bourc'his et al., 2001; Hata et al., 2002), каталитически неактивного, родственного белка, который образует гетеротетрамерный комплекс с Dnmt3a (Jia et al., 2007). Хотя Dnmt3L первоначально считался фактором, необходимым специфически для метилирования импринтированных gDMRs, и для усиления активности Dnmt3a скорее, чем в качестве важного кофактора (Chedin et al., 2002), это предположение было пересмотрено в свете анализа метилирования генома. Во-первых, профилирование метилирование CpG островков в ооцитах путем снижения представленности bisulphite sequencing (RRBS)
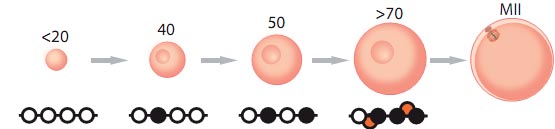 Fig. 1. Establishment of DNA methylation during oocyte growth. DNA methylation occurs in growing oocytes, with the onset of methylation coinciding with the transition from primary to secondary follicles or as oocytes attain a diameter of >50 mm. At any particular sequence (a typical gDMR of an imprinted gene is depicted here, with individual CpGs represented by circles and black circles representing methylation), DNA methylation appears to be a progressive process, such that partially methylated intermediates can be detected in populations of oocytes. CpG methylation is completed by the time oocytes are >70 mm. Fully grown oocytes also accumulate methylation at cytosines outside CpG dinucleotides (red circles) although, in contrast to CpG sites
in gDMRs which all become methylated, non-CpG sites are less consistently methylated (Tomizawa et al., 2011).
Fig. 1. Establishment of DNA methylation during oocyte growth. DNA methylation occurs in growing oocytes, with the onset of methylation coinciding with the transition from primary to secondary follicles or as oocytes attain a diameter of >50 mm. At any particular sequence (a typical gDMR of an imprinted gene is depicted here, with individual CpGs represented by circles and black circles representing methylation), DNA methylation appears to be a progressive process, such that partially methylated intermediates can be detected in populations of oocytes. CpG methylation is completed by the time oocytes are >70 mm. Fully grown oocytes also accumulate methylation at cytosines outside CpG dinucleotides (red circles) although, in contrast to CpG sites
in gDMRs which all become methylated, non-CpG sites are less consistently methylated (Tomizawa et al., 2011).
идентифицировало более 1000 полностью метилированных CpG островков в GV или metaphase II (MII) ооцитах и продемонстрировало, не говоря о горсточке, все зависят в равной степени от Dnmt3a и Dnmt3L для своего метилирования (Smallwood et al., 2011). (Горстка исключений представлена CpG островками, которые уже были метилированы до начала роста ооцита и до появления Dnmt3a и Dnmt3L; они могут представлять собой редкие элементы, которые не становятся деметилированными во время деметилирования по всему геному, которое происходит в примордиальных зародышевых клетках.) Во-вторых, всего генома shotgun bisulphite секвенирование (BS-Seq) продемонстрировало, что метилирование в ооцитах происходит преимущественно в телах генов и что все такие метилирования тел генов зависят от Dnmt3L (Kobayashi et al., 2012). В отсутствие Dnmt3L многие, но не все вкрапленные повторы также гипометилируются.
Помимо Dnmt3a и Dnmt3L существуют два др. фактора, которые, как было установлено, необходимы для метилирования gDMR в ооцитах мышей, но ни один из них не нужен повсеместно. Ооциты, лишенные гистоновой H3 lysine-4 demethylase Kdm1b (также известной как Aof1 или Lsd2), неспособны метилировать 4 из 7 исследованных gDMRs (Ciccone et al., 2009). Причина такой избирательности неизвестна; возможные механистические связи между Kdm1b и метилированием ДНК обсуждаются ниже. Ооциты, лишенные KRAB-zinc finger белка Zfp57, неспособны метилировать gDMR в локусе Snrpn, но не в др. 4-х протестированных импринтированных локусах (Li et al., 2008). Zfp57 является сиквенс-специфическим ДНК-связывающим фактором, который посредством связывания с репрессором Kap1 (также известным TRIM28, Tif1b или KRIP-1), взаимодействует с несколькими эпигенетическими модификаторами, включая H3K9 methyltransferase SETDB1 (также известна как ESET), а также Dnmt3a (Quenneville et al., 2011; Zuo et al., 2012). Однако его связывающий мотив присутствует во всех gDMRs и он соединяется будучи метилированным, но как Zfp57 участвует в метилировании de novo специфических gDMR неясно. Zfp57 важен для преимплантационных эмбрионов для поддержания метилирования всех gDMRs, как у мышей, так и людей (Li et al., 2008; Mackay et al., 2008; Quenneville et al., 2011). Исследования на людях также идентифицировали дополнительные белки, необходимые для метилирования gDMR. Мутации в NLRP7 и C6orf221 приводят к семейной biparental hydatidiform mole, состоянию повторных прерываний беременности, вызываемому неспособностью устанавливать метилирование ДНК множественных импринтов в ооцитах или поддерживать его в оплодотворенном яйце (Murdoch et al., 2006; Parry et al., 2011). Мутации в NLRP2 были обнаружены в случаях нарушения импринтинга при синдроме Beckwith-Wiedemann, при котором выявлено отсутствие метилирования KCNQ1OT1 gDMR (Meyer et al., 2009). Способ действия этих белков в метилировании ДНК неизвестен. NLRP2 и NLRP7 являются членами семейства белков CATERPILLAR, которые участвуют в во внутриклеточной регуляции бактериями индуцированного воспаления, в то время как C6orf221 является частью семейства белков, характеризующихся N-терминальным KH доменом (K homology domain), которые могут связывать РНК. Исходя из свойств родственных белков у мышей, было предположено, что NLRP7 и C6orf221 могут составлять часть комплекса, это может помочь составить представление о структурной организации цитоплазматических процессов в ооците (Parry et al., 2011). Принимая во внимание цитоплазматическое расположение, было бы интересно определить, как эти белки в конечном счете регулируют метилирование ДНК, но в отсутствие прямых ортологов у мышей делает функциональные исследования затруднительными. Точнее, невозможно сегодня заключить, участвуют ли NLRP2, NLRP7 и C6orf221 в становлении метилирования в ооцитах или в поддержании метилирования в зиготах как результата предоставляемого материнским белком из ооцита.
Transcription determines DNA methylation in oocytes
Важным является вопрос, как Dnmt3a и Dnmt3L понуждаются метилировать gDMRs. В свете недавних механистических и определяющих профили метилирования исследований, это, по-видимому, неверный путь, рассматривать как и где метилирование ДНК устанавливается в ооците. Предположение, которое теперь рассматривается как неверное, это то, что Dnmt3a в комбинации Dnmt3L рекрутируются с помощью специфических мотивов последовательностей ДНК или свойств последовательностей ДНК, таких как регулярное пространственное распределение CpG динуклеотидов (Jia et al., 2007). Наиболее вероятно, что комплекс Dnmt3a:Dnmt3L метилирует ДНК в ответ на состояние модифицированных гистонов, ассоциированных с хроматином, и это скорее, чем отражение лежащих в основе последовательностей ДНК, состояние гистоновых модификаций, допустимое для Dnmt3a:Dnmt3L, может быть определено в значительной степени за счет транскрипционной активности (Smallwood and Kelsey, 2012; Kelsey and Feil, 2013). Первое убедительное наблюдение в подтверждение роли транскрипции в метилировании ДНК было сделано для
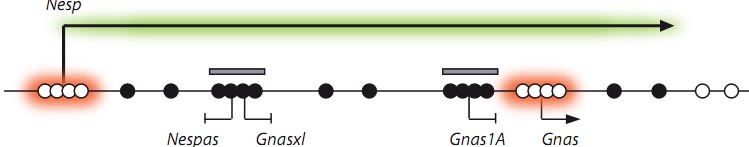 Fig. 2. Transcription is required for DNA methylation at imprinted germline differentially methylated region (gDMRs). The scheme represents the imprinted Gnas locus, for which a requirement for transcription in gDMR methylation was first demonstrated. The locus comprises several alternative transcripts, Gnas, Gnas1A, Gnasxl and Nesp, which initiate from alternative promoters but are part of the same transcription unit, and Nespas, which is transcribed in the opposite direction. The Gnas and Nesp promoters are active during oocyte growth (arrowheads), whereas the Gnas1A, Gnasxl and Nespas promoters are inactive. Importantly, transcription initiating from the Nesp promoter passes through the entire locus, including the gDMRs (grey bars). Preventing Nesp transcription blocks the establishment of methylation of the gDMRs (Chotalia et al., 2009; Frцhlich et al., 2010). Whole genome BS-Seq (Kobayashi et al., 2012) has revealed that the entire transcription unit is methylated (black circles), with the exception of the CpG islands associated with the Gnas and Nesp promoters (white circles). These CpG islands may escape transcription-induced DNA methylation because they are active in oocytes and may bind factors that ensure a chromatin organisation non-permissive for engagement of Dnmt3a:Dnmt3L. It is expected that the same principles apply to all active transcription units in oocytes.
Fig. 2. Transcription is required for DNA methylation at imprinted germline differentially methylated region (gDMRs). The scheme represents the imprinted Gnas locus, for which a requirement for transcription in gDMR methylation was first demonstrated. The locus comprises several alternative transcripts, Gnas, Gnas1A, Gnasxl and Nesp, which initiate from alternative promoters but are part of the same transcription unit, and Nespas, which is transcribed in the opposite direction. The Gnas and Nesp promoters are active during oocyte growth (arrowheads), whereas the Gnas1A, Gnasxl and Nespas promoters are inactive. Importantly, transcription initiating from the Nesp promoter passes through the entire locus, including the gDMRs (grey bars). Preventing Nesp transcription blocks the establishment of methylation of the gDMRs (Chotalia et al., 2009; Frцhlich et al., 2010). Whole genome BS-Seq (Kobayashi et al., 2012) has revealed that the entire transcription unit is methylated (black circles), with the exception of the CpG islands associated with the Gnas and Nesp promoters (white circles). These CpG islands may escape transcription-induced DNA methylation because they are active in oocytes and may bind factors that ensure a chromatin organisation non-permissive for engagement of Dnmt3a:Dnmt3L. It is expected that the same principles apply to all active transcription units in oocytes.
импринтируемого локуса Gnas. Этот локус содержит два gDMRs выше CpG островкового промотора для Gnas; немного далее выше имеется дополнительный альтернативный промотор, для Nesp транскрипта (Fig. 2). Nesp промотор активен в растущих ооцитах, хотя кодируемый Nesp белок не обладает очевидной функцией в ооцитах. Важно, что инициация транскрипции с промотора Nesp проходит через gDMRs и когда транскрипция устраняется (путем делетирования промотора или инсерции кассеты окончания транскрипции), то метилирование gDMRs частично или полностью теряется (Chotalia et al., 2009; Frцhlich et al., 2010). У человека делеции гомологичного NESP55 промоторного региона ассоциируют с полной потерей метилирования DMRs в локусе GNAS, если передаются от матери (Bastepe et al., 2005). Сходная потребность в транскрипции через gDMR в ооцитах для становления метилирования недавно установлена для импринтируемого Snrpn локуса (Smith et al., 2011). Эта находка может предоставить объяснение, почему передаваемые от матери делеции в цис-положении, но отделенные от SNPRN gDMR у человека, могут приводить к потере метилирования gDMR, что является одной из молекулярных причин синдрома Angelman. Важная роль транскрипции в метилировании de novo может быть сегодня выведена из RRBS и BS-Seq данных по ооцитам мышей. RRBS, которое преимущественно определяет профиль CpG островков, показало, что метилированные CpG островки в ооцитах непропорционально расположены внутри генов скорее, чем в их 5' концах, как можно было ожидать для CpG островков (Smallwood et al., 2011). Это действительно оказалось так после установления структуры гена с помощью mRNA-Seq данных скорее, чем благодаря использованию обычных аннотаций к генам. BS-Seq данные показали, что большая часть метилирования ДНК в ооцитах находится внутри тел генов, а уровень метилирования коррелирует с уровнем генной экспрессии, исходя из mRNA-Seq анализа (Kobayashi et al., 2012). Помимо демонстрации строгой корреляции между транскрипцией и метилированием, эти наблюдения важны в др. отношении. Они показывают, что метилирование gDMR и внутригенных CpG островков является сходным с и поэтому механистически сходно с метилированием в теле генов. Это подтверждает заключение, что метилирование gDMR не детерминируется в первую очередь последовательностью ДНК, а скорее расположением внутри транскрипционной единицы. Однако воздействие последовательности ДНК на метилирование не может быть исключено, и свойства последовательностей могут быть более важны в определении специфических сайтов, чтобы быть защищенными от метилирования. Следовательно, внутригенно расположенные CpG островки, ассоциированные в активными промоторами могут быть защищены от самопроизвольного метилирования тела гена (Fig. 2; and see Chotalia et al., 2009) путем связывания активирующих транскрипционных факторов, которые непосредственно или косвенно рекрутируют активности, модифицирующие гистоны, это создает состояние хроматина не подходящее для Dnmt3a:Dnmt3L (Kelsey and Feil, 2013).
Заключение, что транскрипция является основным двигателем метилирования ДНК в ооцитах имеет два важных следствия. Во-первых, оно указывает на механистическую модель, которая интегрирует транскрипцию, процессы модификации гистонов, связанные с транскрипцией и известные свойства Dnmt3a:Dnmt3L в связи с их взаимодействием с хроматином. Во-вторых, оно показывает, как метилирование ДНК может быть скоординировано с помощью факторов, которые контролируют рост ооцитов.
Transcription, transcription-dependent histone modifications and the de novo DNA methylation complex
Фундаментально важной находкой было то, что Dnmt3L является чувствительной к состоянию модифицирования гистонов. Посредством своего PHD (plant homeodomain)-подобного домена, Dnmt3L взаимодействует с N-терминальным хвостом гистона H3, но не когда лизин в остатке 4 метилирован (Fig. 3; Ooi et al., 2007; Hu et al., 2009). В дальнейшем было показано, что PHD домен Dnmt3a обладает сходными свойствами (Zhang et al., 2010). Это сравнимо со способностью ДНК метилировать транскрипционно неактивные промоторы, которые истощены в отношении H3K4 tri- и di-метилирования. Это также помогает объяснить наблюдение, что некоторые gDMRs неспособны становиться метилированными в ооцитах, лишенных H3K4 деметилазы Kdm1b, которая активна вопреки H3K4 di- и моно-метилированию (Ciccone et al., 2009). Интересно, было также сообщено, что KDM1B в клетках человека (HeLa) ассоциирует с телами генов (Fang et al., 2010): если это приложимо также к ооцитам, тогда связанная с транскрипцией активность Kdm1b может быть в целом необходимой для подготовки тел генов к метилированию ДНК, включая внутригенные CpG островки и gDMRs внутри транскрипционных единиц. Поскольку Kdm1b единственный легко обнаружимый в ооцитах со второй фолликулярной стадии, то возможное объяснение, почему только субнабор gDMRs зависит от Kdm1b для метилирования ДНК, заключается в том, что эти gDMRs обычно метилируются позднее во время роста ооцита, так что альтернативная H3K4 деметилазная активность, присутствующая на более ранних стадиях, необходима для др. gDMRs или транскрипционных единиц (Ciccone et al., 2009). Было бы интересно исследовать коррелирует ли зависимость от Kdm1b со временем активности транскрипционной единицы, в которой эти gDMRs расположены. Dnmt3a чувствительна к дополнительным гистоновым модификациям, поскольку её PWWP домен, как было установлено, соединяется с H3K36me3 (Fig. 3; Dhayalan et al., 2010). Это свойство может быть важным, поскольку H3K36me3 является гистоновой модификацией, ассоциированной с транскрипционной элонгацией: главной активностью, ответственной за триметилирование H3K36, является Setd2 (также известен как HYPB), ассоциированный с элонгацией связанной формой RNA polymerase II (Yoh et al., 2008). Т.о., считывание H3K36me3 метки с помощью Dnmt3a может объяснить преобладание метилирования в теле гена в ооцитах. Учитывая эти свойства, можно предсказать, что транскрипционно активные гены, включая внутригенные CpG островки и gDMRs, ассоциированные с неактивными промторами, обладают комбинацией гистоновых модификаций, пригодных для привлечения Dnmt3a:Dnmt3L: неметилированный H3K4 и триметилированный H3K36 (Fig. 3). Однако помимо одного ChIP-Seq исследования растущих ооцитов, которое показало, что CpG островки предназначенные, чтобы стать ДНК метилированными, обладают пониженными уровнями H3K4me3 (Smallwood et al., 2011), состоянием гистоновой модификации специфических генов неизвестным в ооцитах. Приведенная выше модель (детальнее в Kelsey and Feil, 2013) нуждается в проверке профиля гистоновых модификаций в растущих ооцитах и её зависимости от транскрипции, которая является заманчивой, поскольку количество материала, необходимое для воспроизведения исследований с иммунопреципитацией хроматина может быть достигнуто или может быть установлено с помощью генетического мутирования активностей гистоновых модификаторов.
Transcription as a means to coordinate DNA methylation with the control of oocyte growth
Убежденность, что транскрипционный контроль того, где будет происходить метилирование ДНК в геноме ооцита, и транскрипционные факторы, которые предопределяют, какие промоторы являются активными, как выполняющие основную роль по выявлению, где и вообще-то когда метилирование ДНК будет происходить в ооцитах. Интересно, мы установили, что многие импринтированные гены обладают альтернативными вышестоящими промоторами, активными в ооцитах, и оказалось, что активность этих вышестоящих стартовых сайтов, которая оказывает эффект на помещение gDMRs внутри активных транскрипционных единиц необходима, чтобы обеспечить их метилирование (Chotalia et al., 2009).
Далее с помощью анализа mRNA-Seq мы установили, что происходит переключение в явном сайте старта транскрипции, используемом в плодных зародышевых клетках и растущих ооцитах, во многих импринтируемых генах, указывая тем самым, что эти новые промоторы индуцируются с помощью транскрипционных факторов, которые появляются во время активации фолликулов или роста ооцитов. Важно формализовать эти наблюдения с помощью более утонченного картирования сайтов старта транскрипции и их изменений во время развития и роста ооцитов и выяснения временных взаимоотношений с метилированием. Как отмечалось выше, начало метилирования ДНК, как известно, отличается между gDMRs (Lucifero et al., 2004; Hiura et al., 2006; Denomme et al., 2012), так что одной из причин этой асинхронности может быть время, в течение которого событие транскрипции, пересекающее gDMRs, индуцируется во время роста ооцита. В качестве привлекательности этой логики может быть то, что сигнальные пути, которые трансдуцируют информацию от гранулёзных клеток, которые поддерживают рост ооцита, должны предопределять, какие гены д. стать метилированными за счет контроля специфических наборов транскрипционных факторов. Если это имеет место, то некоторые специфичные для генов аномалии в метилировании ооцитов д. возникать в результате нарушений в специфических путях сигнальных:транскрипционных факторов. Важно протестировать такую гипотезу, чтобы посмотреть, действительно ли устранение специфических транскрипционных факторов и нарушение активации специфических транскрипционных единиц будет приводить к к нарушению метилирования ДНК предсказуемым, локус-специфичным способом. Хотя нет связи с сигнальным путем или транскрипционным фактором, в принципе такие дефекты локус-специфичного метилирования могут возникать благодаря нарушению роста ооцитов, как недавно было сообщено. Ооциты от мышей, дефицитных по connexin 37, который необходим для образования щелевых соединений между ооцитом и гранулезными клетками, не достигают полного размера и неспособны к вызыванию метилирования Peg1 gDMR, в то время как Peg3 и Snrpn gDMRs остаются не затронутыми (Denomme et al., 2012).
The role of DNA methylation in oocytes and its vulnerability to external factors
Какова роль метилирования ДНК в ооцитах? Сегодня мы знаем в существенных деталях где в геноме ооцита происходит метилирование. Необходимо учитывать, что зародышевые клетки становятся глобально деметилированными в начале свой спецификации (Guibert et al., 2012) и в случае зародышевой линии самок метилирование de novo начинается лишь позднее в фазе роста ооцита, так, вступление в мейоз, фолликулогенез и ранние стадии роста проходят в отсутствие значительного метилирования ДНК (в телах генов, CpG островках и во многих вкрапленных повторах). Это указывает на то, что метилирование ДНК, зависимое от молчания генов, в основном безразлично для большей части развития ооцита. В самом деле, лишение ооцитов de novo метилирования посредством генетического устранения Dnmt3a или Dnmt3L, по-видимому, не оказывает существенного влияния на развитие, созревание и компетентность ооцита (Bourc'his et al., 2001; Hata et al., 2002; Kaneda et al., 2004). Было также установлено, что метилирование ДНК оказывает минимальное влияние на экспрессию генов в ооцитах. Сравнение mRNA-Seq данных постнатальных d10 растущих ооцитов в начале метилирования de novo при наличии полностью выросшего GV
Fig. 3. The de novo methyltransferase complex senses the modification state of histones. The scheme at the top depicts the Dnmt3a:Dnmt3L complex binding to the amino-terminal tail of histone H3 dependent on H3K4 being unmethylated and H3K36 being trimethylated: the PWWP domain of Dnmt3a specifically binds with H3K36me3 (Dhayalan et al., 2010). These interactions then enable methylation of cytosines on the associated DNA strand (yellow circles). Below, chromatin state non-permissive to Dnmt3a:Dnmt3L, owing to the presence of methylated H3K4, which inhibits binding of the PHD-like domains of Dnmt3a and Dnmt3L to the amino-terminal tail of H3 (Ooi et al., 2007; Hu et al., 2009; Zhang et al., 2010), and the lack of H3K36 trimethylation. As noted in the text, the permissive H3K4me0 and H3K36me3 state may in part be determined by transcription events through the coupling of the relevant histone modifying activities with elongating RNA polymerase II. Additional histone modifications may influence the binding of Dnmt3a and Dnmt3L with chromatin.
ооцита, указывает на то, что избыток метилирования ДНК оказывает незначительный эффект на обилие ассоциированных транскриптов (Smallwood et al., 2011). Сходным образом, имеются очень незначительные отличия к концентрации у Dnmt3L-/- ооцитов по сравнению с контрольными MII ооцитами (Kobayashi et al., 2012). Не исключено, что имеется множество легких изменений в сайте старта транскрипции, используемом в ооцитах и что метилирование может помогать супрессировать латентные промоторы. Однако, очевидно, что большинство молчащих промоторов в ооцитах обусловливается отсутствием соотв. транскрипционных факторов скорее, чем метилированием ДНК. Метилирование тела гена, по-видимому, является самопроизвольным механизмом скорее, чем активным процессом, регулирующим активность промотора.
Как отмечалось выше некоторое метилирование ДНК, устанавливаемое в ооцитах, является жизненно необходимым наследием у эмбрионов. Эмбрионы, получаемые из Dnmt3a- или Dnmt3L-дефицитных ооцитов, по-видимому, нормальны вплоть до эмбрионального дня (e) 8, но погибают на ст. e10 (Bourc'his et al., 2001; Hata et al., 2002; Kaneda et al., 2004). Их гибель в этом состоянии приписывается нарушению регуляции экспрессии импринтируемых генов: без становления материнских gDMRs в ооцитах, корректная моноаллельная экспрессия большинства импринтируемых генов нарушается, приводя к тотальной потере экспрессии или к потере импринтируемого молчания, в зависимости от локуса. Но помимо импринтируемых генов большая часть метилирования ген-специфичной ДНК в ооцитах может рассматриваться как безучастные наблюдатели эффекта малого функционального значения, поскольку это метилирование стирается во время первых эмбриональных делений дробления (Smallwood et al., 2011; Smith et al., 2012). Должен существовать высоко эффективный механизм у ранних эмбрионов, чтобы гарантировать, что метилирование ДНК в gDMRs будет сохраняться, но всё остальное метилирование гамет д. быть очищено. Точность этого процесса зависит в основном от материнских факторов, предоставляемых цитоплазмой ооцитов (e.g., Zfp57, Kap1, Tet3, Stella, Dnmt1o; as reviewed in Kelsey and Feil, 2013), но избирательность метилирования недостаточно ясна. Существует ли потенциал для трансмиссии метилированного состояния ДНК в генах или регуляторных последовательностях помимо импринтируемых генов, ещё предстоит определить.
Вероятность аберрантного эпигенетического маркирования ооцитов возникает в ряде контекстов: в связи с assisted reproduction technologies (ART); воздействием средовых токсинов, таких как синтетический эстроген bisphenol A (Chao et al., 2012); или в ответ на состояние материнского питания. Как обсуждалось выше, становление метилирования ДНК, является динамически контролируемым во время роста ооцитов, оно регулируется прежде всего, транскрипционными событиями и, следовательно, может быть нарушено с помощью каких-либо неблагоприятных условий, которые меняют обычную транскрипционную программу растущих ооцитов. Были получены доказательства, что дети, появившиеся на свет в животных ART обнаруживают повышенный риск преждевременного рождения, низкого веса при рождении и нарушений, связанных с импринтингом в результате аберрантного метилирования специфических gDMRs, хотя величина риска остается предметом споров (rev. Laprise, 2009). Эпигенетические ошибки могут возникать во время процедут, связанных с ART за счёт ряда механизмов, связанных со стимулированием яичников или эмбриональных культур: за счет понуждения ооцитов к развитию более быстрому, чем в норме; путем использования низкого качества ооцитов, которые нормальны, но не овулируют от доноров с низкой плодовитостью; или за счет изменения набора факторов, которые накапливаются в ооцитах и необходимы для корректного поддержания метилирования gDMR и эпигенетического репрограммирования преимплантационных эмбрионов. Хотя некоторые исследования описывают изменения метилирования в специфических gDMRs у ART индивидов, у которых не выявлены нарушения импринтинга (e.g., Gomes et al., 2009), др. небольшого размера исследования, которые скринировали множественные gDMRs, не обнаружили доказательств для достоверного увеличения метилирования gDMR у детей, полученных с помощью ART, по сравнению с естественно зачатыми (Tierling et al., 2010; Rancourt et al., 2012). Очевидно, что существует необходимость в достаточно крупных и возможно более продолжительных исследований когорты ART-зачатых детей, но различия в ART-ассоциированных процедурах между клиниками оплодотворения и неадекватная чувствительность или воспроизводимость некоторых используемых методов метилирования могут вносить вклад в отсутствие соответствия между этими сообщениями.
Эффект избыточной овуляции в ответ на метилирование gDMR сегодня хорошо документирован у мышей, по крайней мере, когда метилирование определялось у преимплантационных эмбрионов (Market-Velker et al., 2010) или на более поздних стадиях. Наблюдались как гипометилирование gDMRs , обычно метилируемых в ооцитах (Snrpn, Kcnq1ot1 and Peg3) , так и избыток метилирования gDMRs, обычно метилируемых в спермиях (H19). Анализ одиночных ооцитов показал, что эти эффекты возникают не как ошибки метилирования в ооцитах (Denomme et al., 2011), а мозаичная и стохастическая природа изменений в метилировании, обнаруживаемая в эмбрионах, более согласуется с нарушениями поддержания во время раннего эмбриогенеза (de Waal et al., 2012), хотя др. исследование не выявило аномальной избыточности метилирования H19 gDMR в суперовулированных ооцитах, а лишь нормальное метилирование трех материнских gDMRs (Peg1, Kcnq1ot1 и Zac1; Sato et al., 2007). Избыточность метилирования H19 gDMR и неполное метилирование PEG1 gDMR в GV и MI ооцитах человека, получаемая после стимулирования яичников, наблюдалась при анализе одиночных ооцитов, но это сообщение не сопровождалось строгим контролем нестимулированных ооцитов, исследованных тем же самым методом
(Sato et al., 2007).
Concluding remarks
The past couple of years have revolutionised our knowledge of DNA methylation in oocytes. From next generation sequencing mapping of DNA methylation and functional studies in the mouse, we now have very detailed information about the distribution of methylation in the oocyte genome and a good molecular understanding of the processes that confer methylation. These advances have highlighted transcription as a major determinant of DNA methylation, most likely by generating a chromatin state permissive for DNA methyltransferase activity. This brings new perspectives about how DNA methylation of individual genes may be coordinated by the events that control oocyte growth, acting both within the oocyte and from supporting somatic cells. We have also learnt that most DNA methylation in oocytes may be dispensable and is probably only required to mark a subset of genes for activity in the embryo, such as imprinted genes. More work is needed to understand the extent to which the oocyte epigenome is susceptible to procedures used in ART, can be modified by diet, or harmed by environmental factors, and what the long term consequences of such effects are. We have just begun to develop the tools that allow us to acquire high resolution, quantitative information on DNA methylation from small numbers of oocytes, but there is a continued need for further developments, for example, single oocyte analysis, and many other types of molecular analyses will continue to be a challenge.
|

