Посещений:  ОРГАНОГЕНЕЗ
ОРГАНОГЕНЕЗ
Роль ангиогенных факторов роста
|
|
The role of angiogenic growth factors in organogenesis
ENRICO CRIVELLATO*
 Int. J. Dev. Biol. 55: 365-375
doi: 10.1387/ijdb.103214ec
|
Angiogenic growth factors are a class of molecules which exert a fundamental role in the process of blood vessel formation. Besides vasculogenic and angiogenic properties, these compounds mediate a complex series of patterning activities during organogenesis. Angiogenic factors cooperate in the growth and development of embryo tissues in a cross-talk between endothelial cells and tissue cells. It is well established that many tissue-derived factors are involved in blood vessel formation, but there is now emerging evidence that angiogenic factors and endothelial cells themselves represent a crucial source of instructive signals to non-vascular
tissue cells during organ development.Thus, angiogenic factors and endothelial cell signalling are
currently believed to provide fundamental cues for cell fate specification,embryo patterning, organ differentiation and postnatal tissue remodelling.This review article will summarize some of the recent advances in our understanding of the role of angiogenic factors and endothelial cells as effectors in organ formation.
|
;
Сосудистая система позвоночных состоит из организованной разветвленной сети артерий, вен и капилляров, которые проникают практически во все ткани тела. С точки зрения развития система кровообращения является первой функциональной физиологической системой, появляющейся во время эмбриогенеза позвоночных в сочетании с гематологической системой (Risau, 1995; Ribatti, 2006). Параллельное образование сердечно-сосудистой и гематопоэтической систем инициируется. когда размер эмбриона увеличивается настолько, что с помощью диффузии кислорода и существенных молекул оказывается недостаточно гарантирован нормальный клеточный рост. Т.о., образование кровеносной системы является критическим для гарантии собственно роста и дифференцировки всех тканей развивающегося организма, благодаря её участию в доставке кислорода и питательных веществ и в удалении отходов. Помимо гарантии доставки крови, имеются доказательства, что кровеносные сосуды обеспечивают способность предоставления инструктивных регуляторных сигналов в окружающие несосудистые клетки мишени во время развития эмбриона. Эта интересная перспектива отражает увеличение значения роли сосудистого эндотелия в качестве источника онтогенетических передач клеточных сигналов в ранней эмбриональной жизни. В самом деле, становится всё яснее, что васкулогенез и ангиогенез играют прежде всего детерминирующие роли в формировании паттерна развивающихся структур во время эмбриогенеза преимущественно посредством паракринных действий эндотелиальных клеток. Т.о., кровеносные сосуды рассматриваются сегодня как критические факторы эмбрионального развития, дифференцировки органов и постнатального ремоделирования тканей. Постулируется реципрокное влияние между клетками органа и пронизывающими ткань сосудами. С одной стороны, органные инструкции эндотелиальным клеткам предоставляют сигналы для сосудистого развития и приобретения локальных специализаций; с др. стороны, сосудистые сигналы обратно к клеткам органа предоставляют морфогенетические и паттерн-формирующие инструкции во время формирования органа
(Coultas et al. 2005; Cleaver and Melton, 2003).
Angiogenic growth factors involved in early vascular
development
В жизни ранних эмбрионов васкуляризация устанавливается с помощью процесса, наз. васкулогенезом, который участвует в формировании de novo кровеносных сосудов в результате пролиферации и дифференцировки происходящих из мезодермы ангиобластов в эндотелиальные клетки (Risau, 1995). Развитие сосудов начинается очень рано после начала гаструляции с формирования кровяных островков в желточном мешке и предшественников ангиобластов в головной мезенхиме и задней части латеральной пластинки мезодермы. Ангиобласты первоначально образуют крупные кровеносные сосуды туловища, дорсальную аорту и аксиальную вену, а также эндокард сердца. Т.о., васкулогенез дает тело с первичной сосудистой сетью ещё до начала сердцебиений. Термин ангиогенез "суммирует набор морфогенетических событий, которые расширяют и тонко настраивают первоначальную, более примитивную эмбриональную сосудистую сеть из артериол, венул и сильно разветвленных капилляров, чтобы предоставить эффективное кровоснабжение и органные специфические сосудистые функции " (Gerhardt, 2008). Ангиогенез имеет место во время более поздних стадий эмбриогенеза и увеличивает предсуществующие сосудистые ложа благодаря разрастанию, шунтированию и intussusceptive росту. Возникающая васкулатура, сформированная с помощью васкулогенеза и ангиогенеза, стабилизируется посредством рекрутирования пристеночных клеток, а именно перицитов в капиллярах и гладкомышечных клеток в крупных сосудах и продукции внеклеточного матрикса. Затем примитивные сосуды подвергаются ветвлению, подрезке и специализации, чтобы приобрести свойства, необходимые для каждого из соотв. органов (Carmeliet, 2003, 2005).
Очень стереотипная архитектура сосудистого древа возникает как результат комбинации генетических и эпигенетических факторов (Coultas et al., 2005). Спецификация ангиобластов в артериальные или венозные клоны генетически детерминируется и происходит ещё до начала кровообращения. Интересно, что ведение межсомитных сосудов четко зависит от генетических программ, т.к. эти сосуды формируются до кровообращения и не зависят от передачи сигналов кислорода. Давление кислорода и гемодинамические силы являются дальнейшими критическими факторами в формировании замысловатых паттернов локальных сосудистых петель. Примитивный сосудистый лабиринт подвергается существенной экспансии, ветвлению и ремоделированию, приводя к дифференцировке в артериальные, венозные и капиллярные каналы с точно направленной полярностью и четким формированием лево-правостороннего паттерна.
Многие ангиогенные факторы роста и сигнальные пути участвуют в раннем сосудистом развитии, а также в формировании паттерна органов во время эмбриогенеза. Среди них, мы рассмотрим: vascular endothelial growth factor (VEGF), fibroblast growth factor (FGF)-2, angiopoietins (Angs), transforming growth factor (TGF)-β, netrins, semaphorins, ephrin, Notch, survivin.
The vascular endothelial growth factor protein family
Возможно наиболее важными тканевыми факторами, ответственными за дифференцировку ангиобластов и образование трубок являются члены семейства белков VEGF. VEGF начинает действовать на очень ранних ступенях формирования паттерна кровеносных сосудов и позднее модулируют поддержание эндотелиальных клеток в нормальных тканях. Удивительно, эндотелиальные клетки являются источником VEGF, следовательно, эндотелиальными клетками обеспечиваемая аутокринная петля VEGF вносит вклад в сосудистый рост (Yonekura et al., 1999).
Семейство белков VEGF включает , следующие молекулы: VEGF (или VEGF-A), VEGF-B, placental growth factor (PlGF), VEGF-C and VEGF-D и их рецепторы VEGFR-1, -2 and -3 (Tammela et al., 2005). VEGF, как было установлено, является главной ангиогенной молекулой во время органогенеза, а также постнатального физиологического и патологического ангиогенеза. Это ниболее мощный стимулятор пролиферации эндотелиальных клеток, разрастания, миграции и образования трубок. Он также является мощным фактором жизнеспособности и фактором проницаемости эндотелиальных клеток. VEGF связывает VEGFR-1 и VEGFR-2, а также
neuropilin-1 и -2 рецепторы для semaphorins. Ранние эмбрионы мыши экспрессируют его в местах активного васкулогенеза и ангиогенеза, при этом он управляет миграцией VEGFR-1 и VEGFR-2 позитивных клеток (Ferrara et al., 2003). Серия , по крайней мере, из 6 VEGF изоформ была описана, как отличающихся по свойствам тканевой диффузии и связывания с внеклеточным матриксом. Так, VEGF121 диффундибелен, VEGF189 соединяется с матриксом, VEGF165 имеет промежуточный профиль, VEGF123 является наиболее диффузионной изоформой, действующей на длинные расстояния, а VEGF188 на короткие расстояния (Ruhrberg et al., 2002).
Дифференциальная секвестрация различных изоформ VEGF во внеклеточном матриксе является критической для баланса между ветвлением капилляров и увеличением размера сосудов. VEGF является ключевым регулятором васкулогенеза и ангиогенеза. Гомозиготные нокаутные VEGF мыши, а также мыши, лишенные одного из аллелей VEGF, погибают in utero на ранних стадиях развития из-за дефектов образования кровяных островков и сосудистого развития (Ferrara et al. 1996). VEGF строго индуцируется в условиях гипоксии и стимулирует рекрутирование воспалительных клеток, а также деградацию матрикса, связанную с ангиогенезом (Pugh and Ratcliffe, 2003). Хотя и лучше всего охарактеризованный в качестве критического медиатора васкулогенеза и ангиогенеза, VEGF действует не только на эндотелиальные клетки, но и также соединяется с серией др. клеток. VEGF взаимодействует с гематопоэтическими стволовыми клетками, вызывая мобилизацию кровяных элементов из костного мозга (Liang et al., 2001). Он также способствует хемоаттракции моноцитов, а измененная регуляция VEGF приводит к выраженным дефектам в развитии сердца (Stalmans, 2005). VEGF также связан с нейронами стимулирующей нейропротекцией. VEGF защищает нейральные клетки от гипоксии, облегчает рост аксонов, способствует высвобождению эндотелиальными клетками нейрогенных факторов и индуцирует пролиферацию нейральных стволовых клеток (Rosenstein and Krum, 2004; Shen et al., 2004; Schanzer et al., 2004).
PlGF связывает VEGFR-1 и neuropilin-1. Эта ангиогенная молекула, по-видимому, не играет фундаментальной роли в формировании сосудов во время эмбриональной жизни, т.к. PlGF нокаутные мыши не экспрессируют существенных фенотипических отклонений (Nagy et al., 2003). Очевидно, что PlGF наиболее активен в постнатальном образовании сосудов. VEGF-B также является лигандом для VEGFR-1 и neuropilin-1 и подобно PlGF, может иметь легкие ангиогенные эффекты во взрослой жизни (Silvestre et al., 2003). VEGF-C действует на VEGFR-3 и индуцирует избирательный лимфангиогенез, не сопровождаемый ангиогенезом (Karkkainen et al., 2004). В самом деле, мыши, лишенные обоих VEGF-C аллелей неспособны формировать лимфатические сосуды.
VEGF-D активирует VEGFR-2 и VEGFR-3. Он является как ангиогенным, так и лимфангиогенным (Saharinen et al., 2004). VEGFR-1 (Flt-1) и VEGFR-2 (Flk-1) присутствуют в общем на сходных структурах. VEGFR-1 связывает VEGF, VEGF-B и PlGF с высоким сродством. VEGFR-2 связывает VEGF, VEGF-C и VEGF-D. VEGFR-1 сначала экспрессируется в ангиобластах и эндотелиальных клетках, особенно на ранних стадиях развития. VEGFR-2 является прежде всего рецептором, передающим VEGF сигналы в эндотелиальных клетках. Он экспрессируется не только в эндотелиальных клетках, но и также первичной энтодермой, эмбриональными ангиобластами, остеобластами и клетками ретинальных предшественников (Ferrara et al., 2003). Затронутые по гену VEGFR-1 мыши погибают на ст. E8.5 из-за дезорганизации кровеносных сосудов и избыточного роста эндотелиальных клеток (Ferrara et al., 2003). Затронутые по гену VEGFR-2 мыши погибают на ст. E 8.5-E 9.5 из-за отсутствия развития кровяных островков, эмбриональных сосудов и гематопоэтических клеток (Shalabi et al., 1995).
The fibroblast growth factor protein family
FGFs является семейством heparin-binding ростовых факторов. Идентифицировано более 20 структурно родственных членов семейства FGF (Presta et al., 2005). FGFs осуществляют свою ангиогенную активность путем взаимодействия с различными поверхностными рецепторами эндотелиальных клеток, включая высокого сродства тирозин киназные рецепторы (FGFRs), heparin-sulphate proteoglycans и integrins. In vitro эндотелиальные клетки разного происхождения экспрессируют FGFR1 и при некоторых условиях FGFR2. Хотя FGFs могут стимулировать эндотелиальные клетки и индуцировать ангиогенез, эти цитокины являются митогенными для многих типов клеток. FGF-2 является критическим фактором для индукции плюрипотентных клеток бластодиска перепела к васкулогенезу, а эксперименты на эмбрионах кур подтвердили, что передача сигналов FGF важна для инициации спецификации ангиобластов (Flamme et al., 1997; Cox and Poole, 2000). Помимо своей критической роли в раннем образовании сосудов, цитокины семейства FGF играют важную роль в разных событиях органогенеза, в частности они участвуют в контроле морфогенеза ветвления (Metzger et al., 2008).
Tie-1, Tie-2 and angiopoietins
Семейство Angs состоит из Ang-1, -2 и ортолога Ang-3 у мышей и Ang-4 у человека. Все Angs являются лигандами для рецепторной тирозин киназы Tie-2 (также известной как TEK) и играют критическую роль в разрастании эндотелия, ремоделировании стенок сосудов и рекрутирования пристеночных клеток (Thurston, 2003). Tie-1 является орфановой рецепторной тирозин киназой. Ang-1 и -4 активируют Tie-1, хотя Tie-1 не соединяется непосредственно с этими лигандами (Saharinen et al., 2005). Ang-1 продуцируется перицитами и гладкомышечными клетками, активирует эндотелиальный Tie-2, усиливает взаимодействия между эндотелиальными клетками и перицитами и экспрессируется позади ведущего края ангиогенных сосудов, позиция, согласующаяся с созреванием сосудов (Sundberg et al., 2002). Мутации или Ang-1 или Tie-2 не затрагивают инициального образования кровеносных сосудов, но эмбрионы погибают в средине беременности из-за крупных дефектов ремоделирования и стабильности сосудов (Dumont et al., 1994; Sato et al., 1995). Ультраструктурный анализ показал, что Tie-2-нокаутные кровеносные сосуды лишены пристеночных клеток (Patan, 1998). Нокаутные эмбрионы, лишенные Tie-2, обнаруживают неспособность эндотелиальных клеток слипаться и взаимодействовать с околососудистыми клетками и внеклеточным матриксом (Davis and Yancopoulos, 1999). У PDGF-B дефицитных мышей, Ang-1 восстанавливает структуру и проницаемость сосудов (Uemura et al., 2002). Ang-1 также противодействует VEGF-индуцируемой текучести эндотелия (Thurston et al., 1999). Во время ангиогенеза Ang-2 экспрессируется эндотелиальными клетками, расположенными на ведущем крае пролиферирующих сосудов (Maisonpierre
et al., 1997) и действует как дестабилизирующий фактор, который ограничен эндотелиальными клетками в областях ремоделирования сосудов и соединяется с Tie-2 без индукции сигнальной трансдукции (Maisonpierre et al., 1997). Во время активации эндотелия, Ang-2 секретируется из эндотелиальных клеток, где он накапливается в тельцах Weibel-Palade (Fiedler et al., 2004). В целом семейство Ang из ангиогенных факторов играет критическую роль в разрастании эндотелия, ремоделировании стенок сосудов и рекрутировании пристеночных клеток. Активация Tie-2 вызывает ремоделирование сосудов, но также поддерживает стабильность сосудов и жизнеспособность эндотелиальных клеток.
The transforming growth factor protein family
TGF-β и TGF-β рецепторы экспрессируются эндотелиальными клетками и пристеночными клетками. Три изоформы TGF-β распознается:
TGF-β1, TGF-β2 и TGF-β3. TGF-β играет критическую роль в формировании кровеносных сосудов. У мышей генетическая делеция пути передачи сигналов TGF-β ведет к гибели животных in utero из-за уродливости сосудистого фенотипа (Choi and Ballermann, 1995; Dunker and Krieglstein, 2000). Эндотелиальные клетки, как было установлено, экспрессируют разные рецепторы для TGF-β. Помимо TGF-βRI рецептора, наз. ALK5, который экспрессируется на большинстве типов клеток, эндотелиальные клетки обладают двумя уникальными рецепторами: endoglin, TGF-βRIII рецептором и ALK1, TGF-βRi рецептором (Lebrin et al., 2005). TGF-β является критическим фактором для конструкции кровеносных сосудов. В самом деле, спецификация и пролиферация пристеночных клеток обеспечивается с помощью TGF-β и platelet-derived growth factor (PDGF)-B, экспрессируемыми эндотелиальными клетками (Betsholtz et al., 2001). Когда мезенхимные клетки приходят в контакт с эндотелиальными клетками, то активация латентного TGF-β1 вносит вклад в дифференцировку клеток предшественников в перициты и гладкомышечные клетки (Darland and D'Amore, 2001). Мыши, дефицитные по endoglin, TGF-β1 ко-рецептору,
обнаруживают пониженную ассоциацию с гладкомышечными клетками и перицитами (Li et al., 1999). TGF-β1 ингибирует пролиферацию и мигирацию эндотелиальных клеткок, а мыши, дефицитные по компонентам передачи сигналов TGF-β1 обнаруживают расширенные и нерегулярной формы микрососуды (Lebrin et al., 2005). Сосуды с самой низкой скоростью пролиферации эндотелиальных клеток обладают наивысшей ассоциацией с перицитами. Семейство bone morphogenic protein (BMP) является крупнейшим в сверхсемействе TGF-β ростовых факторов, оно также включает activins, inhibins, myostatin и др. (Massague, 1998). BMPs соединяется с двумя основными типами связанных с мембраной serine/threonine киназных рецепторов, type I и type II рецепторами (Wan and Cao, 2005). BMPs являются мощными факторами дифференцировки остеобластов, но они участвуют и в ряде различных эмбриогенных функций.
Netrins
Netrins являются связанными с матриксом белками, участвующими в привлечении и ведении аксонов во время развития нервной системы (Dickson, 2002).
Netrins также участвуют в отталкивании аксонов. Этот эффект обеспечивается рецепторами семейства Unc5. недавнее исследование показало, что netrins участвуют также в развитии кровеносных сосудов. Netrin1 и Unc5b, один из четырех Unc5b рецепторов млекопитающих, регулирует отталкивание кровеносных сосудов (Lu et al., 2004). Роль Unc5b в обеспечении отталкивания эндотелиальных клеток подтверждено анализом развивающихся межсегментных сосудов у эмбрионов рыбок данио. Unc5b экспрессируется в эндотелиальных верхушечных (tip) клетках. Потеря Unc5b у мышей ведет к аберрантному расширению филоподий верхушечных клеток и обширному ветвлению многих сосудов. Во время эмбриогенеза netrin1, по-видимому, предупреждает межсегментные сосуды от проникновения в соседние сомиты путем активации Unc5b (Lu et al., 2004).
Semaphorins
Semaphorins это семейство ассоциированных с клетками и секретируемых белков, которые передают сигналы посредством мультимерных рецепторных комплексов, представленных plexins, neuropilins и др. молекулами (Bagri and Tessier-Lavigne, 2002). Ассоциированные с мембранами semaphorins соединяются с plexins, тогда как секретируемые semaphorins соединяются с neuropilins. Генетические исследования на Drosophila и мышах показали, что передача сигналов semaphorin действует как отталкивающий сигнал в ведении аксонов и миграции нейрональных клеток (Raper, 2000). Neuropilin-1 является рецептором для растворимого лиганда semaphorin-3A. Помимо дефектов формирования паттерна нейральных клеток, neuropilin-1-дефицитные эмбрионы обладают также аномальным образованием сердечно-сосудистой системы и дефективным ветвлением сосудов (Kawasaki et al., 1999). Neuropilin-2 является рецептором для semaphorin-3F, но также связывает VEGF165. некоторые исследования показали, что class-3-semaphorins функционируют в качестве ингибиторов ангиогенеза. Semaphorin-3A противодействует эффектам VEGF при ангиогенезе in vitro и in vivo (Miao et al., 1999; Bates et al., 2003) и оба semaphorin-3A и -3F, как было установлено, ингибируют ремоделирование сосудов во время эмбрионального развития посредством эффектов на обеспечиваемую integrin клеточную адгезию (Serini et al., 2002). Более того, наблюдалось, что semaphorin-3F может ингибировать FGF-2- , а также VEGF-индуцированный ангиогенез in vivo (Kessel et al., 2004). Neuropilin-2-нулевые мыши доживают до взрослого периода, но не образуют нормальных лимфатических сосудов и капилляров (Yuan et al., 2002). некоторые semaphorins и их рецепторы участвуют как непосредственные регуляторы ведения и ветвления сосудов. Semaphorin-4D, который взаимодействует с plexinB1, индуцирует миграцию эндотелиальных клеток и тубулогенез in vitro и стимулирует формирование кровеносных сосудов in vivo (Suchting et al., 2006).
Ephrins
Ephrins являются молекулами ведения аксонов, которые предоставляют отталкивающие сигналы для растущих аксонов. Роль ephrin в формирования паттерна сосудов также предполагается. В самом деле, делеция передачи сигналов ephrin приводит к генеральной неспособности к ангиогенному ремоделированию первичного сосудистого сплетения и к последующей эмбриональной летальности в середине беременности (Gerety et al., 1999). Кроме того, взаимодействие между ephrinB2 и его рецептором ephB4, как полагают, помогает в становлении и поддержании границ, возникающих между артериями и венами в эмбриональной васкулатуре (Wang et al., 1998). Ephrin2B специфически экспрессируется в артериях, а ephrinB4 рецептор в венозном эндотелии, создавая самое раннее из известных молекулярных отличий между артериями и венами. Пути ephrin/ephrin рецептор также, как полагают, участвуют в ведении межсомитных сосудов между сомитами, поскольку нарушение передачи сигналов ephrin/ephrin рецептор предопределяет аномальный рост межсомитных веточек в сомитах (Helbling et al., 2000). Молекулы семейства ephrin/ephrin рецептор, как было установлено, участвуют в регуляции пролиферации лимфатических сосудов (Makinen et al., 2005).
Notch
Передача сигналов Notch необходима для ремоделирования первичного сосудистого сплетения в иерархию ложа зрелых сосудов и поддержания артериальной судьбы (Alva and Iruela-Arispe, 2004). Notch-3 рецептор экспрессируется на высоком уровне в перицитах, а нарушение передачи сигналов Notch-3 у Notch-3 -/- мутантных мышей дает более крупные сосуды из-за отсутствия перицитов (Wang et al., 2007). Незрелые перициты экспрессируют nerve/glial antigen-2 (NG2) протеогликан во время ранних стадий ангиогенеза, а растворимый NG2 способствует подвижности эндотелиальных клеток и ангиогенезу посредством вовлечения galectin-3 и α3β1 integrin (Fukushi et al., 2004). Блокирование обоих с помощью антител, а также нокаут гена, кодирующего NG-2 устраняет рост сосудов (Ozerdem and Stallcup, 2004). Недавние находки подтвердили, что передача сигналов Notch регулирует, как эндотелиальные клетки отвечают на стимуляцию с помощью VEGF. Образование верхушечных клеток зависит от баланса между передачей сигналов VEGF и Notch. Разрушение пути
Notch ведет к избыточной спецификации верхушечных (tip) клеток. Т.о., передача сигналов Notch действует, чтобы репрессировать образование верхушечных клеток. Этим способом эндотелиальные клетки при разрастании становятся стебельковыми клетками. Передача сигналов Notch т.о., действует как механизм негативной обратной связи от стоящего ниже VEGF, чтобы избрать одиночные верхушечные клетки в голове разрастающегося капилляра.
Survivin
Survivin является малым ингибитором апоптических белков. Он предохраняет клетки от гибели, способствует прогрессии клеточного цикла и экспрессируется на высоком уровне в пролиферирующих клетках, тогда как едва обнаружим в покоящихся тканях взрослых (Altieri, 2008). У мышей исследования с условной инактивацией генов показали, что жизнеспособность важна для развития головного мозга, гематопоэза, ангиогенеза и кардиогенеза (Leung et al., 2007; Jiang et al., 2005; Zwerts et al., 2007). У Xenopus laevis, избыточная экспрессия одного из двух surviving генов вызывает пролиферацию эндотелиальных клеток (Du Pasquier et al., 2006). Во время развития рыбок данио survivin вносит вклад в нормальный васкулогенез, ангиогенез, нейрогенез и гематопоэз (Ma et al., 2007; Delvaeye et al., 2009).
У мышей, истощенных по survivin в эндотелиальных клетках развитие эмбрионального сердца аномально и мутантные клетки эндокардиального клона не могут поддерживать эпителиально-мезенхимную трансформацию (Zwerts et
al., 2007). Исследования на модельных рыбках данио также подчеркивают важность survivin в развитии сердца (Delvaeye et al., 2009).
Angiogenic factors and heart development
У эмбрионов развитие сердца происходит из прекардиальных латеральных складок, чтобы сформировать первичную сердечную трубку (Sugy and Markwald, 1996). Кардиальный эндотелий, который у позвоночных является продолжением эндотелия крупных кровеносных сосудов, происходит из клеток эндотелиальных предшественников, которые появляются у мышей на ст. E 7. Эндотелиальные клетки эндокарда являются критическими для развития сердца. В самом деле, некоторые экспериментальные данные показывают, что эндотелиальные клетки эндокарда участвуют в органогенезе сердца. В эмбриональном сердце позвоночных ткань подушек эндотелиального происхождения. Начиная с E 15, эндокардиальные клетки, располагающиеся внутри атриовентрикулярного или конотрункального регионов трансформируются из эндотелиального в миграторный мезенхимный клеточный фенотип и проникают в подлежащий кардиальный гель (Icardo, 1989; Markwald et al., 1996). Эндотелиально-мезенхимная трансформация находится под контролем разных факторов, происходящих из эндокардиальных клеток. TGF-β является одним из таких факторов, который играет роль во время ранних ступеней развития сердца. Изменения в экспрессии TGF-β происходят в эндокардиальных клетках, и их мезенхимном потомстве, это коррелирует с началом образования подушек (Akhurst et al., 1990; Nakajima et al., 1994). Передача сигналов TGF-β-3 способна стимулировать и поддерживать эндотелиально-мезенхимное превращение (Ramsdell and Markwald, 1997). Neuregulin-1, член семейства epidermal growth factor (EGF), является др. молекулой. продуцируемой и секретируемой эндокардиальными клетками, которые предоставляют важные сигналы во время развития сердца
(Garratt, 2006). Neuregulin-1 является фактором роста и дифференцировки, который действует посредством тирозин киназных рецепторов семейства ErbB, а именно,
ErbB2 и ErbB4 (Meyer et al., 1997). Мыши, несущие гомозиготные мутации в Neuregulin-1, ErbB2 или ErbB4 погибают около E 10.5 из-за недостаточности эмбрионального сердца. Обнаруживается отсутствие образования трабекул в стенке желудочков и аберрантные, медленные сокращения сердечных камер (Lemke, 1996). Т.о.,, Neuregulin-1 предоставляет важные паракринные сигналы для миокардиальных клеток, приводя к формированию нормальных трабекулированных желудочков сердец (Garrat et al., 2003). Также у рыбок данио, нокдаун экспрессии Neuregulin-1 предопределяет серьёзные пертурбации развивающегося сердца (Milan et al., 2006).
Angiogenic factors and liver development
У млекопитающих зачаток печени развивается из вентральной части энтодермы передней кишки, мультипотентной ткани, которая также дает легкие, поджелудочную железу и щитовидную железу (Gualdi et al., 1996; Wells and Melton, 1999; Zhao and Duncan, 2005). тесные структурные взаимоотношения между органогенезом печени и развитием печеночных сосудов известно давно. Сосуды печени растут благодаря комбинации васкулогенеза и ангиогенеза (Gouysse et
al., 2002; Perez-Pomares et al., 2004). У мышей генерация зачатка печени происходит одновременно с развитием печеночной васкулатуры. Экспериментальные данные показывают, что кровеносные сосуды, в частности эндотелиальные клетки, являются интегральной частью в регуляции роста печеночного зачатка. Начиная с E 8.5-E 9, до появления зачатка печени, CD31+ предшественники эндотелиальных клеток или ранние эндотелиальные клетки в septum transversum тесно окружают только что специфицированную печеночную энтодерму (Matsumoto et al., 2001). Тесные взаимодействия происходят между печеночной энтодермой и этими сосудистыми предшественниками, которые способствуют морфогенезу печени и вычленяют мезенхимный домен, в котором растет зачаток печени. VEGF-R2
гомозиготные мутантные эмбрионы, которые лишены эндотелиальных клеток, но всё ещё поддерживают печеночную спецификацию энтодермы передней кишки, обнаруживают дефектный рост зачатка печени (Matsumoto et al., 2001). В отсутствие эндотелиальных клеток, следовательно, печеночные эпителиальные клетки неспособны мигрировать в окружающую мезенхиму. Сигналы, испускаемые эндотелиальными клетками. чтобы способствовать морфогенезу зачатка печени, пока неизвестны, но некоторые доказательства указывают на BMP-4 и FGF-8 как потенциальных кандидатов (Jung et al., 1999; Rossi et al., 2001). Фактически, фенотипы мышей, лишенных этих белков, сходны с VEGF-R2 мутантным фенотипом. Печеночные эпителиальные клетки, пролиферируют внутри энтодермы передней кишки у этих животных, но неспособны отсоединиться в мезенхиму поперечной перегородки.
Предположение, что эндотелиальные клетки тесно связаны с развитием ранней печени дале было подтверждено находкой, что синусоидные эндотелиальные клетки снабжают гепатоциты митогенным фактором и фактором жизнеспособности hepatocyte growth factor (HGF) (LeCouter et al., 2003).
Angiogenic factors and pancreas development
Органогенез поджелудочной железы является дальнейшим подтверждением, что критической роли кровеносных сосудов и факторов ангиогенного роста во время эмбриогенеза (Lammert et al., 2001; Jacquemin et al., 2006). У мутантных эмбрионовXenopus отсутствие дорсальной аорты ведет к строгой редукции или отсутствию маркеров, указывающих на развитие дорсального панкреатического зачатка, таких как insulin, NeuroD и Pax6 (Lammert et al., 2001). У мышей дорсальный и вентральный панкреатические зачатки нуждаются в некоторых разных мезодермальных индукторах и транскрипционных эффекторах (Kumar et al., 2003). Взаимодействия эндотелиальных клеток, как было установлено, наиболее критические для дорсального, чем вентрального панкреатического развития (Yoshitomi and Zaret, 2004). Эндотелиальные клетки аорты, в самом деле, находятся в прямой ассоциации с Pdx1-позитивной дорсальной энтодермой. У VEGF-R2 гомозиготных нулевых мутантных эмбрионов, у которые отсутствуют эндотелиальные клетки и васкулатура, Pdx1-позитивные клетки обычно нормально возникают в дорсальной энтодерме (Yoshitomi and Zaret, 2004). Однако к моменту, когда дорсальный панкреатический зачаток обычно начинает развиваться, обнаруживается меньшее количество Pdx1-позитивных клеток у этих животных по сравнению с диким типом, и не обнаруживаются признаки зачатка.
Иной путь недавно был предложен, при этом эндотелиальные клетки непосредственно поддерживают мезенхимные клетки, которые, в свою очередь, стимулируют инициальную дифференцировку дорсальной панкреатической энтодермы (Jacquemin et al., 2006). В самом деле, жизнеспособность мезенхимных клеток, которые обычно близки к аорте, ростральнее задней кишки, избирательно поддерживаются присутствием аорты (Esni et al., 2001). Метод тканевых эксплантов показал, что аортальные эндотелиальные клетки поддерживают жизнеспособность дорсальной части мезенхимы в отсутствие факторов циркуляции. В самом деле, N-cadherin-дефицитные мыши (Cdh2 -/-) обнаруживают апоптоз дорсальной мезенхимы и неспособность к развитию дорсального панкреатического зачатка, Такие эмбрионы также имеют аномальный эндотелий аорты и дефицит кровообращения (Edsbagge et al., 2005). Эти данные подтверждают, что "формирования паттерна и функционирование кровеносных сосудов происходят одновременно с органогенезом и могут иметь генеральное значение для управления дифференцировкой и морфогенезом [pancreas] " (Edsbagge et al., 2005).
Angiogenic factors and renal development
Почечные кровеносные сосуды появляются одновременно с помощью васкулогенных и ангиогенных механизмов (Abrahamson et al., 1998). VEGF является одним из критических факторов, регулирующих образование кровеносных сосудов в зачатке почки. Этот цитокин ответственен за регулировку почечного васкулогенеза, гломерулогенеза, а также генеза канальцев (Tufro et al., 1999). В самом деле, скоординированное развитие паренхимной и сосудистой почечной архитектуры зависит от доступности VEGF в органной культуре почек (Kitamoto et al., 1997).
В зачатке почки сборка гломерул не происходит в отсутс твие сосудов. Эти данные получены с помощью генетических манипуляций у рыбок данио. Мутантные cloche рыбки данио, которые неспособны к развитию эндотелиальных клеток, не формируют обычные пронефрические гломерулы (Majumdar and Drummond, 1999). Кроме того, неспособность к нормальному гломерулогенезу происходит у новорожденных мышей, обработанных растворимым VEGF рецепторным химерным белком, это приводит к почти полному ингибированию VEGF (Gerber et al., 1999a). Гомозиготная делеция VEGF специфически в подоцитах предупреждает рекрутирование и созревание эндотелиальных клеток в гломерулах (Eremina et al.,
2003). Мыши со специфическим устранением PDFG-B в эндотелиальных клетках обнаруживают нарушения гломерулогенеза из-за дефектов мезангиальных клеток (Bjarnegard et al., 2004). Итак, эти результаты подтверждают, что эндотелиальные клетки, рекрутируемые с помощью VEGF из подоцитов важны для обеспечения созревания подоцитов и мезангиальных клеток, ведущего к нормальному гломерулярному морфогенезу и барьерной функции фильтрации (Eremina and Quaggin, 2004).
Angiogenic factors and lung development
Существуют тесные структурные и функциональные взаимоотношения между развитием зачатка легких и развитием легочной васкуляризации. Ранние стадии сосудистого развития легких используют как васкулогенез, так и ангиогенез (de Mello et al., 1997). Экспериментальные процедуры, предупреждающие формирование кровеносных сосудов, вызывают выраженные нарушения легочного морфогенеза. Ингибирование развития легочных эндотелиальных клеток, в самом деле, сопровождается ингибированием дифференцировки и созревания эпителиальных клеток воздушных путей. Развитие легочных сосудов осуществляется во всё возрастающей близости к эпителиальным клеткам на периферии легочных канальцев (Burri, 1984). VEGF-A является центральным фактором роста, регулирующего физиологическое и патологическое формирование легких. Недавние исследования подтвердили, что VEGF-A/VEGFR-2 обеспечивает сцепление между процессами морфогенеза ветвления, развитием сосудистой системы и морфогенезом эпителиальной легочной системы. Эксперименты с целенаправленными делециями VEGF-A или VEGFR-2 продемонстрировали вовлечение этой системы лиганд-рецептор в морфогенезе легких. Легкие от новорожденных мышей, обработанные растворимым VEGF рецепторным химерным белком, который вызывает высокую степень нейтрализации VEGF-A, выглядят незрелыми и с менее сложным рисунком альвеол (Gerber et al., 1999a). Кроме того, использование нейтрализующих антител против VEGFR-2, инъецированных внутрь амниона, нарушают созревание легких плода (Compernolle et al., 2002). Удивительно, инъекция антител против flt1 оказалась неэффективной. VEGF-A секретируется с помощью периферических респираторных эпителиальных клеток на верхушке развивающихся респираторных трубок, создает VEGF градиент, которые заставляет сосудистую сеть сопровождать и окружать растущие бронхи (de Mello et al., 1997; Ng et al., 2001). In vitro эксперименты с культурой эмбриональных легких, обработанных антисмысловым олигоденуклеотидом к VEGFR-2 рецептору, показали, что потеря функции VEGF ведет к редукции эпителиального ветвления, снижению индекса эпителиальной и мезенхимной пролиферации, а также к подавлению экспрессии BMP-4 (Del Moral et al., 2006). Удивительно, изолированные на ст. E 19 альвеолярного типа II пневмоциты крыс, как было установлено, экспрессируют VEGFR-2 (Raoul et al., 2004). Кроме того, стимулирование VEGF-A увеличивает транскрипты surfactant protein B в этой экспериментальной системе. Недавняя работа Ahlbrecht et al. (2008) продемонстрировала на мышах, что экспрессия VEGFR-2 ограничивается ранней сосудистой примитивной сетью со ст. E 12.5 до E 15.5, тогда как VEGFR-2 обнаруживается в эпителиальной системе с E 16.5 и сохраняется до постнатального периода.
На постнатальных стадиях экспрессия VEGFR-2 всё больше ограничивается индивидуальными клетками в альвеолярных перегородках. Изоляция и in vitro культивирование альвеолярных эпителиальных клеток подтверждает экспрессию VEGFR-2 и показывает секрецию VEGF в supernatant. Тесная онтогенетическая связь между сосудистым развитием и морфогенезом легких далее была продемонстрирована с помощью экспериментов по избыточной экспрессии мышиного VEGF в дыхательном эпителии трансгенных мышей. Эта генетическая манипуляция вызывает изменения васкуляризации легких, это ассоциирует с заметными нарушениями структуры легочных ацинусов (Zeng et al., 1998). Легочная архитектура у таких животных обнаруживает дефект морфогенеза ветвления. В культурах эмбриональных легких мышей экзогенная VEGF164, одна из трех изоформ, генерируемых с помощью альтернативного сплайсинга гена Vegf-A, стимулирует морфогенез ветвления и увеличивает индекс пролиферации как эпителия, так и мезенхимы (Del Moral et al., 2006). Итак, эти данные показывают, что морфогенез легких критически зависит от неоваскуляризации легких, а VEGF играет ключевую роль в формирования паттерна легких (Zeng et al., 1998).
Angiogenic factors and skeletal growth
Литературные данные подтверждают, что эндотелиальные клетки управляют мезенхимными стволовыми клетками в направлении остеобластного фенотипа. Т.о., эндотелиальные клетки могут рассматриваться как "osteoinductive" медиаторы при совместном культивировании (Grellier et al., 2009a).Следовательно, инвазия кровеносных сосудов в хрящ, который обычно не содержит сосудов, является критической ступенью в каскаде событий, ведущих к эндохондральной оссификации. Т.о., васкулатурой управляемые сигналы оказываются существенными для корректного морфогенеза костей во время пре- и постнатального развития (Gerber
and Ferrara, 2000). Недавние исследования показали, что эндотелиальные клетки могут участвовать на разных уровнях остеогенеза: так остеоиндуктивные клетки путем высвобождения ростовых факторов, путем контроля основных трех транскрипционных факторов, необходимы для дифференцировки костных клеток (Dlx 5, cbfa1/runx2, osterix) и путем облегчения минерализации ткани в преваскулярной сети (Grellier et al., 2009b). Ростовые факторы, продуцируемые эндотелиальными клетками, включая VEGF и BMP-2, vasoconstrictor endothelin-1 (ET1) и insulin-like growth factor (IGF), которые влияют на миграцию и пролиферацию остеобластов и дифференцировку клеток остеопредшественников (Bouletreau et al.,
2002; Veillette and von Schroeder, 2004; Fiedler et al., 2006). В 1999, Napoleone Ferrara с сотрудниками оказались способны связать унифицированную концептуальную основу плейотропных эффектов VEGF на морфогенез кости. Этот цитокин является ключевым регулятором для i) инвазии кровеносных сосудов в эпифизарную ростовую пластинку, ii) ремоделирования гипертрофического хряща и iii) оссификации вновь сформированного костного матрикса с помощью остеобластов (трабекулы) (Gerber et al., 1999b). Общение между эндотелиальными клетками и кость-формирующими клетками, такими как остеобласты и клетки остеопредшественников, может быть постулировано, поскольку остеобласты и остеопредшественники продуцируют высокие уровни VEGF, которые способствуют ангиогенезу и жизнеспособности эндотелиальных клеток.
VEGF также влияет на остеогенные клетки поскольку он может способствовать рекрутированию клеток предшественников и их дифференцировке в остеобласты возможно путем активации VEGFR-1 (Mayr-Wohlfart et al., 2002; Fiedler et al., 2005). Мыши, дефицитные по VEGFR-1 обнаруживают пониженный объем кости, минерализованной поверхности и скорости отложения минералов и это сопровождается снижением минерализации стромальных клеток костного мозга (Otomo et al., 2007). Во время образования эндохондральной кости, фактически, хондроциты на верхушке ростовой пластинки первоначально пролиферируют, затем становятся зрелыми и гипертрофическими и в конечном итоге подвергаются апоптозу, и замещаются минерализованным внеклеточным матриксом. Гипертрофические хондроциты, как известно, чтобы секретировать ангиогенные молекулы, такие как transferrin, FGF-2, MMP-9, VEGF, которые рекрутируют кровеносные сосуды из соседней субхондральной кости (Baron et al., 1994; Vu et al., 1998; Horner et al., 1999; Gerber and Ferrara, 2000; Carlevaro et al., 1997, 2000).
У мышей и приматов, окада VEGF с помощью внутривенной инъекции растворимых VEGF-R белков почти полностью устраняет инвазию кровеносных сосудов в эпифизарную ростовую пластинку. Нарушенное развитие кровеносных сосудов провоцирует в свою очередь нарушения образования трабекулярных костей из-за безуспешной индукции апоптических сигналов в гипертрофические хондроциты и неспособности рекрутировать хондрокласты и остеобласты (Gerber et al., 1999b; Maes et al., 2002; Zelzer et al., 2002, 2003). Поразительно, после экспансии гипертрофических хондроцитов регион, сходный с тем, что описан у VEGF-дефектных животных, обнаруживается у гомозиготных мышей с нулевой мутацией в гене MMP-9
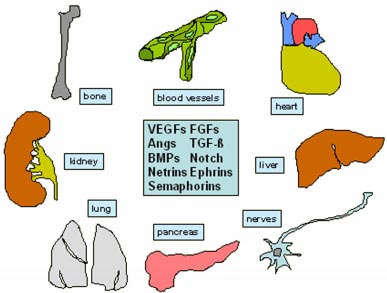 Fig. 1. Angiogenic growth factors are a class of molecules which
promote fundamental cues for cell fate specification, embryo pat-
terning, organ differentiation and tissue remodelling during embryo
development. See text for details.
Fig. 1. Angiogenic growth factors are a class of molecules which
promote fundamental cues for cell fate specification, embryo pat-
terning, organ differentiation and tissue remodelling during embryo
development. See text for details.
(Vu et al., 1998). Матрикс деградирующая протеаза MMP-9 является мощным пусковым механизмом высвобождения ангиогенных факторов из внеклеточного матрикса. Эти результаты предоставляют непосредственные доказательства, что инвазия сосудов в хрящ необходима для собственно формирования кости.
Angiogenic factors and neural development
Имеются всё увеличивающиеся доказательства, указывающие на строгие структурные и онтогенетические взаимоотношения между кровеносными сосудами и нервами.
Эта ассоциация, по-видимому, имеет особое значение для формирования паттерна периферической нервной системы, но вклад в обеспечение развития ЦНС также необходимо учитывать. Молекулярные механизмы, регулирующие общую прокладку нервов и кровеносных сосудов, привлекают значительный интерес в последние годы. Распознаны некоторые общие морфогенетические сигналы и механизмы, которые управляют образованием каждой из структур.
В самом деле, молекулы ведения аксонов, такие как semaphorins, ephrins,
Slits и netrins, функционируют также как ангиогенные и наводящие сосуды факторы. Ангиогенные ростовые факторы, такие как VEGF, обладают также нейрогенным потенциалом. Это предположение может объяснить, почему в периферических тканях кровеносные сосуды часто выстраиваются воль нервов и обнаруживают сходный паттерн ветвления (Mukouyama et al., 2002). С одной стороны, эндотелиальные клетки продуцируют сигналы, такие как artemin и neurotrophin 3, которые наводят аксоны, так чтобы они шли вдоль развивающихся сосудов (Carmeliet and Tessier-Lavigne, 2005). С др. стороны, нервы могут продуцировать сигналы, такие как VEGF-A, чтобы привлекать кровеносные сосуды и стимулировать жизнеспособность эндотелиальных клеток. Т.о., взаимное ведение с контексте элегантной "self-similarity logic" , по-видимому, работает при формирования паттерна как сосудистых, так и нервных сетей (Guidolin et al., 2011). Как растущие сосуды, так и распространяющиеся нейроны экспрессируют специфические регионы на верхушке своих фронтов продвижения, которые обладают некоторыми общими структурными и функциональными свойствами. В нейронах ростовые конусы проецируют многочисленные филоподии, которые активно вытягиваются и оттягиваются назад в ответ на внеклеточные сигналы (Gerhardt et al., 2003; Carmeliet and Tessier-Lavigne, 2005). Во врастающих сосудах эндотелиальные верхушечные клетки сходным образом выпускают филоподии, которые исследуют окружающую среду, чтобы управлять ростом нарастающих сосудов. Сигналы наведения аксонов и сосудов могут быть подразделены на привлекающие и отталкивающие сигналы. Эти молекулярные сигналы д. детерминировать, в каком направлении разрастающаяся структура д. следовать.
Общение между кровеносными сосудами и нервными структурами распознается как в центральной, так и периферической нервной системе. В субгранулярной зоне гиппокампа область, которая поддерживает активную пролиферацию в течение всей взрослой жизни, нейрогенез происходит внутри "ангиогенной ниши" (Palmer et al., 2000). Делящиеся нервные клетки, в самом деле, смешиваются с делящимися эндотелиальными клетками внутри плотных кластеров. Это указывает на то, что нейрогенез интимно ассоциирован с процессом активного привлечения, развития и ремоделирования сосудов. Поразительно, воздействие на E 15 эмбрионов крыс ингибитором ангиогенеза thalidomide приводит к сосудистым уродствам и аномальному развитию нейронов в регионах кортекса и гиппокампа (Hallene et al., 2006). Кроме того, морфологические изменения ассоциируют с гипервозбудимостью нейронов.
В системах совместного культивирования эндотелиальные клетки стимулируют самообновление и расширение нейрогенеза нейральных стволовых клеток из коры головного мозга мыши (Shen et al., 2004). Как эмбриональные (E 10-11) , так и взрослые нейральные стволовые клетки ответственны за растворимые факторы, высвобождаемые эндотелиальными клетками. Эндотелиальные клетки поддерживают развитие как проецирующихся нейронов. так и промежуточных нейронов, стимулирование нейроэпителиальных клеточных контактов и активация Notch и Hes1 способствуют самообновлению нейральных стволовых клеток. Т.о., эндотелиальные клетки, по-видимому, является критическим компонентом ниш нейральных стволовых клеток и ведут себя как критические элементы для поддержания стволовых клеток и нейрогенного потенциала. Передача сигналов эндотелиальными клетками участвует на ранних стадиях развития автономных нейронов. Во время раннего развития мышей первыми крупными артериями являются дорсальная аорта и каротидная система. Гладкомышечные клетки, окружающие эти сосуды, высвобождают диффундирующие факторы, которые управляют ростом симпатических нервов вдоль этих артерий (Glebova and Ginty, 2005; Larrivee et al., 2009). Среди этих факторов, endothelin-3 может быть возможным кандидатом на роль распространения аксонов симпатических нейронов вдоль стенки наружной carotid артерии (Makita et al., 2008). Artemin и neurotrophin 3 являются др. молекулами, секретируемыми эмбриональными кровеносными сосудами, обладающие способностью удлинять аксоны вдоль сосудов из нейронов симпатической цепочки ганглиев (Honma et al., 2002; Kuruvilla et al., 2004).
У эмбрионов птиц, эндотелий и покрывающие мезенхимные клетки дорсальной аорты экспрессируют BMP белки, а именно, BMP-4 и BMP-7, в непосредственной близи к месту, где клетки sympathoadrenergic предшественников агрегируют и начинают дифференцироваться в адрегергические ганглиолярные клетки. BMP-4 и BMP-7 способны индуцировать экспрессию адренергического маркерного энзима tyrosine
hydroxylase в культурах клеток нервного гребня (Schneider et al., 1999). BMP-
2 индуцирует дифференцировку автономных клеток в культуре клеток стволового нервного гребня крыс, это распознается по экспрессии Mash1, транскрипционного фактора, необходимого для аутономного нейрогенеза. В целом эти исследования показывают, что эндотелиальные клетки предоставляют инструктивные сигналы для дифференцировки соседних клеток нервного гребня.
Concluding remarks
In this review article, we have presented the most recent data
concerning the role of angiogenic factors as promotors of cell fate
specification, embryo patterning, organ differentiation and tissue
remodelling during organogenesis (Fig. 1). The majority of these
effects are linked to endothelial cells. Endothelial cells release in a
paracrine fashion and express to the cell surface many signalling
molecules that can affect the destiny of developing tissue cells
intimately associated to them. The emerging scenario is that of a
general developmental model whereby cross-talk between endo-
thelial cells and tissue cells would be responsible for a series of
sequential inductive and differentiating events. Angiogenic factors,
in particular the members of the VEGF family, represent molecular
effectors which provide pleiotropic effects, being able to influence
not only vascular development but also a series of tissue-linked
differentiating properties.
|
Сайт создан в системе
uCoz Fig. 1. Angiogenic growth factors are a class of molecules which
promote fundamental cues for cell fate specification, embryo pat-
terning, organ differentiation and tissue remodelling during embryo
development. See text for details.
Fig. 1. Angiogenic growth factors are a class of molecules which
promote fundamental cues for cell fate specification, embryo pat-
terning, organ differentiation and tissue remodelling during embryo
development. See text for details.