Посещений:  β-КЛЕТКИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
β-КЛЕТКИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Индукция дифференцировки недифференцированных клеток.
|
|
Induction of differentiation of undifferentiated cells
into pancreatic β-cells in vertebrates.MASAKI HOSOYA, YUYA KUNISADA, AKIRA KURISAKI and MAKOTO ASASHIMA  Int. J. Dev. Biol. 56: 313-323 (2012)
doi: 10.1387/ijdb.123522mh |
The β-cells of the pancreatic islets, which maintain glucose homeostasis by secreting insulin, are important cells for sustaining life. In recent years, islet transplantation has been performed as a treatment for type I diabetes. Since there are not enough donors for patients awaiting transplantation, β-cells grown in vitro are expected to be utilized as a substitute for islets. To obtain the cells with properties of human β-cells, it is necessary to understand the process by which human pancreatic islets are formed, as well as their structural characteristics. By using undifferentiated cells, such as Xenopus laevis animal caps and mouse ES cells, pancreatic tissue has shown to be able to be induced in vitro. Various attempts have been made to obtain human β-cells from human ES/iPS cells. Versatile methods have been developed and improved efficiency has been achieved by the use of low molecular weight compounds, but the challenge remains to prevent tumor formation and achieve functional maturation. Inducing the differentiation of somatic stem cells into insulin-producing cells has also brought us closer to clinical application. There are still many challenges related to the practical use of β-cells derived from undifferentiated cells, such as the development of methods to substitute these cells for host β-cells, standardization of the treatment protocol, quality control, and confirmation of safety. Research on the methods of inducing undifferentiated cells to differentiate into β-cells has shown definite progress, suggesting that cell therapy for diabetes may become a preferred therapeutic option over islet transplantation.
|
Во время эмбрионального развития поджелудочная железа происходит из энтодермы. Панкреас это экзокринная железа, которая секретирует панкреатический сок, содержащий переваривающие ферменты, в ЖКТ, но она обладает также дополнительными эндокринными функциями у всех позвоночных от амфибий и т. д. (Heller, 2010). Эндокринные клетки поджелудочной железы формируют массы, наз. островками Лангерганса (pancreatic islets) (In't Veld and Marichal, 2010). Все гормоны, секретируемые панкреатическими островками, участвуют в регуляции метаболизма и концентрации в крови глюкозы, удерживая её в относительно узких пределах. Поскольку глюкоза является принципиальным углеводом крови и является важным источником питания, которые передает энергию в каждую часть тела, чрезвычайно высокий уровень глюкозы вызывают фатальные повреждения различных органов (Stolar, 2010). Инсулин является гормоном, продуцируемым панкреатическими β-клетками, который обладает уникальным действием, снижающим содержание глюкозы в крови, и поэтому является особенно важным гормоном для поддержания жизни. Панкреатические β-клетки синтезируют и секретируют инсулин в ответ на увеличение уровня глюкозы в крови, чтобы поддерживать его в нормальных границах. Если возникает состояние, при котором контроль глюкозы в крови становится невозможным из-за абсолютного дефицита инсулина, возникающего в результате потери или дисфункции панкреатических β-клеток или из-за увеличения периферической резистентности к действию инсулина, то диагностируется diabetes mellitus. Если гипергликемия продолжается в течение длительного периода, то могут появиться осложнения, такие как нейропатии, ретинопатии и нейропатия может возникнуть вместе с дисфункцией органа или гангренами нижних конечностей (amputation) в результате сосудистых болезней. Такие осложнения являются значительной помехой у диабетических пациентов и угрожают жизни, поэтому лечение диабета чрезвычайно важно (Dailey, 2011). Инсулин впервые был получен в 1921, и с тех пор он используется в очень больших количествах у пациентов с диабетом. В последние годы разработаны лекарства, которые стимулируют секрецию инсулина или ослабляют резистентность к инсулину и стало возможным лучше регулировать уровень глюкозы в крови диабетических пациентов (Tahrani et al., 2011). Однако, ежедневный мониторинг глюкозы и инъекции инсулина всё ещё необходимы пациентам, если продукция инсулина истощена, как это происходит при диабете типа 1 или продвинутом диабете типа 2 и облегчение этого груза становится объектом антидиабетической терапии. Более того, инсулин обладает др. функциями помимо регуляции уровней глюкозы в крови, поэтому поддержание базовой секреции инсулина также очень важно (Niswender, 2011).
Поскольку панкреатические β-клетки не просто продуцируют и секретируют инсулин с постоянной скоростью, но необходимы и определенные своевременные запасы, инсулиновая зависимость, как полагают, облегчается трансплантацией поджелудочной железы, путем регенерации панкреатических β-клеток или с помощью трансплантации панкреатических островков. С целью снижения хирургического стресса у пациентов, продолжались многолетние исследования пациентов с трансплантированными островками (Emamaullee and Shapiro, 2008). После Edmonton protocol модифицированного иммуносупрессантного режима (Shapiro et al., 2000), трансплантации панкреатических островков широко используются в последние годы. Хотя длительная свобода от инсулиновой терапии ещё не достигнута, улучшение гликемического контроля наблюдалось во многих случаях. Однако, из-за неспособности некоторых островков функционировать после трансплантации, необходимы панкреатические островки более, чем от одного донора для эффективного лечения. Поэтому нехватка доноров становится проблемой. Поскольку трансплантации панкреатических островков, производимые для лечения хронического панкреатита, а также диабета, сопряжены с чрезвычайной болью, необходимы дальнейшие технические усовершенствования (Matsumoto, 2011).
Регенерация панкреатических β-клеток является одной из технологий, которая привлекает внимание, для преодоления нехватки доноров панкреатических островков (Guo and Hebrock, 2009; Weir et al., 2011, Wen et al., 2011). Из-за трудностей культивирования панкреатических β-клеток, полученных от доноров, и поддержания их свойств во время пролиферации, использованы др. источники клеток для трансплантации. Недавно разработаны методы для индукции функциональных панкреатических β-клеток из легко растущих недифференцированных клеток, таких как ES клетки (Thomson et al., 1998) или недавно открытые induced pluripotent stem cells (iPS) человека (Takahashi et al., 2007; Yu et al., 2007; Okita et al., 2011) (Weir et al., 2011; Wen et al., 2011). Поскольку панкреатические β-клетки обладают уникальными свойствами синтеза и секреции инсулина в ответ на увеличение концентрации глюкозы в крови, индукция дифференцировки этих клеток интересна также с научной точки зрения.
Structure and development of the pancreas and pancreatic islets
Прежде проведения исследований по регенерации поджелудочной железы и панкреатических островков необходимо понять их структуру и развитие. Имеется уже множество обзоров по дифференцировке поджелудочной железы и панкреатической эндокринной системы (Murtaugh, 2007; Oliver-Krasinski and Stoffers, 2008; Puri and Hebrok, 2010; Pan and Wright, 2011).
Инсулин является гормоном, который широко присутствует в царстве животных. У низших животных клетки, которые секретируют инсулин, расположены в пищеварительном тракте, а не в поджелудочной железе (Heller, 2010). Однако у круглоротых (Cyclostomata) такие как миноги, клетки, которые секретируют инсулин, формируют похожие на панкреатические островки структуры, расположенные вне пищеварительного тракта. У высших животных, начиная с хрящевых рыб (Chondrichthyes), эти клетки образуют панкреатические островки (Heller, 2010). С эволюционной точки зрения панкреатические эндокринные клетки скорее всего возникли, чтобы давать кластеры клеток, поскольку их морфология приспособлена для эффективно исполнения их функций (Madsen, 2007; Heller, 2010). В соответствии с этими филогенетическими находками было установлено, что кластеры эндокринных клеток формируются в поджелудочной железе млекопитающих за счет миграции клеток из панкреатического эпителия во время эмбрионального развития. Давно известно из морфологических наблюдений, что островки формируются из панкреатического эпителия, но механизм был установлен лишь недавно (Greiner et al., 2009). Хотя миграция играет важную роль в развитии панкреатической эндокринной системы, обеспечение миграции во взрослой поджелудочной железе, по-видимому, затруднено, поскольку структура уже установлена. Это может быть одним из барьеров, мешающих регенерации панкреатической эндокринной системы. Сигналы, которые стимулируют панкреатические эндокринные клетки мигрировать во время эмбрионального развития неясны, но G protein-coupled рецептор и его лиганд sphingosine-1-phosphate, как было установлено, участвуют в этом процессе (Serafimidis et al., 2011).
Существуют межвидовые различия в морфологии поджелудочных желез. Напр., обнаруживаются заметные различия во внешнем виде поджелудочных желез у грызунов и человека. У грызунов поджелудочная железа распределена в виде сеткообразного (reticular) паттерна вдоль мезентерия, тогда как поджелудочная железа является самостоятельным клинообразным органом у человека. Печень активно регенерирует и снабжена чрезвычайно развитой сосудистой сетью. С др. стороны, поджелудочная железа человека характеризуется сосудистой системой, базирующейся на околопанкреатических артериях
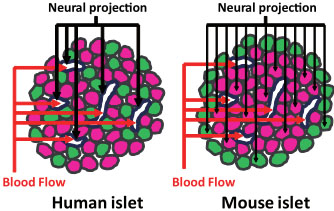 Fig. 1. Structural differences between human and mouse pancreatic islets. In the human islet, β-cells and a-cells are intermingled (left). The nerves innervating human islets project to blood vessels but not to endocrine cells. In contrast, the mouse islet (right) has a so-called "mantle core" structure, in which β-cells form a central cluster and are surrounded by a-cells at the periphery. Nerves innervating mouse islets project directly onto the endocrine cells.
Fig. 1. Structural differences between human and mouse pancreatic islets. In the human islet, β-cells and a-cells are intermingled (left). The nerves innervating human islets project to blood vessels but not to endocrine cells. In contrast, the mouse islet (right) has a so-called "mantle core" structure, in which β-cells form a central cluster and are surrounded by a-cells at the periphery. Nerves innervating mouse islets project directly onto the endocrine cells.
(Okahara et al., 2010), и компартментализация её кровоснабжения также может быть препятствием для её регенерации. Поджелудочная железа обычно образуется за счет слияния двух зачатков, которые, как являются дорсальным и вентральным зачатками, ноу азиатских домашних землероек (Suncus murinus) два зачатка не сливаются (Yi et al., 2003). В органных культурах панкреатические зачатки крыс левая и правая доли сливаются и неразличимы (Spooner et al., 1970). Анатомическое сравнение между азиатскими землеройками и человеком показало, что даже если две части поджелудочной железы слиты анатомия кровеносных, лимфатических сосудов и нервов, происходящих из правого и левого зачатков отличается (Yi et al., 2003). Кроме того, pancreatic polypeptide (PP) клетки, обнаруживаются в правой доле, но редки в левой доле (Gersell et al., 1979). Фактически, два разных типа панкреатических островков обнаруживаются во время плодного развития у человека, один тип содержит мало PP клеток и др. почти полностью состоят из PP клеток (Riedel et al., 2011). Это также подчеркивает важность учитывать различия между левой и правой долями при изучении дифференцировки и функции поджелудочной железы. Структура панкреатических островков варьирует между видами животных. Панкреатические эндокринные клетки являются преимущественно β-клетками, формирующими сложные агрегаты из 5 разных типов эндокринных клеток (Heller, 2010). Панкреатические островки грызунов, т. наз. "mantle-core structure," с β-клетками в центре и окружены α-cells, тогда как β-клетки и α-cells перемешаны у человека (Fig. 1) (Brissova et al., 2005). Так, панкреатические островки свиней, по-видимому, содержат агрегаты из небольших структур мантии и сердцевины, а панкреатические островки обезьян очень сходны по морфологии с таковыми у людей (Brissova et al., 2005), расположение эндокринных клеток в островках, по-видимому, меняется в ходе эволюции. Имеются и др. структурные компоненты панкреатических островков, включая кровеносные сосуды и нервы (In't Veld and Marichal, 2010). В то время как панкреатические эндокринные клетки грызунов плотно иннервированы автономными нервами, панкреатические эндокринные клетки человека получают едва обнаруживаемую прямую автономную (вегетативную) иннервацию (Fig. 1) (Rodriguez-Diaz et al., 2011). В противоположность эндокринным клеткам кровеносные сосуды панкреатических островков грызунов имеют лишь редкую иннервацию, тогда как сосуды панкреатических островков человека обнаруживают плотную иннервацию (Fig. 1) (Rodriguez-Diaz et al., 2011). Эти находки показывают, что роль вегетативной нервной системы в регуляции панкреатической функции отличается у человека и грызунов.
Differentiation of the pancreas
Знание о панкреатическом развитии получены с помощью разнообразных подходов, включая культивирование стволовых клеток, чтобы они дифференцировались в панкреатические β-клетки. Были также предприняты попытки по обеспечению пролиферации эндогенных панкреатических β-клеток и по индукции дифференцировки β-клеток из клеток предшественников или стволовых клеток in situ. Знания, полученные в исследованиях генетически модифицированных животных, в частности, вносят вклад в выяснение механизмов, участвующих в дифференцировке и регенерации панкреас. Однако, этические предписания делают невозможным подтверждение этих находок у человека. Поскольку всё, что может быть сделано на животных требует учитывать возможные межвидовые различия.
Поскольку этически невозможно модифицировать гены человека, чтобы исследовать развитие поджелудочной железы in vivo, поэтому анатомические исследования составляют основу нашего знания о дифференцировке поджелудочной железы человека. С др. стороны, трансплантации панкреатических зачатков (выделенных из эмбрионов человека) под почечную капсулу экспериментальных животных, делают возможным наблюдение процесса органогенеза (Fig. 2). В исследованиях на животных пульсовое мечение аналогом нуклеиновых кислот bromodeoxyuridine (BrdU) путем добавления его к питьевой воде позволило оценить клеточную пролиферацию in situ. У людей такие исследования не могут быть осуществлены непосредственно и мы можем исследовать пролиферацию только после трансплантации панкреас в подпочечную капсулу животных. У мышей β-клетки взрослых обладают способность регенерировать (Brennand et al., 2007). С др. стороны, исследования поджелудочной железы человека показали, что клетки, экспрессирующие NGN3 не метятся с помощью BrdU (Castaing et al., 2005), указывая тем самым, что размер панкреатической эндокринной системы на этой стадии уже предопределен. Функциональные линии β-клеток человека были недавно получены за счет иммортализации вирусами дифференцирующихся клеток в пролиферативной фазе роста под почечной капсулой (Ravassard et al., 2011). Существует всё ещё множество ограничений касательно исследований эмбрионов человека. Необходимо создать pancreata путем культивирования мультипотентных стволовых клеток, таких как ES/iPS клеток скорее, чем выделения её из эмбрионов.
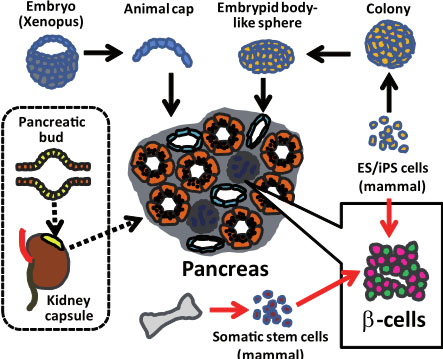 Fig. 2. Strategies for obtaining pancreatic β-cells from undifferentiated cells. Pancreatic buds autonomously differentiate into pancreatic tissue when isolated and grafted under the kidney capsule in immunodeficient mice (dotted line). In vitro, the animal caps of Xenopus blastulas and embryoid body-like spheres of mouse ES cells can also undergo differentiation into pancreatic tissue (top). Methods for specific induction of β-cells have been explored by utilizing ES/iPS cells and somatic stem cells (right).
Fig. 2. Strategies for obtaining pancreatic β-cells from undifferentiated cells. Pancreatic buds autonomously differentiate into pancreatic tissue when isolated and grafted under the kidney capsule in immunodeficient mice (dotted line). In vitro, the animal caps of Xenopus blastulas and embryoid body-like spheres of mouse ES cells can also undergo differentiation into pancreatic tissue (top). Methods for specific induction of β-cells have been explored by utilizing ES/iPS cells and somatic stem cells (right).
Избирательная дифференцировка мультипотентных стволовых клеток позвоночных, чтобы сформировать поджелудочную железу in vitro, была продемонстрирована в исследовании недифференцированной клеточной массы бластулы (анимальной шапочки) у Xenopus laevis (Fig. 2) (Moriya et al., 2000a, 2000b). Анимальные шапочки могут быть эффективно дифференцированы в панкреас-подобную ткань путем инкубации с высокой концентрацией activin, затем воздействия ретиноевой кислоты и дальнейшего культивирования (Fig. 3). Полученная таким образом ткань экспрессировала инсулин и глюкагон. Идентифицированы похожие на ацинарные клетки, содержащие секреторные гранулы, подтверждая, что недифференцированные клетки могут быть дифференцированы в панкреатическую ткань in vitro. Путем оптимизации концентраций activin и ретиноевой кислоты была индуцирована дифференцировка различных органов из анимальной шапочки (Asashima et al., 2009). Если анимальная шапочка культивируется без стимуляции, то она становится аморфным эпидермисом, но воздействие низкой концентрации activin индуцирует кровяные островки и мышцы. Когда анимальная шапочка обрабатывается высокой концентрацией activin, то индуцируется дифференцировка хорды и энтодермальных клеток также. Путем комбинирования activin с ретиноевой кислотой или физическими манипуляциями становится возможным индуцировать дифференцировку 22 различных внутренних органов и органов из анимальной шапочки. Т.к. получаются воспроизводимые результаты с анимальными шапочками, то получение последовательных выборок и профилей генной экспрессии д. позволить нам создать дорожные карты экспрессии генов для органогенеза и для обнаружения новых маркеров панкреатической дифференцировки (Kurisaki et al., 2010). Комбинированное воздействие activin и ретиноевой кислоты впоследствии было применено к мышиным ES клеткам, и продукция поджелудочной железы млекопитающих была успешной (Nakanishi et al., 2007). Когда мышиным ES клеткам позволяли формировать сферы, похожие на эмбриоидные тельца (EBSs), и затем они обрабатывались activin и ретиноевой кислотой, формировалась панкреатическая ткань, которая содержала как экзокринные, так и эндокринные клетки (Fig. 2). В отличие от эмбриоидных телец (EB), которые формируются за счет реагрегации ферментативно диссоциированных ES клеток, EBS происходят из одиночной ES клетки. Поскольку EBSs образуются без нарушения межклеточных слипчивых соединений и их структура ближе к таковой из анимальной шапочки Xenopus или ранних эмбрионов мыши, они, по-видимому, обладают некоторыми преимуществами по достижению панкреатической дифференцировки. Довольно легко создавать EBSs из мышиных ES клеток, но трудно стимулировать человеческие ES к образованию масс недифференцированных клеток. Эти отличающиеся свойства человеческих и мышиных ES клеток объясняются их происхождением на разных стадиях эмбриогенеза. Когда мышиные epistem cells (EpiSCs) были выявлены в более продвинутых эмбрионах, чем пост-имплантационные эмбрионы, используемые в качестве источника ES клеток,их свойства сильно напоминали таковые у ES клеток человека (сходная морфология, независимость от LIF и зависимость от bFGF для поддержания плюрипотентности и т.д.) (Tesar et al., 2007). Мышиные ES клетки обладают как химера-формирующими, так и тератома-формирующими свойствами, тогда как мышиные EpiSCs могут формировать тератомы, но не химеры. В последнее время считается, что ES клетки крыс не обладают способностью формировать химеры, но химеры были недавно установлены из этих клеток путем блокирования сигналов дифференцировки с низким молекулярным
 Fig. 3. Schematic representation of in vitro organ induction with Xenopus animal caps. Animal caps are treated with various concentrations of activin A, followed by dissociation and re-aggregation (D&R), and then by sandwiching with untreated caps (Sd). This results in induction of various organs. By combining activin A with retinoic acid, other organs can be induced, including the pancreas. A high concentration of activin A is effective at inducing endodermal organs, but subsequent treatment with retinoic acid is necessary for pancreatic differentiation. It has become possible to induce the differentiation of 22 different organs through these strategies.
Fig. 3. Schematic representation of in vitro organ induction with Xenopus animal caps. Animal caps are treated with various concentrations of activin A, followed by dissociation and re-aggregation (D&R), and then by sandwiching with untreated caps (Sd). This results in induction of various organs. By combining activin A with retinoic acid, other organs can be induced, including the pancreas. A high concentration of activin A is effective at inducing endodermal organs, but subsequent treatment with retinoic acid is necessary for pancreatic differentiation. It has become possible to induce the differentiation of 22 different organs through these strategies.
весом соединений (Buehr et al., 2008; Li et al., 2008). Исходя из этих находок, были распознаны две фазы плюрипотентности, известные как "naive" и "primed" (Nichols and Smith, 2009). Во время стадии бластоциста неограниченные (naive) клетки, как полагают, генерируются первыми и затем эти клетки подготавливаются для детерминации клонов (primed). Их свойства воспроизводятся культивируемыми ES клетками и EpiSCs. Недавно, описан оптимум культуральных условий для быстрого фенотипического превращения человеческих ES клеток из primed в naive клетки (Gu et al., 2012). Когда naive человеческие ES/iPS клетки становятся доступны повседневно, то такие клетки могут быть пригодны для проведения исследований органогенеза in vitro посредством образования EBS. Поскольку поджелудочная железа содержит как экзокринные, так и эндокринные клетки, которые могут быть сформированы в почечной капсуле в месте, которое полностью отличается от их анатомического расположения (Castaing et al., 2005), то предполагается, что нейральное вовлечение не существенно для дифференцировки панкреатической эндокринной системы. Более того, поскольку недифференцированные Xenopus анимальные шапочки и мышиные ES клетки могут быть избирательно понуждены дифференцироваться в функциональную поджелудочную железу in vitro (Moriya et al., 2000a, 2000b, Nakanishi et al., 2007), система кровоснабжения, по-видимому, не существенна для этого. С др. стороны, сосудистая эндотелиальная система, очень важная для развития органов (Crivellato et al., 2007) и для дифференцировки эндокринной системы, а также для ранней дифференцировки поджелудочной железы, регулируется сигналами от кровеносных сосудов (Lammert et al., 2001). Напротив, кровеносные сосуды привлекаются панкреатическими островками с помощью секреции сигнальных молекул, таких как IL-1b (Shchors et al., 2006). Мезенхима также выполняет важную роль в панкреатическом развитии (Scharfmann, 2000). Чтобы достичь роста панкреатической ткани или достаточного количества эндокринных клеток для использования лечения диабета, то может быть необходимо модифицировать протокол стимуляции органогенеза, так, чтобы способствовать ангиогенезу, отдельно от детерминации судеб панкреатических и эндокринных клонов.
В др. исследовании ES/iPS клетки крыс были инъецированы мышиным эмбрионам, которые потеряли способность формировать поджелудочную железу с помощью генетических модификаций и была достигнута продукция чужеродной поджелудочной железы с помощью "blastocyst complementation" (Kobayashi et al., 2010). Теоретически также возможен, что может быть проделано и у таких крупных животных, как свиньи. Существуют этические проблемы с продукцией химерных эмбрионов человек-животные. Имеются также трудности, связанные с их практическим использованием, поскольку трудно полностью удалять клетки, происходящие от хозяина, такие как сосудистые клетки. Однако, если бы это было возможно продуцировать поджелудочную железу таким способом, то это был бы важный инструмент для диабетических исследований и клинического применения.
Selective induction of the differentiation of ES/iPS cells into pancreatic β-cells
Мышиные ES клетки первоначально использовали для разработки методов для
Fig. 4. Methods for obtaining pancreatic β-cells from human ES/iPS cells. The steps of each protocol are aligned based on the use of cytokines, low molecular weight compounds, and supplements for the culture medium. Activin and retinoic acid are denoted by red and blue letters, respectively. Since the protocols reported by Shin et al., and Nostro et al., contain the steps to treat the cells after formation of embryoid bodies, notes are provided in parentheses. FBS, fetal bovine serum; FGF, fibroblast growth factor; DAPT, N-(N-((3,5-Difluorophenyl)acetyl)-L-alanyl)-L-phenylglycine tert-butyl ester; IGF, insulin-like growth factor; HGF, hepatocyte growth factor; KGF, keratinocyte growth factor; KAAD-CYC, 3-Keto-N-(aminoethyl-aminocaproyl-dihydrocinnamoyl) cyclopamine, ILV, (-)-Indolactam V; GLP, glucagon-like peptide; BMP, bone morphogenetic protein; VEGF, vascular endothelial growth factor.
для избирательной индукции ES клеток, чтобы дифференцировать их в панкреатические β-клетки (Lumelsky et al., 2001; Soria 2001; Blyszczuk et al., 2004), но исследования на ES клетках и iPS клетках человека теперь становятся основным направлением. Несмотря на это мышиные ES клетки получили преимущества в отношении легкости генетических модификаций и превращения их в линии клеток и оказались пригодными для детального анализа механизмов дифференцировки (Marchand et al., 2009). Поскольку находки, полученные с помощью клеток, происходящих из мышиных ES клеток, могут быть легко интерпретированы в экспериментах на животных, их значение для базовых исследований остается непревзойденным.
Описаны многочисленные методы понуждения ES клеток человека дифференцироваться в инсулин-продуцирующие клетки (Fig. 4). Использование activin для индукции дифференцировки недифференцированных ES клеток в энтодерму и индукции панкреатической дифференцировки путем комбинации ретиноевой кислоты с др. фактором, являются важными элементами, которые являются общими почти для всех методов (Fig. 4) (D'Amour et al., 2006; Jiang et al., 2007; Kroon et al., 2008; Chen et al., 2009; Thatava et al., 2011). Дифференцировка glucagon-продуцирующих клеток с помощью сходных методов также было описано (Rezania et al., 2011). Возможно, что индукция панкреатической дифференцировки мышиных EBSs возможна с помощью одновременной стимуляции activin и ретиноевой кислотой (Nakanishi et al., 2007),но, по-видимому, необходима обработка ES клеток человека этими факторами последовательно. Воздействие activin и ретиноевой кислоты было осуществлено отдельно в исследованиях по индукции ES клеток человека дифференцироваться посредством образования EBs (Shim et al., 2007; Nostro et al., 2011). Эти различия между людьми и мышами, по-видимому, скорее всего, могут быть приписаны различиям в эмбриональных стадиях, на которых возникают ES клетки человека и мыши. Необходимо проведение исследований с мышиными EpiSCs, чтобы подтвердить эту точку зрения.
Из-за различий в свойствах между ES клеточными линиями человека, подчеркивается, что необходимо найти линии, которые будут легко обнаруживать панкреатическую дифференцировку (Osafune et al., 2008).
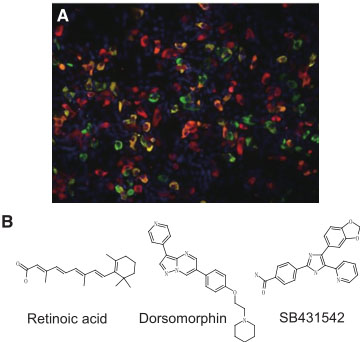 Fig. 5. Pancreatic endocrine cells prepared from human iPS cells. (A) Pancreatic endocrine cells were differentiated from human iPS cells using the method reported by Kunisada et al. Insulin (red), glucagon (green) and nuclei (blue) were identified by immunofluorescent staining. (B) The low molecular weight compounds used for pancreatic differentiation.
Fig. 5. Pancreatic endocrine cells prepared from human iPS cells. (A) Pancreatic endocrine cells were differentiated from human iPS cells using the method reported by Kunisada et al. Insulin (red), glucagon (green) and nuclei (blue) were identified by immunofluorescent staining. (B) The low molecular weight compounds used for pancreatic differentiation.
Kunisada et al., недавно разработали метод индукции iPS клеток человека, чтобы дифференцировать их в инсулин-продуцирующие клетки (Fig. 5) путем скрининга на низкомолекулярные соединения, чтобы стимулировать каждую стадию дифференцировки (напр., путем комбинации их с активином. ретиноевой кислотой и т. д.) (Kunisada et al., 2012). Специальным признаком их метода является то, что инсулин-продуцирующие клетки получаются с одинаковой эффективностью, когда используются разные человеческие iPS клеточные линии. Эта разносторонность была подтверждена на многих iPS клеточных линиях, которые отличались по возрасту, полу донора и методу перепрограммирования, но не было проведено исследований с ES клетками человека. Помимо инсулин-продуцирующих были индуцированы с помощью этого метода клетки, продуцирующие glucagon, somatostatin и ghrelin среди панкреатических эндокринных клеток, но не было клеток, продуцирующих PP. Неравномерность распределения PP клеток в поджелудочной железе упоминалась выше и вполне возможно, что индукция ткани, соответствующая левой доле поджелудочной железы (которая содержит PP клетки) может нуждаться в иных сигналах. Сообщалось, что возможна регулировка дифференцировки поджелудочной железы с помощью низкомолекулярных соединений, подобных ингибиторам гистоновой деацетилазы (HDAC) (Haumaitre et al., 2009), и такие соединения были описаны как эффективные для усиления эффективности дифференцировки человеческих ES и iPS клеток в инсулин-продуцирующие клетки. Chen et al., сообщили, что (-)-indolactam V является соединением, которое эффективно заставляет ES клетки человека дифференцироваться в PDX1-экспрессирующие клетки (Chen et al., 2009). В методе, описанном Kunisada et al., экспрессия PDX1 индуцируется, когда SOX17-позитивные энтодермальные клетки подвергаются действию ретиноевой кислоты и dorsomorphin (ингибитор BMP type I рецептора), в этом случае дифференцировка идет настолько далеко, до NGN3-позитивных панкреатических эндокринных клеток предшественников, когда добавлялся SB431542 (ингибитор TGFβ type I рецептора) в то же самое время (Fig. 5) (Kunisada et al., 2012). Более того, использование ALK5 ингибитора II описано в системе для дифференцировки α-клеток. Поскольку экспрессия Hedgehog ингибируется в панкреатических зачатках по сравнению с окружающими органами, поэтому два ингибитора Hedgehog сигналов (cyclopamine и KADD-cyclopamine) были использованы во многих др. методах (D'Amour et al., 2006, 2007; Kroon et al., 2008; Chen et al., 2009; Thatava et al., 2011; Nostro et al., 2011; Rezania et al., 2011).
Проведено детальное сравнение функций между человеческими панкреатическими β-клетками и инсулин-продуцирующими клетками, которые дифференцируются из ES клеток человека (Basford et al., 2011). Определение профилей экспрессии генов показало, что гены, связанные с функциями β-клеток, такими как ощущение глюкозы и экзоцитоз, экспрессируются в обоих типах клеток, т.к. являются специфическими транскрипционными факторами, участвующими в панкреатической эндокринной системе. Однако инсулин-продуцирующие клетки дифференцируются in vitro, также экспрессирующие glucagon и чувствительность к глюкозе не выявлены. Эти свойства напоминают таковые в недифференцированных эндокринных клетках, которые появляются во время эмбрионального развития. Тем не менее, находки, что инсулин-продуцирующие клетки, дифференцирующиеся in vitro, негомогенны подтверждает возможность получения клеток, которые будут пригодны для клеточной терапии путем очистки, базирующейся на различиях их свойств (Basford et al., 2011). Более того, долговременные жизнеспособность и функционирование in vivo были описаны, когда панкреатические похожие на островковые структуры были приготовлены из инсулин-продуцирующих клеток, которые были дифференцированы из ES клеток человека и трансплантированы животным с диабетом (Eshpeter et al., 2008). Способность ES и iPS клеток дифференцироваться в инсулин-продуцирующие клетки описана во многих работах. Однако отсутствует рутинный метод для индукции функционального созревания in vivo или in vitro.
Differentiation of somatic stem cells into pancreatic β-cells
Существуют некоторые проблемы с ES клетками человека, такие как изменения в количестве хромосом в результате повторного субкультивирования, чего не происходит с ES клетками мышей. Существуют также этические проблемы по использованию оплодотворенных яиц для получения ES клеток человека. Поскольку оплодотворенные клетки не нужны, то этический барьер снижается в отношении iPS клеток человека. Однако стандартизация iPS еще более трудна, чем для ES клеток человека, из-за различий в эффективности и аккуратности репрограммирования. Так как вероятность того, что ES клетки или iPS клетки будут формировать тератомы вероятна, то необходимо элиминировать недифференцированные клетки насколько это возможно. Это всегда проблема с ES/iPS клетками, которые получают искусственно. С др. стороны, индукция эндокринной дифференцировки была опробована с помощью трансдифференцировки ацинарных клеток и панкреатических клеток протоков. Zhou et al., показали, что возможно репрограммировать ацинарные клетки, чтобы они стали панкреатическими β-клетками in vivo путем внесения трех транскрипционных факторов (NGN3, PDX1 и MAFA) (Zhou et al., 2008). Также сообщалось, что трансдифференцировка α-клеток в β-клетки может быть осуществлена in vivo (Courtney et al., 2011). Эти искусственные методы трансдифференцировки, по-видимому, сталкиваются с теми же самыми проблемами, что и iPS клетки в отношении безопасности, связанной с репрограммированием, поэтому исследования по использованию эндогенных стволовых клеток также очень важны.
Прежде чем были открыты ES или iPS клетки, осуществлялось первичное культивирование панкреатических островков и др. панкреатических клеток (Campbell, et al., 1985; Bonner-Weir et al., 2004; Baeyens and Bouwens, 2008) , чтобы получать клеточные линии (Itkin-Ansari et al., 2003) и клетки предшественники со способностью пролиферировать во время эмбрионального развития (Xia et al., 2009), и такие клетки использовали в регенеративной медицине для диабета. Однако ни один из этих методов не достиг точки практического применения. Исследования крови пупочного канатика или из костного мозга происходящих стволовых клеток, панкреатических эпителиальных клеток протоков, ацинарных клеток и гепатоцитов осуществлялись широко (Aguayo-Mazzucato and Bonner-Weir, 2010), и попытки получения стволовых клеток из самой поджелудочной железы продолжаются (Jiang and Moraham, 2011).
Эффект снижения глюкозы в крови был описан, когда происходящие из костного мозга стволовые клетки вводили животным с диабетом (Hess et al., 2003). Усиление патологии отмечалось, когда происходящие из костного мозга стволовые клетки дифференцировались в инсулин-продуцирующие клетки in vitro и затем вводились животным с диабетом (Tang et al., 2004). Многие аспекты механизма, с помощью которого происходящие из костного мозга клетки дифференцировались непосредственно в панкреатические клетки, неизвестны, но имеются разные сообщения о улучшении течения диабета и восстановлении функции панкреатических β-клеток в результате лечения стволовыми клетками, происходящими из костного мозга. Поэтому исследования стволовых клеток, как метода лечения диабета, продолжаются (Ciceri and Piemonti, 2010). Описана также трансдифференцировка в инсулин-продуцирующие клетки после внесения гена PDX1 в мезенхимные стволовые клетки, происходящие из костного мозга человека (Li et al., 2007). С др. стороны, сообщалось, что панкреатические β-клетки реципиентов трансплантируемых клеток костного мозга не регенерировали в ответ на стимуляцию (Hamamoto et al., 2010). Кроме того, мезенхимные стволовые клетки, происходящие из костного мозга, как было установлено, обладают мультипотентной дифференцировке в разные ткани (Zuk et al., 2002). Более того, сообщалось, что мезенхимные стволовые клетки, происходящие из жировой ткани человека, могут индуцировать дифференцировку в панкреатические гормон-экспрессирующие клетки in vitro (Timper et al., 2006). Kajiyama et al., недавно осуществили внутривенные инъекции стволовых клеток, происходящих из жировой ткани, в которые был внесен ген PDX1 и было показано, что эти клетки колонизируют поджелудочную железу и дифференцируются в инсулин-продуцирующие клетки (Kajiyama et al., 2010). Было установлено, что на органогенетической стадии клетки панкреатических эндокринных предшественников теряют свою способность пролиферировать, как только экспрессируется NGN3 (Castaing et al., 2005). Т.о., внесение только одного PDX1 (без NGN3 или MAFA) может быть эффективным. Поскольку проверка трансплантаций на человеке невозможна, то, по-видимому, необходимо проведение исследований по трансплантации на экспериментальных животных прежде чем продолжить осторожные попытки клинического использования.
Сравнительно недавно было сообщено, что возможна индукция экспрессии инсулина клетками вне панкреатического клона, такого как pr,yfz пульпа, пупочный канатик, амниотическая жидкость и нейральные стволовые клетки, даже без переноса генов панкреатических клеток (Govindasamy et al., 2011; Kadam and Bhonde, 2010; Trovato et al., 2009; Kuwabara et al., 2011). Ещё до этих исследований было описано, что клетки, экспрессирующие маркер нейральных стволовых клеток nestin могут быть дифференцированы в инсулин-продуцирующие клетки (Lumelsky et al., 2001), хотя возможно, что этот результат был артефактом (Hansson et al., 2004). Однако недавнее исследование показало, что цитокин Wnt3, который секретируется паракринным способом нейральными стволовыми клетками, индуцирует экспрессию инсулина посредством NeuroD и ингибируется с помощью IGFBP-4 (Kuwabara et al., 2011). Поскольку нервные клетки и панкреатические β-клетки сходны в разных аспектах (Arntfield and van der Kooy, 2011), то возможно, что нейральные стволовые клетки также могут быть кандидатами на роль источника клеток, экспрессирующих инсулин.
Future prospects and challenges
Необходим тщательный контроль качества, когда клетки используются для медицинских нужд. Поскольку человеческие iPS клетки имеют преимущества, будучи полученными от самих пациентов (Maehr et al., 2009), поэтому всё ещё важно разработать критерии для клеток, которые могут использоваться клинически в отношении степени репрограммирования. Может быть более практичным банк клеток, включая человеческие ES клетки, надежность которых подтверждена и которые обнаруживают тканевую совместимость до определенной степени (Nakatsuji 2010). После того, как стволовые клетки выделены для культивирования, компоненты животного происхождения д. быть удалены на сколько возможно. В дополнение к истощению сыворотки д. быть обращено внимание на компоненты, такие как внеклеточный матрикс, поддерживающая культуральная среда и энзимы, используемые для извлечения клеток. Должны быть предпочтительны для клинического использования клетки, из которых удалены различные возможные загрязнения, чтобы стать пригодными для базовых и клинических исследований. Кроме того, поскольку существует риск образования опухолей в результате загрязнения клетками не дифференцированными адекватным образом, необходимо выработка критериев чистоты клеток. Современное состояние потенциала базирующейся на клетках терапии для диабета типа I суммированы в Table 1.
Поскольку сегодня трансплантации панкреатических островков осуществляются внутрипеченочно путем инфузии в портальную вену, то груз осложнений низок. Однако из-за множества факторов, включая качество островков, плохое снабжение кислородом и индукция иммунной реакции, доля выживания панкреатических островков после трансплантации не высока, так что трансплантации островков не очень эффективны.
Поскольку качество панкреатических островков зависит от здоровья донора, приёма донором лекарств метода обработки островков, то довольно трудно оценить вероятный исход в каждом отдельном клиническом случае (Berney and Toso, 2006). По этой причине трансплантации обычно проводят не более одного раза. Исследования на крысах подтвердили, что трансплантации в поджелудочную железу оказывают больший терапевтический эффект на диабет, нуждаются в меньшем количестве островков, чем при вливании в портальную вену для трансплантаций в печень (Stagner et al., 2008). Однако высокая инвазивность трансплантаций в поджелудочную железу и риск возникновения панкреатита являются проблемами, которые препятствуют клиническому их использованию (Rajab, 2010). Др. места для трансплантаций, включая селезенку и брюшину, также были исследованы, но доводы за и против и оптимальные места трансплантаций островков в них не установлены (Rajab, 2010). При использовании устройств, которые делают возможной иммунологическую изоляцию путем инкапсуляции панкреатических островков или β-клеток животного происхождения, так что они могут быть трансплантированы, но их длительное использование пока затруднительно.
Как сообщалось Kajiyama et al., если будет возможно инъецировать клетки в периферические вены для колонизации и дифференцировки в поджелудочную железу у человека, то вопрос о месте трансплантации будет решен (Kajiyama et al., 2010). Давно известно, что мезенхимные стволовые клетки проникают в кровоток и задерживаются в местах повреждений, но механизмы их самонаведения и миграции через стенки сосудов, неясны (Sordi, 2009). Однако, как было установлено, используются взаимодействия с помощью CXCR4-CXCL12 и CX3CR1-CX3CL1 в мезенхимных стволовых клетках, происходящих из костного мозга, и панкреатическими островками и мезенхимные стволовые клетки, экспрессирующие эти рецепторы, были выделены из панкреатических островков (Sordi et al., 2005). Т.о., использование механизма доставки, который уже существует в теле, дает преимущество мезенхимным стволовым клеткам, которыми не обладают ES/iPS клетки. Чтобы использовать эти клетки клинически, необходимы обширные проверочные эксперименты, чтобы гарантировать безопасность и эффективность. Процесс контроля качества переноса одиночного гена в аутогенные клетки более прост по сравнению с мониторингом клеток долговременных культур. Оценка методов внесения векторов генной экспрессии, которые не интегрируются в хромосомы, и замена белками и низкомолекулярными соединениями это цель будущих исследований.
Использование соединений низкого молекулярного веса для регуляции дифференцировки клеток вполне пригодно. Согласно обзору Lyssiotis et al., and Li et al., многие соединения могут быть использованы для регуляции дифференцировки и для репрограммирования клеток (Lyssiotis et al., 2011; Li et al., 2011). Механизмы действия некоторых соединений, которые регулируют дифференцировку стволовых клеток, уже известны и идентифицированы молекулы мишени для некоторых из них. Соединения, подобные последним, особенно связанные с выявлением новых механизмов регуляции клеток, включают индукцию дифференцировки. Дальнейшие исследования таких соединений д. приводить к разработке лекарств, которые будут стимулировать регенерацию органов, действуя на эндогенные стволовые клетки. Гиперплазия панкреатических β-клеток, пролиферация и неогенез могут возникать в связи с беременностью, тучностью и повреждениями панкреатических β-клеток, но эти процессы, как известно, отличаются у человека и грызунов (Rieck and Kaestner, 2010), поэтому необходимы очень тщательные исследования. Пролиферация панкреатических β-клеток не наблюдается у человека при беременности или диабете типа 2 (Rieck and Kaestner, 2010). Если возможно будет найти фактор, который ингибирует пролиферацию
TABLE 1SUMMARY OF POSSIBLE CELL-BASED THERAPIES FOR TYPE I DIABETES
*Living Cell Technologies (LCT, New Zealand) is conducting a Phase II clinical trial to study the safety and effectiveness of transplanting encapsulated porcine islet cells as a treatment for type 1 diabetes.
β-клеток, подобно открытому фактору репрограмирования для генерации iPS клеток, то мы полагаем, что будут разработангы низкомолекулярные лекарства для регенерации поджелудочной железы.
Доступность зрелых и функциональных панкреатических β-клеток человека очень важна не только для клеточной терапии, но и также для разработки лекарств от диабета. Панкреатические островки уже были использованы для проведения исследований, при трансплантациях панкреатических островков возникают повреждения как результат harvesting (Kin et al., 2007). Существует множество сообщений относительно первичной культуры, но к сожалению практичный протокол не установлен для культивирования островков, которые функционально интактны. Несмотря на то, что многие клеточные линии доступны, довольно трудно выявить панкреатические β-клетки, которые собственно сохраняют свою функцию in vitro. Клеточные линии, подобные INS-1 (Asfari et al., 1992) и MIN6 (Miyazaki et al., 1990) были получены от грызунов и внесли крупный вклад в исследования панкреатических β-клеток. После различных попыток получить линии клеток человека из эндокринных опухолей, подобных инсуломам, недавно были описаны EndoC-bH1 клетки как функциональная панкреатическая линия β клеток (Ravassard et al., 2011). Однако это единственный пример, что очень трудно культивировать человеческие панкреатические β-клетки. Предупреждение и лечение диабета чрезвычайно важно для здравоохранения особенно в экономической перспективе (Boqaert and Schrier, 2011). Более того, инсулин выполняет и др. важные функции помимо регуляции уровня глюкозы в крови, поэтому сохранение базального уровня секреции инсулина также необходимо (Niswender, 2011). Восстановление или поддержание функции имеющихся β-клеток, как полагают, будет снижать затраты здравоохранения, а также предупреждать прогрессирование диабета. Поэтому мы нуждаемся в человеческих панкреатических β-клетках, приготовленных in vitro из недифференцированных клеток. Открытие и разработка лекарств от диабета продолжаются с целью сохранения или восстановления функции панкреатических островков, которые повреждены в силу разных причин, включая гипергликемию.
Conclusion
Inducing the differentiation of pancreatic β-cells in vitro has been achieved as a result of various avenues of research. Selective induction of undifferentiated stem cells into cells that perform special functions such as pancreatic β-cells is very interesting from an academic standpoint. However, patients are looking forward to the establishment of a method of inducing pancreatic β-cell differentiation for the treatment of diabetes. As a result of continuing efforts, progress is being made in research aiming at the development of cell therapy for diabetes instead of pancreatic islet transplantation. This review has covered recent developments as far as possible. We hope it will be helpful for understanding which problems have been solved already and which problems remain to be tackled.
|
 Fig. 1. Structural differences between human and mouse pancreatic islets. In the human islet, β-cells and a-cells are intermingled (left). The nerves innervating human islets project to blood vessels but not to endocrine cells. In contrast, the mouse islet (right) has a so-called "mantle core" structure, in which β-cells form a central cluster and are surrounded by a-cells at the periphery. Nerves innervating mouse islets project directly onto the endocrine cells.
Fig. 1. Structural differences between human and mouse pancreatic islets. In the human islet, β-cells and a-cells are intermingled (left). The nerves innervating human islets project to blood vessels but not to endocrine cells. In contrast, the mouse islet (right) has a so-called "mantle core" structure, in which β-cells form a central cluster and are surrounded by a-cells at the periphery. Nerves innervating mouse islets project directly onto the endocrine cells.  Fig. 2. Strategies for obtaining pancreatic β-cells from undifferentiated cells. Pancreatic buds autonomously differentiate into pancreatic tissue when isolated and grafted under the kidney capsule in immunodeficient mice (dotted line). In vitro, the animal caps of Xenopus blastulas and embryoid body-like spheres of mouse ES cells can also undergo differentiation into pancreatic tissue (top). Methods for specific induction of β-cells have been explored by utilizing ES/iPS cells and somatic stem cells (right).
Fig. 2. Strategies for obtaining pancreatic β-cells from undifferentiated cells. Pancreatic buds autonomously differentiate into pancreatic tissue when isolated and grafted under the kidney capsule in immunodeficient mice (dotted line). In vitro, the animal caps of Xenopus blastulas and embryoid body-like spheres of mouse ES cells can also undergo differentiation into pancreatic tissue (top). Methods for specific induction of β-cells have been explored by utilizing ES/iPS cells and somatic stem cells (right). Fig. 3. Schematic representation of in vitro organ induction with Xenopus animal caps. Animal caps are treated with various concentrations of activin A, followed by dissociation and re-aggregation (D&R), and then by sandwiching with untreated caps (Sd). This results in induction of various organs. By combining activin A with retinoic acid, other organs can be induced, including the pancreas. A high concentration of activin A is effective at inducing endodermal organs, but subsequent treatment with retinoic acid is necessary for pancreatic differentiation. It has become possible to induce the differentiation of 22 different organs through these strategies.
Fig. 3. Schematic representation of in vitro organ induction with Xenopus animal caps. Animal caps are treated with various concentrations of activin A, followed by dissociation and re-aggregation (D&R), and then by sandwiching with untreated caps (Sd). This results in induction of various organs. By combining activin A with retinoic acid, other organs can be induced, including the pancreas. A high concentration of activin A is effective at inducing endodermal organs, but subsequent treatment with retinoic acid is necessary for pancreatic differentiation. It has become possible to induce the differentiation of 22 different organs through these strategies.  Fig. 5. Pancreatic endocrine cells prepared from human iPS cells. (A) Pancreatic endocrine cells were differentiated from human iPS cells using the method reported by Kunisada et al. Insulin (red), glucagon (green) and nuclei (blue) were identified by immunofluorescent staining. (B) The low molecular weight compounds used for pancreatic differentiation.
Fig. 5. Pancreatic endocrine cells prepared from human iPS cells. (A) Pancreatic endocrine cells were differentiated from human iPS cells using the method reported by Kunisada et al. Insulin (red), glucagon (green) and nuclei (blue) were identified by immunofluorescent staining. (B) The low molecular weight compounds used for pancreatic differentiation.