Передача сигналов Notch необходима для ремоделирования первичных сосудистых сплетений в иерархию зрелых сосудистых русл и для поддержания артериальной судьбы (Alva and Iruela-Arispe, 2004). Notch-3 экспрессируется на высоком уровне в перицитах, а разрушение передачи сигналов Notch-3 у
мутантных мышей ведет к увеличению сосудов из-за отсутствия перицитов (Wang et al., 2007). Пациенты, страдающие от синдрома CADASIL (Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarcts and Leukoencephalopathy), патологии, ассоциированной с мутациями в
, характеризуются присутствием сосудов, лишенных перицитов (Louvi et al., 2006). В пульпе зуба периваскулярные клетки в основном экспрессируют
(Lovschall et al., 2007) и в сетчатке перициты экспрессируют также Notch-3 (Claxton and Fruttiger, 2004). Недавно, Liu et al. (2009) показали, что нокдаун с помощью небольших интерферирующих РНК демонстрирует, что передача сигналов Notch-3 необходима для зависимой от эндотелия дифференцировки муральных клеток и что Notch-3 вносит вклад в проангиогенную способность муральных клеток, ко-культивируемых с эндотелиальными клетками.
Открытие, что члены семейства ephrins (Eph) дифференциально экспрессируются в артериях и венах с очень ранних стадий развития, что явилось первым указанием на то, что качественные особенности артерий и вен запрограммированы от природы. Eph-B2 экспрессируется в артериальных эндотелиальных клетках. Принципиальный рецептор для Eph-B2, Eph-B4, обнаруживает реципрокный паттерн экспрессии в эмбриональных венах (Bratley-Siders and Chen, 2004). Мутации Eph-B2 и Eph-B4 ведут к ранней эмбриональной летальности (Wang et al., 1998; Adams et al., 1999; Gerety et al., 1999; 2002). Ремоделирование первичных сосудистых сплетений в артерии и вены остановлено у обоих мутантов, это подтверждает роль Eph-B2/Eph-B4 взаимодействий для артериальных и венозных эндотелиальных клеток, соотв.
Ephrin-B2 является критическим регулятором миграции муральных клеток, врастания и адгезии во время сборки сосудистой стенки (Foo et al., 2006). Недавно Salvucci et al. (2009) сообщили, что Eph-B является критическим медиатором постнатальных перицитов для сборки эндотелиальных клеток в сосудистые трубки. Более того, ингибирование активности Eph-B предупреждает сборку перицитов и эндотелиальных клеток.
The role of pericytes in angiogenesis
Во время инициальной фазы ангиогенеза активированные перициты в выпячиваниях от родительских сосудов, укорачивают свои отростки и увеличивают свой объем, происходит интенсивная пролиферация клеток, перициты проецируются в периваскулярное пространство, их базальная мембрана разрушается и фрагментируется и происходит отсоединение от стенки сосуда (Diaz-
Flores et al., 1992). Хотя первоначальное врастание эндотелиальных клеток может происходить без участия перицитов, но перициты находятся в числе первых клеток, чтобы проникать во вновь васкуляризуемую ткань и локализуются по фронту роста эндотелиального врастания путем детерминации локализации образования отростка и путем наведения вновь формирующихся сосудов (Nehls et al., 1992). Индивидуальные перициты может быть обнаружены на кончиках ангиогенных врастаний в желтом теле, где перициты являются первыми сосудистыми клетками для инвазии гранулезной складки разорвавшегося фолликула, и в опухолях (Amselgruber et al., 1999; Gerhardt and Betsholtz, 2003; Morikawa et al., 2002).
Давно считается, что образование эндотелиальных трубок сопровождается с помощью перицитов, которые используются эндотелиальными клетками отростков в качестве сигналов к миграции migration. Соответственно, перициты рекрутируются с помощью дифференцировки окружающих мезенхимных предшественников или за счет миграции из муральной стенки соседнего сосуда (Gerhardt and Betsholtz, 2003). Таким способом перициты супрессируют эндотелиальный рост (Orlidge and D'Amore, 1987) и миграцию (Sato and Rifkin, 1989). Существует поразительное соответствие между вкладом перицитов и стабилизацией микрососудов (von Tell et al., 2006; Bergers and Song 2005) и вклад перицитов был также непосредственно отмечен в наделении резистентностью капилляров для возвращения в прежнее состояние in vivo (Benjamin et al., 1998).
Клинические доказательства стабилизирующей функции перицитов подтверждены находкой, что развитие микроанеуризм капилляров сетчатки, симптом диабетической ретинопатии, коррелирует с инициальной потерей внутримуральных перицитов (Kuwabara and Cogan, 1963).
В 1990, Blood and Zetter писали, что: "Формирование базальной мембраны и наделение (investment) капилляров перицитами обычно ассоциирует с концом пролиферативной стадии и началом созревания или стадии покоя капиллярной функции". Сравнительно недавно Stratman et al. (2009) продемонстрировали, что взаимодействия эндотелиальных клеток с перицитами регулируют повышенную экспрессию генов белков базальной мембраны и белков, таких как fibronectin и laminin, а также интегринов, которые распознают ремоделируемый матрикс, чтобы контролировать этот процесс, и эти изменения происходят специфически при совместном культивировании эндотелиальных клеток и перицитов, но не в культуре только эндотелиальных клеток.
Альтернативно перициты м. инвазировать ткань в отсутствие эндотелиальных клеток и могут формировать трубки, позволяющие последующее проникновение эндотелиальных клеток (Ozerdem and Stallcup, 2003). Rajantie et al. (2004) показали, что производные костного мозга клетки гематопоэтических предшественников CD11b+ и CD45+, экспрессирующие маркер перицитов NG2, локализуются в тесной близости к кровеносным сосудам в модели подкожной B16-F10 меланомы. Происходящие из костного мозга PDGFR-β+/Sca-1+ предшественники перицитов были продемонстрированы в мышиных моделях туморогенеза панкреатических островков, которые были способны дифференцироваться с зрелые перициты, экспрессирующие маркеры NG2 и alpha smooth actin (Song et al., 2005). Virgintino et al. (2007) продемонстрировали на телэнцефалоне плодов человека, что растущие микрососуды формируются с помощью ангиогенного процесса, управляемого перицитами, при этом эндотелиальным клеткам предшествовали и вели их мигрирующие перициты.
В целом эти данные указывают на существование взаимного влияния между эндотелиальными клетками и перицитами в управлении ангиогенным процессом, приписывая перицитам предполагаемую морфогенетическую роль.
Pericytes as targets in tumor therapy
При патологических условиях, при которых ангиогенная активность усилена, например при опухолях, перициты располагаются вблизи кровеносных сосудов на растущем фронте опухоли, где ангиогенез наиболее активен и обнаруживает морфологические аномалии (Schlingemann et al., 1990; Wesseling et al., 1995; Morikawa et al., 2002). Более того,
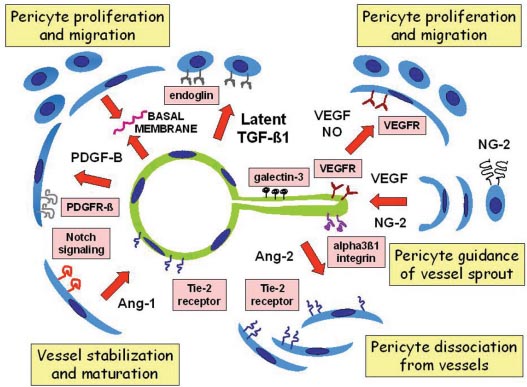 Fig. 3. Signaling pathways operating in endothelial cell/pericyte paracrine
cross-talk. Pericytes are involved in endothelial cell stimulation and guidance as
well as endothelial stabilization and maturation. Vessel sprouts (right) cause
destabilization of pericyte investment through Ang-2/Tie-2 signaling. Pericytes
provide guidance for endothelial movement and tube formation through secretion
of VEGF and soluble NG-2. Spreading endothelial cells, in turn, stimulate pericyte
precursor cell proliferation and migration by releasing VEGF and NO. Vessel
stabilization (left) occurs by pericyte investment and close interaction with endot-
helial cells. Mature endothelial cells secrete PDGF-B, which promotes proliferation
and migration of pericyte precursor cells through activation of PDGFR-? receptors
expressed on the surface of pericyte progenitors. This mechanism leads to pericyte
coverage of early endothelial tubes. Vessel maturation further develops through
Ang-1- and Notch-mediated signaling. Pericyte stabilize and reinforce the endothe-
lial tube contributing to secretion of basal membrane.
Fig. 3. Signaling pathways operating in endothelial cell/pericyte paracrine
cross-talk. Pericytes are involved in endothelial cell stimulation and guidance as
well as endothelial stabilization and maturation. Vessel sprouts (right) cause
destabilization of pericyte investment through Ang-2/Tie-2 signaling. Pericytes
provide guidance for endothelial movement and tube formation through secretion
of VEGF and soluble NG-2. Spreading endothelial cells, in turn, stimulate pericyte
precursor cell proliferation and migration by releasing VEGF and NO. Vessel
stabilization (left) occurs by pericyte investment and close interaction with endot-
helial cells. Mature endothelial cells secrete PDGF-B, which promotes proliferation
and migration of pericyte precursor cells through activation of PDGFR-? receptors
expressed on the surface of pericyte progenitors. This mechanism leads to pericyte
coverage of early endothelial tubes. Vessel maturation further develops through
Ang-1- and Notch-mediated signaling. Pericyte stabilize and reinforce the endothe-
lial tube contributing to secretion of basal membrane.
дефицит перицитов может быть частично ответственен за аномалии сосудов в опухоли (Gerhardt and Semb, 2008), а частичная диссоциация перицитов (Hobbs et al., 1998; Hashizume et al., 2000) вносит вклад в повышенную проницаемость опухолевых сосудов.
Ингибирование VEGF устраняет опухолевые сосуды без удаления перицитов (Morikawa et al., 2002). Антиангиогенное лечение, направленное против эндотелиальных клеток с использованием ингибиторов VEGF вызывает регрессию опухолевых сосудов и снижает размер опухоли (Baluk et al., 2005), приводя к нормализации сосудов, характеризующееся повышением покрываемости перицитами, опухолевой перфузией и чувствительностью химотерапевтическим средствам (Jain, 2005). Более того, удаление ингибиторов VEGF вызывает возобновление роста опухоли, обусловленное тем фактом, что перициты создают каркас для быстрого возобновления роста опухолевых сосудов (Mancuso et al., 2006).
Перициты ведут себя как предполагаемые мишени для фармакологической терапии опухолей с использованием синергичного эффекта анти-эндотелиальных и анти-перицитарных молекул. Удаление покрытия перицитами ведет к обнажению опухолевых сосудов, это может объяснить усиление эффекта комбинированных ингибиторов, которые нацелены как на опухолевые сосуды. так и перициты. Bergers et al. (2003) показали, что комбинированное лечение или предварительное лечение anti-PDGF-B/PDGFBR-β, снижающее покрытие перицитами увеличивает успешность anti-VEGF лечения у модельных RIP1-TAG2 мышей.
Однако обширная регрессия эндотелиальных клеток не наблюдается в опухолях после ингибирования передачи сигналов PDGFR-β (Abramsson et al., 2003). STI571 (Gleevec, Imatinib), который находит PDGFRs и др. рецепторные тирозин киназы, не снижает плотность сосудов, если действует один, но эффекты усиливаются ингибиторами VEGF inhibitors (Bergers et al., 2003). После обработки RIP1-TAG-2 опухолей и легочной карциномы Lewis AG-013737 или VEGF-Trap, выживающие перициты становятся более тесно ассоциированными с эндотелиальными клетками или не обнаруживают видимой ассоциации с опухолевыми сосудами (Inai et al., 2004). Обработка RIP1-TAG2 опухолей anti-PDGFR-β антителами в течение трех недель редуцирует перициты, увеличивает апоптоз эндотелиальных клеток, но, по-видимому, не уменьшает плотности опухолевых сосудов (Song et al., 2005). Сходным образом ингибитор рецепторной тирозин киназы SU6668, который также влияет на передачу сигналов PDGFR-β отсоединяет и уменьшает количество перицитов в RIP1-TAG2 и xenotransplanted опухолях, ограничивая тем самым рост опухоли (Reinmuth et al., 2001; Shaheen et al., 2001).
Sennino et al. (2007) продемонстрировали, что воздействие новым селективным PDGF-B blockade DNA aptamer AX102, который блокирует действие PDGF-B ведет к прогрессирующей потере перицитов в легочной карциноме Lewis. Недавно Murphy et al. (2010) получили серию избирательных типа II ингибиторов PDGFR-β и B-RAF мишени для рекрутирования перицитов и выживания эндотелиальных клеток, соотв. и они продемонстрировали, что двойное ингибирование PDGFR-β и B-RAF вызывает синергичную антиангиогенную активность у рыбок данио и мышей, моделирующих ангиогенез. Проведено несколько др. важных исследований с целью воздействия на перициты на экспериментальных моделях опухолей (Pietras and Hanahan, 2005; Maciag et al., 2008; Lu et al., 2010) и даже в клинических испытаниях у людей с клеточной карциномой почек (Haisnworth et al., 2007).
Мы недавно продемонстрировали, что комбинированное воздействие на перициты и клетки эпителиальных опухолей комбинацией пептидного лиганда aminopeptidase A (APA), открытого с помощью фаговой технологии для поставки liposomal doxorubicin (DXR) в клетки периваскулярных опухолей, и aminopeptidase N (APN)-targeted липосомного DXR усиливает противоопухолевое воздействие липосомной химиотерапии у мышей, несущих нейробластому человека
(Loi et al., 2010).
Concluding remarks
Pericytes are critical cells in vascular biology. They intervene
at different levels of blood vessel formation, being involved in
endothelial cell stimulation and guidance as well as endothelial
stabilization and maturation. Signaling pathways operating in
endothelial cell-pericyte cross-talk are currently being investi-
gated and will provide crucial information on the paracrine mo-
lecular mechanisms controlling capillary formation (Fig. 3). This
point is of critical interest in the physiopathological and clinical
approach to degenerative vasculopathies as well as tumor angio-
genesis. Finding drugs that allow manipulation of pericyte/endot-
helial cell interactions will provide physicians with a potent tool
capable of controlling and blocking vascular proliferation and
permeability. Increase of pericyte recruitment to stabilize new
vessels will potentially ameliorate vascular disorders, such as
diabetic retinopathy. In addition, a stable capillary microvascula-
ture may represent an important prerequisite for preventing tumor
cell dissemination. The future use of molecules interfering with
the endothelial cell/pericyte unit will be also of interest in tissue
engineering as well as the development of multi-tissue organs.
Further studies are needed to highlight further aspects of pericyte
molecular biology and physiology.
Сайт создан в системе
uCoz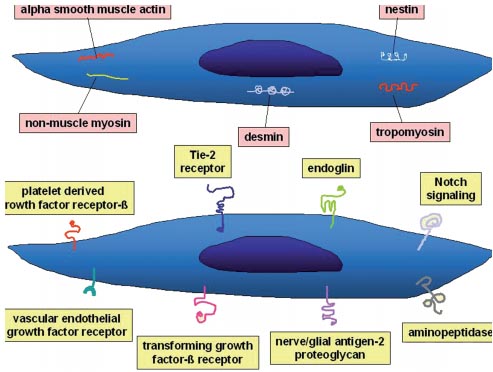 Fig. 1. Cytoplasmic markers (above) and membrane determinants (be-
low) expressed by pericytes.
Fig. 1. Cytoplasmic markers (above) and membrane determinants (be-
low) expressed by pericytes.  Fig. 2. Schematic drawing that illustrates the paracrine interactions occurring between pericyte precursor cells and endothelial cells in PDGF-mediated angiogenesis. Endothelial cells secrete PDGF-B, that causes pericyte precursor cell proliferation and migration through activation of PDGFR-β receptors. Pericytes surround and cover early endothelial tubes. By contrast, endothelial cells in vascular sprouts release VEGF, which in turn mediates suppression of PDGFR-β signaling through the induction of VEGFR-2/PDGFR-β complexes. This pathway abrogates pericyte coverage of endothelial sprouts leading to vascular instability and regression.
Fig. 2. Schematic drawing that illustrates the paracrine interactions occurring between pericyte precursor cells and endothelial cells in PDGF-mediated angiogenesis. Endothelial cells secrete PDGF-B, that causes pericyte precursor cell proliferation and migration through activation of PDGFR-β receptors. Pericytes surround and cover early endothelial tubes. By contrast, endothelial cells in vascular sprouts release VEGF, which in turn mediates suppression of PDGFR-β signaling through the induction of VEGFR-2/PDGFR-β complexes. This pathway abrogates pericyte coverage of endothelial sprouts leading to vascular instability and regression.  Fig. 3. Signaling pathways operating in endothelial cell/pericyte paracrine
cross-talk. Pericytes are involved in endothelial cell stimulation and guidance as
well as endothelial stabilization and maturation. Vessel sprouts (right) cause
destabilization of pericyte investment through Ang-2/Tie-2 signaling. Pericytes
provide guidance for endothelial movement and tube formation through secretion
of VEGF and soluble NG-2. Spreading endothelial cells, in turn, stimulate pericyte
precursor cell proliferation and migration by releasing VEGF and NO. Vessel
stabilization (left) occurs by pericyte investment and close interaction with endot-
helial cells. Mature endothelial cells secrete PDGF-B, which promotes proliferation
and migration of pericyte precursor cells through activation of PDGFR-? receptors
expressed on the surface of pericyte progenitors. This mechanism leads to pericyte
coverage of early endothelial tubes. Vessel maturation further develops through
Ang-1- and Notch-mediated signaling. Pericyte stabilize and reinforce the endothe-
lial tube contributing to secretion of basal membrane.
Fig. 3. Signaling pathways operating in endothelial cell/pericyte paracrine
cross-talk. Pericytes are involved in endothelial cell stimulation and guidance as
well as endothelial stabilization and maturation. Vessel sprouts (right) cause
destabilization of pericyte investment through Ang-2/Tie-2 signaling. Pericytes
provide guidance for endothelial movement and tube formation through secretion
of VEGF and soluble NG-2. Spreading endothelial cells, in turn, stimulate pericyte
precursor cell proliferation and migration by releasing VEGF and NO. Vessel
stabilization (left) occurs by pericyte investment and close interaction with endot-
helial cells. Mature endothelial cells secrete PDGF-B, which promotes proliferation
and migration of pericyte precursor cells through activation of PDGFR-? receptors
expressed on the surface of pericyte progenitors. This mechanism leads to pericyte
coverage of early endothelial tubes. Vessel maturation further develops through
Ang-1- and Notch-mediated signaling. Pericyte stabilize and reinforce the endothe-
lial tube contributing to secretion of basal membrane.