Посещений:  ФОРМИРОВАНИЕ ПРЕДШЕСТВЕННИКОВ КРОВИ
ФОРМИРОВАНИЕ ПРЕДШЕСТВЕННИКОВ КРОВИ
Роль обоняния
|
|
Olfactory Control of Blood Progenitor Maintenance Jiwon Shim, Tina Mukherjee, Bama Charan Mondal, Ting Liu, Gloria Chin Young, Dinali Priasha Wijewarnasuriya and Utpal Banerjee  Cell 155, 1141-1153, November 21, 2013 http://dx.d0i.0rg/l 0.1016/j.cell.2013.10.032 |
Drosophila hematopoietic progenitor maintenance involves both near neighbor and systemic interactions. This study shows that olfactory receptor neurons (ORNs) function upstream of a small set of neurosecretory cells that express GABA. Upon olfactory stimulation, GABA from these neurosecretory cells is secreted into the circulating hemolymph and binds to metabotropic GABAB receptors expressed on blood progenitors within the hematopoietic organ, the lymph gland. The resulting GABA signal causes high cytosolic Ca2+, which is necessary and sufficient for progenitor maintenance. Thus, the activation of an odorant receptor is essential for blood progenitor maintenance, and consequently, larvae raised on minimal odor environments fail to sustain a pool of hematopoietic progenitors. This study links sensory perception and the effects of its deprivation on the integrity of the hematopoietic and innate immune systems in Drosophila.
|
Поддержание клеток гематопоэтических предшественников очень сильно связано со взаимодействиями с нишами (Garrett and Emerson, 2009; Jung et al., 2005; Krzemien et al., 2007; Mandal et al., 2007; Mercier et al., 2012); однако менее известно о системных механизмах, регулирующих этот процесс. In vivo, генетический анализ Drosophila сделал возможным механистическое исследование клеток гематопоэтических предшественников в их природном микроокружении. Гемоциты, кровяные клетки Drosophila, похожие на миелоидные клетки позвоночных, развиваются внутри специализированного гематопоэтического органа, наз. лимфатической железой во время эмбриональной и личиночных стадий и вносят вклад в кровяные клетки, которые циркулируют у куколок и взрослых (Jung et al., 2005). Дифференцированные гематоциты, расположенные в самом наружном слое лимфатической железы, наз. кортикальной зоной layer of the lymph gland called the cortical zone (CZ; Figures 1A and 1B), возникают из недифференцированных предшественников, расположенных внутри внутреннего стержневого региона, наз. медуллярной зоной (MZ). Свойства MZ предшественников включают неспособность включения bromodeoxyuridine (BrdU), а также отсутствие маркеров дифференцировки и мультипотентность, поскольку они дают все клоны кровяных клеток Drosophila (Jung et al., 2005; Krzemien et al., 2010; Minakhina and Steward, 2010). Нет пока прямых доказательств для асимметричных клеточных делений при гематопоэзе Drosophila (см, однако, Minakhina and Steward, 2010). Небольшая группа клеток в лимфатическом узле, наз. posterior signaling center (PSC), экспрессирует Hedgehog (Hh) и функционирует как гематопоэтическая ниша (Mandal et al., 2007). Hh, происходящий из PSC, действует совместно с происходящим из CZ сигналом, инициируемым Adenosine deaminase growth factor-A (Adgf-A) (Mondal et al., 2011), и эти сигналы совместно важны для поддержания предшественников в MZ (Figure 1B). Предшественники из MZ также реагируют на системные сигналы, которые запускаются с помощью уровней аминокислот и инсулина у животных (Benmimoun et al., 2012; Dragojlovic-Munther and Martinez-Agosto, 2012; Shim et al., 2012; Tokusumi et al., 2012). Циркулирующие кровяные клетки личинок также возникают из головной мезодермы эмбриона независимо от лимфатического узла. Они располагаются в сегментно повторяющихся эпидермально-мышечных карманах, в которых они контактируют с периферической нервной системой (PNS) для свой локализации и жизнеспособности (Makhi-jani et al., 2011).
В данной работе мы описываем связь между активностью обонятельных нейронов, передачей сигналов GABA и поддержанием кровяных предшественников. Личиночная обонятельная система состоит из пары дорсальных органов, экспрессирующих 25 специфических odorant receptors (OR) в 21 olfactory receptor neurons (ORNs) (Kreher et al., 2005; Vosshall and Stocker, 2007). Примером такого рецептора является рецептор Or83b (Oreo), атипичный обонятельный рецепторный белок, который широко экспрессируется в каждом ORN и является важным для распознавания всех запахов (Larsson et al., 2004). Внутри гломерул личиночной антенной доли ORNs образуют возбуждающие синапсы с проекционными нейронами (PN), чьи аксоны иннервируют более глубокие регионы, которые представляют собой высшие центры головного мозга, перерабатывающие информацию (Vosshall and Stocker, 2007). Гломерулы взаимно соединены с помощью или ингибирующих GABAergic (iLN) или возбуждающих холинергических (eLN) локальных промежуточных нейронов, которые тонко контролируют сеть ORN-PN (Masse et al., 2009).
Здесь мы показали, что активация обонятельных нейронов ведет к секреции GABA нейросекреторными клетками в
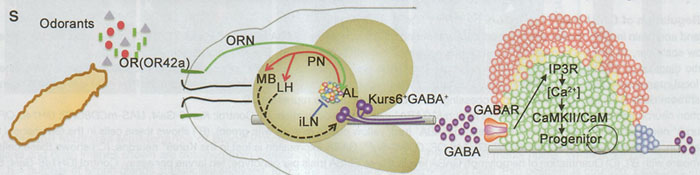 Figure 6. OR42a-Mediated Blood Progenitor Maintenance and Its Physiological Relevance
Figure 6. OR42a-Mediated Blood Progenitor Maintenance and Its Physiological Relevance
DISCUSSION
Olfactory Sensory Stimulation in the Control of GABA and Maintenance of Blood Progenitors
Зависимые от ниш механизмы развития и поддержания гематопоэтических предшественников много раз описывались как для пз, так и беспозвоночных (Garrett and Emerson, 2009; Jung et al., 2005; Krzemieh et al., 2007; Mandal et al., 2007; Mercier et al., 2012). Механизмы, независимые от ниш, которые оперируют на более системном уровне, но затрагивают развитие предшественников, стали обнаруживаться в последнее время (rev. Gancz and Gilboa, 2013).
Здесь мы описываем сигналы, которые исходят из головного мозга и регулируют поддержание кровяных предшественников (Figure 6S). Этот путь не зависит от питательных (nutritional) сигналов, которые используют Drosophila insulin и TOR (Shim et al., 2012). Мы установили, что зависимая от обоняния сенсорная стимуляция испускает системные сигналы из ЦНС к недифференцированным кровяным предшественникам путем регуляции физиологических уровней GABA, секретируемых в кровоток. GABA экспрессируется небольшим количеством нейросекреторных клеток головного мозга, а высвобождение GABA из этого класса нейросекреторных клеток критически зависит от обонятельной стимуляции. Дисфункция обоняния снижает экспрессию GABA в нейросекреторных клетках и также снижает системные уровни GABA в кровообращении. Предшественники крови экспрессируют metabotropic GABAb рецептор, который способен отвечать на GABA, повышая концентрацию в них цитозольного кальция, важного для ингибирования преждевременной дифференцировки и поддержания предшественников. Этот контроль теряется, когда или обонятельные нейроны или их партнеры по сети в обонятельных гломерулах разрушены. Следствием представленного выше механизма является то, что личинки Drosophila дикого типа, вскармливаемые на среде с ограниченным запахом драматически снижают уровни системного GABA и вследствие этого кровяные предшественники дифференцируются преждевременно. В ответ на блокирование обоняния, уровни GABA во всем центральном регионе головного мозга снижаются (Figure S4A), но имеются две экспрессирующие GABA нейросекреторные клетки в каждой доле центральной части головного мозга, которые важны для контроля секретируемого GABA в аорту, который контролирует гематопоэз.
В лимфатическом узле GABAB рецептор экспрессируется в кровяных предшественниках и подавляется, когда клетки дифференцируются. Соединение GABA с GABABR поддерживает высокий уровень цитозольного Ca 2+ в предшественниках, обязательное условие, чтобы они оставались недифференцированными. Дифференцированные кровяные клетки обладают очень низкими или необнаружимыми уровнями Ca 2+ и являются также нечувствительными к его альтерациям. Ниже повышенных уровней Ca 2+ функционируют Calmodulin и CaMKII, важные для поддержания предшественников. События, происходящие ниже, пока неизвестны. В принципе, Ca 2+ может непосредственно или опосредованно взаимодействовать с ROS или связанным с Wg путями, как известно, важных для поддержания предшественников (Kohn and Moon, 2005; Owusu-Ansah and Banerjee, 2009; Sinenko et al., 2009; Yan et al., 2006).
Brain and the Innate Immune/Hematopoietic System
Накапливаются доказательства, показывающие, что нервная система млекопитающих также регулирует врожденные иммунные реакции посредством гормональных и нейральных путей. Симпатическая и парасимпатическая нервные системы непосредственно иннервируют иммунные органы, при этом нейроэндокринные факторы контролируют воспаление на системном уровне. Кроме того, иммунные клетки экспрессируют рецепторы для разных нервных факторов, подкрепляя идею, что имеется вклад нервной системы в иммунитет (Bhat et al., 2010; Kawashima and Fujii, 2003; Sternberg, 2006). Дисфункция головного мозга, включая определенные нейродегенеративные заболевания, генерирует повышенную иммунную реакцию, поскольку ЦНС, как полагают, обычно ингибирует иммунные реакции (Sternberg, 2006). Гематопоэтические ниши млекопитающих иннервируются (Mendez-Ferrer et al., 2009), а клетки внутри ниш экспрессируют рецепторы, чувствительные к Ca2+, на своей поверхности, которые они используют, чтобы сохранить пристанище в periendosteal компартменте (Adams et al., 2006). Однако прямое участие секретируемого GABA или обоняния для поддержания гематопоэтических предшественников не было продемонстрировано для любых др. систем.
GABA законсервирован от бактерий и растений до животных. У растений GABA функционирует в качестве метаболита, сигнальной молекулы и в реакции на стрессы (Roberts, 2007). У позвоночных GABA функция прежде всего была изучена в нейротрансмиссии (Li and Xu, 2008), но он также действует как метаболит (Erecinska et al., 1996) и в передаче онтогенетических сигналов как в эмбриональной ткани, так и при регенерации у взрослых (Nilsson et al., 1993; Ohmasa and Saito, 2004; Soltani et al., 2011). Мы можем уже определять GABA, секретируемый в гемолимфу Drosophila. Это не является беспрецедентным, т.к. GABA может быть измерен в кровотоке многих млекопитающих, включая и человека (Ferkany et al., 1978). Интересно, что GABABR экспрессируется прежде всего в HSCs человека и его экспрессия выше в незрелых стволовых клетках, чем в более зрелых предшественниках (Steidl et al., 2004). Функция GABA в HSCs человека остается неясной и неизвестно, контролируется ли его функция посредством сенсорных сигналов, как мы это описали для Drosophila.
Dual Use of Signals for Development and Stress Response
Помимо универсально используемых путей развития, таких как Hh, Dpp и Wg, кровяные предшественники Drosophila используют несколько необычных путей для своего развития. Напр., физиологически сгенерированные ROS функционируют как сигнальные молекулы, которые позволяют предшественникам крови дифференцироваться (Owusu-Ansah and Banerjee, 2009), тогда как повышение ROS, в результате инфекции является стрессовым сигналом, который вызывает быструю экспансию этого процесса дифференцировки (Sinenko et al., 2012). Недавно было показано, что инсулин поддерживает популяцию предшественников во время нормального развития, а голодание является стрессовым условием, которое вызывает падение уровней инсулина и делает возможной преждевременную дифференцировку (Benmimoun et al., 2012; Dragojlovic-Munther and Martinez-Agosto, 2012; Shim et al., 2012; Tokusumi et al., 2012). Сходным образом, Hifa, стабилизируется при нормотоксических условиях за счет физиологически генерируемого NO, связывает Notch и поддерживает класс кровяных клеток, тогда как в условиях гипоксии, ощущаемой как стресс, стабилизируются дополнительные количества Hifa и повышается количество этих кровяных клеток (Mukherjee et al., 2011).
Итак, во всех приведенных выше примерах мы встретились с сигналами, которые используются миелоидными предшественниками для своего нормального развития запрограммированным способом и те же самые сигналы вызывают быструю экспансию этих кровяных клеток в условиях стресса. У мух условия, которые благоприятствуют дифференцировке крови, включая снижение обоняния, обычно инициируются во время окукливания, когда нужда в повышенных количествах макрофагов критическая. В качестве бонуса, эти же самые пути могут вызывать повышенную дифференцировку в ранней личиночной жизни, когда активация этих путей воспринимается как стрессовая реакция. Эта реакция отражается в наших мутационных исследованиях.
В целом, это исследование описывает механизм координации стимулов от стимуляции обонянием для поддержания кровяных предшественников посредством регуляции системных уровней GABA. Поскольку обоняние является важным сенсорным стимулом для личинок, то неспособность воспринимать запахи может быть интерпретирована как важная стрессовая реакция. Лишенные обоняния личинки не могут выжить в конкурентных условиях, связанных с отсутствием поведения поиска пищи (Asahina et al., 2008). Более того, недавнее исследование показало, что OR56a ощущает запах микробов, чтобы избегать неподобающих мест питания и размножения (Sten-smyr et al., 2012). Т.о., собственно обоняние способствует выживанию, позволяя улучшать конкурентность внутри выводка и избегать инфекционных организмов. Усиленная гематопоэтическая дифференцировка в отсутствие обонятельных стимулов должна быть благоприятна для личинок по повышению иммунных реакций, хотя это ещё предстоит проверить. У людей с потерей обоняния, ассоциирует с аномалиями во многих частях головного мозга, и нарушенное обоняние ведет к умножению воспалений у млекопитающих (Strous and Shoenfeld, 2006). Наши данные по Drosophila подчеркивают, что сенсорные стрессы влияют непосредственно на развитие и выбор клеточных судеб кровяными предшественниками. Имеет ли это место у высших организмов предстоит проверить.
|
 Figure 6. OR42a-Mediated Blood Progenitor Maintenance and Its Physiological Relevance
Figure 6. OR42a-Mediated Blood Progenitor Maintenance and Its Physiological Relevance