Construction of a Vertebrate Embryo from Two Opposing Morphogen Gradients | |
|
Development of vertebrate embryos involves tightly regulated molecular and cellular processes that progressively instruct proliferating embryonic cells about their identity and behavior. Whereas numerous gene activities have been found to be essential during early embryogenesis, little is known about the minimal conditions and factors that would be sufficient to instruct pluripotent cells to organize the embryo. Here, we show that opposing gradients of bone morphogenetic protein (BMP) and Nodal, two transforming growth factor family members that act as morphogens, are sufficient to induce molecular and cellular mechanisms required to organize, in vivo or in vitro, uncommitted cells of the zebrafish blastula animal pole into a well-developed embryo. |
Формирование эмбрионов позвоночных зависит от активности организующего центра, соответствующего дорсальной губе бластопора у амфибий и известного как Spemann-Mangold или дорсальный организатор (1). Будучи трансплантированным в вентральную часть хозяина этот организатор приводит к образованию в месте трансплантации вторичной эмбриональной оси. Молекулярная природа активности, вносимой с помощью этой дорсальной ткани идентифицирована (2), и её основными компонентами являются дорсально секретируемые факторы, которые действуют как антагонисты вентральных морфогенов и помогают становлению вентро-дорсального градиента их активности (fig. S1 A). Однако, будучи помещенными в нейтральную среду, такую как анимальный полюс бластулы, Шпемановский организатор обнаруживает очень ограниченную организующую активность, приводящую только к индукции аксиальной мезэнтодермальной ткани (3).
Ранее мы установили, что у рыбок данио организующие активности, контролирующие развитие эмбриона, не ограничены дорсальным организатором, а распределены все по краю эмбриона (5, 4) и в результате возникает комбинированная активность из двух сигнальных путей: bone morphogenetic protein (BMP) и Nodal. Мы установили, что организующая активность каждой порции на краю эмбриона варьирует в зависимости от соотношения активностей BMP/Nodal (fig. S1B): Высокое соотношение BMP/Nodal организует хвост; низкое соотношение BMP/ Nodal организует заднюю часть головы, тогда как промежуточные соотношения активности вызывают образование туловища (4). Базируясь на этих наблюдениях, мы предположили, что воздействие на недетерминированные эмбриональные клетки постоянно варьирующими соотношениями BMP/ Nodal может быть достаточным для организации полной эмбриональной оси (fig. S1C).
Чтобы проверить эту гипотезу мы создали противоположно направленные градиенты BMP и Nodal с помощью инъекций соотв. их мРНК на ст. 128 клеток, в два разных бластомера анимального полюса, которые давали разные клоны клеток, секретирующих эти факторы (Fig. 1 A). Анимальный полюс бластулы был выбран как территория, чтобы инструктировать, поскольку она содержит все элементы, необходимые для обеспечения молекулярных и клеточных реакций на стимуляцию BMP и Nodal (3, 4). Кроме того, из-за того, что анимальный полюс удален от края, поэтому влияние первичной оси и материнских детерминант ожидается минимальным.
В подтвержение нашей гипотезы, что эти два секретирующих центра организуют клетки анимального полюса (see supplementary materials and methods) во вторую эмбриональную ось, которая формируется на анимальном полюсе (Fig. 1, В - E), исключительно из клеток анимального полюса (fig. S2). Эта эктопическая ось содержит ткани и органы, присутствующие в первичной оси и идет от переднего мозга к кончику хвоста (Fig. IB). В большинстве случаев, первичная и вторичная оси сливаются в цефалическом регионе, где клетки анимального полюса рекрутируются обеими растущими структурами. Однако в некоторых случаях (1.3%; n = 1012 эмбрионов), клоны были в таком положении, что две эмбриональные оси не сливались (Fig. 1, С - E), при этом каждая обладала передним мозгом, глазами и сокращающимся сердцем и обладала спонтанными миотомными контракциями, указывающими на функциональность нервной системы (movie SI). Хотя antero-posterior (A-P) ось первичного эмбриона всегда параллельна анимально-вегетативной (An-Vg) оси яйца, мы не обнаружили корреляции между An-Vg осью яйца и А-P осью вторичного эмбриона, которая может быть параллельно, перпендикулярной или даже антипараллельной с А-P осью первичного эмбриона, следовательно, с An-Vg осью яйца (Fig. 1, С - E). Это демонстрирует, что у рыбок данио отсутствует врожденная информация в яйце или в раннем эмбрионе, детерминирующая ориентацию А-P оси, которая не может быть повернута в противоположную сторону с помощью использования соотв. сигналов.
Чтобы понять относительный вклад двух сигнальных путей в организацию вторичной эмбриональной оси, мы исследовали последствия добавления индивидуально BMP или Nodal. На ст. бластулы передача сигналов BMP уже активна на анимальном полюсе (5); добавление дополнительных количеств BMP к этому региону оказывает незначительный эффект (fig. S3). Напротив, на ст. бластулы, стимуляция анимального полюса с помощью Nodal приводит к утолщению бластодермы анимального полюса (Fig. 2 A). В начале гаструляции центральная часть возникающего выпячивания интернализуется (Fig. 2, В и C), образуя бластопор с циркулярярной, радиально симметричной губой бластопора, где мезодермальные клетки заворачиваются внутрь (movie S2).
На стадиях бластулы и гаструлы epiboly рассредотачивает клетки анимального полюса по эктодерме. Однако в присутствии Nodal-экспрессирующего клона, окружающие клетки анимального полюса не расползаются, а конвергируют в направлении центра источника, секретирующего Nodal (fig. S4). Известно, что сигналы наведения для конвергирующих перемещений в гаструле рыбок данио контролируются с помощью передачи сигналов janus kinase/signal transducer and activator of transcription 3 (JAK/STAT3) (6,7). Активация STAT3 не зависит от передачи сигналов Nodal, но зависит от материнского β-catenin сигнального пути (6). Поскольку эктопическая передача сигналов Nodal индуцирует центр притяжения на анимальном полюсе, мы полагаем, что STAT3 может быть активирован в этом домене. В согласии с этим, у STAT3 morphant эмбрионов, эктопическая передача сигналов Nodal неспособна индуцировать радиальные конвергирующие движения, тогда как интернализация мезодермы не изменяется (Fig. 2D). Более того, Nodal индукция экспрессии liv1 (Fig. 2E), нижестоящей мишени STAT3 (8), устраняется у STAT3 morphant эмбрионов (Fig. 2F), демонстрируя, что хотя Nodal и не нужен для активации STAT3 в дорсальном домене бластулы (7), он достаточен, чтобы индуцировать его активацию на анимальном полюсе.
У рыбок данио Nodal, как известно, важен для индукции организующей активности, осуществляемой дорсальным краем гаструлы (9-11). Соотв., стимуляция клеток анимального полюса с помощью Nodal вызывает экспрессию генов дорсального и дорсо-латерального края (fig. S5), но никогда не индуцирует маркеров, характеризующих латеральные или вентральные клетки, таких как eve1 (Fig. 2G). В начале гаструляции, экспрессия генов, индуцируемых на анимальном полюсе с помощью Nodal, организуется в концентрические круги (fig. S5), отражая морфогенетическую активность Nodal (12). На ст. поздней гаструлы, домен хорды, экспрессирующий ntl, простирается из анимального полюса в результате движений радиальной конвергенции и вытягивания (Fig. 2G), и уменьшаются в кличестве клетки прехордальной пластинки, экспрессирующие frzb,
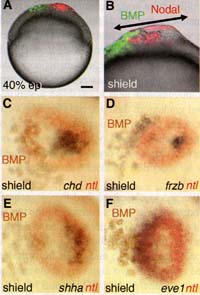 Fig. 1. BMP and Nodal induce a secondary embryonic axis at the animal pole. (A) Injection of Nodal and BMP mRNAs in two different animal pole blastomeres at the 128-cell (128c) stage results in (B) formation of a secondary embryonic axis (ii) expressing sonic hedgehog a from the midbrain to the tip of the tail. (C to E) Secondary embryonic axes including anterior head and displaying antero-posterior (а-p) orientation (red arrow) (C) parallel, (D) perpendicular, and (E) antiparallel to а-p orientation (blue arrow) of the primary axis (i). e, eye; fp, floorplate; h, heart; hg, hatching gland; n, notochord; mb, midbrain. Images in (B) to (E) are composite photos from a stack of images made at different planes of focus, hpf, hours postfertilization.
Fig. 1. BMP and Nodal induce a secondary embryonic axis at the animal pole. (A) Injection of Nodal and BMP mRNAs in two different animal pole blastomeres at the 128-cell (128c) stage results in (B) formation of a secondary embryonic axis (ii) expressing sonic hedgehog a from the midbrain to the tip of the tail. (C to E) Secondary embryonic axes including anterior head and displaying antero-posterior (а-p) orientation (red arrow) (C) parallel, (D) perpendicular, and (E) antiparallel to а-p orientation (blue arrow) of the primary axis (i). e, eye; fp, floorplate; h, heart; hg, hatching gland; n, notochord; mb, midbrain. Images in (B) to (E) are composite photos from a stack of images made at different planes of focus, hpf, hours postfertilization. 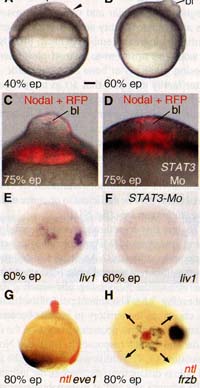 Fig. 2. Nodal induces formation of a blastopore where ectopic gastrulation occurs. (A) Thickening of the blastoderm (arrowheads) induced by ectopic Nodal signaling. (B) Formation of a blastopore (Ы) at gastrulation. (C) Internalization of the Nodal-secreting cetls [Nodal plus red fluorescent protein (RFP)]. (D) Blastopore induced by Nodal after STAT3 depletion by morpholino (STAT3 Mo) injection. (E and F) Nodal induces expression of livl in the wild type (E), but not in STAT3-depleted embryos (F). (G and H) Expression of genes induced by Nodal at the animal pole revealed by doublecolor in situ hybridization. Arrows in (H) indicate the spreading of prechordal plate cells expressing frzb. The developmental stage is indicated in the lower left corner of each panel, ep, epiboly. Probes are indicated in the lower right corner in (E) to (H). (A to D and G) Lateral view; (E, F, H) animal pole view. Scale bar in (A) corresponds to 100 pm for (А), (В), (E), and (F) and 40 |im for (C) and (D).
Fig. 2. Nodal induces formation of a blastopore where ectopic gastrulation occurs. (A) Thickening of the blastoderm (arrowheads) induced by ectopic Nodal signaling. (B) Formation of a blastopore (Ы) at gastrulation. (C) Internalization of the Nodal-secreting cetls [Nodal plus red fluorescent protein (RFP)]. (D) Blastopore induced by Nodal after STAT3 depletion by morpholino (STAT3 Mo) injection. (E and F) Nodal induces expression of livl in the wild type (E), but not in STAT3-depleted embryos (F). (G and H) Expression of genes induced by Nodal at the animal pole revealed by doublecolor in situ hybridization. Arrows in (H) indicate the spreading of prechordal plate cells expressing frzb. The developmental stage is indicated in the lower left corner of each panel, ep, epiboly. Probes are indicated in the lower right corner in (E) to (H). (A to D and G) Lateral view; (E, F, H) animal pole view. Scale bar in (A) corresponds to 100 pm for (А), (В), (E), and (F) and 40 |im for (C) and (D). достигают желточного синцитиального слоя и распространяются во всех направлениях радиально симметричным способом (Fig. 2H). Т.о., искусственное создание градиента активности Nodal на анимальном полюсе приводит к образованию радиально симметричной структуры, обладающей дорсальными характеристиками.
Предоставление градиента BMP противоположным градиенту активности Nodal (Fig. ЗА) превращает радиально симметричную структуру, индуцируемую с помощью Nodal, только в билатерально симметричную эмбриональную ось. Time-lapse анализ показал, что на ст. бластулы (movie S3), выпячивание, индуцируемое в присутствии градиентов BMP и Nodal, морфологически идентично выпячиванию, индуцируемому лишь с помощью Nodal (Figs. 2A и ЗА). Однако во время гаструляции мы наблюдали истончение губы бластопора вблизи BMP-секретирующего клона и одновременное утолщение противоположной стороны (Fig. 3B), подтверждая. что клетки мигрируют прочь от источника BMP. Это, скорее всего, отражает отталкивающий эффект BMP на мигрирующие латеральные мезодермальные клетки (13). Кроме того, и в соответствии с его функцией в формировании дорсо-вентральной (D-V) оси (14-16), BMP формирует паттерн губы бластопора, индуцируемой с помощью Nodal, определяя вентральный домен вблизи к центру секреции BMP и прогрессивно всё более дорсальные качественне характеристики по мере увеличения расстояния от источника BMP. В результат на ст. гаструлы дорсальные маргинальные маркеры ограничены доменом губы бластопора, самого дального от клона, секретиоующего BMP (Fig. 3, С to E), тогда как гены. специфичные для вентральной и латеральных частей индуцируются вбоизи центра секреции BMP (Fig. 3F and fig. S6).
В то время как формирование паттерна D-V нуждается в активности BMP (16), становление А-P полярности, как было установлено, зависит от Nodal (17). Соотв., А-P полярность вторичной оси, индуцируемая Nodal или с помощью Nodal и BMP, противоположна ориентации, характерной для первичной эмбриональной оси (fig. S7, A and B). Это возможно следствие экспрессии в индуцированной эктопической губе бластопора, FGF8a (18) и Wnt8a (19), которые действуют как posteriorizing морфогены (20, 21) (fig. S7, С - F). Хотя эти факторы постериоризации контролируют инициальную А-P полярность, направление вытягивания индуцированной вторичной оси зависит только от позиции клона,
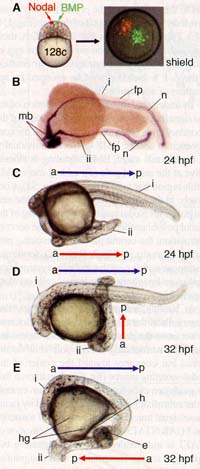 Fig. 3. BMP breaks the radial symmetry and patterns the blastopore lip induced by Nodal.
(A) BMP- and Nodal-secreting clones induce (B) a blastopore with an asymmetrical blastopore lip. (C to F) Expression of genes induced at the animal pole by Nodal and BMP. The developmental stage is indicated in the lower left corner of each panel; probes are indicated in the lower right corner in (C) to (F). Brown cells in (C) to (F) are cells secreting BMP. (A and B) Lateral view; (C to F) animal pole view. Scale bar in (A) corresponds to 100 цт for (A) and 40 цт for (B) to (F).
Fig. 3. BMP breaks the radial symmetry and patterns the blastopore lip induced by Nodal.
(A) BMP- and Nodal-secreting clones induce (B) a blastopore with an asymmetrical blastopore lip. (C to F) Expression of genes induced at the animal pole by Nodal and BMP. The developmental stage is indicated in the lower left corner of each panel; probes are indicated in the lower right corner in (C) to (F). Brown cells in (C) to (F) are cells secreting BMP. (A and B) Lateral view; (C to F) animal pole view. Scale bar in (A) corresponds to 100 цт for (A) and 40 цт for (B) to (F). секретирующего BMP, по отношению к губе бастопора, индуцируемой с помощью Nodal, и полностью не зависит от ориентации первичной эмбриональной оси (fig. S7, G and H, и fig. S8). Все эти данные подкрепляют заключение, что образование вторичной эмбриональной оси, который мы генерировали, происходит без участия сигналов, которые организуют и формируют паттерн первичной оси и что она завист только от клонов, серетирующих BMP и Nodal, которые мы создали. Чтобы ещё больше продемонстрировать это, мы проверяли способность BMP и Nodal индуцировать эмбриональное развитие из эксплантов бластулы из анимального полюса in vitro и, следовательно, независимость от первичной оси.
Эксплантация клеток анимального полюса осуществлялась на ст. 512 клеток [midblastula transition (МВТ)] (Fig. 4A). На этой ст. клетки анимального полюса
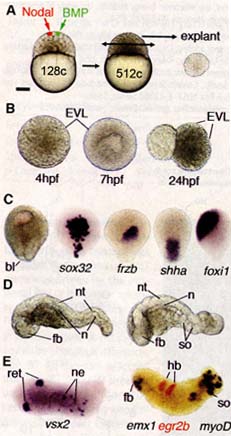 Fig. 4. In vitro construction of embryonic axes with opposing gradients of BMP and Nodal.
(A) Animal pole injection and explantation, c, cells.
(B) Uninjected explants. (C to E) Explants from embryos injected with both BMP and Nodal mRNAs analyzed at the gastrula stage (0 for the morphology (left) and by in situ hybridization with endo-derm (sox32), prechordal (frzb), notochord (shha), and epidermal (foxil) markers or observed at 24 hpf (D and E) and analyzed by in situ hybridization with retina (ret, vsx2), spinal cord neurons (ne, vsx2), forebrain (fb, emxl), hindbrain (hb, egr2b), and somite (so, myoD) markers. Ы, blastopore; n, notochord; nt, neural tube. Scale bar in (A) corresponds to 200 pm for (A), 80 pm for (B) and (C), and 100 pm for (D) and (E).
Fig. 4. In vitro construction of embryonic axes with opposing gradients of BMP and Nodal.
(A) Animal pole injection and explantation, c, cells.
(B) Uninjected explants. (C to E) Explants from embryos injected with both BMP and Nodal mRNAs analyzed at the gastrula stage (0 for the morphology (left) and by in situ hybridization with endo-derm (sox32), prechordal (frzb), notochord (shha), and epidermal (foxil) markers or observed at 24 hpf (D and E) and analyzed by in situ hybridization with retina (ret, vsx2), spinal cord neurons (ne, vsx2), forebrain (fb, emxl), hindbrain (hb, egr2b), and somite (so, myoD) markers. Ы, blastopore; n, notochord; nt, neural tube. Scale bar in (A) corresponds to 200 pm for (A), 80 pm for (B) and (C), and 100 pm for (D) and (E). эмбрионов рыбок данио плюрипотентны, недифференцированы и эквивалентны (22). Заметим. что ядра клеток анимального полюса полностью лишены β-catenin (23), который накапливается в ядрах только небольшого числа дорсо-маргинальных клеток (24, 25). Это отличается от того, что наблюдается для эмбрионов амфибий, которые обладают предсуществующим паттерном в анимальном полюсе бластулы (26), который зависит от эндогенного D-V градиента β-catenin (24). Анимальный полюс неинъецированных эмбрионов, эксплантированный на ст. МВТ помещённый в культуральную среду, не дифференцировался в какие-либо ткани или органы (Fig. 4B). Экспланты становились сферическими и спустя ~1 час, дифференцировались в морфологически видимый покрывающий слой (EVL). Спустя 3 ч., появлялась внутренняя полость в экспланте, напоминающая бластоцель, заполненную жидкостью центральную полость бластулы, которая наблюдается у большинства видов позвоночных, но отсутствует у рыбок данио (27).
Наш анализ генов, экспрессируемых в этих эксплантах во время, соответствующее гаструляции у контрольных эмбрионов (fig. S9) показал. что клетки анимального полюса перед или в этот момент времени эксплантации не получают сигналов, индуцируемых материнскими дорсальными детерминантами. Спустя 1 день культивирования отсутствуют морфологически видимые структуры и наблюдается только разрыв EVL с выходом некоторых из заключенных эмбриональных клеток (Fig. 4B). Стимуляция с помощью инъекции мРНК Nodal в один из бластомеров анимального полюса перед эксплантацией позднее индуцирует гаструляцию с образованием радиально симметричной губы бластопрора (movie S4). Когда создаются секретируемые центры как для Nodal, так и BMP, то гаструлирующие экспланты обнаруживают асимметричную губу бластопора, содержащие клетки всех трех зародышевых слоёв, которые формируют чёткий паттерн вдоль А-P и D-V осей (Fig. 4C). Спустя 1 день культивирования, эти экспланты дифференцируются в эмбриоиды, которые обладают морфологически распознаваемыми структурами, такими как передний мозг, нервная трубка и сомиты (Fig. 4D). Эти эмбриоиды экспрессируют орган-специфические молекулярные маркеры (Fig. 4E); их нервные трубки формируют паттерн вдоль А-P оси и они часто обнаруживают билатеральную экспрессию, что иллюстрируется экспрессией vsx2, которая выявляет присутствие двух глаз (Fig. 4E).
Сходные наблюдения были сделаны после слияния двух эксплантов анимального полюса: одного неинъецированного экспланта и др. экспланта, инъецированного мРНК BMP и Nodal (fig. S10). В этих условиях все мезэнтодермальные ткани происходили из инъецированного экспланта, тогда как клетки из неинъецированного экспланта дифференцировались в производные передней части эктодермы. Способность сигналов BMP и Nodal организовывать слитые экспланты (that initially contain two animal poles with An-Vg axes in opposite orientation) в единый эмбриоид с чёткой А-P осью подтверждает, что не сущестует строгого пристрастного предсуществующего паттерна в регионе анимального полюса бластулы рыбок данио.
Наше исследование демонстрирует, что стимуляция недетерминированных клеток анимального полюса бластулы с помощью противоположно направленных градиентов BMP и Nodal достаточна, чтобы инициировать принципиальные молекулярные и клеточные процессы, необходимые для организации полной эмбриональной оси. Все др. сигнальные пути, необходимые для достижения полного эмбрионального развития, индуцируются и регулируются в ответ на два инициальных, экспериментально созданных сигнала. Следовательно, наши находки устанавливают базовую линию минимальных сигнальных потребностей для раннего эмбрионального развития и предоставляют основу для будущих исследований в области регенеративной медицины, имеющей целью конструирование тканей и органов in vitro из популяций культивируемых плюрипотентных клеток.
|