Посещений:  ТКАНЕВОЙ МОРФОГЕНЕЗ И ФОРМИРОВАНИЕ ПАТТЕРНА
ТКАНЕВОЙ МОРФОГЕНЕЗ И ФОРМИРОВАНИЕ ПАТТЕРНА
Роль механическаих сил
|
|
Forces in Tissue Morphogenesis and Patterning Carl-Philipp Heisenberg and Yohanns Bellaiche  Cell 153, May 23, 948- 2013 |
During development, mechanical forces cause changes in size, shape, number, position, and gene expression of cells. They are therefore integral to any morphogenetic processes. Force generation by actin-myosin networks and force transmission through adhesive complexes are two selforganizing phenomena driving tissue morphogenesis. Coordination and integration of forces by long-range force transmission and mechanosensing of cells within tissues produce large-scale tissue shape changes. Extrinsic mechanical forces also control tissue patterning by modulating cell fate specification and differentiation. Thus, the interplay between tissue mechanics and biochemical signaling orchestrates tissue morphogenesis and patterning in development.
Рисунки к статье
|
Процессы, с помощью которых многоклеточные организмы приобретают форму, управляются силами, которые обычно генерируются молекулярными моторами и передаются посредством цитоскелетных элементов и адгезивных молекул внутри и между клетками. Изучение сил в морфогенезе эмбрионов имеет длинную историю, стартующую с Entwicklungsmechanik (механики развития)- которая описывала, как силы, проявляемые клетками придают форму эмбриону-и продолжающуюся плодотворными вкладами от Holtfreter, Steinberg и др., которые анализировали как специфическое клеточное сродство и клеточное поведение скоординировано управляют морфогенезом (for review, see Keller, 2012). Одной из основных задач в анализе роли сил в морфогенезе стал мониторинг in vivo механических сил на уровне порядка pN - nN и связь их с клеточными и биохимическими процессами, с помощью которых они генерируются, распространяются и воспринимаются внутри организма. В последние годы достигнут существенный прогресс в разработке средств получения изображений, чтобы записывать динамические изменения в форме клеток и тканей с высоким пространственным и временным разрешением и в разработке средств анализа изображений, чтобы количественно оценить динамику клеток и тканей (Montero et al., 2005; Kwon et al., 2008; Keller et al., 2008; Blanchard et al., 2009; Olivier et al., 2010; Bosveld et al., 2012; Tomer et al., 2012; Gao et al., 2012; Krzic et al., 2012). Более того, использование различных биофизических инструментов, таких как устройства для лазерной резки и микропипетки для анализа механических и адгезивных свойств клеток и тканей, предоставило новую информацию о процессах, с помощью которых силы генерируются и распространяются внутри клеток и тканей (Kiehart et al., 2000; Chu et al., 2004; Farhadifar et al., 2007; Rauzi et al., 2008; Mayer et al., 2010; Maitre et al., 2012; Movie S1 available online). Важной ступенью в этом направлении также стало успешное конструирование и реализация сенсоров молекулярных сил, которые сделали возможным "визуализацию" сил, действующих на специфические молекулы аппарата, трансдуцирующего силы (Grashoff et al., 2010). Наконец, были использованы различные физические модели, которые позволили смоделировать морфогенетические процессы как на клеточной, так и тканевой шкале и т.о., протестировать вероятность и предсказуемость исходов определенных механистических моделей (for review, see Morelli et al., 2012).
Интегральный клеточно-тканевой морфогенез это способность клеток воспринимать механические силы и физические ограничения, модулируя свою спецификацию и дифференцировку. Хотя влияние касательные усилия (shear force) вызываемые током жидкости на эндотелиальные клетки, формирующие сосудистую сеть анализировалось всесторонне (for rev. Freund et al., 2012), большинство недавних успехов в развитии устройств, придающих микроформу (microfabricated) также предоставило доказательства критической функции статических сил в спецификации судеб и дифференцировке клеток (for rev. Kobel and Lutolf, 2011). Назрела потребность в интеграции роли механических сил в тканевом морфогенезе и спецификации судеб клеток с целью понять, как происходят взаимодействия между клеточным/тканевым морфогенезом и спецификацией клеточных судеб и дифференцировкой во время эмбриогенеза.
Существуют многочисленные превосходные обзоры о том, как специфические морфогенетические процессы осуществляются на клеточном и тканевом уровне и как функционируют при этом различные сигнальные пути (Solnica-Krezel, 2005; Leptin, 2005; Hopyan et al., 2011; Suzuki et al., 2012). Здесь мы намереваемся подчеркнуть недавние успехи, достигнутые в идентификации фундаментальных и общераспространенных механизмов, с помощью которых механические силы участвуют в тканевом морфогенезе и спецификации судеб и дифференцировке клеток.
Forces in Tissue Self-Organization
Тканевой морфогенез описывает процессы, с помощью которых ткани приобретают форму. Такие процессы обычно используют изменения в количестве, размере, форме и позиции клеток. Изменения в количестве в количестве клеток внутри ткани достигаются с помощью пролиферации и гибели клеток. Пролиферация клеток управляется с помощью клеточных делений, которые распределяют две дочерних клетки в соответствии с ориентацией деления. Гибель обычно приводит к исчезновению погибших клеток, заполняя место занимаемое клеткой перед гибелью. Изменения в размере и форме клеток могут приводить к многообразным проявлениям-клетки могут увеличивать свой размер, напр., за счет метаболического роста или осмотического разбухания. Изменения клеточной формы могут колебаться от крупномасштабных изменений, таких как элонгация клеток, до локальных модуляций в форме клеток, таких как образование специализированных клеточных выпячиваний. Наконец, изменения в позиции клеток, вызываются или миграцией клеток или клеточными перестройками, такими как клеточные интеркаляции и/или изменения соседства. Важным для всех этих клеточных процессов вызывать изменения в форме ткани в форме передачи сил между индивидуальными клетками, обычно обеспечиваемые слипчивостью клеток. Это д. позволять индивидуальным клеткам изменения, которые могут быть транслированы в более глобальные изменения в морфологии ткани. Напр., скоординированные изменения в форме индивидуальных клеток вызывают глобальные альтерации в морфологии ткани как это происходит при сужении эпителиальных клеток на своей апикальной стороне, что приводит к локальному изгибу слоёв эпителиальных клеток (rev. Pilot and Lecuit, 2005). Сходным образом, скоординированные изменения в позиции индивидуальных клеток вызывают ротацию ткани (Aigouy et al. 010; Suzanne et al, 2010) или одновременное сужение и удлинение ткани, обусловленное клеточными интеркаляциями (for rev. Keller, 2006). Наконец, пространственно контролируемая пролиферация клеток, ориентация клеточных делений и клеточная гибель в многоклеточных тканях могут приводить к глобальным изменениям в форме ткани (rev. Hopyan et al., 2011). Т.о., понимание тканевого морфогенеза нуждается в расшифровке, как генерируются силы на базе индивидуальных клеток, как эти силы передаются соседним клеткам и как они интегрируются внутри ткани, чтобы запускать глобальные изменения в форме ткани.
Хотя клетки могут генерировать силы благодаря актину или полимеризации микротрубочек и осмотическому давлению, генерация клеточных сил обычно базируется на активностях двигательных белков, таких как миозины (rev. Howard, 2001). Эти белки взаимодействуют с цитоскелетными структурами, такими как актиновые волокна, чтобы менять их организацию (rev. Salbreux et al., 2012). Цитоскелетные изменения передаются соседним клеткам и внеклеточному окружению благодаря соединению с цитоскелетными межклеточными и клетка-матрикс адгезивными молекулами, такими как cadherins и integrins,
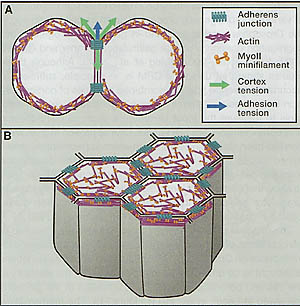 Figure 1. Self-Organization of Cells at Steady State Determined by Actin-Myosin Contractility and Cell Adhesion
Figure 1. Self-Organization of Cells at Steady State Determined by Actin-Myosin Contractility and Cell Adhesion
(A) Upon cell-cell contact, the contacting cells change their shape in response to mechanical forces associated with actin-myosin contractility (green arrow) and adhesion (blue arrow).
(B) In epithelial tissues, adhesive contacts and the actin-myosin network are organized in belt-like structures at the apical domain of the cell. At steady state, the arrangement of epithelial cells at their apex is determined by actin-myosin contractility and cell-cell adhesion.
соотв. Теперь хорошо известно, что кортикальное натяжение в клетках обусловлено сокращениями актомиозина и cadherin-обусловленной межклеточной адгезией, представляющих два фундаментальных и эволюционно хорошо законсервированных свойств, генерирующих силы и передачи между клетками, управляющими самоорганизацией тканей (Dickinson et al., 2011). Чтобы составить представление, как эти свойства управляют самоорганизацией ткани, разработаны различные модели. В большинстве моделей предполагается, что ткани формируются благодаря непрерывному ряду состояний равновесия и что, поэтому сумма механических сил находится в балансе. Механические уравнения могут быть написаны и решены или аналитически или путем использования методов конечных элементов, чтобы охарактеризовать тканевую динамику (Brodland et al., 2007; Ranft et al., 2010; Hannezo et al., 2012). Следовательно, предположение, что адгезия и кортикальное натяжение являются доминирующими детерминантами формы клеток и тканей и что клетки и ткани обладают наследственной тенденцией минимизировать свою поверхностную свободную энергию, и что формы клеток и тканей могут быть описаны с помощью их состояния наинизшей энергии (Steinberg, 1963; Foty et al., 1996). Природа этой энергии базируется на связывании адгезивных молекул, заставляющих клетки расширять их межклеточные контакты, и на контрактильной активности актомиозинового кортекса клетки, ингибирующего расширение контактов в местах соприкосновений и способствующего его контактам за пределами клетки (rev. Amack and Manning, 2012; Figure 1 A). Математическая формулировка концепции минимизации энергии для описания организации многоклеточных структур базируется на комбинации активностей кортикального натяжения и адгезии представлена Cellular Potts Model (CPM), которая была успешно использована для объяснения исхода различных морфогенетических процессов, таких как позиционирование клеток в омматидиях Drosophila и в сегрегации клеток предшественников зародышевых слоёв во время гаструляции у позвоночных (Graner and Glazier, 1992; Kafer et al., 2007; Krieg et at., 2008). Хотя эти исследования обнаруживают, что использование CPM является в принципе достаточным для описания, как комбинированные активности кортикального натяжения и адгезии предопределяют организацию ткани, но экспериментальные инструменты для измерения входных параметров, таких как клеточная адгезия и кортикальное натяжение, всё ещё редки. Одним из подходов в этом направлении явились исследования на рыбках данио, при которых экспериментально определялись значения клеточной адгезии (определяемые по силе разрыва адгезий межклеточных контактов) и натяжения кортекса, чтобы показать, что кортикальное натяжение скорее, чем энергия адгезии, управляет образованием межклеточных контактов и сегрегацией во время гаструляции у рыбок данио (Krieg et al., 2008; Maitre et al., 2012). Принцип минимизации энергии может быть также приложим к различным формам морфогенеза эпителиев у позвоночных и беспозвоночных. У Drosophila, конфигурация межклеточных соединений, как полагают, управляет взаимодействием между эластичностью клеток и контрактильностью кортекса и адгезией в соединениях (rev. Lecuit et al., 2011; Figure 1B). Математическая формулировка этой концепции в форме двухмерной "vertex-model" и родственных моделей была успешно применена для описания различных типов морфогенетических процессов в крыловых дисках Drosophila и в эпителии зародышевого диска (Farhadi-far et al., 2007; Rauzi et al., 2008; Landsberg et al., 2009; Aegerter-Wilmsen et al., 2010; Aigouy et al., 2010; Schilling et al., 2011; Aliee et al., 2012). Примерами этого являются образование границ компартментов в тканях у Drosophila, в которых анизотропное накопление myosin II (Myoll) в межклеточных соединениях, облицовывающих границу, ведет к усилению контрактильности границы, которая, в свою очередь, выпрямляет границу и предупреждает перемешивание клеток через неё (Landsberg et al., 2009; Monier et al., 2010; Aliee et al., 2012). Более того, анизотропное накопление Myoll в межклеточных соединениях, как полагают, управляет укорочением этих соединений, это приводит к клеточным перестройкам, лежащим в основе удлинения зародышевого диска Drosophila и скручивания в нервную трубку у позвоночных (Rauzi et al., 2008; Nishimura et al., 2012). Наконец, при гаструляции у асцидий обратное моделирование для определения клеточных свойств, базирующееся на самом морфогенетическом процессе показало, что увеличение кортикального натяжения на верхушках клеток и вдоль боковых соединений способствует апикальным сужениям клеток и апикально-базальному укорочению клеток (Sherrard et al., 2010). Итак, разные типы самоорганизации ткани могут быть объяснены с помощью моделей, базирующихся на концепции минимизации энергии, представленной комбинированными активностями кортикального натяжения и адгезии клеток. Однако молекулярные и клеточные механизмы, с помощью которых кортикальное натяжение и адгезия функционируют совместно в этих процессах, но потенциальный вклад др. фундаментальных клеточных процессов, таких как подвижность и направленная миграция, всё ещё необходимо исследовать.
Force Generation and Transmission at Cell Scale
Концепция минимизации энергии, базирующаяся на активностях адгезии и кортикальной сократимости, предоставляет ценную информацию о том, как распределение молекул детерминирует адгезивные и контрактильные клеточные свойства, предопределяя форму клеток и тканей в равновесии. Чтобы объяснить врожденную динамику клеточного и тканевого морфогенеза, некоторые исследования начали анализировать, как динамические изменения в субклеточном распределении цитоскелетных и адгезивных компонентов управляют тканевым морфогенезом. Наиболее впечатляют внутриклеточные перемещения актина и/или миозина, которые участвуют в различных ключевых морфогенетических процессах в эмбриогенезе. Токи актина и миозина активно исследовали на уровне одиночных клеток в процессах, таких как миграция, цитокинез и поляризация зигот (Bray and White, 1988; Munro et al., 2004; Mayer et al., 2010). Чтобы понять, как такие токи в одиночных клетках вызывают изменения в тканевом морфогенезе, необходимо принимать во внимание некоторые важные аспекты, связанные с генерацией сил с помощью динамичных токов actin-myosin (пульсирующие в противовес постоянным) и направления (centripetal или anisotropic) для пространственно-временных вариаций в генерации сил. Во-вторых, чтобы токи actin-myosin приводили к изменениям формы клеток и тканей, необходимо, чтобы токи были эффективно связаны с адгезивными комплексами на клеточной поверхности, которые передают силы, возникающие в результате этих токов в др. части ткани. В-третьих, процессы, при которых деформации клеток или тканей преходящие из-за пульсирующих токов actin-myosin, то такие деформации необходимо стабилизировать, чтобы привести к закреплению изменений формы клеток.
Gastrulation
При гаструляции у Drosophila инвагинация мезодермы управляется скоординированными апикальными сужениями мезодермальных клеток (rev. Leptin, 1995; Movie S2). Апикальные сужения инвагинирующих мезодермальных клеток снова запускаются при формировании Myoll пятен и волокон в их апикальном кортексе (Martin et al., 2010). Эти апикальные структуры Myoll являются динамичными, повторно увеличивающими интенсивность и перемещающимися к центру верхушки клетки, вызывая в результате пульсирующие центростремительные токи actin-myosin. Пульсирующие токи транслируются в периодические апикальные контракции мезодермальных клеток, обусловленные направленными внутрь перемещениями апикальных межклеточных соединений, с которыми связана актомиозиновая сеть (Martin et al., 2009; Roh-Johnson et al., 2012; Figure 2A and Movie S2). Апикальные сокращения в конечном счете стабилизируются за счет поддержания высоких уровней Myoll на верхушке клетки. Связь актомиозиновой сети с апикальными соединениями также приводит к апикальной организации Myoll в надклеточную сеть, которая соединяет каждую клетку, чтобы передавать силовые воздействия на всю ткань (Martin et al., 2010).
Сходная ситуация с гаструляцией у Drosophila, это вторжение энтодермальных предшественников при гаструляции у C. elegans, запускаемое с помощью пульсирующих, изотропных и центростремительных токов actin-myosin к верхушке этих клеток (Roh-Johnson et al., 2012; Movie S3). Интересно, что эти пульсирующие апикальные токи actin-myosin первоначально не вызывают достоверных апикальных контракций клеток, указывая тем самым, что actin-myosin сеть ещё не достаточно эффективно связана с апикальными соединениями энтодермальных клеток. В конечном итоге пульсирующие токи actin-myosin превращаются в апикальные сужения клеток в результате купирования с адгезивными соединениями сети actin-myosin, которые постепенно уменьшают размер верхушки клеток.
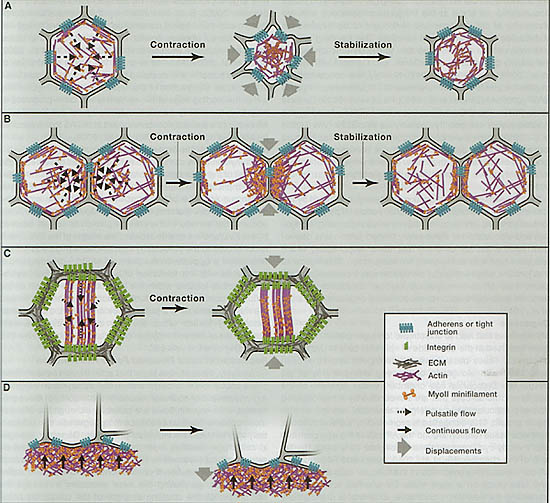
Figure 2. Actin-Myosin Network Dynamics and Force Generation
(A) Once coupled to adhesive contacts, pulsatile and centripetal flow of the apical actin-myosin network promotes apical cell constriction. In Drosophila mesodermal cells, the accumulation of apical actin-myosin is thought to stabilize cell shape changes between each pulse, leading to incremental reductions of the cell apex area.
(B) Pulsatile anisotropic flow induces junction shortening during cell intercalation. Resultant enrichment of actin-myosin at the junction stabilizes junction length reduction.
(C) Basal myosin flow on a static-oriented actin network produces anisotropic deformation of the base of the Drosophila follicular cells.
(D) Continuous actin-myosin flow in the zebrafish yolk cell produces the mechanical force necessary for EVL spreading over the yolk cell during early zebrafish early delopment.
Coordinated Cell Intercalation
Actin-myosin токи также наблюдались во время элонгации эпителиальной ткани, управляемой с помощью скоординированной интеркаляции клеток (Scoglund et al., 2008; Rauzi et al., 2010; Sawyer et al., 2011). Примеры такого пульсирующего тока actin-myosin обнаружены в верхушках эпителиальных клеток во время интеркаляции клеток вдоль дорсо-вентральной (DV) в зародышевом диске Drosophila, приводящему к элонгации зародышевого диска вдоль передне-задней (AP) оси (Rauzi et al., 2010; Sawyer et al., 2011; Figure 2B and Movie S4). Эти токи были центростремительными, приводили к формированию локальных скоплений actin-myosin и были анизотропно ориентированы в направлении DV соединений клеток, приводя к накоплению в них Myoll. Анизотропный ток Myoll в направлении DV соединений вызывает урезание этих соединений, которое является важной ступенью в клеточной интеркаляции во время элонгации зародышевого диска. Накопление Myoll в DV соединениях совпадает с урезанием DV соединений и, как полагают, является необходимым для стабилизации прореженных соединений. Купирование и/или ориентация actin-myosin тока к DV соединениям нуждается в активностиα-catenin, E-cadherin и Canoe/Afadin (Rauzi et al., 2010; Sawyer et al., 2011). Отметим, что концентрации catenins и E-Cadherin являются более низкими в DV соединениях по сравнению с AP соединениями (Simoes et al., 2010; Rauzi et al., 2010; Tamada et al., 2012). Концентрация E-Cadherin регулируется с помощью Frizzled пути планарной клеточной полярности посредством RhoGEF2 (Warrington et al., 2013). Такая низкая концентрация, как полагают, ведет к более рыхлому закреплению сети actin-myosin между двумя DV соединениями клетки, это позволяет actin-myosin сети более свободно перемещаться между двумя этими соединениями (Rauzi et al., 2010).
Во время интеркаляции клеток, прореживание соединений сопровождается образованием и расширением новых соединений, ориентированных перпендикулярно прореженным соединениям. В крыле куколок Drosophila элонгация и стабилизация этих вновь образуемых соединений зависит от активности PTEN опухолевого супрессора, который снижает уровень Myoll во вновь сформированных соединениях. Это иллюстрирует то, что растягивание вновь сформированных соединений также может быть активным процессом и объяснять, как гомогенное кортикальное распределение Myoll может быть восстановлено после интеркаляции в контролируемую организацию ткани (Bardet et al., 2013).
Oogenesis
Токи миозина, которые ведут к генерации анизотропных сил также наблюдали на базальной стороне эпителиальных клеток при оогенезе у Drosophila. Эти базальные перемещения являются центростремительными и ассоциированы с удлинением яйцевой камеры (He et al., 2010). Яйцевая камера Drosophila, которая состоит из ооцита и питающих клеток, которые окружены однослойной эпителиальной фолликулярной тканью, подвергается серьезному AP удлинению во время роста. Этой элонгации способствует глобальная ротация фолликулярной эпителиальной ткани вокруг AP оси яйцевой камеры и затем циклическим сокращениям фолликулярных клеток вдоль DV оси камеры (He et al., 2010; Haigo and Bilder, 2011). Токи миозина на базальной стороне фолликулярных клеток являются пульсирующими и происходят на более статичной DV-ориентированной сети актина, в результате происходит превращение тока в сократительные силы, которые преимущественно ориентированы вокруг окружности ооцита, это способствует глобальной АР элонгации яйцевой камеры (Figure 2C). Период пульсаций базального миозина более продолжителен, чем наблюдаемые апикальные токи во время инвагинации мезодермальных клеток, напр., и он регулируется как с помощью E-Cadherin-зависимой межклеточной адгезии, так и зависимой от интегрина адгезии клеток с внеклеточным матриксом (He et al., 2010).
Tissue Spreading
Actin-myosin токи в тканевом морфогенезе также ассоциированы с образованием крупных actin-myosin канатов и кольцеобразных структур во время тканевого распределения. При дорсальном закрытии у Drosophila латеральный эпидермис перемещается дорсально поверх amnio-serosa (AS) клеток, чтобы закрыть дорсальную полость в эпидермисе эмбриона (for rev. Harden, 2002; Movie S5). Дорсальное закрытие нуждается в экспрессии как c-Jun N-terminal kinase (JNK), так Decapentaplegic (DPP) в ведущем крае эпидермиса, которые специфицируют клетки ведущего края и связаны с формированием крупных надклеточных actin-myosin кабелей на ведущем крае (Harden, 2002). Как контракции с помощью этих надклеточных (supracellular) actin-myosin кабелей, так и апикальные сужения клеток AS, как полагают, управляют закрытием, в то время как силы от массы латерального эпидермиса противодействуют им (Hutson et al., 2003; Gorfinkiel et al., 2009; Solon et al., 2009; Almeida et al., 2011). Апикальные сужения AS клеток являются пульсирующими и обеспечиваются с помощью actin-myosin токов в их верхушках. Сокращения надклеточного actin-myosin кольца в ведущем крае эпидермиса, как полагают, трансформируют первоначально временные апикальные сужения AS клеток в стабильные апикальные сужения AS, которые необходимы для эффективного дорсального закрытия (Solon et al., 2009).
Nonpulsatile Actin-Myosin Flows
Actin-myosin токи могут быть также не пульсирующими, как это наблюдается в желточных клетках гаструлирующих эмбрионов рыбок данио, в которых они участвуют в выталкивании enveloping cell layer (EVL)-слоя сквамозных эпителиальных клеток на поверхности эмбриона- поверх желточных клеток (Behrndt et al., 2012; Movie S6). Эти токи появляются на поверхности желтковых клеток, которые еще не покрыты EVL и ориентированы в направлении края EVL, который соединен с желточными клетками с помощью плотных соединений (Figure 2D). Ориентация тока противоположна направлению распределения EVL и ассоциирована с образованием крупных actin-myosin похожих на кабели структур, локализованных внутри желтковых клеток по краю EVL. Комбинированные активности actin-myosin токов в направлении края, генерирующие тянущие усилия на край EVL, когда им противостоят сцепление внутри желтковых клеток и сокращения по окружности actin-myosin кабелей, как полагают, управляют распространением EVL поверх желточных клеток.
Regulation of Actin Flow and Force Transmission
В целом эти исследования показали, что токи актин-миозиновых сетей играют критическую роль в генерации и трансмиссии сил, запускающих морфогенез эпителиальных тканей. В большинстве этих процессов actin-myosin токи являются пульсирующими, хотя эффект этих пульситующих токов на морфогенез клеток и тканей может существенно варьировать между разными индивидуальными процессами. В целом изменения в форме клеток, возникающие в результате пульсирующих токов зависят от нескольких критических параметров: (1) частоты и амплитуды контракций actin-myosin сети и направления токов actin-myosin, генерирующих силы, необходимые для изменений формы клеток; (2) силы связи контрактильной actin-myosin сети с соединительными комплексами, функционирующими в качестве молекулярной сцепляющей манжетки, передающей силы от actin-myosin сети к соединениям и посредством этих соединений к соседним клеткам; и (3) стабилизация периодических изменений формы, обусловленных пульсирующими сокращениями actin-myosin, функционирующими в качестве молекулярного храповика (ratchet), противостоящего изменениям клеточной формы, обусловленным реляксацией actin-myosin сети. Выяснение того, как эти параметры контролируются и связаны, позволит понять, как пульсирующие actin-myosin токи действуют в морфогенезе клеток и тканей. Пока мало известно относительно молекулярных и клеточных механизмов, с помощью которых частота и амплитуда контракций actin-myosin контролируется внутри организма. В Drosophila AS клетках белки полярности Par3 и Par6, как было установлено, регулируют частоту сокращений апикальной actin-myosin сети посредством пока неизвестного механизма (David et al., 2010). Хотя специфические вышестоящие регуляторы амплитуды сокращений actin-myosin сети, пока ещё не идентифицированы, можно предположить, что амплитуда зависит от механических свойств сети и её связи и сцепления с cadherin или integrin цитоплазматическими линкерами. Механические свойства actin-myosin сети, в свою очередь, детерминируются её специфической молекулярной композицией из актина, миозина и поперечных связок, а также оборота и скоростей (un)binding её молекулярных компонентов (Bendix et al., 2008; Koenderink et al., 2009) Направление actin-myosin токов может контролироваться с помощью анизотропных напряжений (Mayer et al., 2010; Behrndt et al., 2012). Связь actin-myosin сети с cadherin и integrin адгезивными сайтами, и тем самым с функцией молекулярного захвата (clutch), зависит от kоn и koff их взаимодействия. Теоретическая формулировка и экспериментальные данные показывают, что такая связь может приводить к появлению осциллирующих растягивающих (traction) сил (Chan and Odde, 2008). Более того, адгезивные комплексы подвергаются эндоцитозу и/или рециклингу, детерминирующему их динамический оборот в плазматической мембране, а разные компоненты адгезивных комплексов обнаруживают разные скорости связывания и рассоединения, контролирующие механические свойства продукции сил этих комплексов. Стабилизация периодических изменений формы клеток, обусловленных пульсирующими сокращениями сети и тем самым функцией храповика, ещё более загадочна. В качестве возможных механизмов, лежащих в основе функции храповика в клетках Drosophila, может быть предложено формирование крупных апикальных скоплений Myoll, ассоциированных с каждым центростремительным током в мезодерме и/или с увеличением кортикального натяжения в апикальных соединениях в эпителии зародышевого диска (Martin et al. 2009, 2010; Rauzi et al., 2010). У беспозвоночных генерация сил и функции храповика могут зависеть от разных изоформ Myoll, которые выполняют разные роли в эпителиальной ткани благодаря свой различающейся ATPase активности и свойствам связывания актина (Smutny et al., 2010).
Остаются также вопросы, как используются периодические в противове постоянным actin-myosin сокращениям в тканевом морфогенезе. Различия между периодическими и постоянными сокращениями лежат в основе динамики процессов, с пульсирующими сокращениями , приводящими к более частым изменениям формы, чем постоянные сокращения. Эта усиленная динамика может просто представлять собой врожденное свойство любого работающего вхолостую actin-myosin мотора, который чтобы оставаться продуктивным, всё ещё д. быть стабильно связан со своими эффекторными структурами. Напротив, пульсирующие сокращения могут помочь в скрининге клеточных гибких производственных систем, которые соответствуют минимальному и тем самым предпочтительному энергетическому состоянию, которое характеризует только непрерывные сокращения, это может быть трудно достижимым. Др. различия между пульсирующими и постоянными сокращениями могут заключаться в том, что пульсирующие сокращения по другому активируют механочувствительные петли обратной связи в молекулярных "захватах" или "храповиках", которые связывают actin-myosin сеть с соединениями, тем самым приспосабливая активность захватов и/или храповиков к механическими ограничениям ткани.
Force Integration and Coordination at Tissue Scale
Анализ actin-myosin динамик в индивидуальных клетках предоставляет информацию о том, как механические силы, локально сгенерированные, передаются посредством межклеточных соединений соседним клеткам. Однако только интеграция этих локальных сил в паттерн глобальной тканевой силы детерминирует окончательные изменения в форме клеток и тканей. Во время инвагинации мезодермы у Drosophila , изотропный, центростремительный ток актина в верхушках мезодермальных клеток вызывает апикальные сужения этих клеток. Теперь глобальный стресс ткани является анизотропным, при этом более высокий стресс вдоль AP оси, и поэтому каждый изотропный (одинаковый во всех направлениях) центростремительный ток actin-myosin не связан с изотропным апикальным сужением, а вместо этого связан с предпочтительным сужением вдоль DV оси (Figure ЗА; Martin et al., 2010). Сходным образом, во время оогенеза Drosophila пульсирующие сокращения Myoll на базальной стороне фолликулярных клеток генерируют анизотропные сокращения по окружности, которые сдавливают и тем самым удлиняют ооцит вдоль AP оси (He et al., 2010). Наконец, во время удлинения зародышевого диска Drosophila внешние силы, ассоциированные с мезодермальной инвагинацией способствуют, клеточной элонгации вдоль AP оси, тем самым внося вклад в общее удлинение зародышевого диска (Butler et al., 2009). Помимо роли внешних сил в изменении паттерна сил в ткани, возникают коллективные эффекты, обусловленные комбинаторными активностями малых тканевых деформаций, происходящих в результате изменений в форме, позиции и/или делении индивидуальных клеток, решительно влияющих на глобальные деформации на уровне ткани. Следовательно, понимание тканевого морфогенеза нуждается не только в констатации того, как динамичные изменения actin-myosin генерируют механические силы, но и также как коллективное поведение клеток контролируется и координируется на уровне ткани. Недавние успехи в области планарной клеточной поляризации и механотрансдукции предоставили информацию о молекулярных и клеточных механизмах, с помощью которых индивидуальные клеточные динамики координируются, чтобы вызывать крупные деформации на тканевой шкале (Figures 3B-3D).
Planar Cell Polarity
Существенный прогресс был достигнут в вычленении сигнальных механизмов двух основных путей, детерминирующих PCP в тканях; Wnt/Frizzled (Fz) и Fat/Dachsous (Ds) пути (for rev. Goodrich and Strutt, 2011; Gray et al., 2011). У Drosophila путь Wnt/Fz-PCP преимущественно необходим для детерминации полярности волосков, щетинок и омматидий, но обнаруживается не столь явная функция в тканевом морфогенезе. Напротив, передача сигналов Wnt/Fz-PCP у позвоночных играет главную роль в клеточных интеркаляциях, управляющих морфогенезом зародышевого слоя во время гаструляции и нейруляции (rev. Roszko et al., 2009). В частности, недавние исследования функции передачи сигналов Wnt/Fz-PCP в морфогенезе нервной трубки предоставили информацию о том, как этот путь одновременно контролирует образование складок нервной пластинки и движения конвергентного вытягивания (Nishimura et al., 2012). Закрытие нервной трубки использует (1) интеркаляции нейроэпителиальных клеток, ассоциированные с перемещениями конвергентного вытягивания нервной пластинки и (2) искривление нервной пластинки вдоль её AP оси (Movie S7). Изгибание нервной пластинки управляется с помощью скоординированных апикальных сужений клеток нервной пластинки вблизи срединной линии нервной пластинки, это зависит от активности Shroom3, recruiting Rho-kinase (ROCK), и, следовательно, активации Myoll на верхушках этих клеток (Hildebrand and Soriano, 1999; Haigo et al., 2003; Hildebrand, 2005; Nishimura and Takeichi, 2008). Отметим, что апикальные сужения клеток нервной пластинки являются анизотропными и эти анизотропные сужения, в принципе, достаточны, чтобы объяснить ориентированные интеркаляции клеток, объясняющие движения конвергентного удлинения, так и поляризованное изгибание нервной пластинки. Поляризованное расположение Wnt/Fz-PCP компонента Celsrl, гомолога у позвоночных Drosophila Flamingo, в апикальных соединениях вдоль DV оси нервной пластинки необходимо для накопления ROCK в этих соединениях
Apical constriction -> Tissue elongation
Coordination by gene expression pattern and PCP
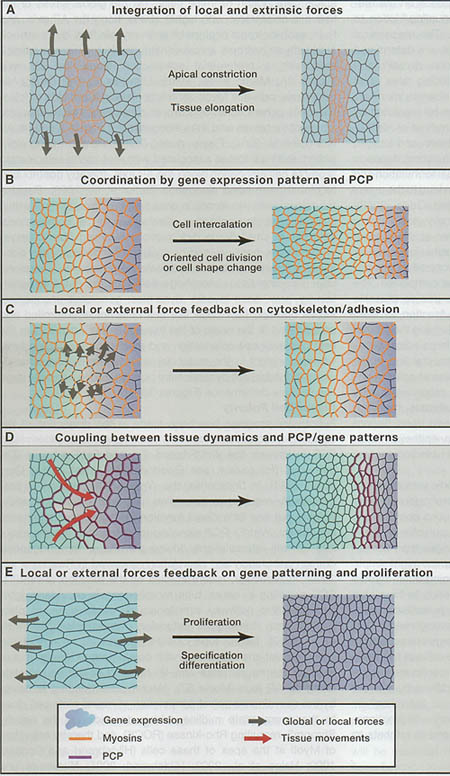 Figure 3. Principles Determining Tissue Morphogenesis and Patterning
Figure 3. Principles Determining Tissue Morphogenesis and Patterning
(A) The integration of local and global mechanical forces determines cell/tissue shapes changes. Here, apical isotropic actin-myosin contractility and external pulling force lead to anisotropic apical cell constriction.
(B) Gene expression patterns coordinate local cell mechanical properties (anisotropic cell contraction via PCP in [B] or apical cell constriction in [A]) to generate collective cell dynamics (cell shape changes, oriented cell divisions, oriented cell rearrangements) associated with large-scale tissue deformations.
(C) Tissue morphogenetic movements deform gene expression and planar cell polarity patterns.
(D and E) Mechanotransduction functions in cell/tissue morphogenesis by modulating cell mechanical properties, cell proliferation/death, and gene expression.
(Nishimura et al., 2012). ROCK, в свою очередь, ведет к накоплению phosphomyosin легкой цепи и предпочтительному сужению DV соединений, управлению интеркаляцией AP-ориентированных клеток и изгибанием нервной пластинки (Nishimura et al., 2012). Хотя механизмы, с помощью которых Celsrl локализуется в DV соединениях, остается неизвестным, наблюдения, что Celsrl одновременно регулирует конвергентное удлинение нервной трубки и изгибание предоставляет новую информацию о функции Wnt/Fz-PCP по интеграции разных морфогенетических движений.
Путь Drosophila Fat/Ds-PCP играет фундаментальную роль в регуляции морфогенеза эпителиальных тканей Drosophila (Baena-Lopez et al., 2005; Mao et al., 2006; Saburi et al., 2008; Aigouy et al., 2010; Mao et al., 2011; Bosveld et al., 2012). Гены fat и ds кодируют протокадгерины, чье гетерофильное связывание модулируется с помощью four-jointed (Fj) располагающейся в Гольджи киназой (Ishikawa et al., 2008; Brittle et al., 2010; Simon et al., 2010). Во многих эпителиальных тканях Drosophila, ds и fj экспрессируются в тканях в виде противоположных градиентов (Yang et al., 2002; Ma et al., 2003). Fat и Ds оказываются планарно поляризованными в специфических доменах fj , а градиенты экспрессии ds в тканях необходимы для поляризованного распределения Myosin Dachs (Bosveld et al., 2012; Brittle et al., 2012; Ambegaonkar et al., 2012). В то время как Fat исключает Dachs из кортекса клеток, чтобы регулировать передачу сигналов Hippo (Mao et al., 2006; Rauskolb et al., 2011), внутриклеточный домен Ds взаимодействует с Dachs, чтобы поляризовать распределение Dachs и определить направление планарной поляризации Dachs (Bosveld et al., 2012). Будучи поляризованным, Dachs локально увеличивает кортикальное напряжение вдоль линии своей поляризованной локализации, приводя к ориентированным перестройкам клеток, которые придают форму эпителию дорсального торакса Drosophila (Bosveld et al., 2012). Итак, исследования Wnt/Fz-PCP и Fat/Ds-PCP подчеркивают консервативную роль этих путей в регуляции интеркаляций клеток с помощью поляризованного субклеточного распределения Myosins (Figure 3B).
Mechanotransduction
Помимо поляризации ткани посредством передачи сигналов, механотрансдукция между соседними клетками или вдоль разных тканей, как было установлено, является критической для координации контрактильности и динамики клеток. Во время инвагинации мезодермы координация апикальных сокращений мезодермальных клеток необходима для запуска инвагинации ткани. Эта координация, как полагают, достигается с помощью Myoll-зависимых апикальных сужений мезодермальных клеток, ингибирования эндоцитоза и тем самым инактивации секретируемого белка Folded-gastrulation, который также является ключевым сигналом, способствующим апикальному сужению в мезодермальных клетках (Pouille et al., 2009). Координация клеточных интеркаляций посредством механочувствительности, как было установлено, для удлинения зародышевого диска Drosophila, при котором формирование паттерна вдоль AP оси нуждается в обогащении Myoll в AP клеточных соединениях (Zallen and Wieschaus, 2004). В свою очередь, Myoll-обусловленное кортикальное натяжение вызывает дальнейшее рекрутирование Myoll в AP соединения соседних клеток, приводя к формированию надклеточных Myoll кабелей, которые запускают одновременные интеркаляции множественных клеток, внося вклад в удлинение зародышевого диска (Blankenship et al., 1006; Fernandez-Gonzalez et al., 2009). Образование надклеточных кабелей является также критическим для формирования границ компартментов, предупреждающих перемешивание клеток, связанное с клеточными делениями вблизи к границе (Landsberg et al., 2009; Monier et al., 2010; Schilling rt al., 2011; Aliee et al., 2012). Хотя передача сигналов Hedgehog и Wingless участвуют в формировании надклеточных кабелей на границе (Butler et al., 2009; Landsberg et al., 2009; Schilling et al., 2011), вполне допустимо, что механическая обратная связь, с помощью которой сокращения кабелей способствуют образованию кабелей, может также быть вовлечена. Некоторые предполагаемые механизмы могут существовать, с помощью которых миозином обеспечиваемые сокращения усиливают накопление миозина путем модуляции активности самих миозинов, благодаря стабилизации их ассоциаций с актином, напр., (Cremo and Geeves, 1998; Сovacs et al., 2007; Kee and Robinson, 2008). Альтернативно, комплексы E-Cad/catenin могут действовать как сенсоры механических стрессов, чтобы локально увеличить накопление actin-myosin и контрактильность (Ladoux et al., 2010; Liu et al., 2010; le Due et al., 2010; Yonemura et al., 2010; Taguchi et al., 2011; Borghi et al., 2012). Наконец, поляризованное myosin-обусловленное механическое натяжение может деформировать и распределять actin-myosin сеть вдоль оси натяжения, которое затем ещё больше усиливает контрактильную активность миозина вдоль этой оси.
У C. elegans механическая связь между эпидермисом и мышцами необходима для элонгации эмбриона (Zhang et al., 1011). Мышцы стенки тела соединены с базальной стороной эпидермиса посредством полу-десмосом. Полудесмосомы также соединяют апикальную сторону эпидермиса с цитоскелетом. Промежуточные филаменты (IFs), натягивающие клетки эпидермиса, закреплены на апикальных и базальных полудесмосомах (Zhang and Labouesse, 2010). Мышечные сокращения способствуют ассоциации G-protein-receptor kinase interactor (GIT-1) с полудесмосомами. GIT-1 в свою очередь стимулирует киназную активность p21-activated kinase (PAK-1), которая фосфорилирует IFs, при этом модифицируя организацию IF и способствуя стабильности полудесмосом (Zhang et al., 2011).
Tissue Morphogenesis and Signaling
Пути передачи сигналов не только координируют динамику индивидуальных клеток, чтобы вызывать крупные деформации на уровне ткани, также обеспечивая обратной связью организации сигнальных центров, модулируя тем самым формирование тканевого паттерна (Figure 3D). Исследования как на тканях животных, так и растений предоставляют исчерпывающие доказательства критической функции в вызываемых силовыми воздействиями клеточных перестройках внутри тканей, чтобы повлиять на глобальную тканевую PCP и формирование паттерна. В развивающейся крыловой пластинке Drosophila клетки обнаруживают планарную поляризацию вдоль своей проксимо-дистальной оси (PD). Эта поляризация обеспечивается за счет локализации белков пути Fz-PCP на дистальной и/или проксимальной стороне клеток крыловой пластнки (for rev. Goodrich and Strutt, 2011). Недавняя работа показала, что PD локализация этих белков является результатом инициальной планарной поляризации клеток крыла в направлении края крыла, и последующей перестройки клеток крыла посредством анизотропного натяжения вдоль PD оси ткани (Aigouy et al., 2010; Sagner et al., 2012). Анизотропное натяжение, перестраивающее крыловые клетки, возникает в результате контракций крылового шарнира, прикрепленного к пластинке. Критические клеточные процессы, лежащие в основе клеточных перестроек за счет анизотропного тканевого натяжения, изменяют соседние клетки и ориентацию клеточных делений. Оба процесса также зависят от пути Ft/Ds и поэтому дефекты в передаче сигналов Ft/Ds приводят к тяжелым нарушениям перестройки клеток за счет анизотропных тканевых натяжений. Функция Ft/Ds частично может опосредоваться с помощью myosin Dachs, контролирующего как перестройки клеток, так и ориентацию делений (Mao et al., 2011; Bosveld et al., 2012) или с помощью Myoll, который может становиться поляризованным в ответ анизотропное натяжение, генерируемое сокращениями шарнира крыла.
Интересно, что сходные наблюдения обеспечиваемых силами перестроек клеток и реорганизации цитоскелета, затрагивающими форму и/или формирование паттерна, сделаны и на растениях (Hamant et al., 2008; Kuchen et al., 2012). Сигнальные центры, предопределяющие рост листьев, как полагают, первоначально расположены перпендикулярно др. др., детерминируя PD и медио-латеральный рост листа. Эти первоначально ортогонально расположенные сигнальные центры, как полагают, постепенно запускают изменения в форме листа, которые снова обеспечивают обратную связь, чтобы модулировать пространственное расположение самих сигнальных центров. Такая взаимная обратная связь между сигнальными центрами, детерминирующая скорость клеточного роста и направление внутри ткани и возникающие в результате клеточные перестройки, меняющие организацию этих сигнальных центров, как было установлено, достаточна, чтобы объяснить вариации в форме листа, наблюдаемые у разных видов (Kennaway et al., 2011; Kuchen et al., 2012).
Итак, механизмы, с помощью которых коллективные эффекты от кумулятивных и комбинаторных активностей локальных тканевых деформаций влияют на глобальные деформации на уровне ткани, начинают расшифровываться. Как воздействия экзогенных глобальных сил от соседних тканей и механочувствительность внутри тканей, по-видимому, играют определяющие роли, хотя точный молекулярный и клеточный механизмы лежащих в основе сил интеграции и механочувствительности всё ещё ясны не до конца.
Force Regulation of Cell Differentiation and Proliferation
Способность клеток воспринимать внешние механические силы, влияющие на размер и архитектуру ткани, не только за счет изменений их адгезивной и цитоскелетной организации на короткой временной шкале, но и также за счет воздействия на спецификацию их судьбы и дифференцировку на длинной временной шкале (Figure 3E). Внешние механические силы могут возникать от микроскопических токов жидкости и от взаимодействия с внеклеточным матриксом (ECM) и глобальных тканевых стрессов.
Extracellular Matrix Interactions
Роль статических сил в пролиферации клеток, спецификации судьбы и детерминации клонов, лучше всего можно понять в контексте взаимодействий между клетками и ECM, обеспечиваемых с помощью integrin рецепторов (for rev. Eyckmans et al., 2011). Молекулярные механизмы, с помощью которых клетки присоединяются к ECM посредством integrins активно исследовались (for rev. Parsons et al., 2010). В последние годы разработка microfabricated устройств для контроля химического и механического окружения клеток независимо др. от др. революционизировали исследования по механотрансдукции и их роли в дифференцировке стволовых клеток и развитии тканей (Kobel and Lutolf, 2011). В частности, стало возможным разделение соотв. вкладов закрепления на ECM, округления клеток, межклеточных взаимодействий, натяжения клеток и компакции клеток для поддержания и дифференцировки стволовых клеток. Сегодня чётко установлено, что изменения формы клеток и изменчивость жесткости ECM, обеспечиваемая с помощью интегринов может оказывать решительное воздействие на разные типы клеток, такие как мезенхимные стволовые клетки (MSCs), мышечные стволовые клетки и эндотелиальные клетки (for rev. Discher et al., 2009). В частности, MSCs дифференцируются в остеобласты на жестком ECM, который воспроизводит свойства натуральной кости, тогда как MSCs дифференцируются в др. клоны, такие как адипоциты, на мягком ECM (Discher et al., 2009).
Transducing Mechanical Forces
MAL7SRF и YAP/TAZ транскрипционные регуляторы считаются ключевыми молекулами, передающими эффект механических сил на пролиферацию клеток, дифференцировку стволовых клеток и детерминацию клонов (Connelly et al., 2010; Dupont et al., 2011; Wada et al., 2011). Механически вызываемые изменения в уровнях G-actin нуждаются в MAL (megakaryocytic acute leukemia, также известным как MRTF-A и MKL1), взаимодействующем с serum response factor (SRF) (for rev. Olson and Nordheim, 2010). Комплекс MAI7SRF также участвует в восприятии механических сил от ECM, оказывая влияние на выбор стволовыми клетками эпидермальной судьбы (Connelly et al., 2010) и на миграцию пограничных клеток у Drosophila (Somogyi and Rorth, 2004). Yorkie-гомолог YAP (Yes-associated protein) и TAZ (transcriptional coactivator with PDZ-binding motif), которые ассоциируют с TEA доменовыми транскрипципционными факторами, считаются ключевыми механосенсорами и механотрансдукторами, контролирующими детерминацию клонов и пролиферацию клеток во многих клеточных типах, таких как MSCs (Dupont et al., 2011). Ядерная локализация YAP/TAP предопределяется с помощью жесткости ECM-высокая жесткость ECM и распределение клеток увеличивают кортикальное напряжение и способствуют образованию стрессовых волокон, которые с помощью пока неизвестного механизма, приводят к транслокации YAP/TAZ в ядро, тогда как низкая жесткость и округление клеток способствуют цитоплазматической его локализации (Dupont et al., 2011; Wada et al.,
2011). Потеря функции YAP/TAZ в MSCs вызывает их дифференцировку в адипоциты, независимо от ригидности ECM. Напротив, активация of YAP/ТAZ в MSCs достаточна для обеспечения их дифференцировки в остеобласты на твердом субстрате зависимым от Rho способом. В ответ на образование стрессовых волокон, YAP/TAZ также участвует в регуляции клеточной пролиферации (Dupont et al., 2011; Wada et al., 2011). Подтверждением роли накопления F-actin для обеспечения эффекта механических сил на активности YAP/ТAZ являются находки у Drosophila, которые показали, что увеличение уровней F-actin способствует росту и пролиферации клеток посредством Yorkie, гомологу YAP у Drosophila (San-sores-Garcia et al., 2011; Fernandez et al., 2011). Как F-actin регулирует YAP/ТAZ активности и является ли он окончательным сигналом, который регулирует YAP/TAZ-обусловленное поведение клеток в ответ на механические сигналы, обусловленные контрактильным аппаратом, ещё предстоит охарактеризовать.
Tissue Compression
Обычно сдавливание ткани и стрессы, как полагают, играют критическую роль в регуляции размера ткани и спецификации клеточных судеб. Во время роста имагинальных дисков Drosophila интеграция передачи сигналов, запускаемых с помощью TGFβ-гомолога Decapentaplegic (Dpp), и механических стрессов обусловливают гомогенную скорость пролиферации по всей ткани, тем самым контролируя размер ткани (Hufnagel et al., 2007; Aegerter-Wilmsen et al., 2012). Сходным образом, механическое сжатие stomadeal зачатка у эмбрионов Drosophila, обусловливающее элонгацию зародышевого диска, оказывается достаточным для активации в зачатке экспрессии twist (Desprat et al., 2008). Активация экспрессии twist зависит от компрессией индуцированного высвобождения β-catenin из клеточных соединений зависимым от Src способом (Desprat et al., 2008). Сходным образом, у мышей мышечные сокращения необходимы для поддержания предшественников суставов, детерминируемых к своей судьбе благодаря активации β-catenin в клетках предшественников (Kahn et al., 2009).
Condensation
У позвоночных конденсация MSCs во время образования зубов представляет пример того, как конденсация клеток и тем самым связанная с этим механическая компрессия влияет на спецификацию клеточных судеб и дифференцировку (Mammoto et al., 2011). Во время образования эмбрионального зубного органа fibroblast growth factor (FGF), продуцируемый зубным эпителием (DE), способствует миграции мезенхимных клеток и т.о., привлекает повышенные количества мезенхимных клеток под зубным эпителием. Однако, зубной эпителий также секретирует коротко-действующий отталкивающий сигнал, Sema3f, который локально отталкивает мезенхимные клетки. Поэтому мезенхимные клетки конденсируются и становятся плотно упакованными под DE. Возникающее в результате механическое сдавливание вызывает округление клеток и потерю стрессовых волокон и снижает активность RhoA. Пониженная активность RhoA, в свою очередь, ведет к индукции одонтогенной клеточной судьбы в этих клетках за счет активации экспрессии одонтогенных генов, таких как Pax9 (Mammoto et al., 2011). У Drosophila и рыбок данио сдавливающие силы ассоциированы с перенаселенностью, что, как полагают, ведет к выталкиванию живых клеток из эпителия (Eisenhoffer et al., 2012; Marinari et al., 2012).
Fluid Flows
Не только статические силы, но и также силы, возникающие в результате микроскопических токов жидкости, как было установлено, влияют на клеточную дифференцировку и глобальное формирование паттерна ткани и эмбриона (Freund et al., 2012). Наиболее впечатляет ток жидкости внутри органа laterality, контролирующего формирование паттерна эмбриона вдоль его лево-правосторонней (LR) оси у разных видов (Nonaka et al., 1998; McGrath et al., 2003; Tanaka et al., 2005). Здесь реснички расположены в полости на вентральной поверхности узелка у кур и мышей-и на внутренней поверхности Kuppfer's пузырька у рыбок данио-наклонены вдоль AP оси эмбриона (Okada et al., 2005; Hirokawa et al., 2006; Okabe et al., 2008). Эти однонаправленный наклон ресничек нуждается в планарной поляризации клеток, формирующих реснички, с помощью Wnt/Fz-PCP пути и позволяет ресничкам вызывать направленный ток жидкости по поверхности эффективно направляя его только в одно направлении (Song et al., 2010; Borovina et al., 2010). Однонаправленный ток по поверхности, как полагают, асимметрично распределяет ещё не идентифицированные сигнальные молекулы (Tabin and Vogan, 2003) dljkm LR оси органа, который постепенно поляризует эмбрион вдоль этой оси (Nonaka et al., 2002; Okada a. 2005). Кроме того, или альтернативно, однонаправленный ток, обусловленный поляризованными ресничками колеблющимися на поверхности органа laterality, как полагают, запускает механочувствительную реакцию в ресничках, расположенных на левой стороне полости, это в свою очередь поляризует эмбрион вдоль его LR оси (Tabin and Vogan, 2003).
Механочувствительность клеток к току жидкости была также описана для эндотелиальных клеток, формирующих кровеносную и лимфатическую сосудистую систему (rev. Jones et al., 2006; Swartz and Fleury, 2007). В кровеносной сосудистой системе эндотелиальные клетки ощущают механические воздействия от сдирающего стресса жидкости, обусловленного кровотоком, , как было установлено, модулируя форму? качественные характеристики (вены в противовес артериям; leNoble et al., 2005; Buschmann et al., 2010; Corti et al., 2011) и функцию кровеносных сосудов (rev. Jones et al., 2006; Swartz and Fleury, 2007). Некоторые механотрансдукторы, как полагают, обеспечивают реакцию эндотелиальных клеток на сдирающий стресс жидкости. В частности первичные реснички могут представлять собой одну из таких механочувствительных структур, т.к. дефектный цилиогенез в эндотелиальных клетках сопровождается тяжелыми нарушениями развития сердца (Slough et al., 2008). В лимфатической сосудистой системе вихревые потоки (shear flow) кооперируют с транскрипционными факторами PROX1 и FOXC2 при контроле сборки и вычленения территории лимфатических клапанов (Sabine et al., 2012). Механочувствительность к сдирающим (вихревым) стрессам жидкости также участвует в спецификации гематопоэтических стволовых клеток (HSCs), которые образуются вблизи эндотелиальных клеток кровеносных сосудов (North et al., 2009; Adamo et al., 2009). Сдирающий стресс жидкости выявляет механочувствительную реакцию HSCs, которая ведет к выраженным изменениям в спецификации судьбы их клеток и потенциала дифференцировки.
Итак, растут доказательства для внешних механических сил, функционирующих в морфогенезе тканей и эмбрионов, путем модулирования спецификации клеточных судеб и дифференцировки. Поскольку молекулярные и клеточные механизмы, с помощью которых внешние силы влияют на дифференцировку клеток, были установлены. Остается исследовать, как дифференцировка клеточных судеб оказывает обратный эффект на способность клеток генерировать и воспринимать эти силы.
Conclusions
Центральная роль механических сил, играющих роль в тканевом морфогенезе и формировании паттерна становится всё яснее. Хотя механизмы, с помощью которых силы функционируют в этих процессах активно исследовали ex vivo, сравнительно мало известно о функции сил при физиологических условиях в развивающихся эмбрионах. Всё ещё до конца неясны величина и распределение сил внутри эмбриона и как такие силы вызывают механочувствительные реакции в клетках эмбрионов, которые могут решительно повлиять на их развитие. Технические успехи по точному измерению и манипуляциям с силами внутри развивающегося эмбриона являются важными для решения этого вопроса. Важными ступенями в этом направлении являются недавнее использование вычислительных методов, чтобы сделать вывод о силах, деформирующих ткань или о сегментированных изображениях (Brodland et al., 2010; Ishihara and Sugimura, 2012; Chiou et al., 2012), а также экспериментальные методы, такие как сенсоры молекулярных сил и оптические пинцеты, с помощью которых силы могут быть измерены и использованы на субклеточном уровне внутри клеток и тканей in vivo. Также недавние успехи в оптогенетических подходах, при которых функция специфических молекул может быть локально активирована или инактивирована с помощью света (for rev. Toettcher et al., 2011), подтверждают, что это может быть ценным инструментом для манипуляций с генерирующими силы и воспринимающими силы процессами пространственно-временным высоко контролируемым способом внутри эмбриона. Более того, чтобы выяснить взаимодействие между функцией механических сил в мофрогенезе и спецификацией клеточных судеб, важно одновременно отслеживать силы и экспрессию генов, ассоциированных с приобретением и поддержанием специфических судеб клеток внутри эмбриона. Наконец, хотя многие исследования были предприняты с двумерными эпителиальными слоями клеток, важной задачей остается дальнейшее расширение недавних методов сегментации, кинематографических измерений и механических моделей для трех измерений
(Olivier et al., 2010; Kennaway et al., 2011; Gelbart et al., 2012; Osterfield et al., 2013).
Another important challenge ahead will be to analyze morphogenesis in tissues in which cell proliferation plays a major role. As of yet, tissue morphogenesis is best understood in nonproliferative tissues in which cell shape changes and cell rearrangements are the predominant processes driving morphogenesis. For quantifying the specific contributions of cell shape changes and cell rearrangements to global morphogenesis of those tissues, the application of various mathematical frameworks has been decisive. In contrast, although there has been important progress in analyzing morphogenesis of some proliferative tissues (Boehm et al., 2010), the contribution of the rate and orientation of cell divisions and their interplay with cell shape changes and cell rearrangements is still not entirely clear. Moreover, recent findings have provided insight into the role of mitotic cell rounding in tissue invagination (Kondo and Hayashi, 2013) and the interaction of dividing cells with their neighboring cells regulating cytokinesis and epithelial tissue organization (Fou-nounou et al., 2013; Guillot and Lecuit, 2013; Herszterg et al., 2013). The analysis of morphogenesis in proliferative tissues is, in part, impeded by the lack of a rigorous quantitative framework, with the help of which specific contributions of cell divisions and apoptosis in addition to cell shape change and cell rearrangements to tissue morphogenesis can be determined.
Irrespective of the proliferative nature of tissues, it will be critical to understand how diverse and elaborated tissue shapes can be generated by the combinatorial activities of different signaling pathways in controlling cell shape, rearrangements, and division. Combinatorial activities of signaling pathways have been shown to be important for the regulation of diverse flower shapes in plants (Cui et al., 2010). To dissect the specific contributions of different signaling pathways in embryo morphogenesis, the development of subtractive approaches of deformation field rates and cell dynamics in embryos with defects in certain signaling pathways have turned out to be instrumental in assigning specific functions to specific signaling pathways in morphogenesis (Bosveld et al., 2012).
|
 Figure 1. Self-Organization of Cells at Steady State Determined by Actin-Myosin Contractility and Cell Adhesion
Figure 1. Self-Organization of Cells at Steady State Determined by Actin-Myosin Contractility and Cell Adhesion 
 Figure 3. Principles Determining Tissue Morphogenesis and Patterning
Figure 3. Principles Determining Tissue Morphogenesis and Patterning