Посещений:  ФОРМИРОВАНИЕ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
ФОРМИРОВАНИЕ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Детерминация клонов
|
|
Pancreas Organogenesis:From Lineage Determination to Morphogenesis
Hung Ping Shih, Allen Wang, and Maike Sander
 Annu. Rev. Cell Dev. Biol. 2013. 29:19.1–19.25
The Annual Review of Cell and Developmental
Biology is online at http://cellbio.annualreviews.org
|
The pancreas is an essential organ for proper nutrient metabolism and has both endocrine and exocrine function. In the past two decades, knowledge of how the pancreas develops during embryogenesis has signifcantly increased,largely from developmental studies in model organisms. Specifcally,the molecular basis of pancreatic lineage decisions and cell differentiation is well studied. Still not well understood are the mechanisms governing threedimensional morphogenesis of the organ. Strategies to derive transplantable β-cells in vitro for diabetes treatment have benefited from the accumulated knowledge of pancreas development. In this review, we provide an overview of the current understanding of pancreatic lineage determination and organogenesis, and we examine future implications of these findings for treatment of diabetes mellitus through cell replacement.
|
Поджелудочная железа важна для метаболизма питательных веществ и обладает как экзокринной, так и эндокринной функцией. Экзокринная часть поджелудочной железы состоит из ацинарных клеток и клеток протоков, роль которых заключается в переваривании пищевых веществ. Ацинарные клетки секретируют сок, содержащий энзимы, которые катализируют распад белков, углеводов и липидов. После высвобождения из ацинарных клеток панкреатический сок транспортируется в двенадцатиперстную кишку посредством системы протоков (Figure 1). Функционирующая в основном независимо от экзокринных клеток, эндокринная часть поджелудочной железы ответственна за регуляцию гомеостаза глюкозы с помощью высвобождения гормонов в кровоток. Эндокринная часть поджелудочной железы представлена пятью типами эндокринных клеток, которые располагаются в виде небольших кластеров, наз. островками Лангерганса.
Биология поджелудочной железы активно исследовалась в основном в надежде найти наилучшее лечение разрушительных болезней поджелудочной железы, таких как сахарный диабет, панкреатиты и панкреатическая аденокарцинома. В частности, успехи в технологии стволовых клеток недавно возбудили оптимизм, что диабет может быть излечен с помощью использования стволовых клеток для терапевтических целей. Это привело к повышению интереса к пониманию эмбрионального развития поджелудочной железы, особенно к событиям, связанным с выбором решений относительно судеб клеток и дифференцировки эндокринных клеток. Недавние успехи в получении панкреатических клеток из human pluripotent stem cells (hPSCs) представили доказательства плодотворного применения онтогенетических принципов к дифференцировке стволовых клеток.
OVERVIEW OF PANCREAS DEVELOPMENT
Использование генетических инструментов, в частности, трансгенных мышей, стало средством определения молекулярных событий, ведущих к органогенезу поджелудочной железы. Эксперименты по отслеживанию генетических клонов показали
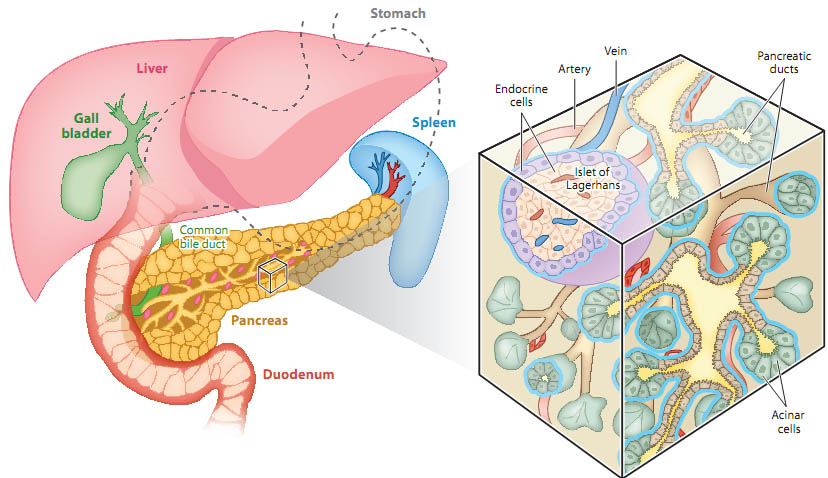 Figure 1
Overview of adult pancreas anatomy. The pancreas lies behind the stomach in the abdomen and attaches to the duodenum. For illustration purposes, the stomach is outlined with a dashed line and the duodenum is shown as a cut view. Exocrine acinar cells secrete pancreatic juice containing enzymes for the breakdown of proteins, carbohydrates, and lipids. The pancreatic juice is transported through a ductal network that releases the juice into the duodenum. The endocrine pancreas consists of small cell clusters, called islets of Langerhans, containing five endocrine cell types, namely glucagon-producing α-cells, insulin-producing β-cells,
somatostatin-producing δ-cells, and pancreatic polypeptide-producing PP cells. Note, the figure shows the islet organization characteristic for mice with centrally located β-cells. Pancreatic islets are surrounded by a dense capillary network through which the hormones are released into the blood stream. See inset for an enlarged cutaway view of the pancreas.
Figure 1
Overview of adult pancreas anatomy. The pancreas lies behind the stomach in the abdomen and attaches to the duodenum. For illustration purposes, the stomach is outlined with a dashed line and the duodenum is shown as a cut view. Exocrine acinar cells secrete pancreatic juice containing enzymes for the breakdown of proteins, carbohydrates, and lipids. The pancreatic juice is transported through a ductal network that releases the juice into the duodenum. The endocrine pancreas consists of small cell clusters, called islets of Langerhans, containing five endocrine cell types, namely glucagon-producing α-cells, insulin-producing β-cells,
somatostatin-producing δ-cells, and pancreatic polypeptide-producing PP cells. Note, the figure shows the islet organization characteristic for mice with centrally located β-cells. Pancreatic islets are surrounded by a dense capillary network through which the hormones are released into the blood stream. See inset for an enlarged cutaway view of the pancreas.
существование общего источника для экзокринных и эндокринных клеток поджелудочной железы из пула клеток предшественников в энтодерме кишки (Gu et al. 2002). У мышей развитие поджелудочной железы впервые становится морфологически заметным примерно на день эмбриогенеза (e) 8.75 с появления эпителиальных зачатков на противоположных сторонах энтодермы передней кишки (Figure 2a). Два панкреатических зачатка постепенно удлиняются вдоль презумптивных двенадцатиперстной кишки и желудка и в результате ротации кишки в конечном итоге сливаются в один орган на ст. e12.5 (Figure 2b). Одновременно пролиферация клеток ведет к быстрому увеличению размера зачатков поджелудочной железы, которые также меняют свою форму и начинаю формировать разветвленные трубчатые структуры в процессе, известном как морфогенез ветвления. Во время этой ранней фазы развития поджелудочной железы, которая обозначается как первичный переход (Pictet et al. 1972), всё ещё недифференцированный панкреатический эпителий плотно окружен мезенхимными клетками. Во время вторичного перехода от ст. e12.5 и до рождения, панкреатический эпителия продолжает расширяться и ветвиться в сложную высоко упорядоченную тубулярную сеть (Figure 2c). Эти морфологические изменения происходят параллельно с дифференцировкой эндокринных, ацинарных и протоковых клеток. В конце вторичного перехода поджелудочная железа мыши в основном приобретает топологическую организацию зрелого органа с кластерами ацинарных клеток, соединяющихся вкруг концов сети протоков, а агрегаты эндокринных клеток оказываются разбросанными по всему органу (Figure 2c,d ).
В последние 20 лет достигнут существенный прогресс в расшифровке ключевых молекулярных механизмов, которые лежат в основе множественных клональных решений, приводящих к образованию типов панкреатических клеток. В сравнении с менее изученной регуляцией морфогенеза поджелудочной железы, и вопросом, существует ли связь между морфогенетическими событиями и дифференцировкой клеток.
LINEAGE DECISIONS DURING PANCREAS DEVELOPMENT
Pancreas Induction
Прежде своего выпячивания панкреатические зачатки, вентральный и дорсальный препанкреатические регионы, специфицируются в энтодерме кишки примерно на ст. e8.5 (Slack 1995). Хотя вентральный и дорсальный панкреатические зачатки возникают независимо в разных местах, молекулярные программы, управляющие их спецификацией, довольно сходны. В противоположность большинству эпителиальных клеток энтодерма ранней кишки, экспрессия sonic hedgehog (Shh) избирательно исключается из презумптивной панкреатической энтодермы (Hebrok et al. 1998, Kim & Melton 1998). Эксперименты по трансгенной эктопической экспрессии у мышей показали, что исключение Shh из препанкреатического региона необходимо для индукции панкреатических маркеров (Apelqvist et al. 1997).
Подобно Shh, ретиноевая кислота (RA) также участвует в формировании паттерна энтодермы кишки. Отсутствие RA ведет к антериоризации энтодермы, приводя к полному агенезу поджелудочной железы у рыбок данио и к отсутствию дорсальной части поджелудочной железы у Xenopus и мышей (Chen et al. 2004, Martin et al. 2005, Molotkov et al. 2005, Stafford & Prince 2002). RA, по-видимому, индуцирует программу дорсальной части поджелудочной железы с помощью Shh-независимого механизма, поскольку потеря RA не связана с эктопической экспрессией Shh в препанкреатическом регионе у мышей (Martin et al. 2005).
Вентральная область передней кишки дает как вентральную часть поджелудочной железы, так и печень, которые развиваются в тесной близи др. к др. (for review, see Zorn & Wells 2009). Передача сигналов fibroblast growth factor (FGF) и bone morphogenetic protein (BMP) являются критическими предпеченочными сигналами, которые испускаются кардиальной мезодермой, окружающей предпеченочный регион (Deutsch et al. 2001, Rossi et al. 2001). Открытие сигналов, необходимых для индукции нормальной поджелудочной железы и печени, нашло практическое применение в протоколе направленной дифференцировки hPSCs, который использует RA и ингибиторы Shh и BMP, чтобы индуцировать панкреатические качественные особенности in vitro (D'Amour et al. 2006, Nostro et al. 2011).
Появление дорсального зачатка, по-видимому, также регулируется внешними сигналами от эндотелиальных клеток. Дорсальный и вентральный панкреатические зачатки развиваются из регионов энтодермы передней кишки, которые непосредственно контактируют с эндотелием сливающихся дорсальной аорты и вителлиновых вен, соотв.
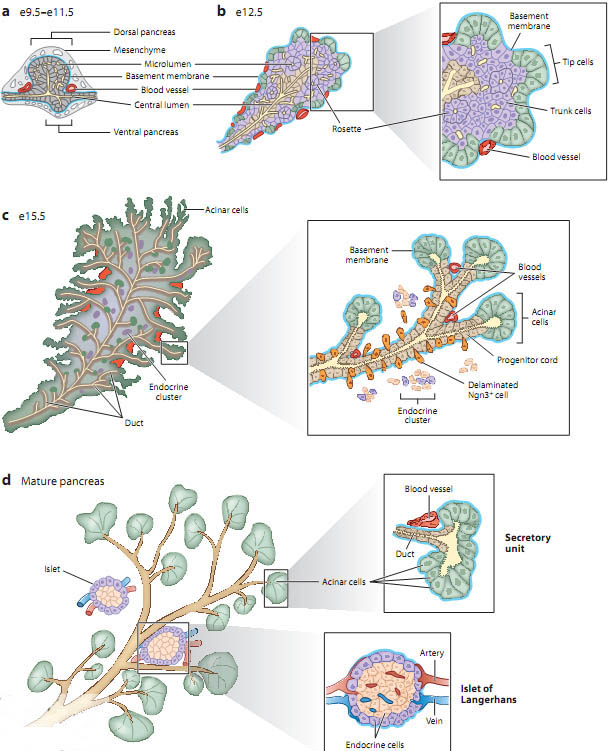 Figure 2
Illustrated overview of pancreatic organogenesis. (a) The dorsal and ventral pancreatic epithelium evaginates into the surrounding mesenchyme between embryonic day (e) 9.5 and e11.5 in mice. At this stage, the pancreatic epithelium is comprised of a multilayered core of unpolarized cells engulfed by a basement membrane. Scattered microlumens (light yellow) arise between epithelial cells. Blood vessels surround but have not yet penetrated the epithelial buds. (b) At e12.5, the outer tip cell layer ( green) of the pancreatic epithelium forms recognizable branch protrusions. In the trunk portion of the pancreatic epithelium, microlumens fuse to form a primitive plexus, and groups of newly polarized cells ( purple) organize into rosettes around a lumen. At the same time, blood vessels begin to intercalate into the epithelium and contact trunk cells. (c) At e15.5, the luminal plexus progressively remodels into a single-layered epithelium consisting of highly branched primitive ducts (also known as progenitor cords) and newly differentiated acinar cells. Ngn3-expressing endocrine precursors (orange) delaminate and migrate away from the progenitor cords to form endocrine clusters. Blood vessels are intercalated between nascent branches of the pancreatic ductal tree. (d ) In the mature pancreas, acinar cells cap the endings of small terminal ducts and form functional exocrine secretory units. Endocrine cells are clustered in so-called islets of Langerhans, which are penetrated by a dense network of blood vessels. See insets for enlarged views of depicted areas.
Figure 2
Illustrated overview of pancreatic organogenesis. (a) The dorsal and ventral pancreatic epithelium evaginates into the surrounding mesenchyme between embryonic day (e) 9.5 and e11.5 in mice. At this stage, the pancreatic epithelium is comprised of a multilayered core of unpolarized cells engulfed by a basement membrane. Scattered microlumens (light yellow) arise between epithelial cells. Blood vessels surround but have not yet penetrated the epithelial buds. (b) At e12.5, the outer tip cell layer ( green) of the pancreatic epithelium forms recognizable branch protrusions. In the trunk portion of the pancreatic epithelium, microlumens fuse to form a primitive plexus, and groups of newly polarized cells ( purple) organize into rosettes around a lumen. At the same time, blood vessels begin to intercalate into the epithelium and contact trunk cells. (c) At e15.5, the luminal plexus progressively remodels into a single-layered epithelium consisting of highly branched primitive ducts (also known as progenitor cords) and newly differentiated acinar cells. Ngn3-expressing endocrine precursors (orange) delaminate and migrate away from the progenitor cords to form endocrine clusters. Blood vessels are intercalated between nascent branches of the pancreatic ductal tree. (d ) In the mature pancreas, acinar cells cap the endings of small terminal ducts and form functional exocrine secretory units. Endocrine cells are clustered in so-called islets of Langerhans, which are penetrated by a dense network of blood vessels. See insets for enlarged views of depicted areas.
(Lammert et al. 2001). Эксперименты по рекомбинации тканей и исследования эндотелия мышей, дефицитного по Flk1, показали, что отсутствие эндотелиальных клеток предупреждает индукцию ранних панкреатических генов (Lammert et al. 2001, Yoshitomi &Zaret 2004). Однако в противоположность этим данным на мышах, исследования на рыбках данио продемонстрировали спецификацию поджелудочной железы в отсутствие сосудистого эндотелия (Field et al. 2003), расхождение может отражать видовые различия.
Establishing and Maintaining Pancreatic Identity
Как только вентральный и дорсальный препанкреатические домены специфицируются, то некоторые транскрипционные факторы начинают специфически экспрессироваться в проспективных панкреатических регионах. Среди самых ранних транскрипционных факторов, которые метят этот регион, находятся Pdx1, Ptf1a и Sox9 (Ahlgren et al. 1996, Guz et al. 1995, Kawaguchi et al. 2002, Krapp et al. 1998, Seymour et al. 2007). Gata4/6, Foxa1/2, Tcf2, Onecut1/2, Hes1, Prox1 и Mnx1 также экспрессируются в препанкреатическом домене, но их экспрессия распространяется более широко на всю энтодерму передней кишки (Figure 3a) (rev. Gittes 2009, Pan & Wright 2011, Seymour & Sander 2011).
Мыши, лишенные любого из этих факторов, обнаруживают разные степени гипоплазии или агенеза поджелудочной железы; однако они всё ещё обнаруживают панкреатические зачатки, это указывает на то, что отсутствие одного фактора не предупреждает полностью инициацию панкреатической программы (rev. Gittes 2009, Mastracci & Sussel 2012, Pan & Wright 2011, Seymour & Sander 2011). Хотя закладка зачатков поджелудочной железы всё ещё наблюдается, имеющиеся доказательства строго указывают, что эти транскрипционные факторы важны для детерминации судьбы поджелудочной железы. Напр., делеция Ptf1a ведет к перемещению субнаборов предшественников, принявших судьбу поджелудочной железы, в др. энтодермальные клоны. Это было продемонстрировано in vivo в экспериментах по отслеживанию клонов, которые выявили вклад Ptf1a-дефицитных клеток в соседнюю дуоденальную энтодерму и энтодерму общего желчного протока (Burlison et al. 2008, Kawaguchi et al. 2002). Дальнейшие доказательства, что эти ранние панкреатические транскрипционные факторы обладают активностью по детерминации судьбы поджелудочной железы, получены в экспериментах с избыточностью функции у Xenopus, которые показали, что постоянно активные формы или Pdx1 или Ptf1a могут передетерминировать печеночные предшественники в панкреатический клон (Horb et al. 2003, Jarikji et al. 2007). Также, эктопически экспрессируемые, Pdx1 и Ptf1a в комбинации достаточны для превращения дуоденальных предшественников в клетки с панкреатической судьбой (Afelik et al. 2006). Т.о. в контексте развития, Pdx1 и Ptf1a могут наделять качественными панкреатическими особенностями не панкреатические клетки. Степень, с которой Pdx1 и Ptf1a также способны активировать панкреатические гены в не панкреатических клетках взрослых, ещё предстоит исследовать. Лучшее понимание контекст-зависимых эффектов этих ранних панкреатических транскрипционных факторов на экспрессию генов может привести к новым стратегиям репрограммирования фибробластов непосредственно в панкреатические клетки, как это недавно было продемонстрировано для нейронов и кардиомиоцитов (Qian et al. 2012, Thier et al. 2012).
Помимо их роли в спецификации поджелудочной железы, все ранние панкреатические транскрипционные факторы необходимы для дальнейшего развития зачатков поджелудочной железы (rev. Gittes 2009, Pan & Wright
2011, and Seymour & Sander 2011). Механистически выраженный эффект на развитие органа, вызываемый потерей только одного транскрипционного фактора, может быть результатом того, что эти ранние транскрипционные факторы функционируют в транскрипционной сети с пространной перекрестной регуляцией между индивидуальными факторми. Напр., экспрессия как Tcf2, так и Ptf1a зависит от Onecut-1 (Haumaitre et al. 2005, Maestro et al. 2003); в то же время экспрессия Onecut-1 зависит от Tcf2 и Ptf1a
 Figure 3
Lineage decisions during pancreas development. (a) During the primary transition, the transcription factors Pdx1, Prox1, Onecut-1 (Oc1), Ptf1a, Foxa1/2, Tcf2, Sox9, Gata4/6, and Hes1 mediate expansion of pancreatic progenitor cells and maintain pancreatic identity. (b) At the onset of the secondary transition, pancreatic progenitors adopt either tip or trunk identity. Notch activity promotes the trunk while repressing tip identity. Cross-repression between Ptf1a and Nkx6.1 mediates tip/trunk separation. (c) Tip cells adopt an acinar phenotype, which is maintained by a positive-regulatory loop between PTF1-L and Nr5a2. Trunk cells are bipotential for the ductal and endocrine cell fate. The ductal versus endocrine fate decision is controlled by graded Notch activity. High Notch promotes the ductal fate by activating both Hes1, a repressor of Ngn3, and Sox9, an Ngn3 activator. At low Notch activity, only Sox9 is activated, leading to endocrine differentiation. (d ) Endocrine precursors further differentiate into five different cell types, of which only α-and β-cells are depicted. Cross-repression between the α-cell determinant Arx and β-cell determinants Pax4, Nkx6.1, and Pdx1 separates the two lineages.
Figure 3
Lineage decisions during pancreas development. (a) During the primary transition, the transcription factors Pdx1, Prox1, Onecut-1 (Oc1), Ptf1a, Foxa1/2, Tcf2, Sox9, Gata4/6, and Hes1 mediate expansion of pancreatic progenitor cells and maintain pancreatic identity. (b) At the onset of the secondary transition, pancreatic progenitors adopt either tip or trunk identity. Notch activity promotes the trunk while repressing tip identity. Cross-repression between Ptf1a and Nkx6.1 mediates tip/trunk separation. (c) Tip cells adopt an acinar phenotype, which is maintained by a positive-regulatory loop between PTF1-L and Nr5a2. Trunk cells are bipotential for the ductal and endocrine cell fate. The ductal versus endocrine fate decision is controlled by graded Notch activity. High Notch promotes the ductal fate by activating both Hes1, a repressor of Ngn3, and Sox9, an Ngn3 activator. At low Notch activity, only Sox9 is activated, leading to endocrine differentiation. (d ) Endocrine precursors further differentiate into five different cell types, of which only α-and β-cells are depicted. Cross-repression between the α-cell determinant Arx and β-cell determinants Pax4, Nkx6.1, and Pdx1 separates the two lineages.
(Poll et al. 2006, Thompson et al. 2012). Сходная перекрестная регуляция продемонстрирована между Sox9, Pdx1, Hes1 и Ptf1a (Ahnfelt-Ronne et al. 2012; Hale et al. 2005; Seymour et al. 2007, 2012; Thompson et al. 2012). Т.о., элиминация одиночного фактора является следствием того, что в конечном итоге затрагиваются множественные компоненты панкреатической программы. Появление инструментов геномной шкалы и доступность базирующихся на стволовых клетках моделей in vitro развития поджелудочной железы (D'Amour et al. 2006, Kroon et al. 2008) теперь делают возможной эксперименты по глобальному определению относящихся к делу транскрипционных сетей. Такое знание может помочь созданию стратегий репрограммирования для получения панкреатических клеток из др. соматических клеток.
Signaling During Early Pancreatic Growth
В то время как мы довольно детально понимает транскрипционные факторы, регулирующие раннее развитие поджелудочной железы, меньше известно о сигналах, контролирующих их экспрессию. И Hes1 и Sox9 регулируются с помощью передачи сигналов Notch (Kageyama et al. 2007, Shih et al. 2012), это указывает на то, что передача сигналов Notch важна для раннего роста поджелудочной железы. В качестве подтверждения этому, эмбрионы, дефицитные по Notch эффектору RBP-jκ, как было установлено, обнаруживают ранний арест роста поджелудочной железы, сходный по степени с тем, что наблюдается после делеции Hes1 или Sox9 (Apelqvist et al. 1999, Fujikura et al. 2006, Jensen et al. 2000, Seymour et al. 2007). Делеция Hes1 также ассоциирует с активацией ингибитора клеточного цикла p57 в предшественниках поджелудочной железы (Georgia et al. 2006). Т.о., по-видимому, существует прямая связь между активностью Notch, экспрессией транскрипционного фактора и регуляцией клеточного цикла в ранней поджелудочной железе. Известные и предполагаемые роли Notch в развивающейся поджелудочной железе тщательно рассмотрены (Afelik & Jensen 2012).
Помимо передачи сигналов Notch в эпителии, панкреатический рост также контролируется внешними сигналами из окружающей мезенхимы. Плодотворные исследования в 1960s продемонстрировали важность мезенхимы для раннего роста
поджелудочной железы (Golosow & Grobstein 1962, Rutter et al. 1964, Wessells &Cohen 1966). Однако, только недавно мы начали понимать, как мезенхимные сигналы контролируют рост ранней поджелудочной железы. Наиболее изученный путь, который передает способствующие пролиферации сигналы из мезенхимы в эпителий это передача сигналов FGF пути. Во время первичного перехода, FGF10 экспрессируется на высоком уровне в панкреатической мезенхиме, тогда как его рецептор FGFR2 экспрессируется по всему эпителию (Bhushan et al. 2001, Dichmann et al. 2003, Seymour et al. 2012). Эксперименты с избыточностью и недостаточностью функции у мышей далее продемонстрировали, что FGF10 стимулирует пролиферацию клеток предшественников и необходим для раннего роста панкреатических зачатков (Bhushan et al. 2001). FGF10, как было установлено, регулирует экспрессию Ptf1a и Sox9 в эпителии (Jacquemin et al. 2006, Seymour et al. 2012), это объясняет, почему делеция FGF10 дает фенотип, сходный с тем, что наблюдается в поджелудочной железе, дейицитной или по Ptf1a или по Sox9 (Bhushan et al. 2001, Kawaguchi et al. 2002, Seymour et al. 2007). Во время ранней фазы роста зачатков поджелудочной железы, Sox9, FGFR2 и FGF10 формируют feed-forward loop, при этом мезенхимный FGF10 поддерживает экспрессию Sox9 в эпителии, а Sox9 поддерживает восприимчивость FGF10 за счет клеточно автономного контроля экспрессии FGFR2 (Seymour et al. 2012). Если эта петля нарушена в любой точке, то эпителиальные клетки поджелудочной железы более не поддерживают своих качественных особенностей и вместо этого активируются печеночные гены (Seymour et al. 2012). Это демонстрирует генетическую связь раннего панкреатического роста с поддержкой качественных характеристик органа.
Дополнительные сигнальные пути, критические для эпителиального роста, включают EGF, Wnt и BMP пути (Ahnfelt-Ronne et al. 2010, Miettinen et al. 2000, Murtaugh et al. 2005). Передача сигналов Wnt и BMP, по-видимому, базируется не на эпителии; вместо этого она передается с помощью мезенхимных клеток (Ahnfelt-Ronne et al. 2010, Jonckheere et al. 2008, Landsman et al. 2011). Неизвестно, секретируется ли лиганд эпителием или самой мезенхимой. Т.о., передача сигналов между мезенхимой и эпителием, скорее всего, использует множественные сигнальные петли. Недавнее исследование in vitro Sneddon et al. (2012) на панкреатических промежуточных клонах, происходящих из hPSCs, подкрепило этот спор, продемонстрировав, что совместное культивирование с мезенхимой эффективно увеличивает количество предшественников и что этот эффект специфичен как для мезенхимной клеточной линии, так и для амплифицируемых предшественников. Далее они показали, что не существует единственного фактора роста или комбинации факторов, достаточных для воспроизведения величины эффекта при совместном культивировании с мезенхимой, это подкрепляет мнение, что многие факторы кооперируются, чтобы стимулировать рост эпителия. Идентификация факторов, совместно контролирующих рост, д. обладать высоким приоритетом в смысле разработки масштабируемых протоколов для продукции in vitro панкреатических клеток.
Compartmentalizing the Organ: Patterning of Tips and Trunk
Вскоре после первичного перехода образующиеся панкреатические зачатки ещё не приобрели макроскопической структуры зрелого органа, ни сформировали дифференцированных типов клеток, необходимых для выполнения панкреатических функций. Вместо этого, они почти целиком состоят из multipotent progenitor cells (MPCs ). Переход недетерминированных MPCs в орган с разными компартментами клеток является многоступенчатым процессом, в котором первой ступенью является разделение на кончиковый (верхушечный) и туловищный (главный) домен в начале процесса вторичного перехода (Figure 3b) (Zhou et al. 2007). В это время развивающийся орган продолжает быстро расти. Одновременно панкреатический эпителий подвергается динамическим структурным изменениям, приводящим к множественным выпячиваниям, которые выпускает зачаток по своим краям. Эти структуры характеризуются экспрессией Ptf1a, c-Myc и Cpa, представляющих концевой домен; напротив, внутренние клетки, представляющие туловищный (основной) домен, характеризуются Nkx6.1/6.2, Sox9, Tcf2, Onecut-1, Prox1 и Hes1 (Figure 3b) ( Jacquemin et al. 2003, Klinck et al. 2011, Kopinke et al. 2011, Kopp et al. 2011, Schaffer et al. 2010, Solar et al. 2009, Vanhorenbeeck et al. 2007, Wang et al. 2005, Zhou et al. 2007). Эти морфологические изменения характеризуют начало сложной последовательности перестроек (Villasenor et al. 2010), приводящих к структуре зрелого органа. Помимо изменений в форме органа, первоначально мультипотентные MPCs проходят первую ступень в направлении детерминации клонов. Эксперименты по отслеживанию клонов показали, что туловищная часть преимущественно дает эндокринные и протоков клеточные клоны, тогда как верхушечная часть быстро ограничивается судьбой ацинарных клеток (Figure 3b) (Kopinke et al. 2011, Kopp et al. 2011, Pan et al. 2013, Solar et al. 2009, Zhou et al. 2007).
Транскрипционные факторы Nkx6.1/6.2 и Ptf1a действуют как ведущие регуляторы во время этого процесса. Эти факторы первоначально экспрессируются в MPCs, но домены их экспрессии полностью разделяются во время компартментализации на туловищную и конечную части: Nkx6.1/6.2 способствует проявлению туловищных характеристик и ограничивается туловищными клетками, а Ptf1a выполняет эквивалентную роль в верхушечном компартменте (Schaffer et al. 2010). В соответствии с правилами механики, этот процесс инициируется с помощью перекрестной репрессии транскрипции между Nkx6.1/6.2 и Ptf1a (Schaffer et al. 2010). Так, Ptf1a, который сначала специфицирует панкреатическую судьбу, а позднее управляет развитием ацинарных клеток (Kawaguchi et al. 2002, Krapp et al. 1998, Masui et al. 2010), иллюстрирует, что онтогенетические транскрипционные факторы могут регулировать разные процессы в зависимости от клеточного контекста.
Генетические исследования предоставили информацию о сигнальных путях, регулирующих разделение на туловищную и верхушечную части, установив, что передача сигналов Notch играет существенную роль в обеспечении качественных особенностей туловищной части. Репрессия передачи сигналов Notch вызывает избыточное образование верхушечной части за счет туловищной популяции (Afelik et al. 2012, Horn et al. 2012, Magenheim et al. 2011b). Напротив, постоянно активный Notch предупреждает образование верхушечной части и способствует расширению туловищного домена частично за счет активации туловищного маркера Nkx6.1 (Afelik et al. 2012, Esni et al. 2004, Murtaugh et al. 2003, Schaffer et al. 2010). Хотя передача сигналов Notch . Безусловно играет жизненно важную роль в координации разделения на туловищную и верхушечную части, остается неизвестным, как Notch регулируется во время этого процесса.
Development of the Acinar Lineage
Помимо своей роли в переваривании, панкреатические ацинарные клетки являются привлекательными мишенями для заместительной терапии β-клетками, поскольку они многочисленны и сохраняют клеточную пластичность, т.е. способны репрограммироваться в β-клетки (Zhou et al. 2008). Более того, поскольку они являются инициирующим типом клеток, предвестником повреждений рака поджелудочной железы (Kopp et al. 2012), ацинарные клетки являются также предметом исследований онкологов. Как указывалось, ацинарные клетки преимущественно возникают из клеток предшественников в верхушечном домене (Pan et al. 2013, Zhou et al. 2007). На ст. e15.5, большинство верхушечных клеток подвергается дифференцировке в ацинарные клетки и затем участвует в расширении ацинарного домена в основном за счет клеточной пролиферации (Pan et al. 2013, Zhou et al. 2007). Дифференцировка ацинарных клеток синергично контролируется транскрипционными факторами Ptf1a, Rbp-jl и Nr5a2/LRH-1, которые первоначально специфичны для верхушечных клеток, а позднее специфически экспрессируются в ацинарных клетках (Holmstrom et al. 2011; Krapp et al. 1996, 1998; Masui et al. 2007, 2010; Rose et al. 2001; Zhou et al. 2007). Перед дифференцировкой в ацинарные клетки, Ptf1a взаимодействует с b-HLH транскрипционным фактором Rbp-jκ (Beres et al. 2006, Masui et al. 2007, Miyatsuka et al. 2007). Итак, эти факторы ответственны за активацию Rbp-jl, постоянно активного, ограниченного ацинарными клетками паралога Rbp-jkappa; (Masui et al. 2007). Во время вторичного перехода, Rbp-jl затем замещает Rbpjkappa; в комплексе с Ptf1a. Этот комплекс. обозначаемый PTF1-L, устанавливает ацинарный фенотип за счет непосредственно активации важных ацинарных генов (т.e., генов. кодирующих переваривающие ферменты и белки для экзоцитоза гранул проэнзимов), также как самих Ptf1a и Rbp-jl (Masui et al. 2007, 2008, 2010; Rose et al. 2001). Т.о., PTF1-L индуцирует и поддерживает ацинарный фенотип посредством петли собственно активации, которая поддерживает высокий уровень экспрессии ацинарных генов (Figure 3c).
Сходным образом, Nr5a2, непосредственный ген мишень для Ptf1a, необходим для дифференцировки ацинарных клеток (Holmstrom et al. 2011, Thompson et al. 2012). Nr5a2 соединяется с и регулирует ряд генов, сходных с теми, что регулируются комплексом PTF1-L, и Nr5a2 и PTF1-L кооперируются для регуляции генов, специфичных для ацинарных клеток (Holmstrom et al. 2011). Итак, эти исследования демонстрируют, что Ptf1a обеспечивает дифференцировку ацинарных клеток путем инициации и стабилизации сети регуляторных генов, которая управляет экспрессией ацинарных генов. Хотя Ptf1a является обязательным координатором развития ацинарных клеток, принудительная экспрессия только Ptf1a недостаточна для эффективной индукции дифференцировки ацинарных клеток (Schaffer et al. 2010). Инициация ацинарной дифференцировки может нуждаться в др. транскрипционных факторах, действующих параллельно с Ptf1a. Одним из кандидатов является Mist1, который строго экспрессируется в ацинарных клетках, но не зависит от PTF1-L комплекса в своей экспрессии (Masui et al. 2010, Yoshida et al. 2001). Mist1-дефицитные мыши обнаруживают потерю характеристик дифференцировки ацинарных клеток, включая потерю клеточной полярности и дефектный экзоцитоз (Pin et al. 2001). Т.о., комплекс PTF1-L, Nr5a2 и Mist1 необходимы для поддержания ацинарного фенотипа. Геномный анализ генов мишеней для Mist позволит определить, занимает ли Mist1 геномные регионы, сходные с таковыми для PTF1-L и Nr5a2 и может ли он регулировать развитие ацинарных клеток вместе с этими факторами.
Менее ясно, почему механизмы спецификации и дифференцировки ацинарных клеток лежат в основе быстрой пролиферативной экспансии ацинарных клеток вплоть до рождения. В отличие от Mist1 и Ptf1a, которые негативно регулируют экспансию ацинарных клеток ( Jia et al. 2008, Rodolosse et al. 2004), Nr5a2 способствует пролиферации экзокринных линий клеток (Benod et al. 2011, Botrugno et al. 2004), указывая на Nr5a2 как потенциального кандидата для управления экспансией ацинарных клеток. Дополнительными кандидатами могут быть c-Myc и β-catenin, чья инактивация в ранних панкреатических предшественниках вызывает гипоплазию ацинарных клеток (Bonal et al. 2009, Murtaugh et al. 2005, Nakhai et al. 2008, Wells et al. 2007). Контролируемая во времени и пространстве инактивация др. ацинарных факторов у мышей может предоставить дополнительную информацию о молекулярном контроле дифференцировки, экспансии и поддержания ацинарных клеток.
The Endocrine Versus Ductal Cell-Fate Choice
В то время как верхушечные клетки детерминируются, чтобы стать ацинарными клетками, основной домен является бипотенциальным и продуцирует клетки протоков и эндокринные клетки (Figure 3c) (Kopinke et al. 2011, Kopp et al. 2011, Solar et al. 2009). После того как верхушечный и основной домены разделены на ст. примерно e12.5, клетки основного домена подвергаются обширным морфогенетическим изменениям, чтобы сформировать 3-D сеть из трубочек, выстланных однослойными эпителиальными клетками (Hick et al. 2009, Kesavan et al. 2009, Villasenor et al. 2010). Эта сеть из канальцев обозначается как примитивные протоки или тяжи предшественников и состоит из эпителия, который дает все эндокринные клетки (Hick et al. 2009, Kopp et al. 2011). Во время вторичного перехода субнабор клеток в тяжах предшественников инициирует экспрессию транскрипционного фактора Neurogenin3 (Ngn3), который маркирует начало дифференцировки эндокринных клеток (Gradwohl et al. 2000, Gu et al. 2002, Johansson et al. 2007, Schwitzgebel et al. 2000). Эпителиальные клетки основной части, которые не активируют Ngn3 в конечном итоге вносят вклад в древо протоков (Beucher et al. 2012, Magenheim et al. 2011b, Wang et al. 2010). Т.о., точный контроль индукции Ngn3 является ключевым фактором, обеспечивающим баланс между выборами судеб между эндокринными клетками и клетками протоков.
Многие из одних и тех же транскрипционных факторов (напр., Sox9, Tcf2, Onecut-1, Hes1, Prox1 и Glis3), которые сегрегируют в главный домен во время разделения на верхушечный и основной домен, позднее оказываются ограниченными протоками и исключаются из эндокринного компартмента (Figure 3c) (Delous et al. 2012, Kang et al. 2009, Maestro et al. 2003, Pierreux et al. 2006, Shih et al. 2012, Wang et al. 2005, Westmoreland et al. 2012, Zhang et al. 2009). В соответствии с их специфичной для протоков экспрессией, их инактивация у мышей вызывает дефекты морфологии клеток протоков и аномальную архитектуру древа протоков. Напр., поджелудочные железы, дефицитные по Sox9, Glis3 или Onecut-1 образуют кисты протоков и лишены первичных ресничек в клетках протоков, функционально важных органелл эпителиальных клеток протоков (Kang et al. 2009, Pierreux et al. 2006, Shih et al. 2012). Отражают ли эти аномалии протоков функциональную потребность в этих факторах для поддержания свойств эпителия протоков или роль в дифференцировке клеток протоков, неизвестно. Кондиционная инактивация генов, кодирующих факоры протоков, в развивающихся или у зрелых мышей д. в дальнейшем определить их роль в развитии и функции протоков. Это знание поможет понять патогенез связанных с протоками болезней, включая панкреатиты и панкреатические аденомные карциномы протоков.
В отличие от развития клеток протоков, эндокринная дифференцировка исследовалась более активно, движимая надеждой, что такие знания смогут помочь осуществить замещение β-клеток в качестве терапии при диабете. Поскольку активация экспрессии Ngn3 существенна для инициации дифференцировки эндокринных клеток, то достигнуты существенные успехи в понимании регуляции Ngn3. Интересно, что многие транскрипционные факторы, контролирующие развитие протоков, такие как Sox9, Tcf2, Glis3 и Onecut-1, также необходимы для индукции Ngn3 ( Jacquemin et al. 2000, Kang et al. 2009, Kim et al. 2012, Lynn
et al. 2007, Maestro et al. 2003, Seymour et al. 2008, Zhang et al. 2009), это указывает на двойную роль этих факторов в развитии обоих клонов. Однако, Ngn3 экспрессируется только в субнаборе клеток внутри примитивных протоков, которые ставят вопрос, как их экспрессия репрессируется в большинстве клеток эмбриональных протоков. Биохимические и генетические доказательства подтверждают, что транскрипционный фактор Hes1 играет важную роль в репрессии транскрипции Ngn3 и в предупреждении широко распространенной активации Ngn3 (Ahnfelt-Ronne et al. 2012, Apelqvist et al. 1999, Jensen et al. 2000, Lee et al. 2001). Недавно было установлено, что Hes1 ускоряет деградацию белка Ngn3 (Qu et al. 2013), это указывает на то, что дополнительные посттранскрипционные механизмы вносят вклад в регуляцию Ngn3. В подтверждение этой идеи, Villasenor et al. (2008) сообщили, что мРНК Ngn3 обнаруживается в значительно более широком домене, чем белок. В целом, детальные механизмы, контролирующие экспрессию Ngn3 всё ещё недостаточно понятны. Прогресс замедлен из-за отсутствия клеточной системы, в которой регуляцию Ngn3 можно было бы изучать ex vivo. Поскольку активация Ngn3 следует во время панкреатической дифференцировки паттерну hPSCs, сходному с тем, что наблюдается in vivo (D'Amour et al. 2006, Xie et al. 2013), hPSCs могут оказаться информативной моделью для дальнейших исследований.
Поскольку протоки одновременно экспрессируют позитивные и негативные регуляторы Ngn3, их относительные уровни и будут предопределять будет ли в предшественнике активирован Ngn3 и приобретет ли он эндокринные характеристики. Доказательства указывают на то, что путь Notch играет важную роль в принятии такого решения. Постоянно активная передача сигналов Notch предупреждает активацию Ngn3 и способствует дифференцировке клеток в протоки (Greenwood et al. 2007, Murtaugh et al. 2003). Это указывает на то, что бипотенциальные ductal/endocrine
предшественники должны избегать передачи сигналов Notch, чтобы инициировать эндокринную дифференцировку. Неожиданно было установлено, что Notch индуцирует как негативные, так и позитивные регуляторы Ngn3. Высокий уровень передачи сигналов Notch способствует экспрессии как Hes1, так и Sox9, приводя в результате к репрессии Ngn3; напротив, низкий уровень активности Notch способствует экспрессии только Sox9, делая возможной активацию Ngn3 (Figure 3c) (Shih et al. 2012). Т.о., избирательная активация Ngn3 в небольших субнаборах предшественников, по-видимому, контролируется градированной активностью Notch в эпителии предшественников. Как индивидуальные клетки в тяжах предшественников приобретают разные уровни активности Notch остается неизвестным.
После вторичного перехода эндокринные предшественники постепенно прекращают возникать из эпителия протоков, это указывает на то, что любой из постнатальных протоков или теряет компетентность к образованию эндокринных предшественников или что отсутствуют проэндокринные сигналы (Kopinke et al. 2011, Kopp et al. 2011, Solar et al. 2009). Исследования моделей с повреждениями поджелудочной железы и клональный анализ клеток протоков in vitro показывают, что взрослые протоки сохраняют способность активировать Ngn3 и, следовательно, компетентны инициировать, по крайней мере, частично эндокринные программы ( Jin et al. 2013, Kopp et al. 2011). Пластичность клеток протоков у взрослых является областью интенсивных исследований (Desgraz et al. 2011, Reichert & Rustgi 2011).
Differentiation of the Islet Cell Types
Начав экспрессировать Ngn3, предшественники выходят из клеточного цикла и отсоединяются от тяжей предшественников в окружающую стромальную ткань (Gouzi et al. 2011, Miyatsuka et al. 2011). Хотя индивидуальные эндокринные предшественники являются унипотентными (Desgraz & Herrera 2009), Ngn3 в целом генерируют пять разных эндокринных типов клеток: glucagon-продуцирующие α-cells, insulin-producingβ клетки, somatostatin-продуцирующие δ-клетки, pancreatic polypeptide-продуцирующие PP-cells, и ghrelin продуцирующие ε-клетки .
Johansson et al. (2007) показали, что компетентность эндокринных предшественников продуцировать разные типы эндокринных клеток контролируется по времени. Когда экспрессия Ngn3 индуцируется в разные моменты времени онтогенеза из кондиционного трансгена Ngn3, то предшественники сначала дифференцируются в α-клетки, затем в β- и d δ-клетки и, наконец, в PP-клетки. Механизмы, контролирующие эти изменения в онтогенетическом потенциале, неизвестны. Исследования развивающихся нейронов, мышц и гипофиза подтверждают, что передача сигналов Notch может быть использована (Mizutani & Saito 2005, Mourikis et al. 2012, Zhu et al. 2006). При этом продолжительность экспозиции Notch является критической для наделения клеток предшественников компетентностью. Если поджелудочная железа использует подобный механизм, то оптимизация экспозиции Notch может быть ключом для максимализации урожая β-клеток для протоколов направленной дифференцировки из hPSCs.
Если дифференцирующиеся в гормон-продуцирующие клетки Ngn3+ эндокринные предшественники подвергаются динамическим изменениям генной экспрессии, приводя к активации как Ngn3-зависимых транскрипционных факторов (Pax4, Arx, Rfx6, NeuroD1, Pax6, Isl1, и IA2), так и гормонов. Анализ мутантов мыши показал, что эти факторы контролируют многие аспекты эндокринного развития, включая дифференцировку клеток, поддержание клеток, и приобретение качественных характеристик клеток островков (rev. Mastracci & Sussel 2012, Pan & Wright 2011). Остановимся на том, как осуществляется выбор между β- и α-клеточными клонами.
Как и в случае механизмов, управляющих расхождением на верхушечную и основную части, выбор судьбы между β- и α клетками предшественниками, как полагают, базируется на взаимной репрессии между противоположными клональными детерминантами. Транскрипционные факторы Pax4, Pdx1 и Nkx6.1 действуют как критические детерминанты β-клеток (Collombat et al. 2003, Gannon et al. 2008, Henseleit et al. 2005, Holland et al. 2002, Sosa-Pineda et al. 1997), тогда как Arx детерминирует характеристики α-клеток (Collombat et al. 2003, 2005). Принудительная экспрессия Pax4, Pdx1 или Nkx6.1 в эндокринных предшественниках благоприятствует выбору судьбы β-клеток за счет α-клеток (Collombat et al. 2009, Schaffer et al. 2013, Yang et al. 2011). Напротив, избыток функции Arx приводит к избытку α-клеток и снижению β-клеток (Collombat et al. 2007). Эксперименты по потере функции выявили реципрокные фенотипы, хотя последствия делеции Pdx1в эндокринных предшественниках ещё исследуются. И Pax4 и Nkx6.1 являются непосредственными транскрипционными репрессорами Arx; напротив, Arx репрессирует Pax4, Nkx6.1 и Pdx1 за сёт прямых и косвенных механизмов (Figure 3d ) (Collombat et al. 2005, 2007; Schaffer et al. 2013; Yang et al. 2011).
Одним из интересных, но механистически плохо понятным наблюдением является то, что некоторые транскрипционные факторы, которые могут менять клональные характеристики эндокринных предшественников, теряют эту способность, если эктопически экспрессируются в дифференцированных эндокринных клетках. Напр., Pdx1 или Nkx6.1 недостаточны, чтобы превратить дифференцированные α-клетки в β-клетки (Schaffer et al. 2013, Yang et al. 2011). Это указывает на то, что эндокринная дифференцировка ограничивает онтогенетическую пластичность. Молекулярные механизмы, ограничивающие клеточную пластичность во время дифференцировки изучены плохо. Недавние исследования показали роль метилирования ДНК (Dhawan et al. 2011, Papizan et al. 2011), но необходимы дополнительные исследования, чтобы понять как такие эпигенетические механизмы ограничивают пластичность клеток. Лучшее понимание этих механизмов позволит разработать стратегии для устранения эпигенетических ограничений в надежде репрограммировать non-β эндокринные клетки в β-клетки .
PANCREAS MORPHOGENESIS
В соответствии с дифференцировкой эндокринных и экзокринных клеток, поджелудочная железа развивается в сильно разветвленный орган, при этом группы ацинарных клеток соединяются вокруг просветов небольших протоков, чтобы сформировать функциональные экзокринные секреторные единицы и клетки протоков организуются в сеть трубочек системы протоков поджелудочной железы (Pictet et al. 1972). Этот процесс наз. морфогенез ветвления (Figure 2), он управляется с помощью динамических перестроек клеток и контролирует пространственно-временную пролиферацию клеток.
Хотя дифференцировка панкреатических клеток и её молекулярный контроль исследуются с 1990s, знания о том, как поджелудочная железа приобретает свою финальную форму и становится функциональным органом, всё ещё рудиментарны. Два важных исследования описали клеточные изменения, ассоциированные с генезом трубочек поджелудочной железы (Kesavan et al. 2009, Villasenor et al. 2010) теперь составляют основу для изучения механизмов, управляющих морфогенезом ветвления в поджелудочной железе. До инициации ветвления эпителия примерно на ст. e12, панкреатические зачатки формируют многослойную сердцевину из неполяризованных клеток, заключенных в одиночную базальную мембрану, примыкающую к мезенхиме (Figure 2a) (Hick et al. 2009, Kesavan et al. 2009, Villasenor et al. 2010). Образование трубочек в поджелудочной железе начинается, когда индивидуальные клетки приобретают апико-базальную полярность: клетки формируют определенную апикальную мембрану, которая обращена лицом в центральный просвет, а базальна поверхность прикреплена к слою внеклеточного матрикса (ECM) (Kesavan et al. 2009, Villasenor et al. 2010). Группы только что поляризованных клеток затем образуют розетки, при этом соседние клетки соединяются с помощью межклеточных соединительных комплексов вокруг возникающего центрального просвета (Figure 2b, inset) (Villasenor et al. 2010). Вновь сформированные микропросветы первоначально не соединены др. с др., но в конечном итоге они сливаются в сплетение просветов (Figure 2c). Ремоделирование сплетения просветов дает сеть трубочек, выстланных поляризованным монослойным эпителием, прикрепленным к базальной мембране (Figure 2c, inset) (Kesavan et al. 2009, Villasenor et al. 2010). При рождении трубочки преобразуются в сильно разветвленное древо протоков, соединяющее экзокринные секреторные единицы с системой протоков (Figure 2d, inset). Одновременно с ветвлением эпителия кровеносные сосуды и нервы начинают проникать в эпителий, внедряясь между формирующимися веточками панкреатического древа протоков (Figure 2b-d ) (Lindsay et al. 2006, Magenheim et al. 2011a, Pierreux et al. 2010). Стереотипическая организация клеток в зрелой поджелудочной железе иллюстрирует, что собственно морфогенез поджелудочной железы нуждается в высоко скоординированной перестройке, с вовлечением ацинарных, протоковых, эндотелиальных, нервных и мезенхимных клеток. Сегодня мало известно о молекулярных сигналах, управляющих перестройкой этих клеток; о том, как морфогенез поджелудочной железы скоординирован с дифференцировкой клеток; или о том, как дифференцировка эндокринных и экзокринных клеток зависит от окружающих не эпителиальных клеток и vice versa.
Intracellular Signals Governing Pancreas Morphogenesis
Во многих органах, включая морфогенез поджелудочной железы, морфогенез эпителия контролируется с помощью семейства Rho GTPases, которые регулируют клеточную полярность, адгезию и миграцию за счет организации актинового цитоскелета (Heasman &Ridley 2008). Kesavan et al. (2009), демонстрируя, что делеция Rho GTPase Cdc42 нарушает поляризацию клеток во время раннего морфогенеза, нарушая эпителиальную морфологию, и абортирует образование канальцев. Преждевременный арест тубулогенеза наблюдается также у мышей, дефицитных по RhoA GTPase ингибитору Strad13 (Petzold et al. 2013), тогда как специфичная для поджелудочной железы делеция Rho GTPase Rac1 не оказывает заметного эффекта на морфогенез поджелудочной железы (Heid et al. 2011). Это указывает на то, что разные Rho GTPases выполняют разные роли в формообразовании органа.
Исследования др. органов показали, что Rho GTPases регулируются с помощью передачи сигналов Ephrin, EGF и ECM-integrin (Heasman & Ridley 2008, Huveneers & Danen 2009, Poliakov et al. 2004). Поджелудочные железы с нарушенным морфогенезом ветвления наблюдаются у мышей, мутантных по Ephrin и EGF рецептору, демонстрируя, что эти сигнальные пути также влияют на активность Rho GTPase в поджелудочной железе (Miettinen et al. 2000, Villasenor et al. 2010). Как внешние сигналы координируют эпителиальный морфогенез и дифференцировку контролируемым в пространстве и во времени способом, это область активных исследований.
Coordinating Morphogenesis and Cell Differentiation
Появляются доказательства, что мезенхимные клетки, кровеносные сосуды и ECM обеспечивают локально ограниченными сигналами, которые влияют на морфогенез и выбор клеточных судеб в ходе развития поджелудочной железы. Разделение на верхушечную и основную части не только маркирует первый выбор клеточных судеб панкреатических предшественников, но и также совпадает с образованием веточек в верхушечном регионе (Figure 2b, inset) (Zhou et al. 2007). Ремоделирование ткани, ассоциированное с образованием веточек приводит к изменению позиций мезенхимных и эпителиальных клеток и компонентов базальной мембраны (Kesavan et al. 2009, Landsman et al. 2011). Получение изображений в реальном времени и статический анализ морфогенеза поджелудочной железы подтвердило, что новые веточки образуются за счет расщепления кончиков (i.e., индивидуальные кончики повторно расщепляются на новые кончики) (Puri &Hebrok 2007, Villasenor et al. 2010). Управляется ли это непосредственно за счет дифференциальной пролиферации верхушечнвх клеток или косвенно за счет ремоделирования клеток основной части, неизвестно. Однако клетки кончиков, как было установлено, пролиферируют более быстро, чем клетки основной части (Petzold et al. 2013, Zhou et al. 2007), это указывает на то, что пролиферация кончиков д. управлять образованием веточек. Одним из сигналов кандидатов регуляции пролиферации верзушечных клеток (tip-cell) является FGF, который секретируется мезенхимными клетками, которые окружают кончики, когда инициируется ветвление (Bhushan et al. 2001). Удаление мезенхимы, как источника FGF останавливает морфогенез панкреатических эксплантов, тогда как добавление FGF к культуре восстанавливает ветвление и пролиферацию клеток (Miralles et al. 1999).
Подобно их ассоциации с мезенхимными клетками, возникающие кончиковые клетки также непосредственно примыкают к базальной мембране в начале эпителиального ветвления (Kesavan et al. 2009, Villasenor et al. 2010). Исследование культур экспланта показали, что нокдаун или блокирование антителами против компонента ECM laminin-1 снижает экспрессию ранних маркеров ацинарных клеток и нарушает ветвление (Kesavan et al. 2009, Li et al. 2004). Поскольку процесс ветвления ведет к повышению экспозиции клеток с ECM, то процесс морфогенеза, как таковой, д. заставлять клетки адоптировать ацинарные качественные особенности.
Способствуют мезенхимные клетки и компоненты ECM приобретению качественных отличий ацинарных клеток и способствуют ветвлению, кровеносные сосуды имеют противоположный эффект. Вынужденная экспрессия VEGFA в панкреатических предшественниках вызывает повышенную экспрессию маркера основной части Hes1 и сопутствующую потерю tip/acinar маркеров Cpa и amylase, тогда как устранение VEGF способствует образованию ацинусов и вызывает избыточное ветвление (Magenheim et al. 2011a, Pierreux et al. 2010). В соответствии с их эффектом, способствующему образованию основной части, кровеносные сосуды остаются физически ассоциированными с основной частью и оказываются отделенными от верхушек (Magenheim et al. 2011a, Pierreux et al. 2010) (Figure 2b-c, inset). Эти примеры иллюстрируют, что морфогенез органа и клеточная дифференцировка интимно связаны. Дальнейшие исследования д. быть сфокусированы на идентификации внешних и внутренних сигналов, обеспечивающих взаимодействия между эндотелиальными, мезенхимными и эпителиальными клетками, и на расшифровке, как эти сигналы управляют морфогенезом и дифференцировкой клеток. Чтобы проанализировать пространственно-временную динамику межклеточных взаимодействий с большей точностью, необходимо разработать систему для изучения органогенеза поджелудочной железы in vitro при определенных условиях. Базирующиеся на стволовых клетках системы 3-D дифференцировки д. обеспечить существенный прогресс.
Morphogenetic Changes and Endocrine Cell Differentiation
Морфогенетические изменения также ассоциированы с инициацией эндокринной дифференцировки в тяжах предшественников. Как только клетки инициируют экспрессию Ngn3, они приобретают форму капелек и отсоединяются от эпителия предшественников (Figure 2c, inset) (Gouzi et al. 2011, Rukstalis & Habener 2007). Gouzi et al. (2011) показали, что экспрессия Snail2, белка, который индуцирует подвижность клеток, благодаря запуску эпителиально-мезенхимного перехода (EMT) (Barrallo-Gimeno & Nieto 2005), зависит от Ngn3. Эктопическая экспрессия Ngn3 также запускает EMT, это указывает на двойную роль Ngn3 в индукции как клеточной дифференцировки, так и деламинации (Gouzi et al. 2011). Степень, с которой эти процессы зависят др от др., неизвестна. Кондиционное инактивирование Snail2, или др. эффекторы EMT, могут объяснить связь между дифференцировкой эндокринных клеток и отделением. Др. механизм, который может обеспечить деламинацию, это асимметричные клеточные деления, при которых клетки делятся так, что только одна дочерняя клетка наследует апикальную мембрану и остается с эпителии предшественников, тогда как дочерняя клетка, унаследовавшая базальную мембрану, выходит из эпителиального слоя и дифференцируется. Этот механизм связан с асимметричным распределением детерминант клеточных судеб между дочерними клетками и применим к дифференцировке нейронов и эпидермальных клеток (rev. Knoblich 2008). Неизвестно, создаются ли эндокринные предшественники за счет асимметричных клеточных делений в тяжах предшественников. Знание может быть важным для подбора соотв. условий культивирования in vitro для продукции функциональных эндокринных клеток из hPSCs. Быстро улучшающиеся технологии получения изображений в реальном времени, которые теперь делают возможной визуализацию флюоресцентно меченных клеток в эксплантах целых органов с разрешением в одну клетку, позволят, скорее всего, определять клеточные события, связанные с появлением эндокринных предшественников из тяжей родоначальников.
APPLICATION OF DEVELOPMENTAL PRINCIPLES TOWARD STEM
CELL DIFFERENTIATION
Конечная цель понимания развития поджелудочной железы это получение информации о болезнях, связанных с поджелудочной железой, и о разработке новой терапии для лечения таких болезней, напр., для лечения диабета за счет замещения или регенерации массы β-клеток. Такие инновационные стратегии для лечения диабета включают увеличение количества β-клеток за счет усиления их врожденной способности реплицироваться; за счет изменения судьбы др. панкреатических клеток в β-клетки (rev. Desgraz et al. 2011);
и более обещающей, как терапии, так и инструмента для изучения генерации β-клеток in vitro за счет дифференцировки hPSCs.
Generating Pancreatic Progenitors from Human Pluripotent Stem Cells
Энтузиазм по поводу получения пригодных для трансплантации β-клеток из hPSCs является прямым результатом бросающихся в глаза достижений в трансплантации клеток, в частности, пригодности аллогенной трансплантации островков, это позволяет пациентам с диабетом отказываться от инъекций инсулина годами (Shapiro et al. 2006). К сожалению, количество донорских островков, необходимых для широкого распространения лечения существенно превосходит возможности и даже, если донорские островки доступны, то реципиенты д. подвергаться в течение все жизни иммуносупрессии для предупреждения отторжения. Хотя эти ограничения предупреждают их широкое использование у пациентов с диабетом, инсулиновая независимость, вызываемая трансплантацией островков, позволяет проверить принцип, что клеточные трансплантации могут быть жизнеспособной терапией диабета. В отличие от аллогенных трансплантатов, которые чувствительны к донорскому дефициту, hPSCs д. представлять неограниченный источник способных к трансплантациям β-клеток. Кроме того, получаемые от пациента индуцированные плюрипотентные стволовые клетки д. избегать иммуносупрессии. По этим причинам сегодня существует большое стремление генерировать панкреатические β-клетки in vitro.
Разработаны протоколы для получения панкреатических предшественников из hPSCs. hPSCs могут быть дифференцированы с высокой эффективностью в дефинитивную энтодерму путем добавления высоких уровней Activin A, воспроизводящего проэнтодермальную роль Nodal во время гаструляции in vivo (rev. Zorn &Wells 2009). Важное исследование D'Amour et al. (2006) предложило протокол по ведению происходящих из hPSC энтодермы в панкреатический клон. Сходные протоколы с тех пор были опубликованы (Kroon et al. 2008, Mfopou et al. 2010, Nostro et al. 2011, Rezania et al. 2012, Xu et al. 2011). Большинство протоколов панкреатической дифференцировки вызывают панкреатическую судьбу путем одновременной обработки клеток с помощью RA и ингибиторов Shh и BMP, воспроизводящих сигнальные условия, которые специфицируют поджелудочную железу in vivo. Такое воздействие генерирует in vitro эквивалентные ранние мультипотентные панкреатические родоначальники, экспрессирующие PDX1, SOX9, PTF1a и NKX6.1. Эти сгенерированные in vitro родоначальники проходят также функциональный тест по определению потенциала формировать зрелые эндокринные, протоковые и ацинарные клетки после трансплантации мышам (Kelly et al. 2011, Kroon et al. 2008, Rezania et al. 2012, Schulz et al. 2012, Xie et al. 2013). Возникающие эндокринные клетки являются функциональными, реагирующие соотв. образом на глюкозу и регулирующие собственно гомеостаз глюкозы у модельных диабетических животных (Kroon et al. 2008, Rezania et al. 2012, Xie et al. 2013). Дальнейшие доказательства их островкового фенотипа это то, что транскрипционная сигнатура и клеточный состав эндокринных кластеров, происходящих из hPSC, очень сходен с таковыми островков человека (Xie et al. 2013).
Обладая дифференцировкой in vitro функциональных панкреатических предшественников, были предприняты попытки оптимизировать эффективность дифференцировки в разных линиях клеток. Кроме того, чтобы сделать возможной крупномасштабной продукцию клеток, были разработаны стратегии для расширения онтогенетических промежуточных клонов in vitro (Cheng et al. 2012, Schulz et al. 2012, Sneddon et al. 2012). Однако поскольку неизвестно, могут ли трансплантаты панкреатических предшественников лечить диабет у человека, это конечная цель генерации функциональных β-клеток in vitro.
Beyond Progenitors: How to Generate Functional Endocrine Cells In Vitro
Сегодня эндокринные клетки, которые возникают in vitro не являются чувствительными к глюкозе и часто одновременно экспрессируют множественные гормоны. Для панкреатической дифференцировки из hPSCs д. быть разработаны надежные методы генерации функциональных панкреатических клеток in vitro. Как обсуждалось выше, развивающаяся поджелудочная железа воспринимает внешние сигналы из мезенхимы, ECM и эндотелия. Однако эти компоненты не добавляются в большинстве протоколов дифференцировки из hPSC. Совместное культивирование с мезенхимными линиями клеток исследуется как стратегия расширения популяций промежуточных предшественников, это согласуется с ролью мезенхимы в расширении ранних панкреатических родоначальников (Sneddon et al. 2012). Возможные инструктивные сигналыот мезенхимы добавляются в современные протоколы дифференцировки поджелудочной железы и в результате отмечается увеличение эффективности индукции PDX1 (Guo et al. 2013). Роль мезенхимы и ECM на более поздних ступенях панкреатического развития in vivo, особенно во время дифференцировки эндокринных клеток, всё ещё плохо изучена. Оба должны учитываться как возможные источники сигналов при разработке стратегии генерации функциональных β-клеток in vitro.
Кровеносные сосуды также могут участвовать в развитии островков, поскольку как нативные островки, так и in vivo-созревающие, трансплантированные, происходящие из hPSC эндокринные клетки снабжены большим количеством сосудов и эндокринные клетки находятся в непосредственном контакте с кровеносными сосудами. Хотя эндотелиальные клетки безусловно важны для собственно ощущения уровней глюкозы в крови и высвобожденных гормонов, их роль в детерминации панкреатических клонов только в начале выяснения. Поскольку кровеносные сосуды способствуют формированию клеток основной части железы за счет формирования верхушечных клеток (see section on Coordinating Morphogenesis and Cell Differentiation) (Magenheim et al. 2011a, Pierreux et al. 2010), то эндотелиальные клетки д. предоставлять критические недостающие сигналы для обеспечения выбора судьбы эндокринных клеток во время дифференцировки in vitro. Как уже обсуждалось эмбриональные поджелудочные железы подвергаются обширным морфогенетическим изменениям в 3-D эпителии, которые могут быть связаны с выбором клеточных клонов. В отличие от развития in vivo дифференцировка поджелудочной железы in vitro из hPSCs преимущественно осуществляется в системах 2-D культуры. Эти различия между условиями дифференцировки in vitro и in vivo, по крайней мере, частично объясняют нашу неспособность генерировать функциональные β-клетки in vitro. Протоколы получения функциональных клеток из др. энтодермальных клонов (напр., кишечника) были использованы в системах 3-D культивирования. Такие 3-D системы поддерживают собственно морфогенез и, как было установлено, продуцируют мини органы, напоминающие свои аналоги in vivo (Sato et al. 2009, Spence et al. 2011). Системы органотипических культур также могут облегчить продукцию функциональных β-клеток из hPSCs.
Важным вопросом является,необходимо ли генерировать островки или только β-клетки. Подсаженные, происходящие из hPSC предшественники дифференцируются в функциональные кластеры, похожие на островки, которые содержат все типы эндокринных клеток, в соотношении, сходном с таковым в островках людей (Xie et al. 2013). Хотя сегодня неизвестно, необходимы ли не-β островковые клетки для функции β-клеток, имеющиеся доказательства показывают, что паракринная передача сигналов между типами эндокринных клеток может быть важной у людей (rev. Caicedo 2012).
Human Pluripotent Stem Cells as a Model for Understanding
Pancreas Biology and Disease
Много информации о развитии и органогенезе поджелудочной железы получено на животных моделях; имеются, однако, некоторые ограничения для этих моделей. На техническом уровне временные популяции развивающихся клеток слишком редки в эмбрионах, чтобы быть изолированными в достаточном количестве для крупномасштабного геномного или биохимического анализа. Способность к дифференцировке таких промежуточных клонов из hPSC в действительности делает неограниченными количества таких исследований и недавно привела к идентификации основных транскрипционных и эпигенетических механизмов детерминации панкреатических клонов (Xie et al. 2013).
Более того, видо-специфические различия в регуляции генов ограничивают использование животных моделей для изучения болезней человека. Одним из примеров является диабет, возникающий с началом созревания (maturity onset diabetes of the young (MODY)), который у людей возникает в результате мутаций одиночного гена, которые не всегда фенокопируются у мышей (Haumaitre et al. 2006, Mayer et al. 2008). Есть надежда, что протоколы для продукции in vitro функциональных β-клеток облегчат исследования, нацеленные на понимание механизмов болезни диабета. Успехи в редактировании генома сегодня позволяют нам моделировать эффекты генных мутаций или полиморфизмов одиночных нуклеотидов в hPSCs. Т.о., продукция β-клеток in vitro не только будет важной ступенью в направлении регенеративной медицины, но и таже поможет нам в понимании патогенеза диабета.
FUTURE PROSPECTS
This review has covered the tremendous progress we have made in understanding pancreatic organogenesis and has briefiy discussed the progress made in recapitulating this process in vitro using hPSCs. Reflecting on this body of work, a few conclusions become strikingly clear. First, much remains to be understood about the complex process of pancreas organogenesis, specifically, how morphogenesis is coupled with cell fate specification. Although we have made significant progress in understanding many of the transcription factors that are required at various stages of pancreas development, the signals that promote and regulate each developmental decision are still poorly understood. Clearly, the current success of in vitro pancreatic differentiation of hPSCs has relied heavily on studies employing animal models. Therefore, we must continue to apply the lessons learned in vivo to achieve the critical goal of generating functional β-cells in vitro.
|
 Figure 1
Overview of adult pancreas anatomy. The pancreas lies behind the stomach in the abdomen and attaches to the duodenum. For illustration purposes, the stomach is outlined with a dashed line and the duodenum is shown as a cut view. Exocrine acinar cells secrete pancreatic juice containing enzymes for the breakdown of proteins, carbohydrates, and lipids. The pancreatic juice is transported through a ductal network that releases the juice into the duodenum. The endocrine pancreas consists of small cell clusters, called islets of Langerhans, containing five endocrine cell types, namely glucagon-producing α-cells, insulin-producing β-cells,
somatostatin-producing δ-cells, and pancreatic polypeptide-producing PP cells. Note, the figure shows the islet organization characteristic for mice with centrally located β-cells. Pancreatic islets are surrounded by a dense capillary network through which the hormones are released into the blood stream. See inset for an enlarged cutaway view of the pancreas.
Figure 1
Overview of adult pancreas anatomy. The pancreas lies behind the stomach in the abdomen and attaches to the duodenum. For illustration purposes, the stomach is outlined with a dashed line and the duodenum is shown as a cut view. Exocrine acinar cells secrete pancreatic juice containing enzymes for the breakdown of proteins, carbohydrates, and lipids. The pancreatic juice is transported through a ductal network that releases the juice into the duodenum. The endocrine pancreas consists of small cell clusters, called islets of Langerhans, containing five endocrine cell types, namely glucagon-producing α-cells, insulin-producing β-cells,
somatostatin-producing δ-cells, and pancreatic polypeptide-producing PP cells. Note, the figure shows the islet organization characteristic for mice with centrally located β-cells. Pancreatic islets are surrounded by a dense capillary network through which the hormones are released into the blood stream. See inset for an enlarged cutaway view of the pancreas.
 Figure 2
Illustrated overview of pancreatic organogenesis. (a) The dorsal and ventral pancreatic epithelium evaginates into the surrounding mesenchyme between embryonic day (e) 9.5 and e11.5 in mice. At this stage, the pancreatic epithelium is comprised of a multilayered core of unpolarized cells engulfed by a basement membrane. Scattered microlumens (light yellow) arise between epithelial cells. Blood vessels surround but have not yet penetrated the epithelial buds. (b) At e12.5, the outer tip cell layer ( green) of the pancreatic epithelium forms recognizable branch protrusions. In the trunk portion of the pancreatic epithelium, microlumens fuse to form a primitive plexus, and groups of newly polarized cells ( purple) organize into rosettes around a lumen. At the same time, blood vessels begin to intercalate into the epithelium and contact trunk cells. (c) At e15.5, the luminal plexus progressively remodels into a single-layered epithelium consisting of highly branched primitive ducts (also known as progenitor cords) and newly differentiated acinar cells. Ngn3-expressing endocrine precursors (orange) delaminate and migrate away from the progenitor cords to form endocrine clusters. Blood vessels are intercalated between nascent branches of the pancreatic ductal tree. (d ) In the mature pancreas, acinar cells cap the endings of small terminal ducts and form functional exocrine secretory units. Endocrine cells are clustered in so-called islets of Langerhans, which are penetrated by a dense network of blood vessels. See insets for enlarged views of depicted areas.
Figure 2
Illustrated overview of pancreatic organogenesis. (a) The dorsal and ventral pancreatic epithelium evaginates into the surrounding mesenchyme between embryonic day (e) 9.5 and e11.5 in mice. At this stage, the pancreatic epithelium is comprised of a multilayered core of unpolarized cells engulfed by a basement membrane. Scattered microlumens (light yellow) arise between epithelial cells. Blood vessels surround but have not yet penetrated the epithelial buds. (b) At e12.5, the outer tip cell layer ( green) of the pancreatic epithelium forms recognizable branch protrusions. In the trunk portion of the pancreatic epithelium, microlumens fuse to form a primitive plexus, and groups of newly polarized cells ( purple) organize into rosettes around a lumen. At the same time, blood vessels begin to intercalate into the epithelium and contact trunk cells. (c) At e15.5, the luminal plexus progressively remodels into a single-layered epithelium consisting of highly branched primitive ducts (also known as progenitor cords) and newly differentiated acinar cells. Ngn3-expressing endocrine precursors (orange) delaminate and migrate away from the progenitor cords to form endocrine clusters. Blood vessels are intercalated between nascent branches of the pancreatic ductal tree. (d ) In the mature pancreas, acinar cells cap the endings of small terminal ducts and form functional exocrine secretory units. Endocrine cells are clustered in so-called islets of Langerhans, which are penetrated by a dense network of blood vessels. See insets for enlarged views of depicted areas.  Figure 3
Lineage decisions during pancreas development. (a) During the primary transition, the transcription factors Pdx1, Prox1, Onecut-1 (Oc1), Ptf1a, Foxa1/2, Tcf2, Sox9, Gata4/6, and Hes1 mediate expansion of pancreatic progenitor cells and maintain pancreatic identity. (b) At the onset of the secondary transition, pancreatic progenitors adopt either tip or trunk identity. Notch activity promotes the trunk while repressing tip identity. Cross-repression between Ptf1a and Nkx6.1 mediates tip/trunk separation. (c) Tip cells adopt an acinar phenotype, which is maintained by a positive-regulatory loop between PTF1-L and Nr5a2. Trunk cells are bipotential for the ductal and endocrine cell fate. The ductal versus endocrine fate decision is controlled by graded Notch activity. High Notch promotes the ductal fate by activating both Hes1, a repressor of Ngn3, and Sox9, an Ngn3 activator. At low Notch activity, only Sox9 is activated, leading to endocrine differentiation. (d ) Endocrine precursors further differentiate into five different cell types, of which only α-and β-cells are depicted. Cross-repression between the α-cell determinant Arx and β-cell determinants Pax4, Nkx6.1, and Pdx1 separates the two lineages.
Figure 3
Lineage decisions during pancreas development. (a) During the primary transition, the transcription factors Pdx1, Prox1, Onecut-1 (Oc1), Ptf1a, Foxa1/2, Tcf2, Sox9, Gata4/6, and Hes1 mediate expansion of pancreatic progenitor cells and maintain pancreatic identity. (b) At the onset of the secondary transition, pancreatic progenitors adopt either tip or trunk identity. Notch activity promotes the trunk while repressing tip identity. Cross-repression between Ptf1a and Nkx6.1 mediates tip/trunk separation. (c) Tip cells adopt an acinar phenotype, which is maintained by a positive-regulatory loop between PTF1-L and Nr5a2. Trunk cells are bipotential for the ductal and endocrine cell fate. The ductal versus endocrine fate decision is controlled by graded Notch activity. High Notch promotes the ductal fate by activating both Hes1, a repressor of Ngn3, and Sox9, an Ngn3 activator. At low Notch activity, only Sox9 is activated, leading to endocrine differentiation. (d ) Endocrine precursors further differentiate into five different cell types, of which only α-and β-cells are depicted. Cross-repression between the α-cell determinant Arx and β-cell determinants Pax4, Nkx6.1, and Pdx1 separates the two lineages.