Г Л У Х О Т А, обусловленная мутациями
Ralph H. Holme, Karen P. Steel
Current Opinion in Genetics & Development 1999, 9No. 3, 309-314.
BOR—branchio-oto-renal;
dom—dominant megacolon;
MITF—micropthalmia-associated transcription factor.
Один из 2000 детей рождается с или приобретает глухоту в результате генетических дефектов. Описаны многочисленные локусы, связанные с нарушением слуха у человека [1].
Две мутантные линии мышей 'pirouette' и 'spinner' характеризуются выраженной глухотой, связанной с дегенерацией механорецепторных волсковых клеток в улитке. В обоих случаях обнаруживаются дефекты морфологии волосковых клеток во время постнатального развития. Специализированные, заполненные актином структуры , стереоцилии, нормально проецируются на апикальной поверхности волосковых клеток. Отклеонение пучка стереоцилий с помощью механической энергии звука инициирует образование электрических сигналов с волосковых клетках; эти сигналы передаются в центральную слуховую систему с помощью слухового нерва. Стереоцилии изменены у мышей pirouette, они заметно тоньше [Figure 1]
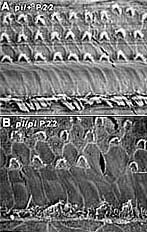 Рис.1 Стереоцилии волосковых клеток в улитках мышей pirouette аномальны. Их толщина уменьшается, а пучки становятся дизорганизованными. А. контрольные мыши pi/+ в возрасте 22 дней. В. Мутантные мыши в возрасте 22-x дней. и постепенно все более портятся в течение первых 3 недель после рождения. Помимо дефектов стереоцилий обнаруживаются аномальные пучки актиновых филамент ("cytocaud") клеточных телах волосковых клеток у мышей pirouette [Figure 2]. Предполагается, что глухота у мышей pirouette связана с аномальной регуляцией полимеризации актина в волосковых клетках. 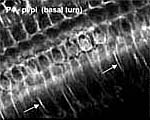 Рис. 2. Образование cytocaud в IHC pi/pi мышей . Заполненные актином проекции ("cytocauds") видны во внутренних волосковых клетках (IHC) 4-дневных мышей (стрелки). Аномальные акиновые филаменты инициируются вблизи апикальной поверхности волосковых клеток, проецируются через все тело клетки и выходят через базальную часть клетки и закрепляются в базальной плазматической мембране. Гомозиготы spinner обнаруживают сходный паттерн потери волосковых клеток. Самым ранним морфологическим дефектом является слегка аномальная структура стереоцилий в улитках 14 дневных мышей, которые укорачиваются или теряются из наружных волосковых клеток (OHC). На 25 день все стереоцилии в OHC или отсутствуют или сильно укорочны.
Локус pirouette располагается на 5-й , а spinner на 9-й хромосоме. Человечьий ортолог pirouette скорее всего локализован в 4p12-14, и по положению являестся скорее всего геном, ответственным за DFNB25 nonsyndromic deafness. Сходным образом, spinner м.б. моделью потери слуха у человека, обуславливаемой мутациями в локусе
|
Во время начальных стадий развития внутреннго уха, отические плакоды, простой слой эпителия, инвагинирует, формируя слуховой пузырек (otic vesicle). В дальнейшем он превратится в закрученную улитку, содержащую Кортиев орган и вестибулярную — состоящую из sacculus, utriculus и полукружных канальцев вместе связанных с ними сенсорных органов (Fig. 1a). Генетический контроль развития внутреннего уха рассматривался в обзоре [2••]. Несколько генов идентифицировано, которые экспрессируются в отическом эпителии и необходимы для его организации. Гомологи этих генов у человека пока не обнаруживают связи с глухотой; однако два гена глухоты у человека, экспрессирующиеся в отическом эпителии, SALL1 и EYA1 могут участвовать в нарушениях слуха.
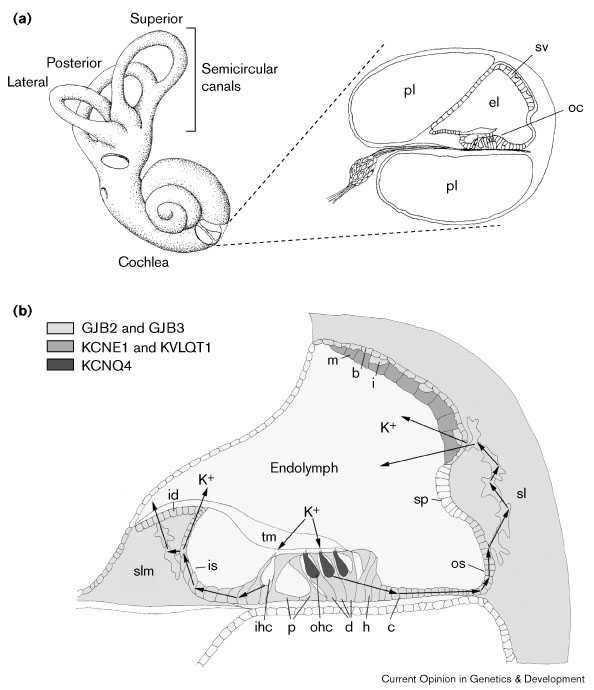 |
Рис. 1 Анатомия улитки и предполагаемые пути дисперсии K+ во время слуховой стимуляции. (a) Поперечный разрез через улитку, показывающий Кортиев органа (oc), расположенный на дне заполненного эндолимфой кохлеарного протока. stria vascularis (sv) располагаются на латеральной стенке улиткового протока. (b) K+, который поступает во внутренние сенсорные волосковые клетки (ihc) возвращается в эндолимфу по медиальному пути, идущем через внутренние клетки борозды (is) и spiral limbus fibrocytes (slm) к interdental клеткам (id). K+, который поступает в наружные сенсорные волосковые клетки (ohc) возвращается в эндолимфу латеральным путем, проходя через Deiter's (d), Hensen's (h), Claudius (c) и наружные клетки борозды (os), затем он проходит через спиральные лигаментозные фиброциты (sl) в stria vascularis. Распределение K+ канальцев (KCNE1, KVLQT1 и KCNQ4) и компонентов щелевых соединений (GJB2, кодируемых коннексином 26 и GJB3, кодируемых коннексином 31), которые могут иргать роль в дисперсии K+ от сенсорных волосковых клеток, как показано в области с разной штриховкой . pl, перилимфа; el, эндолимфа; m, краевые клетки; b, базальные клетки; i, промежуточные клетки; sp, спиральное возвышение; p, pillar клетки; и tm, слуховая перепонка. Illustration by S Holme. Figure 1 Cochlear anatomy and proposed routes for K+ dispersal during auditory stimulation. (a) Cross section through the cochlear canal showing the organ of Corti (oc) situated on the floor of the endolymph-filled cochlear duct. The stria vascularis (sv) is situated on the lateral wall of the cochlear duct. (b) K+ which has influxed into inner sensory hair cells (ihc) is thought to return to the endolymph by a medial route, passing through inner sulcus cells (is) and spiral limbus fibrocytes (slm) to interdental cells (id). K+ which has influxed into outer sensory hair cells (ohc) is thought to return to the endolymph by a lateral route, passing through Deiter's (d), Hensen's (h), Claudius (c) and outer sulcus cells (os), whereupon it passes through spiral ligament fibrocytes (sl) to the stria vascularis. The distribution of K+ channels (KCNE1, KVLQT1 and KCNQ4) and gap junction components (GJB2 encoding connexin 26 and GJB3 encoding connexin 31) that may play a role in the dispersal of K+ from sensory hair cells are shown as regions of varying shades. pl, perilymph; el, endolymph; m, marginal cell; b, basal cell; i, intermediate cell; sp, spiral prominence; p, pillar cells; and tm, tectorial membrane. |
SALL1 и EYA1 кодируют транскрипционные факторы, мутации которых обусловливают Townes-Brocks и branchio-oto-renal (BOR) синдромы, соответственно [3] [4]. Eya1 экспрессируется в клетках слухового пузырька мыши, которые дают Кортиев орган, maculae и cristae. Экспрессия затем поддерживается в этих сенсорных органах по крайней мере в течение 20 дней постнатального развития [5]. Msal экспрессируется в клетках отического эпителия, который дает орган Корти и макулу. У новорожденных мышей экспрессия его обнаруживается в эпителиальном гребне Кортиева органа и сенсорном эпителии вестибулярной системы [6].
Следовательно, Msal и Eya1 вовлечены в спецификацию и дифференцировку сенсорных органов. О функции этих генов можно судить по клиническим проявлениям у пациентиов с синдромами Townes-Brocks и BOR. При обоих синдромах потеря слуха имеет как кондуктивный, так и сенсорнонейральный компонент [3] [4]: последний может быть результатом дефекта дифференцировки органа Корти, тогда как кондуктивный компонент указывает на то, что SALL1 и EYA1 играют дополнительную роль в среднем ухе. Исследования внутреннего уха у BOR пациентов показали, что улитка и полукружные каналы или недоразвиты или полностью отсутствуют [4]. Можно предположить, что EYA1 функция необходима не только для развития сенсорного органа. Eya1 экспрессируется в мезенхиме, окружающей cochlear duct и вестибулярную систему, и может быть необходим для собственно дифференцировки этих типов клеток в хрящевые [5]. Или Eya1 может быть необходим для соответствующей передачи сигналов между отическим пузырьком и мезенхимой, которые существенны для собственно морфогенеза внутреннего уха. Это объясняет тяжелые нарушение внутреннего уха у пациентов BOR .
Mutations affecting sensory hair cells
Каждая сенсорная клетка органа Корти проэцирует около ~100 актин-содержащих стереоцилий(actin-packed stereocilia) со своей апикальной поверхности. Стереоцилии расположены тремя параллельными рядами, которые градированы по высоте и организованы в V-образный паттерн. Основание каждой стереоцилии закреплено в кутикулярной пластинке, которая также богата актином. Латеральные поперечные свзи между стереоцилиями также участвуют в поддержании их точного расположения. Звуковые вибрации заставляют волосковые клетки двигаться по отношению к покрывающей их текториальной мембране, которая, напротив, пригибает самые высокие ряды стереоцилий, в результате происходит контакт между кончиками стереоцилий из разных рядов, которые были согнуты. Это открывает трансдукционные канальцы и ведет к поступлению K+ из эндолимфы, к деполяризации волосковых клеток и высвобождению нейротрансмиттеров [7]. Функция волосковых клеток, следовательно, сильно зависит от из структуры. Следовательно, глухота может вызываться мутациями генов, участвующих в организации цитоскелета.
![]()
 Патология волосковых клеток и нейронов
Патология волосковых клеток и нейронов
Необычные (неконвенциональные) миозины являются двигательными белками, которые продуцируют силу против или по движению вместе с актиновыми филаментами, используя энергию гидролиза АТФ. Они содержат законсервированные домены моторных головок и сильно отличающиеся хвостовые области (reviewed by [8] [9]). Обнаружение, что мутации MYO7A/Myo7a обусловливают глухоту у пациентов с Usher type IB и у shaker1 мышей, было первым указанием на то, что миозины важны для слуха [10] [11]. Затем было установлено, что мутации в Myo6 вызывают глухоту Snell's waltzer мышей, а мутации в MYO15/Myo15 обусловливают глухоту у DFNB3 пациентов и shaker2 мышей [12] [13••] [14•].
Стереоцилии волосковых клеток дизорганизованы у shaker1, слиты уSnell's waltzer и аномально короткие у i>shaker2 мышей ([13••] [15]; TJ Self, KP Steel, unpublished observation). Как эти миозины организуют стереоцилии неясно, но миозин VIIA и миозин VI присутствуют в кутикулярной пластинке, так что они должны функционировать в этом месте закрепления стереоцилий [12] [15] [16]. Возможно, что миозин VIIA, который также присуствует внутри стереоцилий, может участвовать в формировании боковых поперечных связей [16]. Относительно клеточного и внутриклеточного распределения миозина XV известно, что функция этого миозина спекулятивна, но присутствие аномальных актин-содержащих структур в слуховых волосковых клетках shaker2 мышей и короткие стереоцилии на их поверхности указывает на то, что этот миозин участвует в поддержании организации актина [13••].
Миозины, по-видимому, участвуют не только в организации актиновых структур волосковых клеток. Мутация в человеческом гомологе Drosophila Diaphanous обусловливает доминантную форму сенсорнонейральной (DFNA1) [17]. Diaphanous регулирует полимеризацию актина, тем самым участвует в поддержании актинового цитоскелета волосковых клеток.
Фактор транскрипцииPou4f3 (известный также как Brn3.1 и Brn3c) также необходим для поддержания и/или выживания волосковых клеток [18]. Этот ген экспрессируется во внутренних и наружных волосковых клетках взрослых мышей [18] [19]МутацияPOU4F3 обусловливает доминантную форму прогрессирующей глухоты (DFNA15), которая развивается между 18 и 30 годами[20•]. 24-месячные мыши, несущие только одну функциональную копию Pou4f3 не имеют нарушения слуха [19] [20•], или из-за недостаточности времени или из-за того, что гаплонедостаточность не является причиной потери слуха у DFNA15 пациентов. Улитка мышей, гомозиготных по делеции Pou4f3, первоначально содержит миозин-VI- и миозин-VIIa-экспрессирующие клетки, но они неспособны дифференцироваться в зрелые волосковые клетки [21]. В вестибулярной системе Pou4f3-/- мышей, увеличено количество апоптических клеток, указывающее на то, что частично дифференциорованные волoсковые клетки могут дегенерировать с помощь апоптоза [21]. Сходный дегенеративный механизм наблюдается в Кортиевом органе. Таким образом, Pou4f3 необходим не только для генерации или инициальной дифференцировки волосковых клеток, но и для созревания и поддержания волосковых клеток.
Регуляция внутриклеточной концентрации Ca2+ является витальной для функции волосковых клеток. Мутация Atp2b2 — гена, кодирующего плазменно-мембранный насос Ca2+-ATPase type 2 —, обусловливает глухоту у мышей [22]. Мутации этого гена обусловливают глухоту также у deafwaddler мышей [23•]. Atp2b2 присутствует внутри стереоцилий как внутренних, так и внешних волосковых клеток и участвует в удалении Ca2+ из стереоцилий [23•] [24]. Однако мутации этого гена у человека пока не обнаруживают связи с глухотой.
Mutations affecting melanocyte development
stria vascularis внутреннего уха состоит из трех первичных типов клеток: маргинальных, базальных и меланоцит-подобных промежуточных клеток. Маргинальные клетки эпителиального происхождения и контактируют с эндолимфой, базальные клетки мезенхимного происхождения, они образуют непрерывный слой, выстилающий спиральную лигаменту, а меланоцит-подобные промежуточные клетки, по-видимому. происходят из клеток нервного гребня и разбросаны между базальными и маргинальными клетками(Fig. 1b). Мутантные мыши, у которых отсутствуют меланоциты имеют чрезвычайно низкий внутриулитковый потенциал по сравнению с нормальными мышами, это указывает на то, что эти клетки генерируют этот потенциал [25]. Неудивительно, что мутации этих генов, контролирующие развитие меланоцитов, могут вызывать глухоту.
Развитие меланоцитов нарушено у пациентов с синдромом Waardenburg, в результате гипопигментация и нарушения слуха. Этот синдром подразделяется на 4 типа в зависимости от дополнительных симптомов: Waardenburg syndrome type I (WS1) ассоциирует с дистопией (dystopia canthorum); WS3 с дистопией и аномалиями конечностей, а WS2 без дистопии; Waardenburg-Shah syndrome (WS4) ассоциирует с мегаколоном и может вызываться мутациями рецептора эндотелина-В или его лиганда эндотелина-3 [26] [27]. Мутации гомологичных генов найдены у piebaldlethal и lethal spotting мутантных мышей , соответственно [28] [29]. МутацииSOX10/Sox10 как известно также вызывают WS4 и dominant megacolon (dom) у человека и мыши, соответственно [30] [31] [32]. Мыши и люди, несущие мутантную копию Sox10/SOX10 имеют гипопигментацию и отсутствие энтеричских ганглиев. У людей имеется кроме того глухота, тогда как мыши обнаруживают поведение circling, которое указывает на дефекты внутреннего уха. Эти аномалии согласуются с нарушением развития нервного гребня. Sox10 экспрессируется в областях дорсальной нервной трубки, из которой происходят и мигрируют клетки нервного гребня [30] [33]. Более того, отсутствие клеток, экспрессирующих ранний меланобластный маркер Tyrp2 [34] у гомозигот dom мышей указывает на то, что Sox10 играет роль на ранних стадиях развиатия меланоцитов [30].
Известно, что синдромы WS1 и WS3 вызываются мутациями PAX3 [35] [36] [37]. Как и Sox10, Pax3 экспрессируется в дорсальной части нервной трубки, из которой выходят клетки нервного гребня. Эти гены могут, следовательно, действовать на общем пути, контролирующем дифференцировку клеток нервного гребня в меланоциты. Sox10 усиливает транскрипционную активность Pax3 в культуре клеток [32].
Синдром WS2 обусловливается мутациями MITF (microphthalmia-associated transcription factor) [38]. У мышей, гомозиготных по нулевому аллелю Mitf, отсутствуют stria vascularis Tyrp2-экспрессирующие меланоциты [39] [40]. Watanabe et al. [41] сообщили, что PAX3 может трансактивировать MITF промотор in vitro, тогда как мутантный PAX3 белок не может.
Mutations affecting endolymph homeostasisПредполагается, что K+ участвует в слуховой стимуляции волосковых клеток, он поступает обратно в эндолимфу по одному из двух путей [42] [43] (Fig. 1b). Из внутренних волосковых клеток K+ отводится соедними поддерживающими клетками, из которых он переносится медиально в interdental клетки, или непосредственно через клетки внутренней бороздки или через фиброциты spiral limbus. Наконец, K+ высвобождается из interdental клеток в эндолимфу. Из наружных волосковых клеток K+ отводится латеральным путем, через Deiter's, Hensen's, Claudius и клетки наружной бороздки, затем через фиброциты spiral ligament в stria vascularis, откуда он снова поступает в эндолимфу.
Важность транспорта K+ через мембраны волосковых клеток подтвержается мутацией нового калиевого канала (KCNQ4), вызывающей глухоту у DFNA2 пациентов [44••]. В улитке взрослых мышей Kcnq4 экспрессируется только в наружных волосковых клетках, подтвержая тем самым, что функция этого канала уникальна для этого типа клеток. В отличие от нормальных KCNQ4, мутантные каналы не дают каких-либо токов при экспрессии в ооцитах Xenopus. Ко-экспрессия мутантных каналов с нормальными супрессирует ток, указывая на то, что мутантный белок оказывает доминантно-негативный эффект. Kubisch et al. [44••] предположили, что KCNQ4 вряд ли вовлечены в инициальную накачку K+ в наружные волосковые клетки, так как высокое негативное напряжение поперек мембран должно предупреждать их открытие. Более вероятно, что каналы играют роль в удалении K+ из наружных волосковых клеток.
В поддерживающих клетках K+ движутся между клетками с помощью диффузии через щелевые соединения. Каждая половинка щелевого соединения формируется 6 молекулами коннексина. Мутации GJB2 и GJB3, кодирующих коннексин 26 и коннеексин 31 соответственно, обусловливают сенсорнонейральную глухоту[45] [46] [47]. Эти белки присутствуют в клетках, связанных как с медиальным, так и латеральным маршрутами транспорта K+, это указывает на то, что глухота обусловлена дефектами транспорта K+ ([48]; J Edwards, A Forge, personal communication).
Маргинальные клетки stria vascularis экспрссируют Kvlqt1 и IsK (известный также как KCNE1) [49] [50]. Кодируемые белки ассоциируют один с другим для образования калиевых канальцев, и способствуют тем самым секреции K+ в эндолимфу. strial маргинальные клетки мышей, гомозиготных по нулевой мутации IsK, неспособны генерировать короткие цируиты тока, указывая тем самым на отсуствие сереции K+ [51]. У человека мутации или KCNE1 или KVLQT1 обусловливают Jervell и Lange-Nielsen синдром, который связан с глухотой [49] [52].
Высокий позитивный остаточный (resting) потенциал в эндолимфе может быть результатом пассивного H+ efflux из эндолимфы и повышения pH , если не происходит активной секреции протонов в эндолимфу. Мутации в гене, кодирующем B1 субъединицу H+-ATФase, обусловливают ацидоз дистальных почечных канальцев (dRTA), который может быть ассоциирован с глухотой [53••]. В улитке мышей, субъединица B1 обнаруживается в interdental клетках, указывая на то, что эти клетки могут быть вовлечены в поддержание pH эндолимфы.
Межклеточное общение в улитке посредством щелевых соединений позвляет обмениваться электролитами и небольшими метаболитами. Во внутреннем ухе крыс и человека Cх26 экспресссируется широко. Недавно было показано, что и Сх30 также экспрессируется в улитке крыс, частично ко-локализуясь с Сх26. Сх43 обнаруживает слабую экспрессию. Сх31, ассоциируемый с потерей слуха высоких частот, и его транскрипты также локлизован во внутреннем ухе крыс. Щелевые соединения передают ионы К, которые используются для индуцируемой звуком деполяризации волосковых клеток, следовательно Сх26-дефицитные особи неспособны генерировать рецепторный потенциал
У человека Сх26 мутации (Gdel35, W77R, 167delT) описаны в случаях аутосомной несиндромной сенсорнонейральной глухоты и сцеплены с хромосомой 13. Это первый ген несиндромальной сенсорнонейральной глухоты. Мутация 30delG в хромосоме 13 ответственна за 10% всех потерь слуха у детей, 1 из 28 человек является бессимптомным носителем этой мутации. Роль Сх30 остается неизвестной. References
-
Van Camp G, Smith R:
Hereditary Hearing Loss Homepage.
On World Wide Web URL:
-
••
Fekete DM:
Development of the vertebrate ear: insights from knockouts and mutants.
Trends Neurosci 1999, 22: 263–268.
-
Kohlhase J, Wischermann A, Reichenbach H, Froster U, Engel W:
Mutations in the SALL1 putative transcription factor gene cause Townes- Brocks syndrome.
Nat Genet 1998, 18: 81–83.
-
Abdelhak S, Kalatzis V, Heilig R, Compain S, Samson D, Vincent C, Weil D, Cruaud C, Sahly I, Leibovici M, Bitner-Glindzicz M et al.:
A human homologue of the Drosophila eyes absent gene underlies branchio-oto-renal (BOR) syndrome and identifies a novel gene family.
Nat Genet 1997, 15: 157–164.
-
Kalatzis V, Sahly I, El-Amraoui A, Petit C:
Eya1 expression in the developing ear and kidney: towards the understanding of the pathogenesis of Branchio-Oto-Renal (BOR) syndrome.
Dev Dyn 1998, 213: 486–499.
-
Ott T, Kaestner KH, Monaghan AP, Schutz G:
The mouse homolog of the region specific homeotic gene spalt of Drosophila is expressed in the developing nervous system and in mesoderm-derived structures.
Mech Dev 1996, 56: 117–128.
-
Gillespie PG, Corey DP:
Myosin and adaptation by hair cells.
-
Titus MA:
Unconventional myosins: New frontiers in actin-based motors.
Trends Cell Biol 1997, 7: 119–123.
-
Hasson T, Mooseker MS:
The growing family of myosin motors and their role in neurons and sensory cells.
Curr Opin Neurobiol 1997, 7: 615–623.
-
Gibson F, Walsh J, Mburu P, Varela A, Brown KA, Antonio M, Beisel KW, Steel KP, Brown SD:
A type VII myosin encoded by the mouse deafness gene shaker-1.
Nature 1995, 374: 62–64.
-
Weil D, Blanchard S, Kaplan J, Guilford P, Gibson F, Walsh J, Mburu P, Varela A, Levilliers J, Weston MD et al.:
Defective myosin VIIA gene responsible for Usher syndrome type 1B.
Nature 1995, 374: 60–61.
-
Avraham KB, Hasson T, Steel KP, Kingsley DM, Russell LB, Mooseker MS, Copeland NG, Jenkins NA:
The mouse Snell's waltzer deafness gene encodes an unconventional myosin required for structural integrity of inner ear hair cells.
Nat Genet 1995, 11: 369–375.
-
••
Probst FJ, Fridell RA, Raphael Y, Saunders TL, Wang A, Liang Y, Morell RJ, Touchman JW, Lyons RH, Noben-Trauth K et al.:
Correction of deafness in shaker-2 mice by an unconventional myosin in a BAC transgene.
Science 1998, 280: 1444–1447.
-
•
Wang A, Liang Y, Fridell RA, Probst FJ, Wilcox ER, Touchman JW, Morton CC, Morell RJ, Noben-Trauth K, Camper SA, Friedman TB:
Association of unconventional myosin MYO15 mutations with human nonsyndromic deafness DFNB3.
Science 1998, 280: 1447–1451.
-
Self TJ, Mahony M, Fleming J, Walsh J, Brown SD, Steel KP:
Shaker-1 mutations reveal roles for myosin VIIA in both development and function of cochlear hair cells.
Development 1998, 125: 557–566.
-
Hasson T, Gillespie PG, Garcia JA, MacDonald RB, Zhao Y, Yee AG, Mooseker MS, Corey DP:
Unconventional myosins in inner-ear sensory epithelia.
J Cell Biol 1997, 137: 1287–1307.
-
Lynch ED, Lee MK, Morrow JE, Welcsh PL, Leon PE, King MC:
Nonsyndromic deafness DFNA1 associated with mutation of a human homolog of the Drosophila gene diaphanous.
Science 1997, 278: 1315–1318.
-
Erkman L, McEvilly RJ, Luo L, Ryan AK, Hooshmand F, O'Connell SM, Keithley EM, Rapaport DH, Ryan AF, Rosenfeld MG:
Role of transcription factors Brn-3.1 and Brn-3.2 in auditory and visual system development.
Nature 1996, 381: 603–606.
-
Xiang M, Gan L, Li D, Chen ZY, Zhou L, O'Malley BW Jr, Klein W, Nathans J:
Essential role of POU-domain factor Brn-3c in auditory and vestibular hair cell development.
Proc Natl Acad Sci USA 1997, 94: 9445–9450.
-
•
Vahava O, Morell R, Lynch ED, Weiss S, Kagan ME, Ahituv N, Morrow JE, Lee MK, Skvorak AB, Morton Cc
et al.:
Mutation in transcription factor POU4F3 associated with inherited progressive hearing loss in humans.
Science 1998, 279: 1950–1954.
- Xiang M, Gao WQ, Hasson T, Shin JJ:
Requirement for Brn-3c in maturation and survival, but not in fate determination of inner ear hair cells.
Development1998,125:3935–3946.
- Kozel PJ, Friedman RA, Erway LC, Yamoah EN, Liu LH, Riddle T, Duffy JJ, Doetschman T, Miller ML, Cardell EL, Shull GE:
Balance and hearing deficits in mice with a null mutation in the gene encoding plasma membrane Ca2+-ATPase isoform 2.
J Biol Chem1998,273:18693–18696.
-
•
Street VA, McKee-Johnson JW, Fonseca RC, Tempel BL, Noben Trauth K:
Mutations in a plasma membrane Ca2+-ATPase gene cause deafness in deafwaddler mice.
Nat Genet1998,19:390–394.
-
Yamoah EN, Lumpkin EA, Dumont RA, Smith PJ, Hudspeth AJ, Gillespie PG:
Plasma membrane Ca2+-ATPase extrudes Ca2+ from hair cell stereocilia.
J Neurosci 1998, 18: 610–624.
-
Steel KP, Barkway C:
Another role for melanocytes: their importance for normal stria vascularis development in the mammallan inner ear.
Development 1989, 107: 453–463.
-
Puffenberger EG, Hosoda K, Washington SS, Nakao K, deWit D, Yanagisawa M, Chakravart A:
A missense mutation of the endothelin-B receptor gene in multigenic Hirschsprung's disease.
Cell 1994, 79: 1257–1266.
-
Edery P, Attie T, Amiel J, Pelet A, Eng C, Hofstra RM, Martelli H, Bidaud C, Munnich A, Lyonnet S:
Mutation of the endothelin-3 gene in the Waardenburg-Hirschsprung disease (Shah-Waardenburg syndrome).
Nat Genet 1996, 12: 442–444.
-
Hosoda K, Hammer RE, Richardson JA, Baynash AG, Cheung JC, Giaid A, Yanagisawa M:
Targeted and natural (piebald-lethal) mutations of endothelin-B receptor gene produce megacolon associated with spotted coat color in mice.
Cell 1994, 79: 1267–1276.
-
Baynash AG, Hosoda K, Giaid A, Richardson JA, Emoto N, Hammer RE, Yanagisawa M:
Interaction of endothelin-3 with endothelin-B receptor is essential for development of epidermal melanocytes and enteric neurons.
Cell 1994, 79: 1277–1285.
-
Southard-Smith EM, Kos L, Pavan WJ:
Sox10 mutation disrupts neural crest development in Dom Hirschsprung mouse model.
Nat Genet 1998, 18: 60–64.
-
Pingault V, Bondurand N, Kuhlbrodt K, Goerich DE, Prehu MO, Puliti A, Herbarth B, Hermans-Borgmeyer I, Legius E, Matthijs G et al.:
SOX10 mutations in patients with Waardenburg-Hirschsprung disease.
Nat Genet 1998, 18: 171–173.
-
Herbarth B, Pingault V, Bondurand N, Kuhlbrodt K, Hermans-Borgmeyer I, Puliti A, Lemort N, Goossens M, Wegner M:
Mutation of the Sry-related Sox10 gene in Dominant megacolon, a mouse model for human Hirschsprung disease.
Proc Natl Acad Sci USA 1998, 95: 5161–5165.
-
Kuhlbrodt K, Herbarth B, Sock E, Hermans-Borgmeyer I, Wegner M:
Sox10, a novel transcriptional modulator in glial cells.
J Neurosci 1998, 18: 237–250.
-
Steel KP, Davidson DR, Jackson IJ:
TRP-2/DT, a new early melanoblast marker, shows that steel growth factor (c-kit ligand) is a survival factor.
Development 1992, 115: 1111–1119.
-
Hoth CF, Milunsky A, Lipsky N, Sheffer R, Clarren SK, Baldwin CT:
Mutations in the paired domain of the human PAX3 gene cause Klein- Waardenburg syndrome (WS-III) as well as Waardenburg syndrome type I (WS-I).
Am J Hum Genet 1993, 52: 455–462.
-
Tassabehji M, Read AP, Newton VE, Harris R, Balling R, Gruss P, Strachan T:
Waardenburg's syndrome patients have mutations in the human homologue of the Pax-3 paired box gene.
Nature 1992, 355: 635–636.
-
Baldwin CT, Hoth CF, Amos JA, da-Silva EO, Milunsky A:
An exonic mutation in the HuP2 paired domain gene causes Waardenburg's syndrome.
Nature 1992, 355: 637–638.
-
Tassabehji M, Newton VE, Read AP:
Waardenburg syndrome type 2 caused by mutations in the human microphthalmia (MITF) gene.
Nat Genet 1994, 8: 251–255.
-
Opdecamp K, Nakayama A, Nguyen MT, Hodgkinson CA, Pavan WJ, Arnheiter H:
Melanocyte development in vivo and in neural crest cell cultures: crucial dependence on the Mitf basic-helix-loop-helix-zipper transcription factor.
Development 1997, 124: 2377–2386.
-
Tachibana M, Hara Y, Vyas D, Hodgkinson C, Fex J, Grundfast K, Arnheiter H:
Cochlear disorder associated with melanocyte anomaly in mice with a transgenic insertional mutation.
Mol Cell Neurosci 1992, 3: 433–445.
-
Watanabe A, Takeda K, Ploplis B, Tachibana M:
Epistatic relationship between Waardenburg syndrome genes MITF and PAX3.
Nat Genet 1998, 18: 283–286.
-
Spicer SS, Schulte BA:
Evidence for a medial K+ recycling pathway from inner hair cells.
Hear Res 1998, 118: 1–12.
-
Spicer SS, Schulte BA:
The fine structure of spiral ligament cells relates to ion return to the stria and varies with place-frequency.
Hear Res 1996, 100: 80–100.
-
••
Kubisch C, Schroeder BC, Friedrich T, Lutjohann B, El-Amraoui A, Marlin S, Petit C, Jentsch TJ:
KCNQ4, a novel potassium channel expressed in sensory outer hair cells, is mutated in dominant deafness.
Cell 1999, 96: 437–446.
-
Xia JH, Liu CY, Tang BS, Pan Q, Huang L, Dai HP, Zhang BR, Xie W, Hu DX, Zheng D et al.:
Mutations in the gene encoding gap junction protein beta-3 associated with autosomal dominant hearing impairment.
Nat Genet 1998, 20: 370–373.
-
Kelsell DP, Dunlop J, Stevens HP, Lench NJ, Liang JN, Parry G, Mueller RF, Leigh IM:
Connexin 26 mutations in hereditary non-syndromic sensorineural deafness.
Nature 1997, 387: 80–83.
-
Denoyelle F, Lina-Granade G, Plauchu H, Bruzzone R, Chaib H, Levi-Acobas F, Weil D, Petit C:
Connexin 26 gene linked to a dominant deafness.
Nature 1998, 393: 319–320.
-
Kikuchi T, Kimura RS, Paul DL, Adams JC:
Gap junctions in the rat cochlea: immunohistochemical and ultrastructural analysis.
Anat Embryol (Berl) 1995, 191: 101–118.
-
Neyroud N, Tesson F, Denjoy I, Leibovici M, Donger C, Barhanin J, Faure S, Gary F, Coumel P, Petit C et al.:
A novel mutation in the potassium channel gene KVLQT1 causes the Jervell and Lange-Nielsen cardioauditory syndrome.
Nat Genet 1997, 15 186–189.
-
Sakagami M, Fukazawa K, Matsunaga T, Fujita H, Mori N, Takumi T, Ohkubo H, Nakanishi S:
Cellular localization of rat Isk protein in the stria vascularis by immunohistochemical observation.
Hear Res 1991, 56: 168–172.
-
Vetter DE, Mann JR, Wangemann P, Liu J, McLaughlin KJ, Lesage F, Marcus DC, Lazdunski M, Heinemann SF, Barhanin J:
Inner ear defects induced by null mutation of the isk gene.
Neuron 1996, 17: 1251–1264.
-
Tyson J, Tranebjaerg L, Bellman S, Wren C, Taylor JF, Bathen J, Aslaksen B, Sorland SJ, Lund O, Malcolm S:
IsK and KvLQT1: mutation in either of the two subunits of the slow component of the delayed rectifier potassium channel can cause Jervell and Lange-Nielsen syndrome.
Hum Mol Genet 1997, 6: 2179–2185.
-
••
Karet FE, Finberg KE, Nelson RD, Nayir A, Mocan H, Sanjad SA, Rodriguez-Soriano J, Santos F, Cremers CW, Di Pietro A et al.:
Mutations in the gene encoding B1 subunit of H+-ATPase cause renal tubular acidosis with sensorineural deafness.
Nat Genet 1999, 21: 84–90.