Fragile X syndrome (FXS) является наиболее распространенной формой наследственной умственной отсталости с частотой около 1:4000 у мужчин и
1:8000 у женщин. Индивиды с FXS обладают от средней до тяжелой умственной отсталости , а также черепно-лицевыми аномалиями и дисплазией соединительной ткани (Hagerman and Hagerman, 2002). Ген fragile X mental retardation-1 (Fmr1) кодирует РНК-связывающий белок, FMRP, который высоко консервативен в эволюции. FMRP состоит из двух K-homology (KH1-2) доменов и
RGG-box домена (Fig. 1A). Он также обладает nuclear localization (NLS) и export (NES) сигналом (Fig. 1A). Недавно было продемонстрировано, что
RGG-box обеспечивает связывание с субнабором РНК с G-quartet структурой (Darnell et al.,2001). Xenopus FMRP обладает 90%, 95%, 90%, 100% и 61% идентичных аминокислотных последовательностей с NLS, KH1, KH2, NES и
RGG box доменами FMRP человека, соотв. (Fig. 1A). Филогенетический анализ далее показал, что аминокислотные последовательности Xenopus FMRP более близки к человеческому FMRP, чем к рыбкам данио или Drosophila (Fig. 1B), указывая тем самым, что он может служить моделью для изучения функции FMRP.
Горизонтальные срезы эмбрионов на ст. ранней хвостовой почки показали, что энтодермальные, мезодермальные и мезенхимные (нервный гребень) области фарингеальных дуг экспрессируют
Fmr1 (Fig. 3A and D). На ст. ранней хвостовой почки (st. 35) области переднего, среднего и заднего мозга и хорда обнаруживают высокую экспрессию
Fmr1 (Fig. 3C, F and G). Сходные находки в ЦНС (Agulhon et al., 1999) и хорде (Hergersberg et al., 1995) были сделаны у мышей. Снова черепно-лицевые области, включая слуховые пузырьки (Fig. 3F) и глаза (Fig. 3G), обнаруживали высокие уровни транскриптов
Fmr1 на этой стадии. Более того, у поздних головастиков (st. 45) Строгая экспрессия
Fmr1 обнаруживается в ЦНС, обонятельных луковицах и мозжечке (Fig. 4).
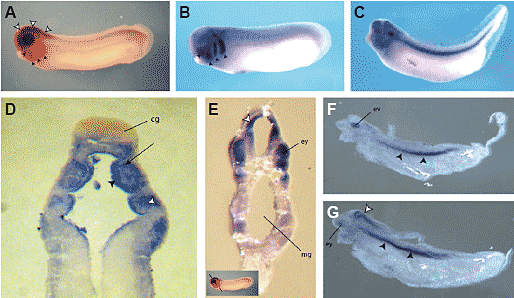 Fig. 3. Whole mount in situ hybridization of developing Xenopus
embryos for Fmr1. (A) Early tailbud stage embryo (st. 26) showing
Fmr1 expression in the CNS (white arrowheads) and pharyngeal
arches (black arrowheads). (B) Expression of AP-2б, a neural crest
marker at tailbud stage (st. 26). In comparison to Fmr1 expression
pattern, AP-2б expression is mostly limited to the pharyngeal arches at
this stage (black arrowheads). (C) Fmr1 expression at early tadpole
stage embryo (st. 26; see F and G for details). (D) Horizontal section of
st. 26 embryo at the level of cement gland showing Fmr1 expression in
endodermal (black arrowhead), mesodermal (black arrow) and mesenchymal
(white arrowhead) regions of the pharyngeal arches, with slight
staining in the ectodermal region. The difference in staining intensity
between the left and right side is due to the oblique nature of the sectioned tissue. Cement gland (cg) is negative for Fmr1 expression. (E) Oblique transverse section of tailbud stage embryo (st. 26). Strong expression is observed in the eye evagination (ey) and in CNS (white arrowhead). Insets show approximate region that has been sectioned (mg: midgut). (F,G) Sagittal section of late tailbud stage embryo depicted in Fig. 3C showing strong expression in the CNS (G: white arrowhead), craniofacial regions, notochord (F,G: black arrowheads), ear vesicle (F: ev) and eye (G: ey).
Fig. 3. Whole mount in situ hybridization of developing Xenopus
embryos for Fmr1. (A) Early tailbud stage embryo (st. 26) showing
Fmr1 expression in the CNS (white arrowheads) and pharyngeal
arches (black arrowheads). (B) Expression of AP-2б, a neural crest
marker at tailbud stage (st. 26). In comparison to Fmr1 expression
pattern, AP-2б expression is mostly limited to the pharyngeal arches at
this stage (black arrowheads). (C) Fmr1 expression at early tadpole
stage embryo (st. 26; see F and G for details). (D) Horizontal section of
st. 26 embryo at the level of cement gland showing Fmr1 expression in
endodermal (black arrowhead), mesodermal (black arrow) and mesenchymal
(white arrowhead) regions of the pharyngeal arches, with slight
staining in the ectodermal region. The difference in staining intensity
between the left and right side is due to the oblique nature of the sectioned tissue. Cement gland (cg) is negative for Fmr1 expression. (E) Oblique transverse section of tailbud stage embryo (st. 26). Strong expression is observed in the eye evagination (ey) and in CNS (white arrowhead). Insets show approximate region that has been sectioned (mg: midgut). (F,G) Sagittal section of late tailbud stage embryo depicted in Fig. 3C showing strong expression in the CNS (G: white arrowhead), craniofacial regions, notochord (F,G: black arrowheads), ear vesicle (F: ev) and eye (G: ey).
В данной работе был показан паттерн онтогенетической экспрессии
Fmr1 у эмбрионов
Xenopus. Хотя предыдущие исследования намекали на экспрессии.
Fmr1 в клетках нервного гребня и бранхиальных дугах у мышей (Agulhon et al., 1999, de Diego
Otero, 2000), наши данные предоставляют четкие доказательства экспрессии
Fmr1 в этих областях. Т.к. различные тканевые структуры, затрагиваемые у пациентов с FXS, являются производными краниального нервного гребня, то наши находки вносят важный вклад в понимание патогенеза FXS. Дальнейшие исследования роли экспрессии
Fmr1 в фарингеальных дугах, а также в различных черепно-лицевых регионах без сомнения улучшат наше понимание Fragile X патологии.
Xenopus может служить прекрасной моделью для изучения роли экспрессии
Fmr1 во время эмбрионального развития.
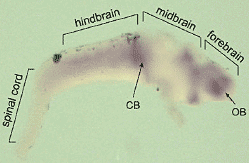 Fig. 4. Whole-mount in situ hybridization of Fmr1 in tadpole brain. The
forebrain, midbrain and hindbrain (lateral view) show moderate to heavy
Fmr1 expression. Abbreviations: ob, olfactory bulb; cb, cerebellum.
Fig. 4. Whole-mount in situ hybridization of Fmr1 in tadpole brain. The
forebrain, midbrain and hindbrain (lateral view) show moderate to heavy
Fmr1 expression. Abbreviations: ob, olfactory bulb; cb, cerebellum.
Qi Yang, Bin Feng, Kun Zhang , Yan-yan Guo, Shui-bing Liu, Yu-mei Wu, Xiao-qiang Li, Ming-gao ZhaoExcessive Astrocyte-Derived Neurotrophin-3 Contributes to the Abnormal Neuronal Dendritic Development in a Mouse Model of Fragile X Syndrome. PLoS Genet 8(12): e1003172. doi:10.1371/journal.pgen.1003172
Fragile X syndrome (FXS) форма наследственной умственной отсталости у человека, возникающая в результате экспансии CGG повторов в гене
Fmr1. Недавние исследования предположили роль астроцитов в развитии нейронов. Однако механизмы, участвующие в регуляции процесса астроцитов от FXS остаются неясными. В этом исследовании мы установили, что астроциты, происходящие от Fragile X модельных, Fmr1 нокаутных (KO) мышей, которые лишены экспрессии FMRP, ингибируют собственно выработку дендритных отростков нейронов
in vitro. Более того, astrocytic conditioned medium (ACM) от KO астроцитов ингибировала собственно рост дендритов в нейронах как дикого типа, так и KO нейронах. Индукция экспрессии FMRP с помощью трансфекции FMRP векторов в KO астроциты восстанавливает морфологию дендритов и уровни синаптических белков. Дальнейшие эксперименты выявили повышенные уровни neurotrophin-3 (NT-3) в KO ACM и в префронтальном кортексе
Fmr1 KO мышей. Однако уровни nerve growth factor (NGF), brain-derived neurotrophic factor (BDNF), glial cell-derived neurotrophic factor (GDNF), and ciliary neurotrophic factor (CNTF) были нормальными. FMRP имеет множественные РНК-связывающие мотивы и участвует в регуляции трансляции. Иммунопреципитация РНК-связывающего белка (RIP) показала, что мРНК NT-3 взаимодействует с FMRP в астроцитах дикого типа. В то время как высокие концентрации экзогенного NT-3 в культуральной среде редуцируют дендриты нейронов и уровни синаптических белков, тогда как эти показатели улучшаются с помощью нейтрализующих антител к NT-3 или в результате нокдауна экспрессии NT-3 в KO астроцитах посредством коротких шпилечных РНК (shRNAs). Микроинъекции в префронтальный кортекс астроцитов дикого типа или инфицированных NT-3 shRNA KO астроцитов устраняли дефицит rescued trace fear memory у KO мышей, одновременно снижали уровни NT-3 в префронтальном кортексе. Это исследование показывает, что избыток NT-3 из астроцитов вносит вклад в аномальное развитие дендритов нейронов и что астроциты могут служить потенциальной терапевтической мишенью при FXS.
 Fig. 3. Whole mount in situ hybridization of developing Xenopus
embryos for Fmr1. (A) Early tailbud stage embryo (st. 26) showing
Fmr1 expression in the CNS (white arrowheads) and pharyngeal
arches (black arrowheads). (B) Expression of AP-2б, a neural crest
marker at tailbud stage (st. 26). In comparison to Fmr1 expression
pattern, AP-2б expression is mostly limited to the pharyngeal arches at
this stage (black arrowheads). (C) Fmr1 expression at early tadpole
stage embryo (st. 26; see F and G for details). (D) Horizontal section of
st. 26 embryo at the level of cement gland showing Fmr1 expression in
endodermal (black arrowhead), mesodermal (black arrow) and mesenchymal
(white arrowhead) regions of the pharyngeal arches, with slight
staining in the ectodermal region. The difference in staining intensity
between the left and right side is due to the oblique nature of the sectioned tissue. Cement gland (cg) is negative for Fmr1 expression. (E) Oblique transverse section of tailbud stage embryo (st. 26). Strong expression is observed in the eye evagination (ey) and in CNS (white arrowhead). Insets show approximate region that has been sectioned (mg: midgut). (F,G) Sagittal section of late tailbud stage embryo depicted in Fig. 3C showing strong expression in the CNS (G: white arrowhead), craniofacial regions, notochord (F,G: black arrowheads), ear vesicle (F: ev) and eye (G: ey).
Fig. 3. Whole mount in situ hybridization of developing Xenopus
embryos for Fmr1. (A) Early tailbud stage embryo (st. 26) showing
Fmr1 expression in the CNS (white arrowheads) and pharyngeal
arches (black arrowheads). (B) Expression of AP-2б, a neural crest
marker at tailbud stage (st. 26). In comparison to Fmr1 expression
pattern, AP-2б expression is mostly limited to the pharyngeal arches at
this stage (black arrowheads). (C) Fmr1 expression at early tadpole
stage embryo (st. 26; see F and G for details). (D) Horizontal section of
st. 26 embryo at the level of cement gland showing Fmr1 expression in
endodermal (black arrowhead), mesodermal (black arrow) and mesenchymal
(white arrowhead) regions of the pharyngeal arches, with slight
staining in the ectodermal region. The difference in staining intensity
between the left and right side is due to the oblique nature of the sectioned tissue. Cement gland (cg) is negative for Fmr1 expression. (E) Oblique transverse section of tailbud stage embryo (st. 26). Strong expression is observed in the eye evagination (ey) and in CNS (white arrowhead). Insets show approximate region that has been sectioned (mg: midgut). (F,G) Sagittal section of late tailbud stage embryo depicted in Fig. 3C showing strong expression in the CNS (G: white arrowhead), craniofacial regions, notochord (F,G: black arrowheads), ear vesicle (F: ev) and eye (G: ey).  Fig. 4. Whole-mount in situ hybridization of Fmr1 in tadpole brain. The
forebrain, midbrain and hindbrain (lateral view) show moderate to heavy
Fmr1 expression. Abbreviations: ob, olfactory bulb; cb, cerebellum.
Fig. 4. Whole-mount in situ hybridization of Fmr1 in tadpole brain. The
forebrain, midbrain and hindbrain (lateral view) show moderate to heavy
Fmr1 expression. Abbreviations: ob, olfactory bulb; cb, cerebellum.