эмбрионам или путём обработки матерей или прямым воздействием на эмбрионы в культуре целых эмбрионов ведет к существенному снижению показателя экзэнцефалии (Martinez-Barbera et al., 2002). Однако, отсутствует очевидное улучшение избыточного апоптоза в среднем мозге у нормализованных фолиевой кислотой эмбрионов, это указывает на то, что или повышенный уровень апоптоза не является непосредственной причиной NTD у этих мутантов или происходит незначительное снижение апоптоза, которое однако достаточно для закрытия нервной трубки или что фолиевая кислота действует за счёт альтернативного механизма, способствующего закрытию нервной трубки. Одна из возможностей, как было предположено на базе др. моделей, заключается в том, что фолиевая кислота действует, чтобы стимулировать пролиферацию и тем самым преодолевать дефект у
нулевых эмбрионов. В самом деле, альтернативная причина NTD, связанная с субоптимальной пролиферацией, предполагается, исходя из наблюдений, что культивируемые фибробласты, полученные от
нулевых эмбрионов, снижают свою пролиферацию и преждевременно стареют, фенотип, который ассоциируется с избыточной экспрессией ингибиторов клеточной пролиферации, кодируемых локусом
(Kranc et al., 2003). Однако, хотя делеция
восстанавливает дефект пролиферации у фибробластов, это не предупреждает экзэнцефалии у двойных нулевых мутантов по
, указывая тем самым. что неправильная регуляция дополнительных генов даёт в результате NTD (Kranc et al., 2003).
Интересно, что NTD у Sp мышей, по-видимому, резистентны к folic кислоте или folinic кислоте. Аллель Sp имеет делецию одной пары оснований по сравнению с делецией 32 пар оснований у Sp2H. Очевидное расхождение в реакции на фолаты может отражать различия в природе мутаций в Рах3 или различия в генетических фонах линий. Кроме того, фолиевая кислота у Sp2H оказывает наивысший эффект на экзэнцефалию, тогда как у spotch мышей базовый уровень экзэнцефалий очень низок (8%-30%).
У
Cart1, Cited2 и splotch моделей нет доказательств эмбриональной летальности до стадии закрытия нервной трубки, так что фолиевая кислота, по-видимому, действует непосредственно или опосредованно на процесс закрытия нервной трубки. Напротив, у
crooked tail и folate binding protein 1 (folbp1) нулевых эмбрионов очевидно, что добавление фолиевой кислоты нормализует раннюю летальность, так что экзэнцефалия становится обнаружимой у выживших эмбрионов (Carter et al., 1999; Piedrahita et al., 1999). Всё ешё более высокие дозы фолиевой кислоты вызывают предупреждение NTD. Т.о., и тяжесть и пенетрантность дефектов, обусловленные гомозиготностью по ещё не идентифицированному гену
crooked tail (Сd), варьируют в зависимости от уровня фолиевой кислоты в материнской диете. Гомозиготные фенотипы включают пре-имплантационную и раннюю пост-имплантационную летальность с экзэнцефалией и карликовость у эмбрионов, которые доживают до плодного периода (Morgan, 1954; Carter et al., 1999). Пренатальные пищевые добавки фолиевой кислоты (10 мг/кг) снижают долю экзэнцефалии по сравнению с базовой линией при диете с 4 мг/кг, с более значительным эффектом у самок (55% снижение показателя), чем у самцов (33% снижение показателя).Поддержание на диете с дефицитом фолата также вызывает снижение показателей экзэнцефалий, наблюдаемое на Е12.5-14.5, но это, по-видимому, возникает из-за соотв. повышения доли эмбриональной летальности. Следовательно, у Cd мышей имеются два раздельных эффекта фолиевой кислоты: (1) восстановление эмбриональной летальности, которое происходит в фолат-дефицитных условиях и (2) предупреждение NTD (высокая доза фолиевой кислоты).
FOLIC ACID PREVENTION OF TERATOGEN-INDUCED NTD
Ряд средовых факторов ассоциирует с фолат-предупреждаемыми NTD (Taбл. 1). Анти-конвульсионная valproic acid (VPA) является тератогеном для людей, т.к. матери, использующие её имеют высокий риск NTD, особенно spina bifida (Lammer et al., 1987). У мышей VPA также является тератогеном для эмбрионов, если принимается беременными самками, возникают NTD на разных уровнях оси тела, а также скелетные дефекты и задержки роста (Kao et al., 1981; Ehlers et al., 1992b). VPA на ст. Е8 вызывает экзэнцефалию, тогда как воздействие на У9 приводит к spina bifida. VPA может индуцировать ТЕВ непосредственно у эмбрионов, т.к. краниальные и спинальные NTD наблюдаются также у культивируемых эмбрионов мышей (и крыс) (Bruckner et al., 1983; Hansen, Grafton, 1991; Seegmiller et al., 1991; Ehlers et al., 1992a). Появление общей задержки роста, а также аномалий отических и оптических пузырьков открывает возможность, что эффект VPA отражает генерализованную токсичность в противоположность специфическому эффекту на нейруляцию.
Pantothenic кислота, витамин Е, methionine и folinic кислота ( 5-formyl tetrahydrofolate) снижают показатели индуцируемых VPA NTD (Trotz et al., 1987; Wegner, Nau, 1992; Al Debb et al., 2000). Однако, в отдельных исследованиях ни фолиниковая, ни фоливая кислота или 5-methyl-tetrahydrofolate (5-MeTHF) не оказывали защитного эффекта (Hansen et al., 1995a,b). Это расхождение может быть обусловлено изменчивостью в эффективности фолиниковой кислоты в зависимости от уровня и частоты дозировки. Недавние оценки разных режимов воздействия на мышиные VPA-индуцированные модели NTD показали защитный эффект, который наиболее выражен после повторного применения перед и во время периода закрытия нервной трубки (Padmanabhan, Shafiuiah, 2003). Потенциальная роль нарушенного метаболизма фолатов в патогенетическом механизме VPA подтверждается метаболическим анализом, показывающим пониженные уровни фолиевой кислоты и 10-formyl TNF и повышенные уровни TNF у обработанных эмбрионов. Кроме того, уровни фолиевой кислоты витамина В12 и метионина также редуцированы, тогда как концентрация гомоцистеина повышена в материнской плазме (Wegner, Nau, 1992; Hishida, Nau, 1998; Padmanabhan, Shafiuiah, 2003). Более того, methotrexate, антагонист метаболизма фолата, оказывается недостаточным, чтобы свмому индуцировать экзэнцефалию, усиливает эффект VPA (Elmazar, Nau, 1992).
Нормализующий эффект метионина на тератогенность VPA необычен тем, что он, по-видимому, обусловлен материнским эффектом скорее, чем коррегирующим метаболические дефекты у самих эмбрионов. У мышей, воздействие на матерей метионином снижает показатели spina bifida occulta (Ehlers et al., 1996), тогда как обработка культивируемых эмбрионов крыс не защищает от VPA-индуцированных аномалий (Nosel, Klein, 1992). Однако, если крысы были использованы в качестве доноров сыворотки или эмбрионов, получавших перед этим пищевые добавки метионина, то наблюдалась достоверная редукция тератогенного эффекта VPA на культивируемые эмбрионы (Nosel. Klein, 1992).
Индукция NTD с помощью грибкового микотоксина fumonisin также, по-видимому, является результатом нарушения метаболизма фолата. Возможная связь между fumonisins и NTD впервые была предположена, исходя из наблюдения, что частоты NTD увеличиваются в популяциях, которые подвержены действию высоких уровней fumonisins из зараженной кукурузы (Hendricks, 1999; Marasas et al., 2004). Хотя оральные дозы fumonisin В1 (FB1) не вызывают ТЕВ у случайно разводимых мышей CD1 высокие частоты экзенцефалий индуцируются у потомков инбредных LMBc мышей после внутрибрюшинных инъекций FB1 перед и во время закрытия нервной трубки (Marasas et al., 2004). Сходным образом, воздействие FB1 на эмбрионов мышей в культурах вызывало экзэнцефалии, а также существенную задержку роста (Sadler et al., 2002). Важно, что фолиевая кислота (in vivo и фолиниковая кислота ( in vivo и in vitro ) снижали показатели экзэнцефалии у обработанных FB1 эмбрионов (Sadler et al., 2002; Marasas et al., 2004).
Биохимический эффект fumonisins заключается в нарушении метаболизма сфинголипидов путём ингибирования синтеза ceramide synthase, энзи ма, который превращает sphingonine в 5-acyl-spingonine. Возникающее в результате накопление shingonine ( и родственных сфинголипидов) является, как полагают, ответственным за fumonisin-обусловленную токсичность и ингибирование пролиферации. Возможным механизмом индукции fumonisin NTD? по-видимому, является механизм ингибирования метаболизма сфинголипидов, приводящий к редукции доступности клеточных фолатов из-за нарушений содержащих сфинголипиды мембранных микродоменов, c которыми GPI-прикрепленные молекулы, включая folbp1, связаны (Marasas et al., 2004; Sabharanjak, Mayor, 2004)юВ подтверждение этой модели, fumonisin ингибирует потребление фолатов в культуре клеток (Stevens, Tang, 1997; Chatterjee et al., 2001). Однако, анализ биохимии фолата у обработанных fumonisin эмбрионов ещё не проводился. Строгая защита индуцированных fumonisin экзэнцефалий с помощью ганглиозида GM1, который ассоциирует с GPI закрепленными молекулами, также подкрепляет патогенный механизм, связанный с участием GPI-закрепленных молекул. Т.к. fplbp1 без сомнения является GPI-закрепленным белком, то и др. белки, включая ephrinA5 (Holmberg et al., 2000) также являются GPI-закрепленными и существенными для краниальной нейруляции. Это открывает возможность того, что fumonisins могут вызывать ТЕВ посредством более чем одного механизма.
Помимо предупреждения NTD? индуцированных с помощью специфических химических тератогенов, фолиевая кислота, как было установлено, редуцирует также долю NTD, индуцируемых с помощью средовых факторов, таких как высокая температура. Эти исследования могут иметь значение для клиники, т.к. эпидемиологические исследования у людей показали, наличие повышенного риска NTD, связанного с лихорадкой или использованием горячих труб или саун (Milunsky et al., 1992)/ Воздействие на беременных мышей гипертермии во время периода закрытия нервной трубки вызывает высокую частоту экзэнцефалий, которые могут быть супрессированы приёмом матерями фолиевой кислоты (Shiota, 1988; Shin, Shiota, 1999). Предполагается, что фолиевая кислота может действовать относительно неспецифическим образом, стимулируя клеточную пролиферацию и тем самым преодолевая временную редукцию, вызываемую воздействием тепла, хотя это не доказано экспериментально.
DOSES FOLATE DEFICIENCY CAUSE NTD IN MICE?
У людей пониженные уровни фолата в сыворотке матерей ассоциируют с повышенным риском NTD (Kirke et al., 1993; Molloy et al, 1998). Однако, не очевидно, что добавки фолиевой кислоты не действуют просто, чтобы скорректировать недостаточное поступление фолата с пищей, т.к. уровни фолатов при NTD беременностях находятся в тех же пределах, что и при нормальных исходах беременностей (Scott et al., 1994; Van der Put et al., 1997). У мышей дефицит фолатов индуцируется у эмбрионов за счёт поддержания самок на фолат-дефицитной диете до спаривания. Хотя эмбрионы растут замедленно, сам по себе дефицит недостаточен, чтобы вызвать NTD (Heid et al., 1992; Burgoon et al,m 2002). В этих исследованиях с недостаточным потреблением с пищей остаточного фолата, по-видимому, достаточно для выживания эмбрионов, т.к. генетическое устранение folbp1, которое, по-видимому, вызывает более выраженную нехватку фолатов, вызывает задержку роста и эмбриональную летальность до стадии закрытия нервной трубки (Piedrahita et al., 1999). Folbp1 является одним из трёх связывающих фолат белков, которые были идентифицированы у мышей (Piedrahita et al., 1999; Spigelstein et al., 2000)> все они действуют как рецепторы высокого сродства, способствуя поступлению фолатов в клетки. Однако, folbp1, по-видимому, является критическим для потребления клетками фолатов у эмбрионов, т.к. нокаутные по folbp2 мыши выглядят нормально, потеря folbp2 вообще менее повреждающая из-за более низкого сродства этого рецептора к фолатам (Brigle et al., 1994). Скармливание матерям фолиниковой кислоты предупреждает существенную пропорцию эмбриональной летальности folbp1 нулевых эмбрионов (Piedrahita et al., 1999) и нормализованные детеныши могут выживать до рождения (Finnell et al., 2002). Присутствие folbp1 нулевых плодов, которые доживают до поздних стадий беременности, но обладают NTD (Piedrahita et al., 1999), указывает на существенную потребность в folbp1 при закрытии нервной трубки. В более поздних исследованиях folbp1 нулевых мышей, которые выживали благодаря добавкам фолиниковой кислоты (25мг/кг), выявили налисие у них в 20% случаев NTD (Finnell et al., 2002), указывая тем самым, что NTD у остальных мышей были предупреждены фолиниковой кислотой.
Очевидная потребность в folbp1 при краниальной нейруляции коррелирует с паттерном экспрессии мРНК folbp1 в краниальных нервных складках во время их смыкания (Saitsu et al., 2003). Существенная роль folbp1 при закрытии нервной трубки подтверждается также продукцией NTD после применения антисмысловиых олигонуклеотидов против folbp1 у культивируемых мышиных эмбрионов (Hansen et al., 2003).
Потенциальным механизмом защитного эффекта фолиевой кислоты является стимуляция пролиферации путем снабжения запасами нуклеотидов для синтеза ДНК. Альтернативные механизмы, которые были предложены, базируются на идентификации повышенных уровней в плазме матерей гомоцистеина или пониженных уровней витамина В
12, ко-фактора синтеза метионина, в качестве дополнительных факторов риска возникновения NTD (Kirke et al., 1993; Steegers-Theunissen et al., 1994). Следовательно, одним из защитных механизмов, которые были предложены, является предположение, что фолиевая кислота обеспечивает снабжение 5-methyl tetrahydrofolate, rj-субстрата, который предоставляет метильные группы для превращения гомоцистеина в метионин. Стимулирование цикла метилирования с помощью фолиевой кислоты д. облегчать активность methyl-transferases или редуцировать потенциально тератогенные уровни гомоцистеина. Последнее кажется маловероятным, т.к. повышенные уровни гомоцистеина из-за своей эмбриотоксичности не вызывают NTD при cem-токсических дозах у мышей (Greene et al/, 2003). Однако, снабжение достаточным количеством метионина, по-видимому, является критическим для краниальной нейруляции, т.к. эмбрионы крыс,. культивируемые в коровьей сыворотке, которая содержит низкие уровни метионина, возникают NTD, которые могут быть предупреждены добавками метионина (Coelho et al., 1989). Более того, у мышей экзэнцефалия вызывается ингибированием метилирования ДНК в результате обработки 5-azacytidine (Matsuda, 1990) или делеции ДНК methyltransferase Dnmt3b, которая строго экспрессируется в краниальном нейроэпителии (Okano et al., 1999).
Incomplete Prevention of NTD by Folic Acid Supplementation
Базируясь на результатах клинических испытаний, в частности на рандомизированных, контролируемых испытаниях, проводимых Med. Res.Council, UK (Wald et al., 1991), фолиевая кислота как было подсчитано предупреждает приблизительно 70% NTD. Величина эффекта фолиевой кислоты варьирует между исследованиями, однако, это исходит из гетерогенности NTD в терминах их чувствительности к фолиевой кислоте. В ряде случаев NTD появляются несмотря на приём свыше 4 мг в день и это скорее всего происходит из-за того, что некоторые случаи NTD могут быть предотвращены фолиевой кислотой, а др. нет. Возможно, что повышенные дозы фолиевой кислоты (выше 4 мг/день) могут предотвращать больше. Однако, сегодня общепринято, что некоторые случаи NTD резистентны к действию фолиевой кислоты.
FOLIC ACID DOES NOT PREVENT ALL MOUSE NTD
NTD у людей не полностью предупреждаются фолиевой кислотой. Эти резистентные к фолиевой кислоте NTD могут возникнуть (a) в субпопуляции эмбрионов у модельных животных, которые в остальном чувствительны к фолату (таких как splotch) или (b) у моделей, у которых фолиевая кислота не оказывает защитного эффекта вообще (такие как curly tail).
Среди мышиных линий, у которых фолиевая кислота оказывает защитное действие, степень защиты редко достигает 100%. Напр., фолиеваяы кислота редуцирует показатель NTD приблизительно на 60%, 65% и 84% среди гомозиготных мутантов Cart1, spotch и Cited2 соотв. (Zhao et al., 1996; Fleming, Coop, 1998; Martinez-Barbera et al., 2002). Эта изменчивость в ответе на добавление очевидна, несмотря на тот факт. что мыши несут одни и те же причиняющие вред повреждения и подвергаются униформным воздействиям среды и режимов лечения. Мутантные линии с частичным предупреждением NTD с помощью фолиевой кислоты предоставляют собой экспериментальную систему, в которой возможен анализ реакции эмбрионов на фолиевую кислоту и корреляций, индуцируемых метаболическими и молекулярными изменениями.
Среди мышиных генетических моделей NTD (Табл. 1) с нечувствительными дефектами находятся краниальные NTD у ephrin-A5 нокаутных мышей и спинальные NTD у curly tail мутантов (Seller, 1994;Holmberg et al., 2000). Сходным образом, отсутствует редукция показателей спинальных NTD среди потомства от гетерозиготных скрещивания после добавок матерям axial defect (Axd) мышей фолиниковой кислоты или витамина В12 (Essien, Wannberg, 1993). Напротив, добавления метионина реудцируют долю спинальных NTD у Axd на 40% (Essien/ 1992). Этот эффект , как полагают, не обусловлен корреляцией дефицита метионина у матерей, т.к. его уровни в плазме нормальны у гетерозиготных Axd самок (Essien, Wannberg, 1993), хотя генетически предопределённый дефицит у гомозиготных эмбрионов не может быть исключен. Небольшая популяция обрабатываемых метионином эмбрионов даёт экзэнцефалию, но т.к. эмбрионы не были генотипированы, то неясно могут ли гомозиготные Axd эмбрионы давать низкие показатели краниальных NTD в дополнение к более превалирующим спинальным дефектам и может ли экзогенный метионин оказывать ингибирующий эффект на закрытие каниальной части нервной трубки, как это описано для мутантов splotch (Fleming, Copp, 1998).
Мыши
curly tail изучены лучше всего в отношении NTD (Van Straaten, Copp, 2001). Спинальные NTD возникают в результате дефектов пролиферации специфических типов клеток в энтодерме задней кишки, это обусловливает избыточный вентральный изгиб каудальной области эмбриона, тем самым ингибируется смыкание нервных складок. Среди гомозиготных мутантных эмбрионов приблизительно 15% дают пояснично-кресцовые spina bifida и 50% дают дефекты флексии хвоста, однако показатели обоих дефектов сильно зависят от генетического фона (Neuman et al., 1994). Частичная пенетрантность и варьирующая экспрессивность NTD у
curly tail с существенным влиянием модифицирующих генов и средовых факторов, представляет парадигму для сложной этиологии NTD у людей. Однако, в ряде исследований спинальные NTD у
curly tail обладали сильной устойчивостью к защитному действию родственных фолату интервенций, включая и фолиевую и фолиниковую кислоту, Pregnavite Forte А или метионин (Seller, 1994; Van Straatev et al., 1995; Tran et al., 2002; Ting et al., 2003). Эмбрионы
curly tail не имеют аномалий метаболизма фолатов (Fleming, Copp, 1998), но повышенные уровни гомоцистеина ( в плазме) и s-adenosylhomocysteine ( в печени) выявлены у взрослых мышей (Tran et al., 2002). Вклад в NTD чувствительности неясен, т.к. уровни в материнской крови или во время нейруляции у эмбрионов не были определены.
PREVENTION OF NTD BY INOSITOL IN FOLATE-RESISTENT MOUSE MODEL
Хотя не предупреждаемые фолиевой кислотой спинальные NTD у curly tail эмбрионов , но предупреждаются добавлениями инозитола или введение матерям (внутрибрюшинно, орально или подкожными влияниями) или в культуре целых эмбрионов (Greene, Copp, 1997; Cogram et al., 2002) Хотя естественно возникшая форма myo-inositol, как было перовнаяально установлено предупреждает NTD, последующие исследования показали, что др. enantiomer, В-chiro-inositol также является протектором и даже более эффективен при низких дозах, чем myo-inositol (Cogram et al., 2002).
Механизм действия инозитола (Рис. 1) исследовали с помощью системы
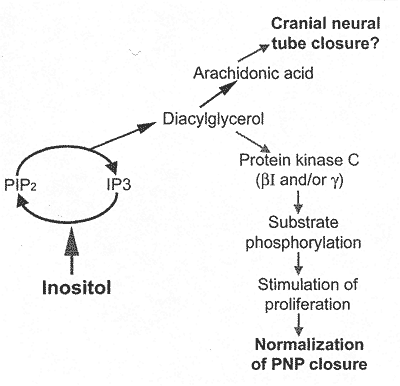 Figure 1. Summary of proposed mechanisms for prevention of neural tube defects (NTD) by inositol. Exogenous inositol enters the inositol phospholipid cycle and is incorporated into inositol phospholipids, including phosphatidylinositol diphosphate (PIP2). Hydrolysis of PIP2 generates IP3 and DAG which are both downstream signaling molecules. Protein kinase C (PKC) isoforms are activated by DAG and the subsequent phosphorylation of specific substrates results in the downstream correction of the proliferation defect that causes spinal NTD in curly tail embryos, thereby normalizing closure. Arachidonic add, is a product of DAG metabolism that may be required for cranial neurulation.
Figure 1. Summary of proposed mechanisms for prevention of neural tube defects (NTD) by inositol. Exogenous inositol enters the inositol phospholipid cycle and is incorporated into inositol phospholipids, including phosphatidylinositol diphosphate (PIP2). Hydrolysis of PIP2 generates IP3 and DAG which are both downstream signaling molecules. Protein kinase C (PKC) isoforms are activated by DAG and the subsequent phosphorylation of specific substrates results in the downstream correction of the proliferation defect that causes spinal NTD in curly tail embryos, thereby normalizing closure. Arachidonic add, is a product of DAG metabolism that may be required for cranial neurulation.
культивируемых эмбрионов, у которых использовалась серия агонистов и антагонистов потенциальных нижестоящих путей (Greene, Copp, 1997; Cogram et al., 2004). Предупреждение NTD с помощью инозитола зависит от цикла inositol phosphalipid, т.к. защитный эффект блокируется с помощью совместным воздействием лития или специфического inositol monophospatase ингибитора, L690,330 (Greene, Copp, 1997 и неоп.) Важным нижестоящим медиатором является семейство протеин киназа С (РКС), по крайней мере, из 10 скрин/треонин киниз, которые участвуют во многих клеточных процессах (Dempsey et al., 2000). PKC активность важна , т.к. превентивный эффект инозитола воспроизводится РКС агонистами и устраняется РКС ингибиторами (Greene, Coop, 1997). Все изоформы РКС присутствуют и посвеместно экспрессируются в мышиных эмбрионах, включая
curly tail, на стадии спинальной нейруляции. Совместное применение инозитола с изоформ-специфическими ингибиторами РКС (Ron et al., 1995) выявило специфическую потребность в РКС βI и γ, тогда как PKCα, βII или ε были неважны для предупреждения NTD (Cogram et al., 2004). В конечном итоге клеточный эффект воздействия инозитола проявлялся в коррекции имеющихся дефектов пролиферации в кишечнике (Cogram et al., 2004).
Хотя причинная мутация неизвестна, но предполагается, что генетические повреждения у мышей
curly tail связаны с мутацией в локусе
grainhead-like-3 (Grhl3) , который кодирует член семейства grainhead-like транскрипционных факторов (Ting et al., 2003).
Grhl3 располагается в критическом для
curly tail регионе, 100% нулевых мутантов по
Grhl3 имеют cpina bifida с низким показателем экзэнцефалии, и мутантные гены не способны комплементировать в компаундных гетерозиготах (
Grhl3-/ct), которые обладают spina bifida. Myo-inosito;, введенный внутрибрюшинно, неспособен редуцировать показатель NTD у
Grhl3 нулевых мутантов, тогда как показатель среди потомков обработанных инозитолом
curly tail мышей снижается на 53% (Ting et al., 2003), что подтверждает более ранние находки
(Greene, Copp, 1997; Cogram et al., 2002, 2004). Как и ожидалось, ни одна из линий не отвечала на фолиевую кислоту. Предполагается, что остаточный
Grhl3 может быть необходим для предупреждения NTD с помощью инозитола у
curly tail эмбрионов, вообще-то в результате индукции экспрессии
Grhl3 после воздействия инозитола (Ting et al., 2003). Альтернативно, учитывая повышенную пенетрантность дефекта у
Grhl3 нулевых мышей по сравнению с
curly tail(100% spina bifida по сравнению с 12%) и дозовую реакцию эффекта инозитола (Greene, Copp, 1997; Cogram et al., 2002) м. понять, почему отсутствие защитного эффекта у нулевых мышей обусловлено повышенной тяжестью лежащего в основе дефекта. Обработка
Grhl3-/ct гетерозигот инозитолом является прекрасным тестом для этой идеи. Предыдущие исследования
curly tail показали повышенную эффективность постоянного дозирования с использованием подкожных осмотических насосов, и
chiro-inositol по сравнению с
myo-inositol (Cogram et al., 2002). Эффект этого терапевтического подхода еще не проверен на
Grhl3 нулевых мышах.
Inositol deficiency Models Indicate a requirement for Inositol in Cranial Neurulation
Т.к. предупреждение спинальных NTD у curly tail нуждается в применении экзогенного инозитола, то нормальный процесс закрытия краниальной части нервной трубки также зависит от инозитола, т.к. дефицит инозитола может вызывать экзэнцефалию, даже не у мутантных линий (Cockroft et al., 1992). Мышиные эмбрионы, культивируемые в сыворотке крыс, содержащей определенные уровни индивидуальных витаминов часто дают экзэнцефалию, если инозитол отсутствует, тогда как дифицит др. витаминов ( включая фолиевую кислоту) не вызывает NTD. Чувствительность к уровню инозитола варьирует в разных линиях мышей, при этом curly tail особенно чувствительны и нуждаются в более высоких уровнях инозитола для устранения эффетк недостаточности.
Недостаток инозитола влияет на индукцию NTD при гипергликемии и диабете. Гипергликемия характеризуется высоким показателем NTD у культивируемых мышиных эмбрионов (Sadler, 1980) и может вность вклад в повышение показателей вноженных уродств (включая и NTD), ассоциированных с диабетом mellitus у матерей, хотя относительная важность разных метаболических нарушений при диабетическом состоянии ещё не решена (Buchanan et al., 1994). У эмбрионов крыс гипергликемия вызывает деплецию инозитола (Hod et al., 1986, 1990; Hashimoto et al., 1990; Khandelwal et al., 1998) и истощает внутриклеточный пул инозитол фосфолипидов и инозитол фосфтов (Strieleman, Metziger, 1993). Метаболизм diacylglycerol, генерируемого на пути инозитол фосфолипидов, продуцирует arachidonic кислоту, главный предшественник, ведущий к синтезу членов семейства eicosanid, которое включает простагландины, лейкотриены, липоксины и тромбоксаны. Снижение активности цикла инозитол фосфолипидов д. приводить к функциональному недостатку arachidonic кислоты, которая вносит вклад в формирование NTD. Arachidonic кислота, подобно инозитолу, обладает защитным действием in vitro у мышей, моделирующих гипергликемию ( а также при диабете у крыс, индуцированным streptozotocin) (Goldman et al., 1985; Pinter et al., 1986). Нижестоящие простагландины, PGE2, cPGI2 и PGF2, также обеспечивают в разной степени защиту против краниальных NTD. Более того, indomethacin, ингибитор метаболизма arachidonic кислоты обращает эффект инозитола (Baker et al., 1990; Goto et al., 1992).
Действие arachidonic кислоты по предупреждению NTD ограничивается мышиным моделям гипергликемии. У культивируемых мышиных эмбрионов diphenylhydantoin (DPH) вызывает NTD, а также задержку роста и черепно-лицевые аномалии. Совместное применение arachidinic кислоты существенно редуцирует частоту DPH-индуцированных аномалий, включая NTD (Bruckner et al., 1983; Kay et al., 1988). Т.о., разные тератогеном индуцированные мышиные модели NTD указывают на то, что интактный метаболизм arachidinic кислоты существенен для закрытия краниальной части нервной трубки.
DISCUSSION
В нескольких разных мышиных моделях NTD, включая и генетические и индуцированные тератогенами модели, имеются доказательства защитного эффекта экзогенных агентов. Так как у людей фолиевая кислота обладает защитным эффектом при некоторых типах NTD? тогда как в др. случаях NTD, по-видимому, резистентный к терапии фолиевой кислотой. Фолиевая кислота может действовать в некоторых случаях, преодолевая генетически детерминированный или индуцированный тератогеном дефект в метаболизме фолата или недостаточность в потреблении клетками фолата. Механистическая связь между метаболизмом фолата и нормализацией дефектов закрытия нервной трубки ещё не установлена, но она связана со стимуляцией клеточной пролиферации, снабжением запасами метионина или удалением избытка гомоцистеина, хотя последнее вряд ли. Метионин сам по себе может действовать как защитный агент при реагирующих на фолат NTD (напр., VPA-индуцированные) или резистентные к фолату NTD (напр., axial dedects), но может также усиливать дефекты в др. моделях (напр., splotch2H ).
У мышей инозитол также оказался эффективным в предупреждении NTD, у мутантов curly tail и у немутантных линий, экспозированных диабетическими условиями или инозитол-дефицитом. Дает ли предупреждение NTD инозитолом указания на потенциальные подходы к будущему уменьшению показателей NTD у людей? В настоящее время вклад дефектных аллелей Grhl3 (кандидата на роль гена curly tail) в ТЕВ у людей неизвестен. Следовательно, несмотря на многие параллели между NTD у людей и curly tail, необходимо протестировать множество мутантных линий в отношении чувствительности к инозитолу, чтобы оценить возможный спектр поддающихся лечению NTD. Наблюдение защитного эффекта при гипергликемии/диабете указывает на то, что инозитол может на самом деле служить средством предупреждения широкого круга NTD/ Более того, материнский диабет является установленным фактором риска для ТЕВ у людей (Holms, 1994). Недавние исследования у людей по сранению уровня myo-inoditol в сыворотке матерей, которые имели нормальные беременности с матерями детей с spina bifida? подтвердили идею, что статус инозитола может вность вклад в чувствительность к NTD. Хотя имеется лишь незначительная редукция в среднем уровне инозитола это сопровождается 2.6-кратным увеличением риска уродств у детей у матерей с уровнями инозитола на низком уровне (10th centile) шкалы (Groenen et al., 2003). Возможная терапевтическая роль инозитола у людей при беременности не были протестирована в клинических испытаниях. Однако, он проходил клинические испытания у людей с психиатрическими нарушениями, инозитол оказался переносимым в высоких дозах и не выявлено патологических эффектов у обработанных плодов мышей
(Benjamin et al., 1995; Levinw et al., 1995; Cogram et al., 2002).
In summary, mouse models of NTD provide a means to investigate possible approaches for primary preventive therapies. Key areas for research include determination of the mechanism of action of folic acid, a known protective agent in humans, and identification of potential approaches to optimize folic acid therapy Given the apparently complex genetics of human NTD, and the differing response of various mouse models of NTD to a range of preventive agents, it is possible that folic acid alone may not be the most effective preventive treatment. A broad-based therapy involving folic acid in combination with other agents, such as inositol, may allow prevention of a greater proportion of NTD than is currently possible.
Сайт создан в системе
uCoz  Figure 1. Summary of proposed mechanisms for prevention of neural tube defects (NTD) by inositol. Exogenous inositol enters the inositol phospholipid cycle and is incorporated into inositol phospholipids, including phosphatidylinositol diphosphate (PIP2). Hydrolysis of PIP2 generates IP3 and DAG which are both downstream signaling molecules. Protein kinase C (PKC) isoforms are activated by DAG and the subsequent phosphorylation of specific substrates results in the downstream correction of the proliferation defect that causes spinal NTD in curly tail embryos, thereby normalizing closure. Arachidonic add, is a product of DAG metabolism that may be required for cranial neurulation.
Figure 1. Summary of proposed mechanisms for prevention of neural tube defects (NTD) by inositol. Exogenous inositol enters the inositol phospholipid cycle and is incorporated into inositol phospholipids, including phosphatidylinositol diphosphate (PIP2). Hydrolysis of PIP2 generates IP3 and DAG which are both downstream signaling molecules. Protein kinase C (PKC) isoforms are activated by DAG and the subsequent phosphorylation of specific substrates results in the downstream correction of the proliferation defect that causes spinal NTD in curly tail embryos, thereby normalizing closure. Arachidonic add, is a product of DAG metabolism that may be required for cranial neurulation.