Посещений:  Синдром ломкой Х
Синдром ломкой Х
|
Brown, V. et al. Microarray identification of FMRP-associated brain mRNAs and altered mRNA translational profiles in fragile X syndrome. Cell 107, 477-487 (2001)
Darnell, J. C. et al. Fragile X mental retardation protein targets G quartet mRNAs important for neuronal function. Cell 107, 489-499 (2001)
FURTHER READING
Chelly, J. & Mandel, J.-L. Monogenic causes of X-linked mental retardation. Nature Rev. Genet. 2, 669-680 (2001) | |
Известно, что fragile X syndrome ген FMR1 кодирует РНК-связывающий белок. Предполагается, что FMR1 регулирует трансляцию, т.к. он ассоциирует с полисмной РНК. Поиск мишеней для этого белка выявил небольшой набор транкриптов - кодируемых генами, участвующими в различных аспектах функции нейронов - они наиболее вероятные кандидаты на роль транскриптов, регулируемых с помощью FMR1.
Victoria Brown, Peng Jin и др. предприняли эксперименты с двумя микромассивами. В первом, мРНК, выделенная из головного мозга мышей , сравнивалась с мРНК, которая иммунопреципитируется FMR1 антителами, с целью найти мРНК, которые связываются с FMR1. Из >25,000 скринированных генов, 432 идентифицированы, которые были обогащены в иммунопреципитатах. Во втором исследовании сравнивали полисомную РНК от fragile X и контрольных линий клеток человека. В этом эксперименте было сравнено более 35,000 генов и 251 обнаруживали существенные отличия фракций полисомных РНК от фрагильной Х и нормальной линии клеток. Частичное сравнение наборов генов показало, что 14 that идентифицируются в обоих экспериментах и м. б., следовательно, мишенями, регулируемыми с помощью FMR1.
В др. работе использовался биохимический подход. После нескольких раундов отбора из пула случайных последовательностей РНК Jennifer Darnell et al. идентифицировали молекулу РНК, которая связывается с FMR1 с высоким сродством. Затем они определили минимальную последовательность, необходимую для связывания и заключили, что FMR1 нуждается в специфической последовательности РНК, названной G quartet, который присутствует лишь в небольшом проценте транскриптов. Они тестировали 12 таких транскриптов для связывания FMR1, и нашли, что 6 из них связываются. Наличие G quartet хорошей меткой для последующего поиска.
Наиболее удовлетворительным является то, что 8 из 14 РНК, идентифицированных в первом исследовании, содержали последовательности, формирующие G quartet. Теперь внимание будет обращено на гены, которые идентифицированы в этих исследованиях.
Существенная фракция идентифицированных мРНК это такие молекулы как semaphorin 3A, potassium channel subunit Kv3.1 и microtubule-associated protein 1B, участвующие в различных аспектах физиологии и развития синапсов. И хотя пока преждевременно пытаться установить связь между этими белками и характеристиками синдрома ломкой Х хромосомы, их идентификация важная ступень в понимании наиболее частой формы умственной отсталости. Это поможет определить ключевую функцию FMR1 в регуляции трансляции специфических РНК.
| FMRP ←→ BC1
The Fragile X Syndrome Protein FMRP Associatiates with BC1 RNA and Regulates the Tramslation of Specific mRNAs at Synapses F.Zalfa, M.Giorgi, B.Primerano, A.Moro, A.Di Penta, S.Reis, B.Oostra, C.Bagni
Cell V. 112, No 2, P. 317-327, 2003 |
|
| |
FMRP является РНК связывающим белком, экспрессирующимся на высоком уровне в головном мозге. Его отсутствие или мутации FMRP ведут к синдрому ломкой Х хромосомы, Х-сцепленному доминантному нарушению, являющемуся наиболее частой причиной врожденной умственной отсталости ( 1 на 4000 мужчин и 1 на 6000 женщин). Синдром характеризуется умственной отсталостью разной тяжести, autistic поведением, macroorchidism у взрослых мужчин, характерными лицевыми признаками и разболтанностью (hyperextensible) суставов. Синдром в основном ассоциирован с нестабильной экспансией ЦГГ повторов, локализованных в 5' UTR гена fragile X mental retardation (FMR1), это ведет аномальному паттерну метилирования, что чаще всего вызывает транскрипционное молчение гена. Известны редкие случаи атипичного синдрома ломкой Х, которые не связаны с амплификацией тринуклеотидных повторов, а с делециями или одиночными точковыми мутациями.
Белок FMRP содержит несколько доменов для связывания РНК, включая два КН мотива и один RGG box. FMRP связывает РНК гомополимеры и мРНК in vitro . В частности, FMRP ассоциирует с мРНК и связывает до 4% мРНК из головного мозга плодов человека, включая мРНК myelin basic protein. Др. мРНК, которые м. ассоциировать с FMRP и которые составляют очень гетерогенное семейство, были выявлены недавно. Более того, специфическое связывание выявлено и со своей собственной мРНК в области, в области, которая м. формировать определенную структуру, называемую пуриновым квартетом. У млекопитающих имеется два гомолога FMRP, FХR1P и FХR2P, которые как полагают, выполняют отдельные. но перекрывающиеся функции. Напр., паттерн экспрессии в головном мозге и тестисах, а также субъядерное распределение в основном перекрываются, но обнаруживаются некоторые отличия. Несколько белков, как было показано, взаимодействуют с FMRP. В цитоплазме это и FХR1P и FХR2P и два белка CYFIP1 и CYFIO2, тогда как в ядре разные белки взаимодействуют с FMRP. Присутствие NLS и NES указывает на то, что FMRP м. функционировать как челнок для экпорта мРНК из ядра в цитоплазму. Имеются также указания на то, что FMRP м. модулировать стабильность и/или трансляцию этих переносимых мРНК-мишеней в клеточном теле, а также в синапсах. Во-первых, обнаружено, что FMRP ассоциирует с рибосомами в теле клетки и в дендритах. Во-вторых, мРНК человека с измененными полисомными профилями обнаруживались с помощью зондирования микромассивов, используя мРНК, выделенную из полирибосом fragile X lymphoblastoid клеточной линии человека. В-третьих, было показано, что FMRP функционирует как неспецифический репрессор трансляции in vitro и в экспериментах по ко-трансфекции. Наконец, было показано, что FMRP дрозофилы регулирует futsch, гомолог мРНК МАР1В млекопитающих, по-видимому, на уровне трансляции. Однако пока неясно, как работает трансляционая регуляция с помощью FMRP и обладает ли она избирательностью к определенным мРНК in vivo.
Здесь, используя FMR1 нокаутных (КО) мышей, мы показали? что FMRP является репрессором трансляции in vivo и регулирует трансляцию специфических мРНК в дендритах, включая те, что кодируют цитоскелетные белки Arc/Arg3 и МАР1В и α-CaMKII. FMRP обнаруживается в рибонуклеопротеиновм комплексе, который кроме того содержит малые дендритыне не-транслируемые РНК ВС1. ВС1 связана непосредственно с FMRP и м. также ассоциировать специфически с мРНК, регулируемые с помощью FMRP. Эти результаты строго подтверждают, что ВС1 РНК рекрутирует FMRP на мРНК-мишени, тем самым предопределяет специфичность действия FMRP
Получены доказательства, что FMRP м. предупреждать образование иниационных комплексов. Согласно представленной модели ВС1 РНК предопределяет специфичность репрессии (Рис. 7). ВС1, нетранслируемая РНК является частью RNP головного мозга. Специфическая локализация ВС1 РНК м. указывать на функциональную роль, связанную с процессами трансляции в соматодендритных компартментах нейронов. Часть ВС1 РНК, ID область, происходит из tRNA Ala, которая была привлечена или адаптирована для выполненеия новой функции. Следовательно, очевидно, что ВС1 РНК м. взаимодействовать с рибосомами и м. участвовать в регуляции синтеза белка. Более того, ткане-специфическая экспрессия ВС1-подобной РНК законсервирована у видов млекопитающих, значительно отстоящих эволюционно, это указывает на то, что эти РНК выполняют важные клеточные функции.
| | |
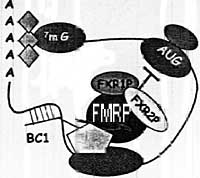 Модель предполагает прямое взаимодействие между ВС1 РНК и целенаправленно регулрируемыми мРНК. FMRP RNP подводится к инициирующему кодну и блокирует трансляцию. Ромбики представляют собой Поли(А)связывающий белок, необзначенные фигуры представляют неизветных партнеров FMRP белка Модель предполагает прямое взаимодействие между ВС1 РНК и целенаправленно регулрируемыми мРНК. FMRP RNP подводится к инициирующему кодну и блокирует трансляцию. Ромбики представляют собой Поли(А)связывающий белок, необзначенные фигуры представляют неизветных партнеров FMRP белка
|
|
BC1 РНК ко-фракционируется в значительной степени с фракцией полисом в отсутствие FMRP белка. Это обнаруживается только на препаратах синаптосом, это связывает ВС1 РНК с регуляцией FMRP в синапах. Показано также, что ВС1 РНК копреципитируется с FMRP белком и что она м. непосредственно связываться с FMRP, устанавливая физическую cdapm между двумя молекулами. Эта ассоциации, по-видимому, довольно прочная, т.к сохраняется при иммунопреципитации при stringet концентрации солей и в экспериментах band shift. Итак, ВС1 РНК связывает FMRP и ассоциирует ч мРНК, сводя их вместе. Т.о., ВС1 м.б. ответсвенной за таргетинг FMRP на мРНК, которые он регулирует. Т.к. FMRP ингибирует трансляцию, как полагают, на ступени инициации, то эта модель предсказывает, что только минораная фракция ВС1 ко-ассоциирует с активно транслирующими рибосамами и что эта фракция д. существенно увеличиваться, когда FMRP, а значит и блок трансляции, устраняются. И это действительно так, Во-вторых, модель предсказывает, что ВС1 РНК должна соединяться с этими мРНК, регулируемыми с помощью FMRP. Мы нашли значительные участки комплементарности между ВС1 РНК и МАР1В, α-CamKII и Arc мРНК, а области эти локализованы на длинной stem петле ВС1 РНК. Продемонстрировано взаимодействие ВС1/мРНК с использованием РНК oligos. Только ВС1 stem петля 1 необходима для взаимодействия с анализируемыми нейрональными мРНК. Интересно отметить, что ВС1 stem петля 1 необходима для локализации ВС1 в дендритах. Наконец, было показано, что ассоциация между ВС1 РНК и FMRP-регулируемыми мРНК м. происходить it; в отсутствие любого белка. Связываение высоко специфично.
Недавно было показано, что ВС1 РНК м. репрессировать трансляцию. Эта информация подтверждает роль комплекса FMRP-ВС1 в репрессии трансляции синаптических мРНК.
Потенциальным аналогом ВС1 у приматов является ВС200 РНК. Распределение человеческой ВС200 РНК выявляет нейрон-специфическую экспрессию и локализацию в дендритах, что подтверждает её роль в дендритном транспорте РНК и/или трансляции. Подобно ВС1 ВС200 РНК м.б. подразделена на 3 струкитурных домена: повторяющийся элемент, центральная область и уникальная областью Вторичная структура выявляет высокую структурную гомологию с ВС1 РНК и выявляется строгая комплементарность между ВС200 и человеческими Arc, α-CaMKII и МАР1В мРНК. Показано, что ВС200 также способна формировать комплекс с FMRP в нейральных опухолевых клетках, так что очень возможно, что две ВС РНК имеют одно и то же функциональное значение.
Мы предполагаем, что специфичность FMRP трансляционной репрессии определяется благодаря взаимодействиям спаривания оснований ВС1 РНК. В этой модели один из РНК свфзывающих доменов FMRP чкорее всего отвечает за связывание ВС1 (Рис. 7). Согдасно др. модели FMRP соединяется непосредствнено со соими мРНК-мишенями. В частности, было показано, что, что FMRP связывается in vitro с мРНК, которые м. образовывать П quartet структуры. Мы полагаем, что оба способа м. проявляться в клетках, возможно связанные с разными функциями, напр., трансляцией и транспортом мрНК. Это находит подтверждение.
Паталогия в головном мозге как у пациентов FRAXA, так и нокаутных FMR1 мышей, по-видимому, ограничена аномалиями дендритных отростков (spines). Т.к. локальный белковый синтез необходим для образования и функционирования синапсов, а репрессиваня роль FMRP скорее всего лежит в основе поведенческих и онтогенетических симптомов у пациентов FRAXA. Тот факт, что деплеция FMRP не вызывает летального эффекта указывает на то, что FMRP является регулятором только субнабора мРНК, чья трансляция происходит в дендритах.
Сайт создан в системе
uCoz Модель предполагает прямое взаимодействие между ВС1 РНК и целенаправленно регулрируемыми мРНК. FMRP RNP подводится к инициирующему кодну и блокирует трансляцию. Ромбики представляют собой Поли(А)связывающий белок, необзначенные фигуры представляют неизветных партнеров FMRP белка
Модель предполагает прямое взаимодействие между ВС1 РНК и целенаправленно регулрируемыми мРНК. FMRP RNP подводится к инициирующему кодну и блокирует трансляцию. Ромбики представляют собой Поли(А)связывающий белок, необзначенные фигуры представляют неизветных партнеров FMRP белка