В работе Farooqi et al. рассмотрен клинический спектр мутаций в MC4R, характер наследования и корреляции между генотипом и фенотипом у 500 неродственных пробандов с тяжелой детской тучностью. Они выявили 21 мутацию у 29 из 500 пробандов (5.8%). Функциональный анализ мутантных рецепторов показал, что все мутации сдвига рамки считывания и часть миссенс мутаций приводят к полной потере функции, но некоторые миссенс мутации кодируют рецепторы с остаточной активностью. Субъекты с мутациями потери функции были более тучными.
MC4R мутации, идентифицированные у гетерозиготных пробандов с ранним началом тучности были полностью пенетрантными, гетерозиготы менее тучные, чем гомозиготные родственники. Это указывает на то, что ожирение, обусловленное мутациями MC4R ассоциировано с ко-доминатным способом наследования, это верно и для мышей.
Сравнение стандартных отклонений среднего body mass index (BMI) у 42 гетерозиготных и 9 гомозиготных субъектов показало, что в первый год жизни он выше на 80%. Ещё большим стандартное отклонение было по высоте детей с дефицитом MC4R. Увеличение массы тела было более высоким у MC4R-гомозигот по сравнению с носителями мутации. Драматичным было 3-кратное увеличение потребления энергии было у носителей мутации MC4R и их незатронутыми братьями-сестрами. Дети в возрасте 11-15 лет были менее гиперфагичными и ели меньше.
Эти наблюдения позволили сделать исследователям вывод, что ко-доминантно наследуемые мутации MC4R вызывают тяжелую тучность с ранним началом, гиперфагию, повышенную массу (исключая жир), повышенный линейный рост и тяжелую гиперинсулинемию.
Сайт создан в системе
uCoz


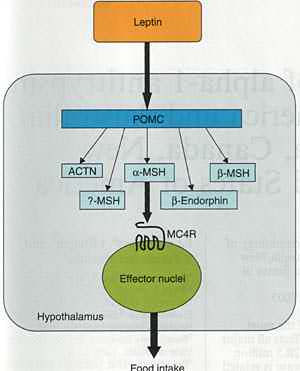 Упрощенная схема меланокортинергического пути. Лептинjv регулируемый pro-opiomelanocortin (POMC) расщепляется на нейропептиды adrenocorticotropin (ACTN), β-endorphin и α-, β- и γ-melanocyte-stimulating hormones (MSHs) в гипоталямусе. α-MSH действует на рецептор melanocortin-4, чтобы индуцировать снижение потребления пищи.
Упрощенная схема меланокортинергического пути. Лептинjv регулируемый pro-opiomelanocortin (POMC) расщепляется на нейропептиды adrenocorticotropin (ACTN), β-endorphin и α-, β- и γ-melanocyte-stimulating hormones (MSHs) в гипоталямусе. α-MSH действует на рецептор melanocortin-4, чтобы индуцировать снижение потребления пищи.