Пользователи: 
АТЕРОСКЛЕРОЗ
Роль оси ImP–I1R
Imidazole propionate is a driver and therapeutic target in atherosclerosis Annalaura Mastrangelo, Iсaki Robles-Vera, Diego Maсanes, et al.
 Nature volume 645, pages254–261 (2025)
|
Atherosclerosis is the main underlying cause of cardiovascular diseases. Its prevention is based on the detection and treatment of traditional cardiovascular risk factors1. However, individuals at risk for early vascular disease often remain unidentified2. Recent research has identified new molecules in the pathophysiology of atherosclerosis3, highlighting the need for alternative disease biomarkers and therapeutic targets to improve early diagnosis and therapy efficacy. Here, we observed that imidazole propionate (ImP), produced by microorganisms, is associated with the extent of atherosclerosis in mice and in two independent human cohorts. Furthermore, ImP administration to atherosclerosis-prone mice fed with chow diet was sufficient to induce atherosclerosis without altering the lipid profile, and was linked to activation of both systemic and local innate and adaptive immunity and inflammation. Specifically, we found that ImP caused atherosclerosis through the imidazoline-1 receptor (I1R, also known as nischarin) in myeloid cells. Blocking this ImP–I1R axis inhibited the development of atherosclerosis induced by ImP or high-cholesterol diet in mice. Identification of the strong association of ImP with active atherosclerosis and the contribution of the ImP–I1R axis to disease progression opens new avenues for improving the early diagnosis and personalized therapy of atherosclerosis.

|
Сердечно-сосудистые заболевания (CVD) являются ведущей причиной смертности во всем мире, причем атеросклероз является их основной детерминантой. Несмотря на достижения в области профилактики и терапии, рост заболеваемости и смертности, связанных с CVD подчеркивает необходимость раннего вмешательства в отношении, казалось бы, здоровых групп населения. Атеросклероз - это сложное многофакторное заболевание, профилактика которого основана на традиционных оценках, основанных на факторах сердечно-сосудистого риска1, которые не выявляют лиц, подверженных риску развития атеросклеротического поражения сосудов на ранних стадиях2. Более того, основные фармакологические вмешательства связаны с установленными факторами риска (липидный метаболизм4 и недавно возникшее воспаление5,6). Это подчеркивает необходимость изучения методов лечения, нацеленных на другие факторы патофизиологии атеросклероза3, особенно для пациентов, которые, несмотря на оптимальное лечение, все еще имеют значительный остаточный сердечно-сосудистый риск6-8.
Перекрестные помехи между метаболизмом микробиоты и хозяина способствуют развитию CVD9-11. Однако было описано лишь несколько метаболитов, зависящих от микробиоты кишечника, которые коррелируют с поздними стадиями заболевания 11,12. Мы стремились идентифицировать микробные метаболиты, связанные с ранними стадиями атеросклеротического заболевания сосудов, которые могли бы способствовать прогрессированию атеросклероза.
Untargeted metabolomics links ImP to atherosclerosis in mice
Для скрининга микробных метаболитов, которые могут влиять на прогрессирование атеросклероза, мы кормили склонных к атеросклерозу мышей Apoe-/- различными диетами с лечением антибиотиками или без него, чтобы истощить микробиоту 13 (Расширенные данные Рис. 1а). Диета с высоким содержанием холестерина (HC) вызывала атеросклероз, который был частично предотвращен при лечении антибиотиками с помощью HC-диеты, дополненной холином (HC/ HC) (рис. 1а). Нецелевая метаболомика показала существенное изменение метаболома плазмы (рис. 1b, c), связанное с изменением состава кишечной микробиоты (рис. 1d, e и Расширенные данные Рис. 1b). 1b) после соблюдения диеты и приема антибиотиков. Во-первых, мы подтвердили метаболомику, продемонстрировав, что совместный метаболит микроорганизма-хозяина, N-оксид триметиламина (TMAO), индуцировался добавлением пищевого холина и ассоциировался с атеросклерозом, зависимым от микробиоты образом 14 (Расширенные данные Рис. 1c, d). Примечательно, что мы идентифицировали ImP, метаболит, зависящий от микробиоты 15, который в значительной степени ассоциирован с атеросклерозом при употреблении HC (рис. 1f, g и Расширенные данные Рис. 1e). Концентрация ImP в плазме крови также была связана с изменениями микробной экологии кишечника после диетического вмешательства, особенно с относительным обогащением кишечника Escherichia и Shigella или Eubacterium (рис. 1н). Однако идентификация специфических штаммов, способных продуцировать ImP, требует дальнейшего исследования.
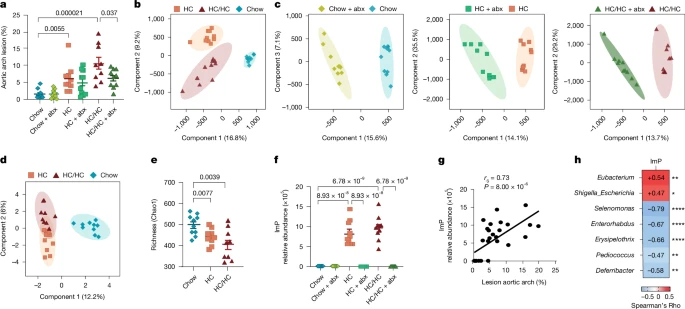 Fig. 1: Untargeted metabolomics unveils ImP as a microbiota-dependent metabolite that is associated with atherosclerosis. Fig. 1: Untargeted metabolomics unveils ImP as a microbiota-dependent metabolite that is associated with atherosclerosis.
Apoe-/- mice were fed chow, HC diet or HC/HC diet with or without antibiotics (abx) in the drinking water. a, Quantification of atherosclerotic plaque lesion size in the aortic arch by Oil red O staining. Each point represents an individual mouse (n = 10 per group for all conditions, except chow-fed mice administered antibiotics and HC/HC-fed mice, n = 9). b–d, Score plots of partial least squares discriminant analysis (PLS-DA) performed on liquid chromatography–mass spectrometry (LC–MS) data of plasma samples collected at endpoint (euthanasia) (n = 10 per group) for the three diets (b) and the three diets with antibiotics (c) and 16S rDNA sequencing analysis of caecal samples collected at endpoint (chow, HC, n = 10; HC/HC, n = 9) (d). e, Chao1 richness analysis of microbiota diversity. f,g, ImP relative abundance in plasma from Apoe-/- male mice at endpoint measured by untargeted LC–MS (f) and correlation with aortic arch lesion (g). h, Correlation matrix showing the correlation between ImP and gut microbiota genera (>0.1% of total abundance) in caecal samples from Apoe-/- mice fed chow, HC or HC/HC diets for 8 weeks. Data are pooled from two independent experiments (chow, HC, n = 10; HC/HC, n = 9). g,h, Correlation coefficient (rs) and P values are calculated by Spearman’s rank-order correlation test. a,e,f, Individual data and arithmetic mean ± s.e.m. of each group are shown. Two-sided one-way ANOVA with Tukey post hoc correction. *P < 0.05, **P < 0.01, ****P < 0.0001.
ImP is linked to subclinical atherosclerosis in humans
Далее мы попытались выяснить, связана ли повышенная концентрация ImP в плазме крови также с атеросклерозом у людей. Мы набрали 400 добровольцев с бессимптомным течением атеросклероза из проспективного когортного исследования "Прогрессирование раннего субклинического атеросклероза" (PESA) Национального исследовательского центра сердечно-сосудистых заболеваний (CNIC) Сантандера (далее - PESA) 2 (Дополнительная таблица 1a,b). На основе мультитерриториальной и мультимодальной визуализации (2D или 3D ультразвуковое исследование сосудов и неконтрастная компьютерная томография) мы классифицировали 295 пациентов с субклиническим атеросклерозом и 105 пациентов контрольной группы без атеросклероза. Степень атеросклероза определяли в соответствии с количеством пораженных участков сосудов и показателем кальция в коронарных артериях (CAC). Для количественного определения ImP и связанных с ним метаболитов (гистидина и урокановой кислоты) 15 в образцах плазмы использовали целевую метаболомику. Концентрации ImP в плазме крови, но не гистидина или урокановой кислоты, были избирательно повышены у лиц с субклиническим атеросклерозом по сравнению с контрольной группой (рис. 2а и расширенные данные рис. 2а). Наблюдались линейные и нелинейные связи между концентрациями ImP и атеросклерозом и степенью выраженности атеросклероза соответственно (рис. 2b). Впоследствии ImP был измерен в независимой группе пациентов с нарушенной толерантностью к глюкозе (IGT) (дополнительная таблица 2a,b), включавшей бессимптомных добровольцев, в том числе 529 человек контрольной группы и 1315 человек с субклиническим атеросклерозом16. Примечательно, что была подтверждена связь между ImP и ранним атеросклерозом (рис. 2с, d и расширенные данные рис. 2а).
 . Fig. 2: ImP is associated with subclinical atherosclerosis in humans. a,c, Plasma ImP in healthy individuals (Ctrl) and individuals with subclinical atherosclerosis (AT) from the PESA (a; Ctrl, n = 105; AT, n = 295) and IGT (c; Ctrl, n = 529; AT, n = 1,315) cohorts. b,d, Dose–response curves of plasma ImP concentration and endpoints in the PESA (b) and IGT (d) cohorts. e,f, Spearman correlation matrices between ImP and atherosclerosis traits, diet and microbiota in the PESA (e) and IGT (f) cohorts. Benjamini–Hochberg adjusted P values. ALT, alanine aminotransferase; AST, aspartate aminotransferase; BM, bone marrow; ECO2D, 2D vascular ultrasound; ECO3D, 3D vascular ultrasound; F, familial; GFR, glomerular filtration rate; GGT, gamma-glutamyl transferase; HTN, hypertension. g, Adjusted regression models for the association of ImP with atherosclerosis (left) and extent of atherosclerosis (right) in the PESA (top, n = 400) and IGT (bottom, n = 1,844) cohorts. Effect estimates were controlled for age, sex, smoking, creatinine, family history of CVD, haemoglobin, hypertension and LDL-C (PESA cohort) and age, smoking, family history of CVD, hypertension, LDL-C, Hb1Ac, hs-CRP and ALT (IGT cohort). Error bars show 95% confidence intervals. OR, odds ratio. h,j, Plasma ImP in individuals with inactive atherosclerosis (FDG-, n = 74) and active atherosclerosis (FDG+, n = 221) (h). FDG+ individuals were further stratified according to vascular inflammation (arterial 18F-FDG uptake, FDG+_A, n = 57), bone marrow activation (18F-FDG uptake in bone marrow, FDG+_BM, n = 40) and systemic inflammation (concurrent arterial and bone marrow 18F-FDG uptake, FDG+_SYS, n = 124) (j). FDG– refers to the group of inactive atherosclerosis. a,c,h,j, Horizontal line represents median and error bars show interquartile range (Supplementary Tables 1a, 2a and 4). Two-tailed Mann–Whitney U-test. i, Dose–response curve for plasma ImP effect on active atherosclerosis for the PESA cohort. b,d,i, Dashed lines represent the 95% confidence interval; vertical lines delineate tertiles. k, Multinomial logistic regression for subclinical atherosclerosis in the atherosclerosis subgroups (FDG+_SYS, FDG+_BM, FDG+_A and FDG-) versus controls according to plasma ImP. Odds ratio was adjusted for age, sex, smoking, glucose, hs-CRP and haemoglobin concentration. g,k, Whiskers indicate 95% confidence intervals (values in Supplementary Tables 3 and 5). ***P < 0.001.
Далее мы изучили связь между ImP, особенностями рациона питания и составом микробиоты. Среди пяти основных рационов питания, полученных на основе анализа главных компонентов (PCA) в когорте PESA (расширенные данные, рис. 2b), ImP обратно коррелировал с Breakfast1 и средиземноморской диетой (рис. 2e), что согласуется с предыдущими выводами17. Секвенирование образцов фекалий с использованием 16S-рибосомной ДНК (рДНК) выявило прямую корреляцию ImP с относительной распространенностью Veillonella и Acidaminococcus и обратную корреляцию с семействами Erysipelotrichaceae и Coriobacteriaceae (рис. 2е), которые изменяются у лиц с CVD18,19.
Затем мы исследовали связь между уровнем ImP в плазме крови и установленными факторами риска сердечно-сосудистых заболеваний. В обеих группах ImP напрямую коррелировал с уровнем глюкозы натощак и неблагоприятным кардиометаболическим профилем, включая повышение уровня высокочувствительного С-реактивного белка (hs-CRP), индекса массы тела (ИМТ), висцерального жира, дислипидемии и артериальной гипертензии, а также снижение уровня холестерина липопротеидов высокой плотности (ЛПВП) (рис. 2е).,f и дополнительные таблицы 1b и 2b). Распространенность конечных точек атеросклероза и оценка CAC также увеличивались по возрастающим показателям (дополнительные таблицы 1b и 2b). После корректировки на традиционные факторы риска в обеих когортах более высокие уровни ImP были независимо связаны с основными исходами атеросклероза (рис. 2g и дополнительная таблица 3), что позволяет предположить, что высокие уровни ImP являются показателем повышенного риска атеросклероза. Следует отметить, что ImP также продемонстрировал аддитивную ценность при добавлении к установленным биомаркерам атеросклероза, полученным из крови, таким как холестерин липопротеин низкой плотности (LDL) и hs-CRP, для определения распространенности атеросклероза в обеих когортах (расширенные данные, рис. 2c,d).
В когорте PESA лица с субклиническим атеросклерозом были дополнительно классифицированы по поглощению 18F-фтордезоксиглюкозы (18F-FDG) в артериях и/или активации костного мозга у лиц с метаболически активным атеросклерозом (FDG+) или без него (FDG+)20,21. Повышенная концентрация ImP в плазме крови наблюдалась в группе FDG+, что имело нелинейную связь с исходом (рис. 2h, i). Дальнейшая стратификация по поглощению 18F-FDG (расширенные данные на рис. 2h, i). 2e и дополнительная таблица 4) выявили более высокую концентрацию ImP в плазме крови в подгруппах активации костного мозга (FDG+_BM) и системного воспаления (FDG+_SYS; рис. 2j). Примечательно, что после корректировки на общепринятые факторы риска связь между ImP и повышенным риском оставалась значимой во всех подгруппах метаболически активного FDG+ атеросклероза (рис. 2к и дополнительная таблица 5). Кроме того, ImP продемонстрировал аддитивную способность к распознаванию активного атеросклероза по сравнению только с холестерином LDL и hs-CRP (расширенные данные, рис. 2c,d). Эти данные свидетельствуют о тесной связи между ImP и атеросклерозом, особенно активным атеросклерозом, что позволяет предположить его потенциальное использование в качестве индикатора раннего активного атеросклероза до того, как другие сопутствующие заболевания станут осложняющими факторами.
ImP causes atherosclerosis without cholesterol change
Для дальнейшего изучения влияния лекарственного препарата на течение атеросклероза и чтобы определить, является ли это причинно-следственной связью, способствовали ли развитию на ранних стадиях заболевания, то назначают ImP в питьевой воде. Атеросклерозу подвержены мыши, в том числе chow-fed Ldlr-/- мыши, на которых мы воздействовали ImP в течение 12 недель (фиг. 3А и расширенные данные, рис. 3а,б) и chow-fed Apoe-/- и мыши, на которых мы воздействовали с ImP в течение 8 недель (рис. 3B и расширенные данные, рис. 3В–е). В обеих моделях добавление ImP увеличивало развитие атеросклероза в аорте и корне аорты, не влияя на концентрацию циркулирующего холестерина или глюкозы (рис. 3a,b и расширенные данные на рис. 3a–e). Кормление только углеводным рационом вызывало выработку ImP (рис. 1f). Дополнительная добавка ImP существенно не усугубляла атеросклероз у мышей Apoe-/- получавших HC, хотя это еще больше увеличивало атеросклеротические поражения у мышей Ldlr-/- (расширенные данные, рис. 3f, g). Таким образом, чтобы создать модель атеросклероза, напрямую зависящую от ImP, для последующих исследований, мы вводили ImP исключительно chow-fed мышам. Примечательно, что у мышей Apoe-/-, получавших ImP в течение восьми недель, наблюдалось увеличение количества провоспалительных моноцитов Ly6C hi и клеток T-хелперов 1 T H1 и T-хелперов 17 (T H17) (рис. 3c, d и фиг. с расширенными данными). 4а) в крови, которые связаны с проатерогенной средой 22.
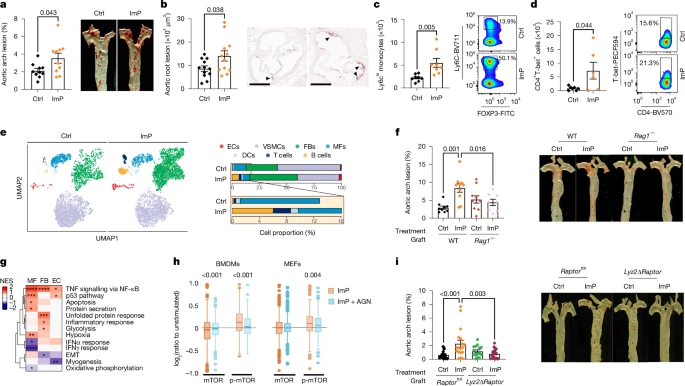 Fig. 3: Increased circulating ImP induces atherosclerosis and systemic inflammation in chow-fed atherosclerosis-prone mice. Fig. 3: Increased circulating ImP induces atherosclerosis and systemic inflammation in chow-fed atherosclerosis-prone mice. a, ImP was administered (ImP) or not (Ctrl) to chow-fed Ldlr-/- mice. Oil red O staining of aortic arch (left, n = 10) and representative images of aorta (right). b–e, ImP was administered (ImP) or not (Ctrl) to Apoe-/- mice. b, Quantification (left) and representative images (right) of Oil red O staining of aortic root lesions. n = 12. Arrowheads indicate areas with positive Oil red O staining. Scale bars, 500 µm. c,d, Flow cytometry analysis of Ly6Chi monocytes (n = 8) (c) and T-bet in CD4+ T cells (n = 6) (d) in blood at endpoint. Right, representative density plots for Ctrl and ImP. e, Uniform manifold approximation and projection (UMAP) embedding (left) and cell proportions (right) labelled by cell type of cells derived from whole aorta, based on transcriptomic profiles. DCs, dendritic cells; ECs, endothelial cells; FBs, fibroblasts; MFs, macrophages; VSMCs, vascular smooth muscle cells. f, Ldlr-/- mice grafted with bone marrow from wild-type (WT) (Ctrl, n = 9; ImP, n = 10) or Rag1-/- (Ctrl, n = 10; ImP, n = 8). Atherosclerosis by Oil red O staining of aortic arch (left) and representative images of aorta (right). g, Heat map of GSEA comparing ImP versus control for endothelial cells, fibroblasts and macrophages from scRNA-seq data of Apoe-/- mice fed chow diet for 4 weeks. EMT, epithelial–mesenchymal transition; NES, normalized enrichment score. h, Global abundance of peptides (mTOR) and phosphopeptides (p-mTOR) in BMDMs (left) or MEFs (right) treated with ImP for 3 h with or without AGN192403 (AGN). The log2 ratio is relative to unstimulated conditions. i, Ldlr-/- mice grafted with bone marrow from control Raptorfl/fl (Ctrl, n = 17; ImP, n = 18) or Lyz2?Raptor (Ctrl, n = 15; ImP, n = 18). Quantification (left) and representative images (i) of Oil red O staining of aorta, showing atherosclerosis in aortic arch. a–d,f,i, Individual data points and mean ± s.e.m. of at least two pooled independent experiments. a–d, Two-tailed unpaired Student’s t-test. f,i, One-way ANOVA with Tukey post hoc correction. g, Two-tailed Kolmogorov–Smirnov test comparing ImP versus unstimulated. h, Two-tailed Wilcoxon signed rank test comparing peptide and phosphopeptide abundance in ImP versus ImP plus AGN treatments.
Чтобы лучше понять специфические изменения, индуцированные ImP в аорте, мы выполнили анализ всей аорты методом одноклеточного РНК-секвенирования (scRNA-seq) от мышей chow-fed Apoe-/-, которым вводили ImP в течение четырех или восьми недель (Расширенные данные, рис. 1). 4b–e). Мыши, получавшие ImP в течение четырех недель, показали умеренное увеличение атеросклероза дуги аорты (Расширенные данные, рис. 4f) и некоторые локальные изменения частоты клеточной популяции в аорте (Расширенные данные, рис. 4e), без изменений в циркулирующих иммунных клетках (Расширенные данные, рис. 4g, h). Напротив, scRNA-seq аорт мышей, получавших ImP в течение восьми недель, выявил увеличение относительного количества фибробластов, эндотелиальных клеток и иммунных клеток (рис. 3e). Увеличенное количество иммунных клеток в аорте было подтверждено анализом проточной цитометрии (Расширенные данные на рис. 4i) и гистологический анализ корня аорты, который показал повышенную инфильтрацию Т–клетками в слое интима-медиа и повышенное окрашивание MAC2 воспалительными макрофагами в атеромной бляшке мышей, получавших ImP, по сравнению с контролем (Расширенные данные, рис. 4j,k). Примечательно, что способность ImP индуцировать атеросклероз была заметно снижена у мышей с Ldlr-/- с трансплантацией Rag1-/- костного мозга, в котором отсутствуют Т- и В-клетки (рис. 3f и Расширенные данные, рис. 4l). Эти данные идентифицируют ImP как новый фактор, влияющий на этиологию атеросклероза у мышей, склонных к атеросклерозу, который связан с активацией иммунного ответа без влияния на концентрацию холестерина в крови.
In vivo ImP alters the aortic transcriptome
Для дальнейшего выделения клеточных мишеней ImP в аорте мы исследовали изменения транскрипции с помощью анализа scRNA-seq после четырех недель лечения. Анализ обогащения набора генов (GSEA) каждого типа клеток показал усиление транскрипционных путей, связанных с воспалением, в макрофагах, фибробластах и эндотелиальных клетках после лечения ImP (рис. 3g). Повторная кластеризация каждого типа клеток в независимых анализах выявила четыре субкластера макрофагов, пять фибробластов и три субкластера эндотелиальных клеток (расширенные данные Рис. 5a–c). Анализ эффекта ImP в этих субкластерах (включая данные за четыре и восемь недель) показал уменьшение кластера MF1, связанного с гомеостатическими генами23, и увеличение кластера MF3, экспрессирующего гены, связанные с метаболизмом липидов, воспалением и активацией макрофагов24-26 (Расширенные данные, рис. 5d,g). Повышенный ImP в кровообращении индуцировал расширение подмножеств FB2, FB3 и FB4 аорты, которые характеризовались экспрессией генов, связанных с реакцией на ацетилхолин, иммунным ответом и воспалением, а также организацией внеклеточного матрикса соответственно (Расширенные данные Рис. 5e,g). Наконец, подмножество EC1, в котором высоко экспрессируются гены, регулирующие функцию эндотелиальных клеток27, мезенхимальные маркеры28 и гены проангиогенеза 29-32, было обогащено в аорте после лечения ImP (Расширенные данные, рис. 5f,g).
В соответствии с этими результатами, ImP смог активировать эмбриональные фибробласты мыши in vitro (MEFs), индуцируя продукцию активного моноцитарного белка-хемоаттрактанта-1, который увеличивает набор моноцитов (Расширенные данные, рис. 5h, i), связанного с атерогенезом33. Более того, анализ РНК-секвенирования (RNA-seq) показал быструю индукцию многих воспалительных и активационных путей после введения ImP, особенно в макрофагах костномозгового происхождения (BMDMs) и в MEF, но не в эндотелиальных клетках аорты мыши (MAEC) (Расширенные данные, рис. 5j), предполагая, что макрофаги и фибробласты могут быть основными мишенями ImP. Следует отметить, что фосфопротеомный анализ показал увеличение глобального содержания фосфопептидов, принадлежащих к пути mTOR, в BMDMs и MEFs при лечении ImP (рис. 3h и Расширенные данные, рис. 5k). Эти результаты согласуются с предыдущими данными о первичных гепатоцитах15 и повышенном сигнале фосфорилирования-S6 (p-S6) (указывающем на активацию mTOR), который мы обнаружили в BMDMs и MEFs после лечения ImP (Расширенные данные Рис. 5l). Кроме того, предварительная инкубация с ингибитором mTOR, рапамицином, предотвращала индукцию продукции TNF ImP в BMDMs и MEFs (расширенные данные, рис. 5м). У мышей Apoe-/-, которых кормили chow диетой и вводили ImP в течение 8 недель, также наблюдалось повышение p-S6 в перитонеальных макрофагах (расширенные данные, рис. 5n). Примечательно, что селективная делеция Raptor34 (также известная как Rptor; связанная с регуляцией mTOR) в миелоидных клетках Ldlr-/- мышей, которым трансплантировали костный мозг от Lyz2ΔRaptor, по сравнению с контрольными пометами Raptorfl/fl предотвращала индукцию атеросклероза ImP (рис. 3i и Расширенные данные, рис. 5o). Эти данные показывают, что ImP непосредственно активирует mTOR-зависимую воспалительную реакцию в миелоидных клетках, способствуя атерогенезу.
ImP drives atherosclerosis via I1R in myeloid cells
ImP стимулирует атеросклероз через I1R в миелоидных клетках
Поскольку ImP содержит имидазольное кольцо, мы предположили, что его можно распознать с помощью повсеместно экспрессируемых имидазолиновых рецепторов I1R и I2R35. Таким образом, мы обрабатывали BMDMs и MEFs ImP в присутствии AGN192403 (антагониста I1R)36 или идазоксана (антагониста имидазолиновых рецепторов)35. Поскольку некоторые лиганды imidazoline рецепторов могут также связывать α2-адренорецепторы (например, idazoxan), мы включили yohimbine (антагонист α2-адренорецепторов с низким сродством к имидазолиновым рецепторам)35. ImP увеличивал p-S6 и индуцировал продукцию TNF в BMDMs и MEFs, и этот эффект избирательно блокировался AGN192403 (расширенные данные на рис. 6а, б). Фосфопротеомный анализ дополнительно подтвердил, что AGN192403 ингибирует активацию mTOR-пути, вызванную ImP (рис. 3h). Подавление I1R с помощью малых ингибирующих РНК (миРНК), нацеленных на Nisch в MEFs, блокировало индуцируемую ImP продукцию p-S6 и TNF, что свидетельствует о том, что ImP избирательно передает сигналы через I1R для этих воспалительных функций. Следует отметить, что AGN192403 предотвращал ImP-индуцированный p-S6 или TNF в контрольных клетках, обработанных миРНК, но не оказывал никакого эффекта на клетки, подавляющие I1R, что согласуется с избирательным действием этого ингибитора на ось ImP-I1R (расширенные данные, рис. 6c, d).
Для дальнейшего анализа функции ImP в миелоидных клетках мы скрестили мышей Lyz2-cre с мышами Nischfl/fl, чтобы получить мышей Lyz2?Nisch. Анализ экспрессии Nisch показал избирательную делецию в миелоидных клетках селезенки, в отличие от сохраненной экспрессии в CD3+ Т-клетках мышей линии Lyz2?Nisch по сравнению с контрольными мышами линии Nischfl/fl (расширенные данные, рис. 6е). Примечательно, что индуцированная ImP индукция продукции p-S6 и TNF с помощью BMDMs полностью зависела от Nisch (расширенные данные, рис. 6f, g), подтверждая, что I1R является рецептором ImP хозяина. Чтобы определить, предотвратит ли блокирование оси ImP–I1R в миелоидных клетках атерогенные эффекты ImP, мы вводили ImP мышам Ldlr-/- CD45.1, с трансплантированным костным мозгом от мышей Nischfl/fl или Lyz2ΔNisch. Отсутствие I1R в миелоидных клетках предотвращало атеросклероз, вызванный ImP (рис. 4а и расширенные данные рис. 6h).
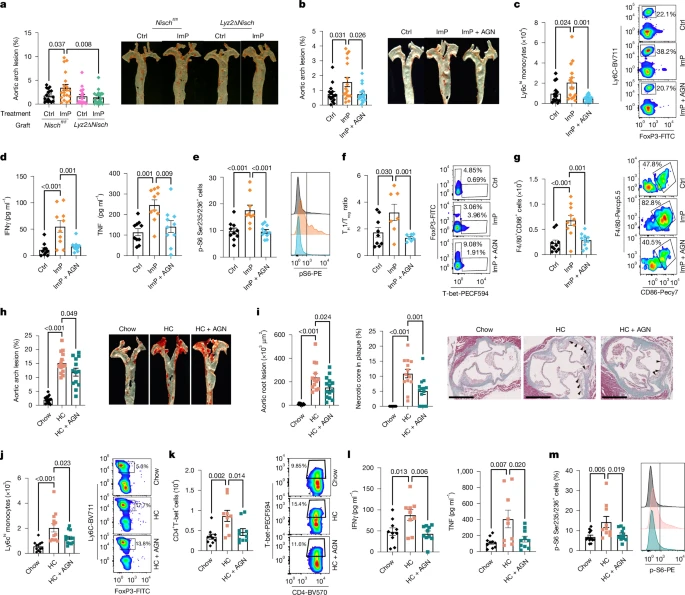 Fig. 4: Blockade of I1R prevents atherosclerosis induction by ImP or high-cholesterol diet. Fig. 4: Blockade of I1R prevents atherosclerosis induction by ImP or high-cholesterol diet. a, Ldlr-/- mice grafted with bone marrow from control Nischfl/fl (Ctrl, n = 17; ImP, n = 20) or Lyz2?Nisch (Ctrl, n = 19; ImP, n = 18) and fed chow diet for 12 weeks. Oil red O staining of aortic arch (left) and representative images of aorta (right). b–g, Chow-fed Apoe-/- mice were treated as indicated. b, Oil red O staining of aortic arch (left) and representative images of aorta (right). Ctrl, n = 15; ImP, n = 17; ImP + AGN, n = 16. c, Left, Ly6Chi monocytes in blood at endpoint (n = 15). Right, representative density plots. d, IFN? and TNF in plasma. n = 10. e, Left, p-S6 staining in peritoneal macrophages. Ctrl, n = 10; ImP, n = 9; ImP + AGN, n = 10. Right, representative histograms. f, Ratio of TH1 to Treg cells infiltrated in aorta. Ctrl, n = 9; ImP, n = 7, ImP + AGN, n = 7. g, F4/80+CD86+ cells infiltrated in aorta. n = 10. f,g, Left, individual data. Right, representative density plots. h–m, Apoe-/- mice were fed a chow diet or HC diet for 8 weeks; AGN192403 was added to the HC group (HC + AGN) in the last 4 weeks. h, Oil red O staining of aortic arch (left) and representative images of aorta (right). Chow, n = 15; HC, n = 14; HC + AGN, n = 13. i, Masson’s trichrome staining of aortic roots. Quantification of lesions in aortic roots (left), necrotic core area (middle) and representative images (right). Arrowheads indicate necrotic areas. Chow, n = 12; HC, n = 13; HC + AGN, n = 14. Scale bars, 500 µm. j,k, Individual data (left) and representative density plots (right) for flow cytometry quantification of blood Ly6Chi monocytes (j; chow, n = 12; HC, n = 13; HC + AGN, n = 13) and T-bet+ CD4+ TH1 cells (k; chow, n = 10; HC, n = 9; HC + AGN, n = 10). l, Plasma IFN? and TNF. Chow, n = 10; HC, n = 9; HC + AGN, n = 10. m, Individual data (left; chow, n = 12; HC, n = 10; HC + AGN, n = 11) and representative histograms (right) for p-S6 staining in peritoneal macrophages. a–m, Individual data points and mean ± s.e.m. from at least two pooled independent experiments. One-way ANOVA with Tukey post hoc correction.
Чтобы проанализировать потенциальное применение AGN192403 для профилактики атеросклероза, вызванного ImP, мы совместно вводили ImP и AGN192403 в питьевую воду мышам, которых кормили Apoe-/- в течение восьми недель. Мы наблюдали, что обработка AGN192403 ингибировала образование атеросклеротических бляшек, индуцированных ImP, как у самцов, так и у самок мышей (рис. 4b и расширенные данные рис. 7a, b), не влияя на общий уровень холестерина или концентрацию ImP в плазме (расширенные данные рис. 7c, d). Лечение AGN192403 предотвращало ImP-индуцированную экспансию моноцитов Ly6Chi и TH1-клеток, продукцию провоспалительных цитокинов, увеличение циркулирующих В- и Т-клеток и ImP-опосредованного p-S6 в перитонеальных макрофагах (рис. 4c–e и расширенные данные рис. 7f). Кроме того, лечение AGN192403 влияло на инфильтрацию иммунных клеток в аорту, локально блокируя способность ImP увеличивать соотношение регуляторных клеток TH1/T (Treg) (рис. 4f и расширенные данные рис. 7g, h) и предотвращая индуцированную ImP инфильтрацию провоспалительных макрофагов и В-клеток (рис. 4f). 4g и расширенные данные (рис. 7i,j). Эти результаты показывают, что специфическая делеция I1R в миелоидных клетках и AGN192403 блокирует ImP-индуцированный атеросклероз у мышей, склонных к атеросклерозу.
ImP–I1R blockade prevents atherosclerosis progression
Чтобы оценить способность ингибирования оси ImP–I1R, чтобы лечить атеросклероз, мы кормили мышей Apoe-/- кормом или HC-диетами в течение восьми недель и получали AGN192403 или нет в течение последних четырех недель HC-диеты. Высококалорийная диета индуцировала атеросклероз и выработку ImP, а лечение AGN192403 ингибировало прогрессирование атеросклероза у самцов и самок мышей, не влияя на концентрацию ImP (рис. 4h и расширенные данные рис. 8a–c). Примечательно, что это лечение также уменьшило размер бляшек, расширение некротического ядра и окрашивание каспазой-3 (рис. 4i и расширенные данные на рис. 8d), это указывает на уменьшение сложности бляшки у мышей37. Тем не менее, этот защитный эффект не повлиял на повышение концентрации холестерина у мышей, получавших HC-диету (расширенные данные на рис. 8е). Более того, лечение AGN192403 предотвращало зависимую от диеты индукцию моноцитов Ly6Chi в крови, TH1–иммунитета и провоспалительных цитокинов (рис. 4j-l). Лечение также нарушало индукцию p-S6 в перитонеальных макрофагах, обусловленную диетой (рис. 4м). Эти результаты демонстрируют, что введение AGN192403, который ингибирует ось ImP–I1R, предотвращает атеросклероз, связанный с активацией иммунных клеток, не влияя на концентрацию холестерина в плазме, что позволяет предложить новый подход к терапии атеросклероза.
Discussion
Сложная этиология CVDs и скрытый характер атеросклероза создают проблемы для выявления ранних стадий заболевания. Предыдущие исследования были сосредоточены на связи ImP и других метаболитов, зависящих от микробиоты, с поздними стадиями сердечно-сосудистых заболеваний или смертностью 10,38-40. В частности, ImP был связан с сахарным диабетом 2 типа, кардиометаболическими заболеваниями у людей с ВИЧ, ишемической болезнью сердца и сердечной недостаточностью15,38,40-43. Здесь мы демонстрируем, что ImP связан с прогрессированием атеросклероза у мышей и с субклиническим активным атеросклерозом у здоровых в остальном людей, у которых атеросклероз выявляется исключительно с помощью передовых визуализирующих исследований, которые недоступны в клинической практике для скрининга большого количества популяций44. Эти результаты были независимо подтверждены в дополнительной когорте IGT, несмотря на различия в медианной концентрации ImP в когорте PESA, что еще больше подтверждает связь между ImP и ранним атеросклерозом и предполагает его использование в качестве сопутствующей диагностической и терапевтической цели для персонализированной медицины. Более того, мы продемонстрировали, что ImP индуцирует атеросклероз, не влияя на концентрацию холестерина в крови. Проатерогенные эффекты ImP могут быть плейотропными и воздействовать на несколько типов клеток 45,46. Мы наблюдали, что введение ImP вызывало локальное повышение транскрипционной активности макрофагов, фибробластов и — в меньшей степени — эндотелиальных клеток. Эти транскрипционные изменения характеризовались усиленным привлечением иммунных клеток и воспалением, которые могли лежать в основе эффекта ImP, способствующего развитию атеросклероза. Кроме того, ImP активирует проатерогенные системные врожденные и адаптивные реакции, приводящие к повышенной инфильтрации иммунными клетками корня аорты, способствуя прогрессированию атеросклероза46, что в дальнейшем коррелирует с клиническими осложнениями и нестабильными или уязвимыми бляшками47,48. Хотя введение ImP не влияет на концентрацию глюкозы, артериальное давление и некоторые параметры функции почек и печени, мы не можем исключать, что другие системные эффекты могут способствовать развитию патологии, которые необходимо будет рассмотреть в будущих исследованиях.
Мы идентифицировали I1R как рецептор для ImP, который индуцирует выработку p-S6 и провоспалительных цитокинов, что согласуется с активацией mTOR в макрофагах, способствующих развитию атеросклероза37,49. Мы обнаружили, что ImP-индуцированный атеросклероз полностью зависит от экспрессии I1R в миелоидных клетках. Однако, учитывая экспрессию и транскрипционные эффекты ImP в других типах клеток, которые способствуют развитию атеросклероза (фибробластах и эндотелиальных клетках), ImP также может влиять на эти клетки, усиливая атеросклероз43. Фармакологическая блокада I1R ингибирует прогрессирование атеросклероза и воспалительную реакцию, вызванную ImP или высококалорийной диетой, независимо от изменений концентрации холестерина, но в зависимости от блокады mTOR в макрофагах. Примечательно, что блокада I1R также снижала окрашивание каспазой-3 и некротическое ядро в бляшке, что указывает на структурную сложность бляшки, связанную с активной и нестабильной бляшкой37, это может лежать в основе ее связи с сердечной недостаточностью38. В настоящее время для предотвращения прогрессирования атеросклероза используется гиполипидемическая терапия. Однако частота сердечно-сосудистых осложнений остается высокой даже у пациентов, получающих соответствующее гиполипидемическое лечение6-8. Хотя доступны другие методы лечения, они еще не разработаны для лечения атеросклероза и, как правило, связаны с установленными факторами риска5,50,51. Таким образом, мы предлагаем ось ImP–I1R в миелоидных клетках в качестве независимой мишени для терапии атеросклероза, которая потенциально может сочетаться с современными методами лечения.
|
 Fig. 1: Untargeted metabolomics unveils ImP as a microbiota-dependent metabolite that is associated with atherosclerosis.
Fig. 1: Untargeted metabolomics unveils ImP as a microbiota-dependent metabolite that is associated with atherosclerosis.  . Fig. 2: ImP is associated with subclinical atherosclerosis in humans.
. Fig. 2: ImP is associated with subclinical atherosclerosis in humans.  Fig. 3: Increased circulating ImP induces atherosclerosis and systemic inflammation in chow-fed atherosclerosis-prone mice.
Fig. 3: Increased circulating ImP induces atherosclerosis and systemic inflammation in chow-fed atherosclerosis-prone mice.  Fig. 4: Blockade of I1R prevents atherosclerosis induction by ImP or high-cholesterol diet.
Fig. 4: Blockade of I1R prevents atherosclerosis induction by ImP or high-cholesterol diet.