Саркопения - это состояние, характеризующееся прогрессирующей потерей мышечной массы и ее функции [1]. Хотя старение является основной причиной, оно все чаще признается как многофакторный синдром, который также может развиться в контексте хронических заболеваний, когда системное воспаление, нарушение регуляции обмена веществ и связанные с лечением эффекты ускоряют истощение мышц [2]. Хотя возрастное снижение мышечной массы является естественным физиологическим процессом, у некоторых пациентов саркопения может прогрессировать значительно быстрее, что приводит к глубоким функциональным нарушениям, повышенной заболеваемости и риску смертности. Следовательно, выявление саркопении и ее устранение в рамках ведения пациентов имеет решающее значение.
Саркопения имеет различную распространенность и факторы риска в разных популяциях. Во всем мире саркопенией страдают от 10% до 16% пожилых людей, при этом более высокая распространенность наблюдается у пациентов с определенными заболеваниями, такими как диабет и рак [3]. Например, в Китае распространенность этого заболевания среди пожилых людей (~60 лет) составляет приблизительно 20,7% [4]. В Египте исследование, посвященное пожилым людям с хрупкими переломами, показало, что распространенность саркопении составляет 69,7%, что указывает на сильную корреляцию между риском саркопении и риском переломов [5]. Напротив, сельские районы Индии продемонстрировали заметно более высокую распространенность саркопении по сравнению с городскими районами, причем повышенному риску способствуют такие факторы, как пожилой возраст, недостаточное потребление белка с пищей и более низкий социально-экономический статус [6]. Понимание этих различий имеет решающее значение для разработки целенаправленных мероприятий и стратегий общественного здравоохранения, направленных на смягчение последствий саркопении, особенно для уязвимых групп населения.
В этом обзоре систематически рассматриваются известные причины, современные определения и подходы к диагностике саркопении, а также последние достижения в ее лечении (рисунок 1). Кроме того, в нем обсуждается растущая роль системной биологии в выявлении потенциальных биомаркеров и терапевтических мишеней саркопении.
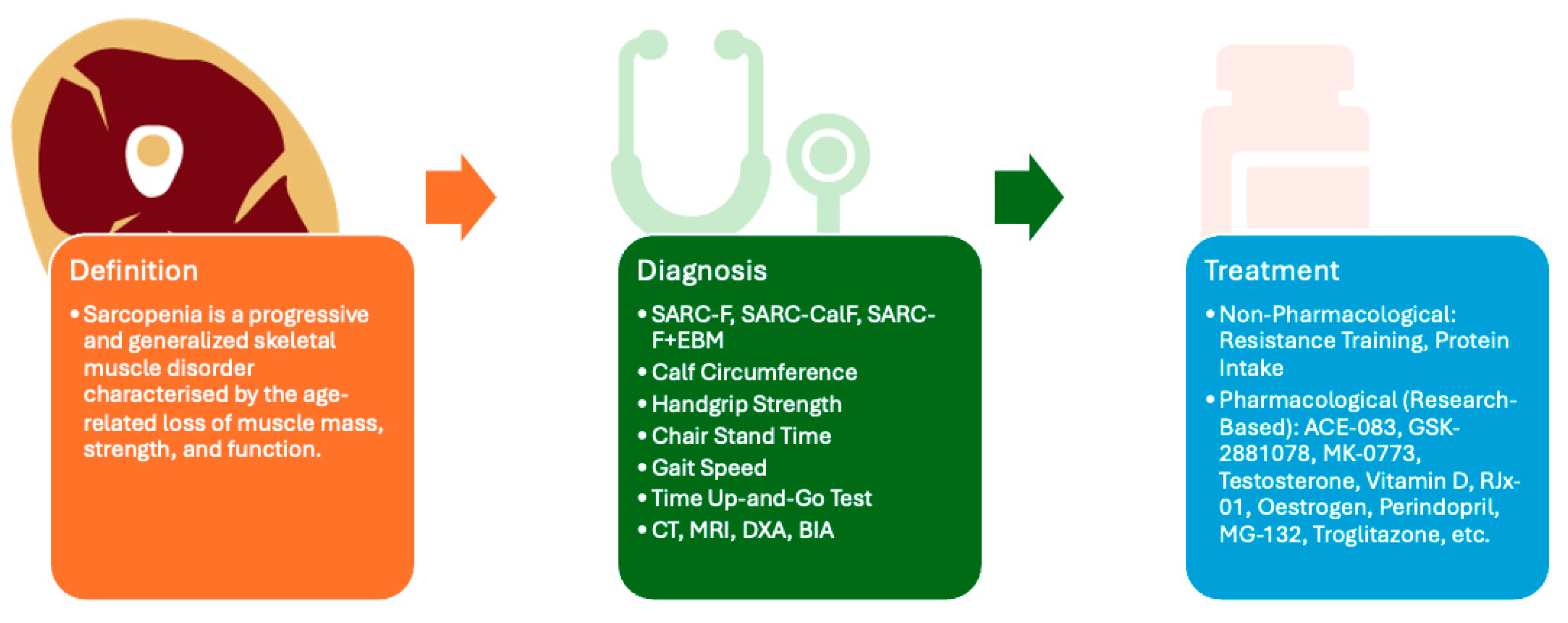 Рисунок 1. На этом рисунке представлен обзор статьи, включающий определение, диагностические подходы и терапевтические стратегии при саркопении. Хотя не было достигнуто универсального консенсуса относительно диагностических критериев, обычно используемые инструменты клинической оценки включают SARC-F [7], SARC-CalF [7], SARC-F+EBM [7], окружность икры [7], силу хвата за руку [7], время стояния на стуле [7], походку. скорость [7], время выполнения теста [7], компьютерная томография (КТ) [8], магнитно-резонансная томография (МРТ) [8], двухэнергетическая рентгеновская абсорбциометрия (DXA) [8] и анализ биоэлектрического импеданса (BIA) [8]. В настоящее время ни одно фармакологическое лечение не получило одобрения FDA; однако в нескольких клинических испытаниях изучаются потенциальные терапевтические агенты, включая ACE-083 [9], GSK-2881078 [10], MK-0773 [11], тестостерон [12], витамин D [13], RJx-01 [14], Эстроген [15], Периндоприл [16], MG-132 [17] и троглитазон [17] среди других.
Рисунок 1. На этом рисунке представлен обзор статьи, включающий определение, диагностические подходы и терапевтические стратегии при саркопении. Хотя не было достигнуто универсального консенсуса относительно диагностических критериев, обычно используемые инструменты клинической оценки включают SARC-F [7], SARC-CalF [7], SARC-F+EBM [7], окружность икры [7], силу хвата за руку [7], время стояния на стуле [7], походку. скорость [7], время выполнения теста [7], компьютерная томография (КТ) [8], магнитно-резонансная томография (МРТ) [8], двухэнергетическая рентгеновская абсорбциометрия (DXA) [8] и анализ биоэлектрического импеданса (BIA) [8]. В настоящее время ни одно фармакологическое лечение не получило одобрения FDA; однако в нескольких клинических испытаниях изучаются потенциальные терапевтические агенты, включая ACE-083 [9], GSK-2881078 [10], MK-0773 [11], тестостерон [12], витамин D [13], RJx-01 [14], Эстроген [15], Периндоприл [16], MG-132 [17] и троглитазон [17] среди других.
Методологическая основа этого обзора была основана на систематическом поиске литературы, проведенном по основным академическим базам данных, включая PubMed (https://pubmed.ncbi.nlm.nih.gov/, дата обращения - 23 января 2025 г.), Web of Science (https://www.webofscience.com/wos/, дата обращения - 23 января 2025 г.), Scopus (https://www.scopus.com /, дата обращения 23 января 2025 года) и Google Scholar (https://scholar.google.com/, дата обращения 23 января 2025 года), вплоть до 2025 года. Были включены только статьи, опубликованные на английском языке.
1.1. Pathophysiology of Sarcopenia
Для разработки эффективных решений крайне важно понимать лежащие в их основе механизмы. В случае саркопении это предполагает изучение сложного взаимодействия между гормональными сдвигами, воспалением, дисфункциями клеточных и субклеточных компонентов, недостатком питания и многими другими факторами, которые в конечном итоге приводят к постепенному снижению мышечной массы и силы.
Предыдущие исследования показали, что саркопения связана с уменьшением как размера, так и количества мышечных волокон II типа, что сопровождается увеличением внутримышечной жировой инфильтрации [18]. Мышечные волокна II типа, особенно IIx и IIb типов, более подвержены атрофии с возрастом, что видно на примере длинной мышцы-разгибателя большого пальца стопы, где у старых мышей площадь поперечного сечения этих волокон значительно уменьшается по сравнению с молодыми [19]. Аналогичным образом, у пожилых женщин с переломами шейки бедра наблюдается обширная атрофия мышечных волокон II типа по сравнению как со здоровыми пожилыми, так и с молодыми людьми, что подчеркивает уязвимость этих волокон к возрастной дегенерации [20]. И наоборот, накопление внутримышечного жира усугубляет саркопению, снижая качество мышц, а не просто уменьшая мышечную массу из-за нарушения сократительной способности мышц и общей функциональной работоспособности [21]. Взаимодействие саркопении и саркопенического ожирения, которое характеризуется увеличением жировой массы и атрофией мышц, подчеркивает сложные метаболические и физиологические изменения в стареющих мышцах, при этом атрофия волокон II типа является критическим фактором повышенного риска падений и переломов у пожилых людей [22].
Митохондрии играют ключевую роль в производстве энергии и клеточном гомеостазе. При саркопении их дисфункция связана с нарушением митофагии, изменением динамики митохондрий и снижением биогенеза [23,24]. Исследования показали, что его дисфункция представляет собой один из ключевых патофизиологических путей в контексте саркопении [25-27]. Более того, накопление реактивных форм кислорода (ROS) и возникающий в результате этого окислительный стресс еще больше усугубляют повреждение митохондрий, способствуя атрофии мышц [23]. Кроме того, при саркопении наблюдается заметное нарушение регуляции гомеостаза клеток-сателлитов, что снижает их способность эффективно восстанавливать мышечную ткань [28,29]. Это нарушение частично объясняется нарушением регуляции митохондрий [30]. Эта связь между митохондриальной дисфункцией и прогрессированием заболевания подчеркивает необходимость целенаправленного лечения для улучшения функции митохондрий и уменьшения последствий саркопении у пожилых людей.
Воспаление связано с несколькими заболеваниями, связанными со старением, и является основным фактором потери мышечной массы у пожилых людей [31,32]. Иммунная микросреда скелетных мышц претерпевает значительные изменения при саркопении, при этом макрофаги играют ключевую роль в опосредовании воспалительных процессов, наблюдаемых в стареющих мышечных тканях [33]. Эти иммунные клетки способствуют хроническому воспалению, которое усугубляет износ мышц. Кроме того, взаимодействие между жировой тканью и скелетными мышцами включает в себя жировую ткань, действующую как эндокринный орган, который высвобождает провоспалительные молекулы и способствует прогрессированию саркопении [34]. Системные маркеры воспаления, такие как С-реактивный белок (CRP) и интерлейкин-1β (IL-1β), повышены у лиц с саркопенией, что указывает на сильную связь между воспалением и потерей мышечной массы [35,36]. Более того, диетические факторы, способствующие воспалению, могут усугубить симптомы саркопении, что подчеркивает роль образа жизни и диеты в лечении этого состояния [31].
Старение оказывает глубокое влияние на эндокринную систему, приводя к снижению уровня анаболических гормонов, таких как тестостерон, growth hormone (GH) и insulin-like growth factor 1 (IGF-1). Эти гормоны играют жизненно важную роль в синтезе и поддержании мышечного белка, и их снижение в конечном итоге способствует развитию саркопении [37,38]. Тестостерон, например, играет жизненно важную роль в поддержании мышечной массы и функциональных возможностей, и его дефицит, наряду с плохим питанием и недостатком физических упражнений, может способствовать развитию саркопении [39]. Аналогичным образом, снижение уровня эстрогена у женщин в постменопаузе может привести к метаболической дисфункции и повышенному риску развития саркопении [18]. Аналогичным образом, GH и IGF-1 связаны с мышечной массой, и их снижение с возрастом связано со снижением синтеза мышечного белка и усилением мышечной деградации [37,40]. Концепция “анаболической резистентности” еще больше усложняет этот сценарий, когда реакция мышц на потребление белка у пожилых людей притупляется, что приводит к недостаточному синтезу мышечного белка, несмотря на адекватное питание [41]. Эта резистентность усугубляется такими факторами, как ожирение, малоподвижный образ жизни и резистентность к инсулину, которые распространены среди стареющего населения [41].
Денервация и потеря двигательных нейронов, включая уменьшение количества двигательных единиц (MUs) и нестабильность нервно-мышечных соединений (NMJ), являются другими ключевыми факторами в патофизиологии саркопении, как подчеркивалось в предыдущих исследованиях [42-44]. Эта потеря двигательных нейронов и последующая денервация приводят к атрофии мышц и слабости [45,46]. Исследования показывают, что эти нервно-мышечные нарушения часто предшествуют клинически диагностированной саркопении, что позволяет предположить, что мониторинг свойств MU и стабильности NMJ может иметь решающее значение для раннего выявления и вмешательства [45,47]. С другой стороны, несколько исследований подтверждают, что старение сосудов, эндотелиальная дисфункция, снижение плотности капилляров и нарушение кровотока являются существенными факторами, способствующими развитию саркопении [48,49]. Эти сосудистые нарушения снижают доставку кислорода и питательных веществ к скелетным мышцам, что снижает анаболизм в миоцитах, что приводит к атрофии мышц и нарушению их функции.
Микробиом кишечника играет важную роль в патогенезе саркопении. Изменения в микробном разнообразии и составе тесно связаны как с началом, так и с прогрессированием этого заболевания посредством нескольких взаимосвязанных механизмов [50]. Например, дисбактериоз кишечника снижает численность бактерий, продуцирующих гидролазу желчных солей, что приводит к накоплению первичных желчных кислот [51]. Это накопление подавляет передачу сигналов фарнезоидным X-рецепторам, тем самым нарушая синтез мышечного белка и ускоряя атрофию мышц [51]. Кроме того, метаболиты, полученные из кишечной микробиоты, такие как короткоцепочечные жирные кислоты и аминокислоты с разветвленной цепью, играют вспомогательную роль в мышечном метаболизме, оказывая противовоспалительное действие и стимулируя синтез белка через сигнальный путь протеинкиназы, активируемый AMP [52]. И наоборот, дисбактериоз не только снижает выработку этих полезных метаболитов, но и увеличивает образование вредных метаболитов, включая индол и п-крезол, которые еще больше способствуют дегенерации мышц [52].
Понимание механизмов, лежащих в основе патофизиологии саркопении, имеет решающее значение для разработки стратегий лечения, направленных на предотвращение потери мышечной массы, поддержание функциональной независимости у пожилых людей и, в конечном счете, снижение распространенности саркопении и ее существенной нагрузки на систему здравоохранения. Мы проиллюстрировали патофизиологические изменения, связанные с саркопенией, на рисунке 2.
 Рисунок 2. Патофизиология саркопении сложна и разнообразна. По мере роста воспаления, митохондриальной дисфункции и активных форм кислорода (АФК) в мышцах, пораженных саркопенией, уменьшается количество миофибрилл, сателлитных клеток, двигательных нейронов и нервно-мышечных соединений, а также анаболических гормонов.
Рисунок 2. Патофизиология саркопении сложна и разнообразна. По мере роста воспаления, митохондриальной дисфункции и активных форм кислорода (АФК) в мышцах, пораженных саркопенией, уменьшается количество миофибрилл, сателлитных клеток, двигательных нейронов и нервно-мышечных соединений, а также анаболических гормонов. 1.2. Molecular and Clinical Biomarkers of Sarcopenia
Как обсуждалось в предыдущем разделе, саркопения имеет сложный механизм развития, что делает важным поиск надежных биомаркеров для ранней диагностики и лечения. В различных исследованиях изучались потенциальные биомаркеры, начиная от маркеров, полученных из крови, и заканчивая метаболическими и генетическими показателями. Выявление этих биомаркеров может привести к разработке более персонализированных подходов к лечению, позволяя медицинским работникам более эффективно диагностировать саркопению и отслеживать ее прогрессирование.
Поскольку воспаление играет ключевую роль в патофизиологии саркопении, в предыдущих исследованиях с саркопенией были связаны несколько маркеров воспаления. Воспаление является важнейшим компонентом патофизиологии саркопении, и с этим состоянием связаны несколько маркеров воспаления. Исследования выявили повышенные уровни провоспалительных цитокинов, таких как интерлейкин-6 (IL-6), интерлейкин-8 (IL-8), фактор некроза опухоли-альфа (TNF-α) и IL-1β у лиц с саркопенией [53-55]. Кроме того, высокий уровень CRP связан с потерей мышечной силы и рассматривается как хороший показатель воспалительного статуса для исследования саркопении [53,54]. Кроме того, показатели воспаления, полученные на основе общего количества клеток крови, такие как соотношение нейтрофилов к лимфоцитам (NLR), соотношение нейтрофилов и моноцитов к лимфоцитам (NMLR) и индекс системной воспалительной реакции (SIRI), были связаны с более высокой частотой саркопении и повышенным риском смерти, что подчеркивает их важность в прогнозировании исходов [56].
Помимо маркеров воспаления, dp-ucMGP показал себя многообещающим биомаркером, более низкие уровни которого ассоциируются с саркопенией и снижением физической работоспособности [57]. Кофермент Q10 и мышечные белки, такие как irisin и креатинкиназа, также были предложены в качестве потенциальных биомаркеров, причем более низкие уровни наблюдаются у лиц с саркопенией [58]. Аналогичным образом, повышенные уровни миостатина и фактора роста и дифференцировки-15 (GDF-15), негативных регуляторов мышечного роста, были связаны с истощением мышц, следовательно, они могут быть хорошими кандидатами в качестве биомаркеров [59]. Другие исследования с использованием метаболомного анализа показали, что phosphatidylinositol в соотношении 32:1 и Cathepsin D обладают высокой точностью диагностики саркопении [60,61]. Seo et al. выделил сфинголипидные метаболиты, в частности керамиды и сфингомиелины, в качестве потенциальных циркулирующих биомаркеров, особенно у мужчин [62]. Протеомное профилирование внеклеточных везикул выявило тромбоцитарный фактор 4 (PF4) и субкомпонент комплемента C1r (C1R) как новые биомаркеры, обладающие значительной диагностической способностью [63].
Кроме того, некодирующие РНК и специфические гены, включая Acss1, Mtfp1 и Oxct1, были вовлечены в саркопению, что позволяет получить представление о молекулярных механизмах, лежащих в основе потери мышечной массы [64,65]. Некодирующие РНК модулируют сигнальные пути, которые управляют физиологией и дисфункцией скелетных мышц. Например, активность miR-434-3p снижается в стареющих мышцах, что усиливает активность eIF5A1 и впоследствии индуцирует гибель клеток через митохондриальный апоптотический путь [66]. Параллельно Acss1 участвует в энергетическом метаболизме, Mtfp1 регулирует динамику митохондрий и апоптоз, а Oxct1 необходим для утилизации кетоновых тел [64]. Нарушение регуляции экспрессии этих генов, наряду с некодирующей регуляцией, опосредованной РНК, подчеркивает их центральную роль в атрофии скелетных мышц и подчеркивает их потенциал в качестве биомаркеров и терапевтических мишеней при саркопении.
Хотя предыдущие результаты являются многообещающими, ни один биомаркер еще не достиг оптимальной диагностической точности, что подчеркивает необходимость дальнейших исследований для подтверждения этих результатов и создания надежных диагностических инструментов [67]. Таким образом, комбинация сывороточных маркеров, диагностической визуализации и функциональных тестов мышечной функции предлагается в качестве идеальной панели биомаркеров для саркопении [68,69].
1.3. Diagnosis
Саркопения диагностируется с использованием нескольких методов, разработанных международными группами (таблица 1). Разнообразие подходов отражает отсутствие универсального диагностического стандарта. Несмотря на различия между методами, они, как правило, включают оценку мышечной силы, массы тела и физической работоспособности. К основным методам диагностики, широко используемым в клинической практике, относятся методы, разработанные Европейской рабочей группой по саркопении у пожилых людей (EWGSOP2), Азиатской рабочей группой по саркопении (AWGS), Международной рабочей группой по саркопении (IWGS) и Фондом национального института здравоохранения (FNIH) в рамках проекта по борьбе с саркопенией.
EWGSOP2 - это пересмотренный консенсус по определению и диагностике саркопении, который широко используется в Европе [70]. В нем в качестве основного критерия подчеркивается низкая мышечная сила, измеряемая с помощью таких инструментов, как тесты на handgrip strength [70]. Это также подтверждается оценкой мышечной массы с использованием методов визуализации, таких как КТ или МРТ, и оценкой физической работоспособности для определения тяжести заболевания. С другой стороны, AWGS модифицирует эти критерии с учетом уникальных особенностей азиатского населения, включая культурно значимые пороговые значения мышечной массы и подчеркивая скорость походки как критический показатель производительности [71]. Кроме того, AWGS рекомендует использовать опросник SARC-F, измерение окружности икр и тесты на работоспособность, такие как 5-кратный тест на стояние на стуле, для выявления лиц, относящихся к группе риска [71]. Эта региональная корректировка подчеркивает необходимость адаптации диагностических инструментов для различных групп населения для достижения улучшенных результатов прогнозирования [72].
IWGS определяет саркопению, уделяя особое внимание низкой мышечной массе и низкой физической работоспособности, не рассматривая мышечную силу в качестве критерия [73]. Этот подход особенно важен для лежачих пациентов или тех, у кого низкая скорость походки, что требует тщательной оценки состава тела [73]. Аналогичным образом, проект FNIH по саркопении был направлен на решение той же проблемы путем анализа существующих источников данных для определения диагностических критериев. Первоначальные результаты были опубликованы в мае 2012 года, а окончательные рекомендации опубликованы в 2014 году [74]. Критерии FNIH включают оценку скорости походки, за которой следует оценка силы хвата и мышечной массы с помощью двухэнергетической рентгеновской абсорбциометрии. В отличие от EWGSOP2, AWGS и IWGS, FNIH рекомендует индекс мышечной массы с поправкой на BMI, а не на рост [73].
Несмотря на растущий интерес к саркопении, общепризнанного консенсуса в отношении ее диагностических критериев еще предстоит достичь. Хотя различные международные рабочие группы предложили различные рекомендации по диагностике, эта неоднородность может привести к путанице и непоследовательности в клинической практике. Необходим универсальный, стандартизированный подход, позволяющий сбалансировать специфичность и глобальную применимость. С этой точки зрения, интеграция данных системной биологии и мультиомики может помочь в разработке более совершенных диагностических инструментов и адаптации их к демографическим и личностным различиям для достижения лучших результатов.
Таблица 1. В сводной таблице представлены наиболее часто применяемые методы диагностики саркопении. Используются следующие сокращения: SARC-F означает силу, помощь при ходьбе, вставании со стула, подъеме по лестнице и падениях. SARC-CalF относится к опроснику SARC-F в сочетании с измерением окружности икр, в то время как EBM означает индекс массы тела пожилых людей. КТ означает компьютерную томографию, а МРТ - магнитно-резонансную томографию. DXA соответствует двухэнергетической рентгеновской абсорбциометрии, в то время как BIA относится к анализу биоэлектрического импеданса. EWGSOP представляет Европейскую рабочую группу по саркопении у пожилых людей, а EWGSOP2 является ее обновленной структурой. Аналогичным образом, AWGS означает Азиатскую рабочую группу по саркопении, а AWGS2 - это обновленная версия. IWGS означает Международную рабочую группу по саркопении. FNIH расшифровывается как Фонд, финансирующий проект Национального института здравоохранения по борьбе с саркопенией, а SDOC - как Консорциум по определению и исходам саркопении.
1.4. Current Treatment Options
В настоящее время при саркопении отсутствуют одобренные FDA методы лечения, которые предлагают ограниченные терапевтические возможности [77]. Однако изучаются различные традиционные методы и инновационные подходы [78]. Эти варианты лечения можно в общих чертах разделить на немедикаментозные вмешательства (таблица 2) и фармакологические подходы (таблица 3).
Силовые тренировки и достаточное потребление белка являются фундаментальными немедикаментозными стратегиями лечения заболевания, поскольку они способствуют сохранению мышечной массы и ее функции [77,79]. Силовые тренировки рекомендуются в качестве основной терапии саркопении, поскольку исследования показали, что они могут увеличить мышечную силу и размер, повысить функциональность и способствовать развитию мышц [80,81]. Рекомендуется заниматься два раза в неделю и каждый раз чередовать упражнения для верхней и нижней части тела, чтобы достичь адекватных результатов [82]. Кроме того, достаточное потребление белка, особенно в сочетании с физическими упражнениями, также важно для контроля саркопении. Для поддержания мышечной массы и достижения оптимальных результатов от силовых тренировок рекомендуется ежедневно потреблять больше белка, чем рекомендуемая диетическая норма (0,8 г белка на каждый килограмм массы тела) [83].
Несмотря на ограниченную доступность одобренных фармакологических методов лечения саркопении, в настоящее время изучается целый ряд терапевтических вмешательств. Предыдущие исследования показали, что тестостерон, селективные модуляторы андрогенных рецепторов (SARMs) и другие гормональные препараты, такие как эстроген и dehydroepiandrosterone (DHEA), могут увеличить мышечную массу и силу, но эти достижения не всегда приводят к улучшению физической работоспособности [84]. Кроме того, ингибиторы миостатина показали многообещающие результаты в предыдущих исследованиях, но для оценки требуются дополнительные исследования [85]. Более того, новый комбинированный препарат RJx-01, в состав которого входят metformin и galantamine, в ранних исследованиях продемонстрировал комбинированные преимущества, улучшая качество мышц, стабилизируя нервно-мышечные соединения и снижая общее воспаление [86]. Другие соединения, такие как apelin and irisin, также исследуются на предмет их потенциальной пользы при лечении саркопении [85].
В дополнение к этим фармакологическим подходам, модуляция кишечной микробиоты стала многообещающим терапевтическим направлением. Для смягчения дисбактериоза кишечника, связанного с саркопенией, были предложены такие мероприятия, как прием пробиотиков, пребиотиков, трансплантация фекальной микробиоты и селективное применение антибиотиков для подавления вредных микробных сообществ [52]. Тем не менее, хотя эти фармакологические методы лечения, основанные на микробиоме, все еще находятся в стадии разработки, физические упражнения и правильное питание остаются краеугольным камнем клинического лечения саркопении [77]. Учитывая многофакторный и системный характер заболевания, в будущих исследованиях приоритет должен отдаваться интегративным подходам, при этом системная биология должна играть решающую роль в определении оптимальных терапевтических стратегий.
Таблица 2. Сводная таблица немедикаментозных методов лечения саркопении, включая физические упражнения, пищевые добавки, растительные лекарственные препараты и другие вмешательства.
Таблица 3. Предлагаемые препараты для лечения саркопении, их описание и стадии разработки.
1.5. Preventive Strategies
Профилактические стратегии играют центральную роль в снижении как частоты возникновения, так и прогрессирования саркопении, особенно в уязвимых группах населения, таких как пожилые люди, страдающие от недоедания или ведущие малоподвижный образ жизни. Эти стратегии в первую очередь направлены на физическую активность, оптимизацию питания и комплексные мероприятия, направленные на сохранение мышечной массы, силы и функциональных возможностей [116]. Среди них наиболее эффективной профилактической мерой были признаны прогрессивные силовые упражнения, учитывая их способность значительно увеличивать мышечную массу и силу [117]. Кроме того, упражнения с несколькими суставами особенно рекомендуются пожилым людям из-за их функциональной значимости [75]. С точки зрения питания, достаточное потребление белка, особенно из высококачественных источников, играет решающую роль в снижении потери мышечной массы [89]. Кроме того, прием добавок с омега-3 жирными кислотами и витамином D продемонстрировал потенциальную пользу; однако имеющиеся данные указывают на то, что наиболее эффективный профилактический подход заключается в сочетании стратегий питания с прогрессивными силовыми тренировками, что позволяет добиться максимального синергетического эффекта для здоровья мышц [89].
2. Systems Biology
Системная биология - это междисциплинарная область, которая объединяет экспериментальные и вычислительные подходы для целостного и всестороннего изучения биологических систем. Она направлена на понимание сложных взаимодействий внутри биологических систем и между ними, от молекулярного до организменного уровней, с использованием методов крупномасштабных измерений и математического моделирования [118,119]. Этот подход подчеркивает целостный взгляд на биологию, а не просто разбивает ее на более мелкие части. Она рассматривает живые существа как единое целое и фокусируется на чертах, которые проявляются, когда все отдельные части объединяются в единый организм. Это произвело революцию в изучении болезней, предоставив представление о механизмах сложных биологических систем, таких как метаболические сети и сигнальные пути, которые имеют решающее значение для понимания физиологических реакций и механизмов развития заболеваний [120,121]. Таким образом, системно-биологический подход имеет решающее значение для понимания сложных взаимосвязей между метаболическими путями, системами генетического контроля, влиянием окружающей среды и выбором образа жизни, которые приводят к саркопении.
Системная биология стала уникальной областью в конце 20-го века, в основном из-за усовершенствования высокопроизводительных омических технологий и необходимости изучения больших наборов биологических данных. Создание технологий позволило проводить обширные измерения клеточных функций, что упростило изучение биологических систем в широком масштабе. Затем исследователи объединили вычислительные методы с биологическими исследованиями, что позволило получить полное представление о сложных биологических системах, таких как экспрессия генов и биологические пути.
Methodologies
Системная биология - это междисциплинарная дисциплина, которая использует различные методологии для изучения сложных биологических систем (рисунок 3). Эти методологии включают в себя технологии omics, сетевой анализ, компьютерное моделирование и машинное обучение. Каждый из этих подходов обеспечивает уникальное понимание функционирования биологических систем, позволяя исследователям понять сложные взаимодействия и динамику внутри этих систем. Интегрируя эти методологии, системная биология стремится обеспечить всестороннее понимание биологических процессов, что может способствовать прогрессу в персонализированной медицине, повысить точность диагностики и направлять разработку целенаправленных стратегий лечения.
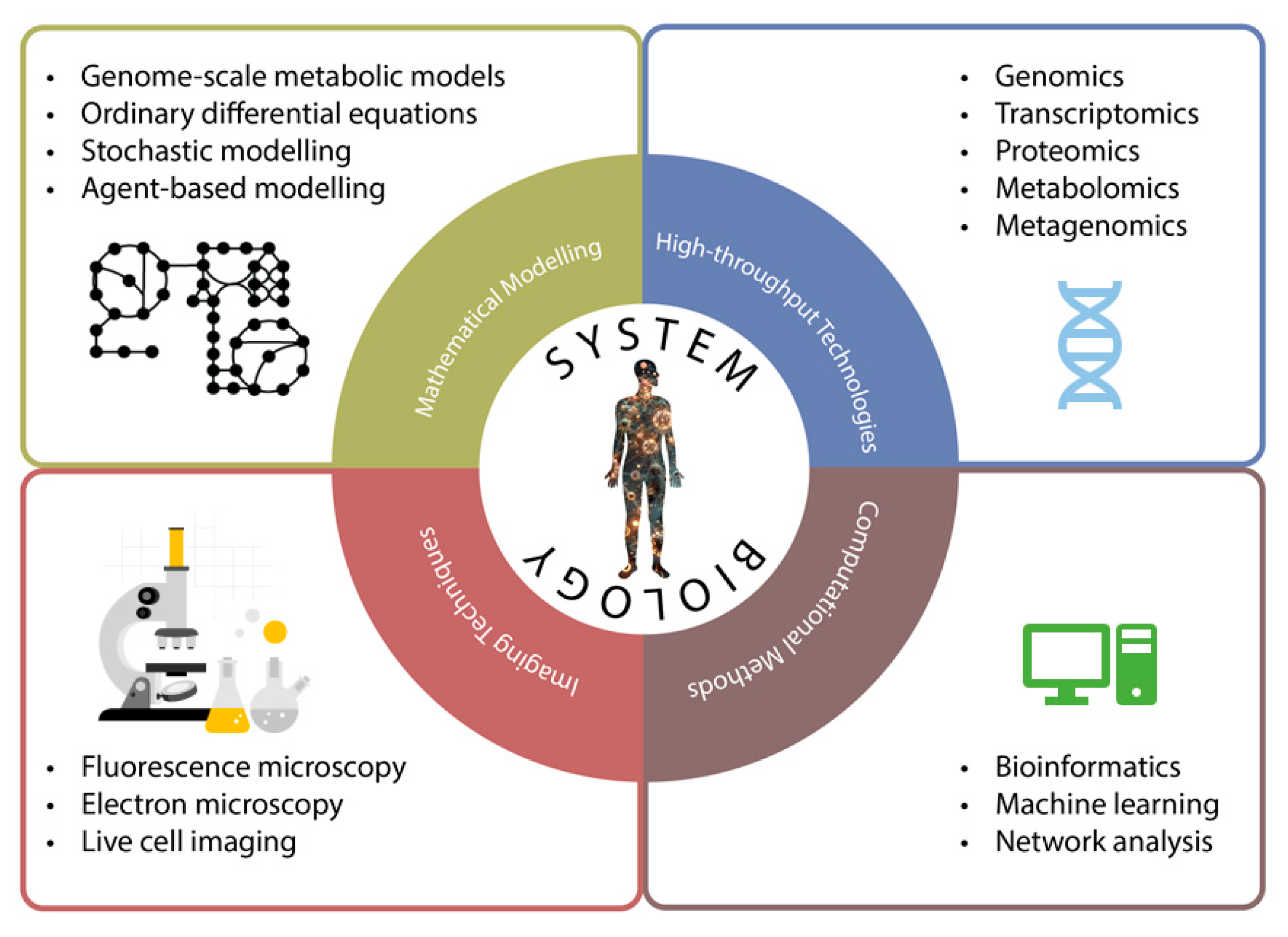
Рисунок 3. Системная биология использует различные методологии из других дисциплин для понимания сложной природы организмов. Эти методологии в основном можно разделить на четыре категории: высокопроизводительные технологии, вычислительные методы, математическое моделирование и методы визуализации.
Технологии Omics предоставляют исчерпывающие данные по различным аспектам биологических систем [122]. Благодаря передовым технологиям у нас теперь есть доступ к огромному массиву данных omics. Наиболее часто используемые методы включают геномику, транскриптомику, протеомику, метаболомику, липидомику и метагеномику, в которых основное внимание уделяется углубленному анализу генов, РНК, белков, метаболитов, липидов и микробиома, соответственно. Эти типы данных позволяют исследователям исследовать конкретные слои центральной догмы молекулярной биологии, помогая идентифицировать ключевые механизмы развития заболеваний. Например, Ceyhan et al. исследовали данные транскриптомики пациентов с дистрофией, связанной с коллагеном VI, что привело к идентификации потенциальных генов-мишеней и препаратов-кандидатов для терапевтического вмешательства [123]. Кроме того, интеграция данных, полученных с помощью различных подходов omics, позволила исследователям достичь более целостного понимания биологических систем, раскрыть сложные молекулярные взаимодействия и создать более точные модели прогнозирования поведения клеток. Например, Meng et al. были использованы данные мультиомиксов, полученные от пациентов с болезнью Альцгеймера, для идентификации ключевых белков плазмы и видов кишечной микробиоты, связанных с прогнозированием тяжести заболевания [124].
Сетевой анализ - это мощный подход в системной биологии для понимания сложных многомерных биологических данных. Эта методология позволяет исследователям анализировать взаимодействия и взаимосвязи на множестве биологических уровней, от генов и белков до метаболитов и фенотипов [125]. Биологические сети могут представлять собой различные молекулярные взаимодействия, такие как метаболические пути, паттерны совместной экспрессии генов, межбелковые взаимодействия, клеточные сигнальные пути и механизмы регуляции генов. Анализируя эти сети, ученые могут определить ключевые компоненты и взаимодействия, которые управляют биологическими процессами, что приводит к более полному пониманию клеточных функций и патофизиологии заболеваний. В частности, Kaynar и др. исследовали сетевые паттерны коэкспрессии генов при мультиформной глиобластоме и выявили важные модули и узловые гены, которые могут служить потенциальными терапевтическими мишенями для лечения [126].
Компьютерное моделирование - это ценный метод, который использует компьютеры для моделирования и анализа сложных систем. В системной биологии этот метод приобрел значительное значение, особенно при использовании метаболических моделей геномного масштаба (GEMs). GEMs - это сетевые инструменты, которые объединяют метаболические данные, включая гены, ферменты, реакции и метаболиты, с биологическими данными с высокой пропускной способностью [127]. Они моделируют метаболические пути, предсказывают фенотипы и помогают определить терапевтические мишени, особенно для лечения заболеваний человека и создания лекарств [127]. Интеграция машинного обучения с GEMs еще больше повысила точность и эффективность их прогнозирования, сделав их ценными инструментами в трансляционной медицине и разработке лекарств [128]. В контексте микробиома кишечника человека GEMs использовались для прогнозирования взаимодействия между рационом питания, микробами и организмом хозяина, что позволяло получить представление о роли микробиоты в возникновении заболеваний, таких как рак и нарушения обмена веществ [129]. Хотя GEMS полезны, они сталкиваются с такими проблемами, как чрезмерное упрощение, ограниченный доступ к экспериментальным данным и кинетическим параметрам, а также неадекватное представление механизмов регуляции [130,131]. Однако ожидается, что достижения в области секвенирования генома и разработка инструментов автоматизированной реконструкции повысят применимость и эффективность GEMs в различных областях биологических и медицинских исследований [128].
3. Integrating Systems Biology Approaches in Sarcopenia Studies
Системная биология используется для поиска более эффективных методов диагностики и лечения различных заболеваний. Ее методы также становятся все более ценными в исследованиях саркопении, позволяя по-новому взглянуть на молекулярные механизмы этого заболевания и потенциальные терапевтические мишени. Эти подходы объединяют различные типы данных omics и аналитические методы, чтобы обеспечить всестороннее понимание сложной патофизиологии саркопении.
Геномные исследования выявили ряд генетических маркеров, связанных с саркопенией, включая 78 SNP, связанных с саркопенией, и 55 SNP, связанных с саркопеническим ожирением, по данным британского биобанка [132]. Кроме того, в азиатских популяциях были идентифицированы генетические биомаркеры, такие как RPS10, NUDT3 и GPD1L, связанные с мышечной массой тела и аппендикулярной скелетной мускулатурой [133]. Исследования в области транскриптомики дополнительно выявили потенциальные терапевтические мишени. Например, Ceyhan и соавт. использовали данные RNA-seq с сетевым анализом для идентификации AGL и PDHX в качестве возможных мишеней для саркопении, предложив MG-132 и troglitazone в качестве кандидатов на фармакологическое лечение [17]. В исследовании, проведенном Zhang и его командой, была изучена транскрипционная регуляторная сеть, связанная с иммунитетом, и путь PAX5-SERPINA5-PI3K/Akt был идентифицирован как возможный механизм саркопении [134].
Протеомный анализ полезен для понимания сложных взаимодействий белков, участвующих в мышечном метаболизме и дегенерации. Используя методы масс-спектрометрии, исследователи могут идентифицировать специфические белковые изменения, связанные с саркопенией, что позволяет получить представление о потенциальных биомаркерах для ранней диагностики и разработки стратегий вмешательства. Ubaida-Mohien и др. исследовали протеомику мышц 58 молодых и пожилых здоровых людей и обнаружили, что у пожилых людей наблюдалось снижение уровня белков, связанных с энергетическим обменом рибосом, таких как цикл ТСА, митохондриальное дыхание и гликолиз [135]. И наоборот, белки, связанные с воспалением и альтернативным сплайсингом, были более распространены [95]. Более того, предыдущие исследования по протеомному профилированию продемонстрировали переход от быстрых типов мышечных волокон к более медленным с возрастом [136].
Метагеномика стала мощным инструментом для понимания сложной взаимосвязи между микробиотой кишечника и саркопенией. Недавние исследования с использованием метагеномного секвенирования позволили получить представление о том, как изменения в составе и функциях микробиоты кишечника могут способствовать развитию заболевания. Например, исследование Xiangya, посвященное саркопении, выявило изменения в составе и функциях микробиома кишечника, подчеркнув потенциал метагеномики для выявления специфических видов микроорганизмов и их функциональных возможностей, которые изменяются при саркопении [137]. Аналогичным образом, измененная микробиота при саркопении связана с изменениями в метаболических путях, такими как снижение активности генов, участвующих в синтезе короткоцепочечных жирных кислот, которые имеют решающее значение для здоровья мышц и модуляции воспаления [138]. Хотя эти исследования подчеркивают потенциал воздействия на ось кишечник-мышцы для смягчения последствий саркопении, необходимы дальнейшие исследования для подтверждения этих результатов в исследованиях на людях и изучения клинической значимости этих микробных изменений в лечении саркопении [139].
The Relationship Between Sarcopenia and Other Diseases
Саркопения тесно связана с различными заболеваниями из-за общих процессов, лежащих в их основе. Методы системной биологии сыграли ключевую роль в выявлении этих связей, показав, что саркопения является не только результатом старения, но и встречается наряду с несколькими хроническими заболеваниями. Эти исследования подчеркивают сложное взаимодействие генетических, молекулярных и экологических факторов, которые играют роль в возникновении и прогрессировании саркопении и других заболеваний. Например, Xu и соавт. использовали подход системной биологии для выявления 114 общих генов между сердечной недостаточностью и саркопенией, связанных с факторами роста, секрецией инсулина и путем cGMP-PKG, включая семь генов-концентраторов в качестве потенциальных биомаркеров или терапевтических мишеней [140]. Этот комплексный подход подчеркивает потенциал разработки целенаправленных вмешательств, направленных как на борьбу с саркопенией, так и с сопутствующими заболеваниями, что в конечном итоге улучшает результаты лечения пациентов за счет более целостного подхода к лечению.
В качестве другого примера, связь между саркопенией и респираторными заболеваниями была исследована в предыдущем исследовании. Wang и соавт. было показано, что хроническая обструктивная болезнь легких и саркопения имеют общие факторы риска, такие как курение, воспаление и окислительный стресс, и оба состояния связаны с системным воспалением и генетическим сходством, которые приводят к потере мышечной массы и снижению функциональности [141]. Другое исследование показало, что активация альфа-бета-Т-клеток и контроль процессов гибели лимфоцитов являются общими путями, связывающими саркопению и COVID-19, подчеркивая, что взаимосвязь между этими двумя состояниями может быть двусторонней, возможно, образуя деструктивный цикл [142]. Недавние данные также указывают на то, что увеличение мышечной массы может служить профилактической стратегией против гастроэзофагеальной рефлюксной болезни и жировой болезни печени, связанной с нарушением обмена веществ. Эти ассоциации подчеркивают важную роль лечения метаболических нарушений в снижении риска развития сопутствующих заболеваний, часто связанных с саркопенией [143,144].
С другой стороны, несколько исследований продемонстрировали причинно-следственную связь между определенными аутоиммунными состояниями и ускоренной потерей мышечной массы. Например, пациенты с ревматоидным артритом демонстрируют значительно более высокую распространенность саркопении по сравнению со здоровыми контрольными группами [145,146]. Аналогичным образом, менделевские рандомизационные исследования выявили причинно-следственную отрицательную связь между сахарным диабетом 1 типа (T1DM) и мышечной массой аппендикса, поскольку хроническое воспалительное состояние, связанное с T1DM, способствует истощению мышц и снижению их функции [145]. Аналогичным образом, в предыдущем проспективном исследовании с участием 158 пациентов с воспалительными заболеваниями кишечника сообщалось о распространенности саркопении в 34,2%, что свидетельствует о значительной связи между саркопенией и госпитализациями в течение года [147]. Результаты этих исследований показывают, что аутоиммунные заболевания негативно влияют на физиологию мышц и ускоряют развитие саркопении. Эта взаимосвязь, безусловно, приводит к негативным клиническим последствиям и затрудняет лечение и прогноз.
4. Future Perspectives
Использование системно-биологических подходов в исследованиях саркопении позволило получить важную информацию о механизмах, лежащих в основе этого заболевания, и потенциальных терапевтических целях. Тем не менее, в этой области все еще существует ряд ограничений и проблем, которые необходимо преодолеть. Ключевая проблема заключается в интеграции различных типов данных omics, что по-прежнему создает значительные вычислительные и аналитические трудности [148]. Большой объем и сложность данных с несколькими omics затрудняют извлечение значимых биологических данных и определение критических путей, участвующих в развитии саркопении. Аналогичным образом, отсутствие стандартизированных методов сбора данных и анализа может привести к вариабельности результатов, что снижает доверие к специалистам в этой области [149].
К настоящему времени было проведено множество исследований по саркопении. Тем не менее, многие из них связаны с относительно небольшими размерами выборки, что ограничивает их статистическую силу и обобщаемость результатов. Кроме того, большинство исследований основаны на перекрестных наборах данных, которые могут не отражать динамический характер прогрессирования саркопении или ее реакции на вмешательства с течением времени [150,151]. С другой стороны, различия в том, как определяется и диагностируется саркопения, приводят к различиям в распространенности заболевания [152-154], что еще больше усложняет решение проблемы. Отчасти это объясняется техническими трудностями при оценке мышечной массы и качества, отсутствием ранней стадии выявления и произвольными ограничениями в диагностических критериях для различных этнических групп [70,155]. Несмотря на потенциал системной биологии в выявлении биомаркеров и целей лечения, клиническая проверка остается серьезной проблемой, замедляющей внедрение открытий в практику.
Забегая вперед, отметим, что перспективы исследований саркопении в будущем многообещающие. Хотя пока нет одобренного FDA препарата для лечения саркопении, существуют многообещающие препараты, которые находятся в стадии изучения в рамках клинических испытаний, таких как trevogrumab и селективные модуляторы андрогенных рецепторов [84,156]. Кроме того, благодаря совершенствованию технологий секвенирование генома и мультиомный анализ со временем становятся менее дорогостоящими [157,158], что в конечном итоге позволит исследователям собирать больше образцов у пациентов с саркопенией с меньшими затратами. Интеграция мультиомных технологий с компьютерным моделированием в рамках системной биологии предоставляет возможности для выявления отличительных молекулярных признаков и изменений путей, связанных с саркопенией. Такие индивидуальные молекулярные профили могут облегчить стратификацию пациентов на биологически определенные подгруппы, направляя разработку целенаправленных вмешательств, таких как прием высокоточных пищевых добавок [159], протоколы физических упражнений, адаптированные к метаболической чувствительности, или терапия, ориентированная на микробиом.
Кроме того, включение лонгитюдных наборов данных omics с клиническими переменными и переменными образа жизни в прогностические сетевые модели может позволить более раннее выявление лиц, подверженных риску, что позволит принять профилактические меры до клинически очевидного снижения мышечной массы [160]. Кроме того, ожидается, что увеличение инвестиций в биомедицинские базы данных [161] и аппаратную инфраструктуру [162] еще больше ускорит применение персонализированной и точной медицины при саркопении и связанных с ней состояниях [163]. В конечном счете, системная биология может привести к переходу от общепринятых методов лечения саркопении к подходам точной медицины, тем самым улучшая терапевтическую эффективность и показатели здоровья у неоднородных стареющих групп населения.
5. Conclusions
Саркопения представляет собой серьезную проблему для гериатрического здравоохранения, влияя на мышечную массу, силу и общее качество жизни пожилых людей. Патофизиология саркопении включает в себя взаимодействие множества факторов, таких как дисфункция митохондрий, воспаление, гормональные изменения и нервно-мышечные нарушения. К сожалению, международный консенсус по поводу диагностики и лечения саркопении отсутствует. Тем не менее, системная биология доказала свою ценность в исследованиях саркопении, способствуя выявлению биомаркеров, совершенствованию диагностических инструментов и выявлению потенциальных фармакологических вмешательств. По мере развития исследований эти достижения могут в конечном итоге привести к улучшению состояния мышц и повышению качества жизни стареющего населения, что позволит снизить растущее бремя саркопении для систем здравоохранения во всем мире.
 Рисунок 1. На этом рисунке представлен обзор статьи, включающий определение, диагностические подходы и терапевтические стратегии при саркопении. Хотя не было достигнуто универсального консенсуса относительно диагностических критериев, обычно используемые инструменты клинической оценки включают SARC-F [7], SARC-CalF [7], SARC-F+EBM [7], окружность икры [7], силу хвата за руку [7], время стояния на стуле [7], походку. скорость [7], время выполнения теста [7], компьютерная томография (КТ) [8], магнитно-резонансная томография (МРТ) [8], двухэнергетическая рентгеновская абсорбциометрия (DXA) [8] и анализ биоэлектрического импеданса (BIA) [8]. В настоящее время ни одно фармакологическое лечение не получило одобрения FDA; однако в нескольких клинических испытаниях изучаются потенциальные терапевтические агенты, включая ACE-083 [9], GSK-2881078 [10], MK-0773 [11], тестостерон [12], витамин D [13], RJx-01 [14], Эстроген [15], Периндоприл [16], MG-132 [17] и троглитазон [17] среди других.
Рисунок 1. На этом рисунке представлен обзор статьи, включающий определение, диагностические подходы и терапевтические стратегии при саркопении. Хотя не было достигнуто универсального консенсуса относительно диагностических критериев, обычно используемые инструменты клинической оценки включают SARC-F [7], SARC-CalF [7], SARC-F+EBM [7], окружность икры [7], силу хвата за руку [7], время стояния на стуле [7], походку. скорость [7], время выполнения теста [7], компьютерная томография (КТ) [8], магнитно-резонансная томография (МРТ) [8], двухэнергетическая рентгеновская абсорбциометрия (DXA) [8] и анализ биоэлектрического импеданса (BIA) [8]. В настоящее время ни одно фармакологическое лечение не получило одобрения FDA; однако в нескольких клинических испытаниях изучаются потенциальные терапевтические агенты, включая ACE-083 [9], GSK-2881078 [10], MK-0773 [11], тестостерон [12], витамин D [13], RJx-01 [14], Эстроген [15], Периндоприл [16], MG-132 [17] и троглитазон [17] среди других.
 Рисунок 2. Патофизиология саркопении сложна и разнообразна. По мере роста воспаления, митохондриальной дисфункции и активных форм кислорода (АФК) в мышцах, пораженных саркопенией, уменьшается количество миофибрилл, сателлитных клеток, двигательных нейронов и нервно-мышечных соединений, а также анаболических гормонов.
Рисунок 2. Патофизиология саркопении сложна и разнообразна. По мере роста воспаления, митохондриальной дисфункции и активных форм кислорода (АФК) в мышцах, пораженных саркопенией, уменьшается количество миофибрилл, сателлитных клеток, двигательных нейронов и нервно-мышечных соединений, а также анаболических гормонов.  Рисунок 3. Системная биология использует различные методологии из других дисциплин для понимания сложной природы организмов. Эти методологии в основном можно разделить на четыре категории: высокопроизводительные технологии, вычислительные методы, математическое моделирование и методы визуализации.
Рисунок 3. Системная биология использует различные методологии из других дисциплин для понимания сложной природы организмов. Эти методологии в основном можно разделить на четыре категории: высокопроизводительные технологии, вычислительные методы, математическое моделирование и методы визуализации.