Кольцевые экстрахромосомные ДНК (ecDNAs) присутствуют при большинстве типов рака и связаны с плохим исходом у пациентов1. ecDNAs обычно имеют размер от 50 кб до 1 Мб и имеют низкую плотность нуклеосом и высокие уровни транскрипции, что приводит к повышенной экспрессии онкогенов, когда они присутствуют5,6. Это дает преимущество в росте клеткам-реципиентам и преимущественное сохранение ecDNA, экспрессирующих онкоген. ecDNA реплицируются автономно, примерно один раз за клеточный цикл7; однако отсутствие центромеры приводит к их неравномерной сегрегации при митозе8,9, что приводит к гетерогенности рака и усилению онкогена в дочерних клетках10. Это способствует развитию опухоли, устойчивости к лечению и увеличению количества копий ecDNA по мере прогрессирования рака. В соответствии с этим, ecDNA предсказывают 43% случаев рака пищевода высокой степени злокачественности и сохраняются на ранних и поздних стадиях рака.
Рекомбинация V(D)J жизненно важна для создания разнообразия генов иммуноглобулинов и Т-клеточных рецепторов (TCR). Она катализируется белками гена, активирующего рекомбинацию (RAG),
RAG1 и RAG2, которые объединяют комплементарные сегменты генов V, D или J в синаптический комплекс путем связывания с соседними последовательностями рекомбинационных сигналов (RSSs)
2. RSS состоят из консервативных гептамерных и неамерных последовательностей, разделенных неконсервативным спейсером длиной 12 ± 1 или 23 ± 1 п.о., причем рекомбинация происходит почти исключительно между RSS с разной длиной спейсера
13. После расщепления на границе сегмента гена и RSS сегменты гена соединяются для получения вариабельных экзонов иммуноглобулинов или TCR, в то время как промежуточная ДНК обычно удаляется
2,3. Сигнальные последовательности на вырезанной ДНК соединяются вместе, образуя сигнальное соединение (SJ) на ESC
2,3 (рис. 1а). ESC из локусов легкой цепи иммуноглобулина обычно имеют размер от 50 Кб до 1 Мб.
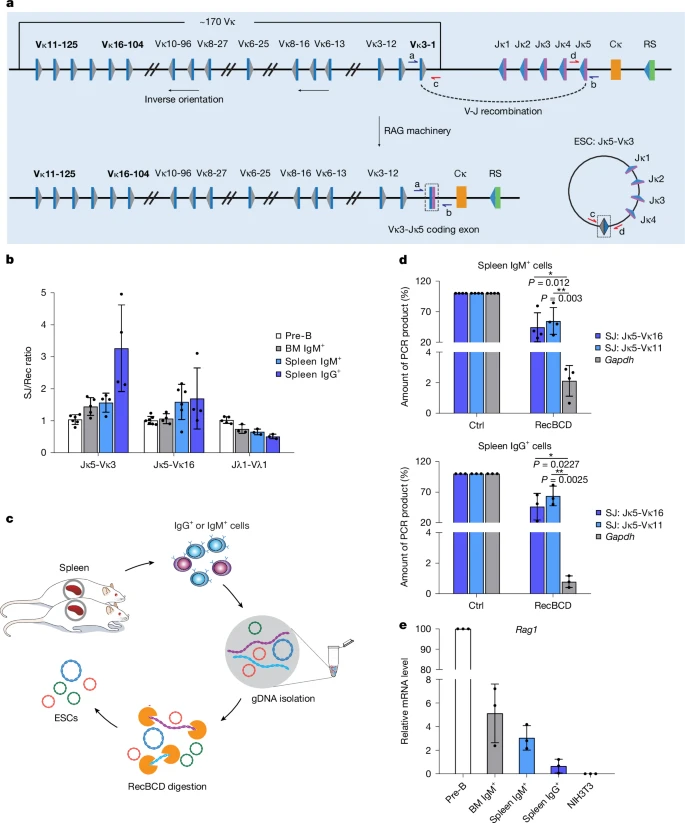 Fig. 1: RAG-generated extrachromosomal circular DNAs persist throughout mouse B cell development.
Fig. 1: RAG-generated extrachromosomal circular DNAs persist throughout mouse B cell development.
a, Schematic of the mouse immunoglobulin kappa (Igk) locus, highlighting the gene segments studied: V?16-104, V?3-1 and V?11-125, which undergo deletional recombination to generate an ESC. All Igl recombination reactions are deletional. Grey and blue triangles represent 12- and 23-RSSs, respectively; blue and purple rectangles represent V and J gene segments, respectively; the orange rectangle represents the constant region exon; the RS element is depicted by a green rectangle. b, Ratio of SJs to recombination junctions (Rec) at sequential stages of B cell development as determined by absolute qPCR for J?5-V?3-1, J?5-V?16-104 and J?1-V?1 and compared with the ratio in pre-B cells, which was set at 1:1 for ease of comparison. n = 3 samples. BM, bone marrow. c, Schematic of the isolation of ESCs from mouse mature B cells. Splenocytes were isolated from six-week-old mice and purified by flow cytometry to obtain IgM+ and IgG+ B cells (Supplementary Fig. 1); genomic DNA (gDNA) was extracted and digested with RecBCD to remove linear DNA. d, J?5-V?11-125 and J?5-V?16-104 ESCs persist as circles in mouse mature B cells (IgM+, upper and IgG+, lower). The amount of undigested DNA was determined by qPCR. Gapdh (encoded by linear, genomic DNA) was used as a negative control; untreated DNA was a further control (Ctrl). P values were determined by an unpaired, two-tailed Student’s t-test. Comparison versus Gapdh, 95% confidence interval: IgM+ J?5-V?11-125, -71.36 to -13.20; IgM+ J?5-V?16-104, -79.49 to -25.81; IgG+ J?5-V?11-125, -80.44 to -10.43; IgG+ J?5-V?16-104, -88.83 to -37.15. n = 3 samples. e, Rag1 expression levels at different stages of mouse B cell development as determined by quantitative PCR with reverse transcription (RT–qPCR). Data are normalized to Hprt expression levels. NIH3T3 cDNA is a negative control. n = 3 samples. Mean values are shown; error bars represent s.d.
Первоначально считалось, что ESCs являются инертными, не поддающимися репликации единицами, которые разлагаются в процессе клеточного деления4. Однако теперь известно, что ESCs вызывают нестабильность генома с помощью двух взаимосвязанных механизмов. Во-первых, RAG повторно связываются с ESC SJ, чтобы катализировать реинтеграцию ESC в RSS-подобные последовательности, известные как криптические RSS (cRSSs), в реакции, которая требует расщепления как ESC SJ, так и геномного cRSS14-16. Хотя частота реинтеграции неизвестна, она может вызывать инсерционный мутагенез в "горячих точках" генов-супрессоров опухолей при остром лимфобластном лейкозе Т-клеточного типа (T-ALL)17. Во–вторых, комплекс RAG-ESC запускает двухцепочечные разрывы ДНК (DSBs) в cRSSs посредством реакции "вырезать и запустить". В этой реакции комплекс RAG–ESC синапсирует с геномным cRSS, но, в отличие от реинтеграции, сокращается только cRSS18. Расщепленный cRSS высвобождается в виде DSB, в то время как комплекс RAG–ESC остается неповрежденным, что потенциально может вызвать дальнейшие DSBs18. Важно отметить, что DSB, вызванные реакцией "отключись и беги", локализуются со многими структурными вариантами (SV), обнаруженными при остром лимфобластном лейкозе ETV6-RUNX1 (ALL)19, и соответствуют часто мутирующим генам в ALL-предшественниках В–клеток (BCP-ALLs)18, это означает, что состояние "отключись и беги" способствует развитию BCP-ALL.
Современная догма гласит, что ESCs разбавляются во время деления клеток и постепенно уменьшаются в количестве до незначительного уровня20,21. Считалось, что это, наряду с подавлением регуляции белков RAG после продуктивной рекомбинации легких цепей иммуноглобулина (IgL)22 или TCRα/γ–рекомбинации, ограничивает потенциально вредное воздействие комплекса RAG-ESC. Однако здесь мы показываем, что ESCs реплицируются и сохраняются в течение нескольких клеточных делений. Более того, как и в случае с ecDNA, высокое количество копий ESCs коррелирует с плохим прогнозом развития рака, что указывает на то, что ESCs также играют ключевую роль в прогрессировании рака.
ESCs persist to mature B cells in mice
ESCs в виде вырезанных кружочков TCR присутствуют у молодых тимусных эмигрантов и сохраняются в циркулирующих лимфоцитах в течение приблизительно двух недель у цыплят и, возможно, гораздо дольше у приматов23-25. Аналогичным образом, каппа-делетирующие кольца рекомбинационного вырезания, образующиеся в результате рекомбинации между интроном Jk–Ck RSS и каппа-делетирующим элементом (KDE у людей, RS у мышей), обнаружены примерно в 30% Igk+ B-клеток и почти во всех вновь образованных Igλ+ B-клетках4. Экспрессия гена RAG снижается после продуктивной перестройки и редактирования TCRα/γ и Igl22, и, следовательно, выработка ESC вне тимуса и костного мозга незначительна. Кроме того, считается, что ESC не поддаются репликации4 и теряются при делении клеток. Однако, чтобы проверить, реплицируются ли ESC, подобно ecDNA, и наследуются ли они, мы очистили геномную ДНК из пре-В-клеток и IgM+ В-клеток из костного мозга мыши, а также IgM+ и IgG+ В-клеток из селезенки мыши.
Несколько продуктов рекомбинации IgL были исследованы из локусов иммуноглобулина каппа (Igk) и лямбда (Igl) вместе с соответствующими им ESC с помощью количественной ПЦР (qPCR) с использованием стандартов с известным количеством копий исследуемого продукта ПЦР. Локус Igk подвергается как делеционной рекомбинации, при которой SJ обнаруживается во внехромосомных ESC, так и инверсионной рекомбинации, при которой SJ сохраняются в геноме; наш анализ был сосредоточен исключительно на событиях делеции (рис. 1а). Примечательно, что соотношение SJ:рекомбинационных соединений демонстрирует лишь незначительные различия на всех стадиях созревания В-клеток и даже, по-видимому, увеличивается в клетках IgG+ для ESC Jk5-Vk3-1 и Jk5-Vk16-104 (рис. 1b и расширенные данные рис. 1a). Это увеличение не может быть объяснено удалением рекомбинационного соединения посредством вторичной рекомбинации, поскольку соотношение рекомбинационного соединения с другими областями генома сохраняется на протяжении всего развития В-клеток (расширенные данные на рис. 1б). Учитывая, что для превращения клеток IgM+ в клетки IgG+ требуется по меньшей мере шесть клеточных делений26, эти данные подразумевают, что SJs в ESC реплицируются и наследуются. Действительно, в отсутствие репликации ESCs были бы разбавлены до 1,6% или менее от их соответствующего рекомбинационного соединения в клетках IgG+.
Однако остается возможным, что ESCs реинтегрировались в геном и были реплицированы как часть геномной ДНК. Реинтеграция не могла произойти путем вскрытия SJ, поскольку анализ для выявления ESCs включает амплификацию интактных SJ. Однако, в принципе, реинтеграция могла бы произойти посредством рекомбинации между RSS на ESC (рис. 1а) и RSS в геноме, что привело бы к вставке интактного SJ. Ожидается, что частота таких событий будет низкой 15-17, но, чтобы исключить эту возможность, мы проверили, сохраняются ли ESCs в виде внехромосомных кругов в клетках IgM+ и IgG+ B...
Наличие значительно более высоких фракций ESCs по сравнению с Gapdh после лечения убедительно указывает на то, что ESCs имеют круглую форму в IgM+ и IgG+ В-клетках селезенки мышей. Более того, очень низкая экспрессия Rag1 в клетках IgG+ означает, что циклические ESCs реплицируются и сохраняются с более ранних стадий, а не образуются вновь (рис. 1е).
ESCs persist to mature B cells in mice
В принципе, присутствие ESCs в зрелых лимфоцитах вряд ли будет иметь функциональные последствия из-за очень низкой экспрессии в них гена RAG. Однако RAGs аномально экспрессируется в большинстве подтипов BCP-ALL28-30 (расширенные данные, рис. 1в), и анализ кДНК из более чем 85 образцов пациентов показывает, что экспрессия RAG1, но не RAG2, значительно повышается при постановке диагноза у пациентов, у которых впоследствии развивается рецидив (расширенные данные, рис. 1в). 1d; RAG1: P = 0,0022). Таким образом, присутствие RAGs и ESC при этих видах рака может увеличить образование комплекса RAG–ESC и риск нестабильности генома в результате реакций "вырезания" или реинтеграции. Чтобы исследовать, обнаруживаются ли ESCs в первичных образцах BCP-ALL, мы сначала определили основные события рекомбинации в девяти образцах ETV6–RUNX1 BCP-ALL, используя вырожденные наборы праймеров31 для усиления перестроек в локусах легких цепей IGK и IGL человека. Полученные ПЦР-продукты были клонированы и секвенированы с последующим выравниванием последовательностей по локусам IGK и IGL (расширенные данные, рис. 2а).
Затем исследовали наличие соответствующих ESC SJs с использованием праймеров, специфичных для каждого образца. Используя эту стратегию, SJS с предсказанными последовательностями были обнаружены у шести из девяти проанализированных пациентов (расширенные данные, рис. 2b), причем у каждого пациента было от одного до трех различных SJS. Поскольку каждое событие рекомбинации генерирует только один ESCs а в этих злокачественных новообразованиях присутствуют миллионы клеток, возможность обнаружения SJs в этих образцах позволяет предположить, что эти ESCs реплицировались и сохранялись на протяжении многих клеточных делений...
Чтобы убедиться, что SJS в BCP-ALL присутствуют в виде внехромосомных колец, из образцов пациентов была получена высокомолекулярная ДНК с использованием условий, минимизирующих сдвиг ДНК. После обработки RecBCD для удаления линейной ДНК SJS были амплифицированы методом цифровой ПЦР с использованием капель (ddPCR). В соответствии с их присутствием во внехромосомных кругах, SJS были амплифицированы до аналогичного уровня с обработкой RecBCD или без нее; напротив, RecBCD снижал уровень контрольной линейной ДНК (GAPDH) примерно до 7% от уровня необработанной ДНК (расширенные данные, рис. 2d).
Чтобы лучше определить долю пациентов с BCP-ALL, несущих ESCs мы затем использовали доступные данные полногеномного секвенирования (WGS) пациентов с ETV6-RUNX1 BCP–ALL и повторно проанализировали их на наличие ESCs. ДНК готовят для WGS путем разделения на фрагменты длиной в среднем 500 п.н., и секвенируют приблизительно по 35-50 п.н. на каждом конце. Если секвенированный фрагмент содержит ESC SJ, соответствующие парные считывания помечаются как "несогласованные" при сопоставлении с геномом, поскольку считывания располагаются гораздо дальше друг от друга, чем ожидалось, и, по-видимому, направлены навстречу друг другу, а не друг от друга удалены. Поэтому для выявления ESCs мы сопоставили данные WGS от 61 пациента с ETV6–RUNX1 BCP-ALL (Европейский архив геномных феноменов: EGAD00001000116) с геномом человека и отфильтровали данные, соответствующие вышеуказанным критериям. Мы выявили ESCs у 51 из 61 пациента, причем у каждого пациента было от 1 до 27 различных ESCs (Расширенные данные на рис. 2е и дополнительная таблица 1). Из-за низкой глубины секвенирования и того факта, что ESC будет идентифицирован только в том случае, если разделенное считывание будет расположено точно поперек SJ, эти данные не позволяют количественно оценить ESC. Тем не менее, они полностью подтверждают наличие ESCs у большинства пациентов с ETV6–RUNX1 BCP-ALL и демонстрируют, что у каждого человека может быть несколько ESCs.
Сосуществование ESCs и RAGs при BCP-ALL может привести к увеличению мутаций, опосредованных RAG–ESC, и прогрессированию заболевания. Однако потенциальный эффект повышенной активности RAG–ESC зависит от количества ESCs и периода времени, в течение которого они присутствуют. Чтобы исследовать это, мы разработали анализы для выявления всех случаев рекомбинации IGK и IGL, а также всех IGK и IGL SJ. Эти анализы, рекомбинация, опосредованная линейной амплификацией (LAM), и LAM-ESC, основаны на высокопроизводительном полногеномном транслокационном секвенировании (LAM-HTGTS)32 и включают линейную амплификацию с использованием биотинилированных праймеров в отношении J-областей через VJ-кодирующие переходы или ESC-SJS (Расширенные данные, рис. 3а,б). Затем отбираются биотинилированные продукты, лигируются адаптеры и кодирующие соединения или SJS амплифицируются с помощью ПЦР. После ампликонного секвенирования продуктов полученные последовательности сопоставляются с заказными справочными базами данных, которые включают все возможные события рекомбинации IGK/IGL или IGK/IGL SJs33 (https://github.com/Boyes-Lab/LAM-ESC-Recombination ), но исключают события рекомбинации внутри области kv34 и их SJS.
Используя методы LAM-рекомбинации и LAM-ESC, мы проанализировали 71 образец, взятый при постановке диагноза у пациентов с BCP-ALL, у 34 из которых впоследствии произошел рецидив. В дополнение к первичному процессу рекомбинации наблюдалось множество вторичных процессов рекомбинации, что указывает на продолжающуюся активность rag
29 (Дополнительная таблица 2). Дополнительные данные LAM-ESC показывают, что у каждого пациента было несколько ESCs и что количество копий ESCs сильно варьировалось (рис. 2а и дополнительная таблица 3). Примечательно, что сравнение нормализованных результатов секвенирования LAM-ESC между пациентами, у которых впоследствии был рецидив, и теми, у кого впоследствии не было рецидива, показывает, что у пациентов, у которых впоследствии был рецидив, присутствовало значительно больше ESC на повышенных уровнях (рис. 2а,б; Р = 0,00017). Напротив, у большинства пациентов, у которых не было рецидива, количество копий ESC было близко к таковым в здоровой крови или костном мозге (рис. 2а). Учитывая, что абсолютное количество копий ESC, определенное с помощью ddPCR, хорошо коррелировало с количеством считываний нормализованной последовательности (расширенные данные на рис. 4a) и что эксперименты с ddPCR независимо подтвердили аналогичное кратное увеличение уровней SJ у пациентов, у которых впоследствии произошел рецидив (расширенные данные, рис. 4b), эти данные подразумевают, что у пациентов, у которых впоследствии произошел рецидив, наблюдалась повышенная репликация и/или персистенция ESC. Не было обнаружено никакой корреляции между экспрессией RAG1 или RAG2 и количеством копий ESC (расширенные данные на фиг. 4c), и даже в образцах BCP-ALL, в которых экспрессия RAG1 была очень схожей, повышенное количество копий ESC наблюдалось у пациентов, у которых впоследствии наблюдался рецидив, но не у тех, у кого его не было (рис. 2c; P = 0,0156). Различия в опухолевой инфильтрации также не объясняют изменения уровней ESC, поскольку уровни лейкозных бластов были одинаковыми (более 90%) в обеих группах пациентов (Дополнительная таблица 4).
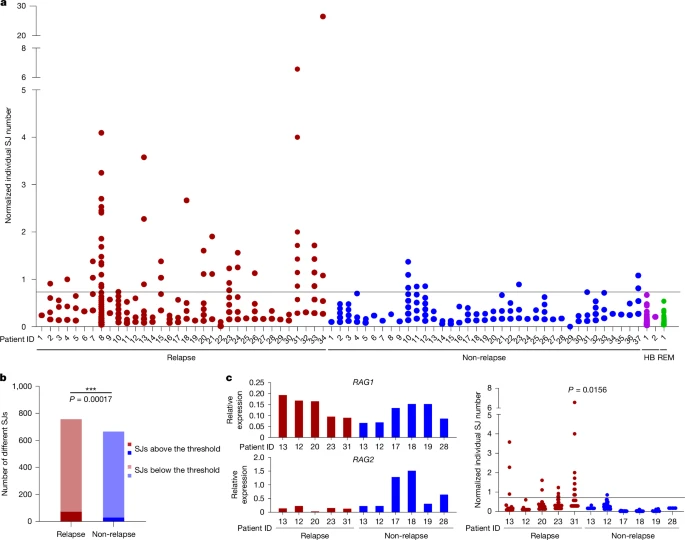 Fig. 2: High SJ copy numbers at diagnosis correlate with subsequent relapse...
Fig. 2: High SJ copy numbers at diagnosis correlate with subsequent relapse... High ESC replication coupled to relapse
Увеличение числа копий ESC у пациентов, у которых впоследствии возникает рецидив, означает, что ESC реплицируются. В соответствии с этим, мы идентифицировали семь SJS, которые были более многочисленны, чем их соответствующие рекомбинационные соединения, используя ddPCR (Расширенные данные, рис. 4d). Аналогичным образом, сравнение количества SJS и рекомбинационных переходов при перестройках KDE-KV2-30 и KDE-KV3-20 в 48 образцах показывает, что количество SJS было значительно выше у пациентов, у которых впоследствии наблюдался рецидив (KDE-KV2-30: P = 0,0461, KDE-KV3-20: P = 9,25 х 10-5). Напротив, гораздо меньшее увеличение (KDE-KV2-30: P = 0,0756, KDE-KV3-20: P = 0,0173) наблюдалось в соответствующих рекомбинационных соединениях (расширенные данные на рис. 4e,f).
Чтобы исследовать степень репликации ESC, мы использовали тот факт, что при генерации каждого ESC в геноме образуется соответствующий рекомбинационный "след". Если клетки претерпевают множественные деления после генерации ESC, то будет несколько копий соответствующего рекомбинационного соединения. Напротив, если ESC был создан недавно, то будет присутствовать меньше копий его рекомбинационного соединения (рис. 3а). Чтобы измерить тиражирование ESC, когда влияние постоянства ESC минимально, мы сосредоточились на недавно созданных ESC. С этой целью мы исследовали ESC, соответствующие нижним пределам обнаруживаемых значений LAM-рекомбинации ~0,2 нормализованных значений); как показано на рис. 3b, отношение этих значений SJS к соответствующему рекомбинационному соединению было значительно выше у пациентов, у которых впоследствии произошел рецидив, что подразумевает повышенную репликацию ESC у пациентов, склонных к рецидивам. Примечательно, что из недавно полученных ESCs 11 были идентичны в обеих группах пациентов (расширенные данные, рис. 5а). После проверки того, что эти ESCs действительно были получены недавно, путем измерения соответствующего рекомбинационного перехода с помощью ddPCR, мы определили количественные уровни SJ. Недавно сформированные SJS присутствовали в значительно более высоких концентрациях у пациентов, у которых впоследствии наблюдался рецидив (рис. 3в; Р = 0,001). Учитывая, что в обеих группах пациентов была исследована точно такая же последовательность SJ, это увеличение репликации не может быть связано с последовательностью ESC. Вместо этого, вполне вероятно, что факторы, присущие клеткам, которые присутствуют при постановке диагноза, вызывают повышенную репликацию ESC у пациентов, у которых впоследствии возникает рецидив.
 Рис. 3: Повышенная репликация ESC у пациентов с BCP - у всех, у кого позже возникает рецидив.
Рис. 3: Повышенная репликация ESC у пациентов с BCP - у всех, у кого позже возникает рецидив.
Чтобы исследовать, что это могут быть за факторы, присущие клетке, мы воспользовались имеющимися данными о секвенировании РНК (RNA-seq)(https://www.cancer.gov/ccg/research/genome-sequencing/target , субисследование dbGaP ID: phs000464), полученное при постановке диагноза от 123 пациентов с BCP-ALL, у 74 из которых впоследствии произошел рецидив. Используя DESeq2 с последующим анализом обогащения набора генов (GSEA), мы обнаружили значительно повышенную экспрессию генов репарации ДНК (P = 0,0095; рис. 3d) у пациентов, которые были склонны к рецидивам. Опубликованные данные одноклеточного анализа РНК-последовательности клеточных линий нейробластомы аналогичным образом показали повышенную экспрессию генов PCNA, POLE3 и RPA2, ассоциированных с репликацией, что соответствует высокому уровню ecDNA 35. Таким образом, вполне вероятно, что продукты генов, связанные с репликацией и репарацией, усиливают репликацию ESC; в соответствии с этим, значительно повышенная экспрессия PCNA, RBX1, POLE3 и POLE4 наблюдалась у пациентов с высоким уровнем SJs, у которых позже наблюдался рецидив (рис. 3е), но не у пациентов с низким уровнем SJs, независимо от того, были ли они активированы. и от того, были ли у них рецидивы (рис. 3е). Кроме того, анализ данных RNA-seq (EGAS00001006863) от семи пациентов с известными уровнями SJ (рис. 2а) с использованием DESeq2 и GSEA показал, что экспрессия PCNA, RBX1, POLE3 и POLE4 была значительно повышена у пациентов с высокими уровнями SJ по сравнению с пациентами с низкими уровнями SJ (расширенные данные на рис. 2а). 5b) и что у пациентов с высоким уровнем SJ наблюдалось значительное увеличение экспрессии генов репарации ДНК (рис. 3f). Таким образом, эти данные связывают более высокую экспрессию генов, связанных с репликацией и репарацией, с увеличением числа копий ESC, хотя причинно-следственная связь с репликацией ESC еще не установлена. Тем не менее, ранее идентифицированные сайты инициации репликации36 присутствуют в последовательностях ESC IGK и IGL (расширенные данные, рис. 6), что позволяет предположить, что ESCs могут реплицироваться эукариотическим путем.
ESCs persist through many cell divisions...
ESC distribution in BCP-ALL
Чтобы дополнительно проверить это и более точно определить распределение ESC, мы провели скрининг интерфазных ядер на наличие сигналов ESC FISH, которые отличались бы от контрольных (хромосомных) сигналов. У пациента с уровнями ESCs аналогичными уровням у пациентов, у которых позже произошел рецидив (пациент Р; Расширенные данные, рис. 8а), ESCs наблюдались примерно в 50% клеток, при этом в некоторых клетках наблюдалось заметное скопление из 3-7 ESCs (рис. 4d–f и расширенные данные, рис. 8b). Напротив, у пациентов с уровнями ESCs аналогичными таковым у пациентов, у которых сохранялась ремиссия (пациенты M и N; расширенные данные, рис. 8а), ESCs были обнаружены в меньшем количестве клеток, только с одним или иногда двумя ESCs на клетку (рис. 4d). Примечательно, что эти интерфазные сигналы FISH показали высокое соответствие с относительными уровнями DAPI-окрашенных нехромосомных ДНК (расширенные данные, рис. 8с), и при наличии повышенных уровней ESCs проявляли заметную внутриопухолевую гетерогенность (рис. 4d). Мы также обнаружили присутствие ESCs IGK и IGL в одной и той же клетке (рис. 4g). Учитывая, что одновременная рекомбинация обоих локусов крайне маловероятна, сосуществование трех ESCs IGK и одного ESCs IGL подтверждает идею о том, что ESCs реплицируются и сохраняются.
Аналогичным образом, в одной клетке было обнаружено семь ESC, полученных в результате рекомбинации в KDE (рис. 4h). Существует только два RSS-файла KDE; следовательно, максимальное количество ESC, которое может быть получено в результате рекомбинации в KDE, равно двум. Таким образом, присутствие семи ESC в одной клетке было убедительным признаком репликации ESC. Чтобы убедиться в этом, мы подготовили метафазные спреды хромосом из клеток BCP-ALL, которые культивировали в присутствии бромдезоксиуридина (BrdU), а затем блокировали при митозе. После гибридизации с антителами к BrdU мы наблюдали сигналы, совпадающие с DAPI-окрашенными нехромосомными ДНК, подтверждающие репликацию ESC (расширенные данные, рис. 8d).
ESC copy number and BCP-ALL progression
Наличие большого количества ESC-копий в нескольких поколениях увеличивает совокупный риск повреждения ДНК и может привести к клональной экспансии клеток с большим количеством ESC-копий. В соответствии с этим, SJS с высоким числом копий были связаны с большей долей клеток, которые подверглись многочисленным делениям (основные события рекомбинации; рис. 4b, слева), чем клетки с низким числом копий (ниже порогового значения) (рис. 4b, справа). Затем мы попытались определить, как количество копий ESC на момент постановки диагноза влияло на прогрессирование BCP-ALL. При других видах рака ecDNA приводят к ухудшению прогноза за счет увеличения числа копий онкогена1,42, действуя как мобильные усилители43, или за счет интеграции ecDNA в ген-супрессор опухолей44. На ESCs из локусов IGK–IGL или TCRA–TCRG нет известных онкогенов, а в удаленных V-J областях человеческих локусов нет известных энхансеров. Аналогично, несмотря на то, что рекомбинация с KDE генерирует ESCs которые содержат два сильных усилителя — iEk и 3 'Ek45,46, — такие ESCs значительно обогащены и обнаруживаются у пациентов, у которых позже развивается рецидив (расширенные данные на фиг. 8e–g), у пациентов, у которых отсутствуют ESCs KV-KDE, тем не менее, развивается рецидив (Дополнительная таблица 3). Таким образом, хотя ESCs могут способствовать злокачественности, действуя как мобильные усилители, ESCs вероятно, влияют на прогрессирование заболевания другими механизмами.
ESC вызывают повышенное количество мутаций при соединении с белками RAG, вызывая либо реинтеграцию ESC в cRSSs, либо реакцию "выключи и беги", которая приводит к образованию DSB в cRSSs. Обе реакции приводят к образованию SV, которые имеют cRSS только с одной стороны от точки остановки14,18. RAGs также вызывают изменения генома, которые не зависят от ESC, посредством нецелевой рекомбинации между двумя CRSS, что приводит к инсерционно-делеционным мутациям или транслокациям хромосом с CRSS по обе стороны точки останова19,47. Чтобы проверить, вносит ли комплекс RAG–ESC значительный вклад в мутации, обнаруженные при BCP-ALL, мы изучили SVS в данных WGS о пациентах с BCP-ALL, используя терапевтически применимые исследования для получения данных об эффективных методах лечения . (https://www.cancer.gov/ccg/research/genome-sequencing/target ; Идентификатор дополнительного исследования dbGaP: phs000464). Используя 150 последовательностей пациентов, полученных при постановке диагноза по всем подтипам BCP-ALL, мы сначала рассчитали долю SV с одним или двумя CRSS в точке останова. В соответствии с предыдущими данными 19, CRSS присутствовали почти в 40% точек останова (38,4%); из них почти в 62% был один CRSS и в 36,4% было два CRSS (расширенные данные на рис. 9а). Чтобы определить вероятную причину сбоев в работе отдельных CRSS, мы использовали собственный скрипт48 (https://github.com/Boyes-Lab/NGS-Analysis ), который показал, что "вырезать и прогнать"18 происходит более чем в 60 раз чаще, чем реинтеграция14-16 или вставки, опосредованные rag49 (расширенные данные, рис. 9а).
Затем мы сравнили количество рецидивов у пациентов и обнаружили значительное увеличение числа рецидивов с cRSSs только по одну сторону границы у пациентов, у которых впоследствии был рецидив, по сравнению с теми, у кого его не было (рис. 5а, слева). Более того, в соответствии с приведенным выше анализом, частота рецидивов с одним cRSS в точке останова (рис. 5а, слева) была намного выше, чем у пациентов с CRSS по обе стороны от точки останова (рис. 5а, справа; средний рецидив: 27,19 против 8,27, средний безрецидивный: 23,48 против 4.635), что указывает на большую роль мутаций, опосредованных RAG–ESC.
 Fig. 5: Association between increased ESC-mediated mutations and relapse.
Fig. 5: Association between increased ESC-mediated mutations and relapse.
Повышенный уровень ESCs у пациентов на момент постановки диагноза означает, что комплекс RAG–ESC продолжает вызывать повреждения в период между постановкой диагноза и рецидивом. Поэтому мы сравнили данные WGS из 83 сопоставимых образцов, взятых на момент постановки диагноза и рецидива. Сосредоточив внимание на SV рядом с генами, которые часто мутируют при рецидиве50,51, мы обнаружили значительно больше SV с CRSS на одной стороне точки останова, которые специфически присутствуют при рецидиве, по сравнению с другими SV (рис. 5b). Аналогичным образом, повторный анализ доступных данных LAM-HTGTS 18 (NCBI SRA: PRJNA483469) показал значительное усиление воздействия комплекса RAG-ESC на гены, ассоциированные с рецидивом, по сравнению с комплексом RAG-RSS в клетках, полученных от пациента с рецидивирующим ETV6–RUNX1 BCP–ALL (рис. 5в).. В совокупности эти данные свидетельствуют о том, что продолжающаяся активность комплекса RAG–ESC запускает мутации в генах, которые связаны с рецидивом.
Чтобы проверить, существует ли прямая связь между повышенными уровнями ESC и SVS при единичных CRSS, мы проанализировали данные WGS (EGAS00001006863) и секвенирования всего экзома (WES) пациентов с BCP-ALL, у которых мы измеряли уровни экспрессии генов SJ и RAG (рис. 2а и расширенные данные рис. 1d).). В соответствии с идеей о том, что комплекс RAG–ESC запускает мутации, связанные с рецидивом, мы наблюдали значительное увеличение SVs при наличии единственного cRSS в точке останова в генах, связанных с рецидивом, у пациентов с высоким уровнем SJs плюс высокой экспрессией RAG1 по сравнению с пациентами с высокой экспрессией RAG1 плюс низким уровнем SJs или низкой экспрессией RAG1 плюс низким уровнем SJS. SJs (Расширенные данные, рис. 9b–d). Более того, у пациента с высоким уровнем SJs мы наблюдали клональную экспансию SV по единственному cRSS в гене тирозинкиназы селезенки (SYK) между постановкой диагноза и рецидивом (расширенные данные, рис. 9е).
Если реакции, связанные с ESCs действительно лежат в основе мутаций, приводящих к рецидиву, то можно ожидать, что наличие достаточного количества копий ESCs во время постановки диагноза или до него приведет к увеличению числа клеток, содержащих ESCs в результате рецидива. Поэтому мы провели LAM-рекомбинацию на образцах, взятых при рецидиве, в тех случаях, когда у пациентов на момент постановки диагноза было высокое количество копий ESC. Частота некоторых рекомбинационных соединений оставалась неизменной или даже снижалась в период между постановкой диагноза и рецидивом, возможно, из-за потери соответствующих клеток, вызванной лечением (дополнительная таблица 2). Однако в других случаях наблюдалось заметное увеличение значений нормализованного секвенирования (расширенные данные, рис. 10а), и это наблюдение было подтверждено методом ddPCR в десяти случаях (рис. 5d).
Затем мы проверили, связана ли клональная экспансия, измеряемая увеличением числа рекомбинационных соединений, с наличием соответствующих ESCs на момент постановки диагноза. Примечательно, что соответствующие ESC были обнаружен в каждом случае клональной экспансии, но только в 58% случаев, когда не наблюдалось расширения рекомбинационных связей, и в этих последних случаях количество копий ESC часто было ниже (расширенные данные, рис. 10b). Эта корреляция примечательна и согласуется с идеей о том, что мутагенез, опосредованный ESCs способствует прогрессированию заболевания до рецидива.
Еще один прогноз заключается в том, что если ESCs действительно размножаются и сохраняются, то одни и те же ESCs должны быть обнаружены как при диагностике, так и при рецидиве. Примечательно, мы обнаружили, что все ESCs сохранялись (рис. 5е) в одном случае более семи лет, а в двух - более четырех лет. Количественная оценка SJS при постановке диагноза и при рецидиве показала, что некоторые из них увеличились, в то время как другие немного уменьшились, что подтверждает идею о том, что SJS находится во внехромосомном кольце , а не интегрирован в геном.
Наконец, если активность ESC вызывает прогрессирование заболевания, то высокое количество копий SJ на момент постановки диагноза должно предсказывать исход заболевания. Поэтому мы повторно проанализировали данные, показывающие уровни SJ на момент постановки диагноза (рис. 2), в соответствии с подтипом BCP-ALL (Дополнительная таблица 4). Хотя геномная интеграция SJs в некоторых образцах DUX4-r (расширенные данные, рис. 10c, d) не позволила провести такой анализ для этого подтипа, была выявлена хорошая корреляция между числом копий SJ, превышающим пороговое значение, и последующим рецидивом для подтипов, которые обычно имеют хороший прогноз (ETV6–RUNX1 и высокий уровень гиперплоидности (HeH) BCP-ALL) или промежуточный прогноз (TCF3::PBX BCP-ALL) (рис. 5f и расширенные данные рис. 10e). Более того, при BCP-ALL, где PAX5 был изменен или мутировал, уровни SJ в целом были выше, но заметно отличались между пациентами с рецидивом и теми, у кого его не было, что позволяет предположить, что более высокий порог может лучше идентифицировать пациентов, подверженных риску рецидива (расширенные данные, рис. 10е). Таким образом, наши данные свидетельствуют о том, что наличие ESCs при постановке диагноза выше пороговых уровней, характерных для конкретного подтипа, часто связано с последующим рецидивом. Это убедительно свидетельствует о центральной роли ESCs в прогрессировании заболевания.
Discussion
Долгое время считалось, что ESCs инертны и растворяются в процессе деления клеток. Однако теперь ясно, что ESCs обладают биологической активностью, реплицируются и сохраняются в здоровых лимфоцитах и при BCP-ALL. При BCP-ALL сохранение повышенного числа копий ESC тесно связано с худшими исходами заболевания, что напоминает ecDNA. ESCs и ecDNAs являются внехромосомными; ESCs IGK/IGL имеют размер, аналогичный размеру ecDNAs; ESCs и ecDNAs реплицируются и сохраняются в течение нескольких клеточных делений, и обе они дают преимущество в росте раковым клеткам, когда присутствуют на повышенных уровнях5,6. Однако есть ключевые различия. В то время как ecDNA часто обеспечивают преимущество в росте за счет увеличения числа копий онкогенов10, ESC запускают мутации, в том числе в генах, вызывающих рак, и генах, связанных с рецидивом, посредством реакции "отключи и убегай"18. Эти мутации накапливаются с течением времени и наследуются всеми дочерними клетками, независимо от того, наследуют ли эти клетки ESC. Аналогичным образом, как только комплекс RAG–ESC вызовет достаточное количество мутаций в ключевых генах, дальнейшее присутствие ESC может не потребоваться. Напротив, для улучшения роста требуется непрерывная амплификация онкогенов с помощью ecDNA. Это может объяснить, почему уровни ecDNA постепенно повышаются по мере прогрессирования раковых преобразований12, в то время как уровни ESC в целом ниже и могут увеличиваться или уменьшаться в период между постановкой диагноза и рецидивом. Более того, стохастический характер, с помощью которого рекомбиназа и, следовательно, комплекс RAG–ESC находят свои мишени, означает, что в каждой клетке будут запускаться различные мутации. Это может объяснить, почему некоторые клетки с высоким числом копий ESC размножаются в период между постановкой диагноза и рецидивом, в то время как другие, возможно, те, в которых мутировало меньше генов, вызывающих рак, либо лучше поддаются лечению, либо становятся менее активными. Хотя примерно в 50% случаев высокое количество копий ESC коррелирует с последующим рецидивом, у некоторых пациентов с низким уровнем ESC на момент постановки диагноза, тем не менее, развивается рецидив. В этих случаях другие мутации, такие как делеция IKZF152 или инициирующие мутации, которые изменяют передачу сигналов, нарушая регуляцию множественных путей50, могут предрасполагать пациента к рецидиву. Тем не менее, хорошая корреляция между высокими уровнями ESC и плохим прогнозом, особенно для ETV6–RUNX1 и HeH BCP-ALL, может иметь клиническое значение. В совокупности наши данные демонстрируют, что ESCs реплицируются и наследуются и образуют комплекс с белками RAG, который может приводить к мутациям, связанным с рецидивами, и клональной экспансии (расширенные данные рис. 11).
 Fig. 1: RAG-generated extrachromosomal circular DNAs persist throughout mouse B cell development.
Fig. 1: RAG-generated extrachromosomal circular DNAs persist throughout mouse B cell development.
 Fig. 2: High SJ copy numbers at diagnosis correlate with subsequent relapse...
Fig. 2: High SJ copy numbers at diagnosis correlate with subsequent relapse...  Рис. 3: Повышенная репликация ESC у пациентов с BCP - у всех, у кого позже возникает рецидив.
Рис. 3: Повышенная репликация ESC у пациентов с BCP - у всех, у кого позже возникает рецидив.
 Fig. 5: Association between increased ESC-mediated mutations and relapse.
Fig. 5: Association between increased ESC-mediated mutations and relapse.