Пользователи: 
ФЕРРОПТОЗ И ОСТРОЕ ПОВРЕЖДЕНИЕ ПОЧЕК
Роль множественных функций эстрадиола
Multiple oestradiol functions inhibit ferroptosis and acute kidney injury Wulf Tonnus, Francesca Maremonti, Shubhangi Gavali, et al.
 Nature volume 645, pages1011–1019 (2025)
| |
Acute tubular necrosis mediates acute kidney injury (AKI) and nephron loss1, the hallmark of end-stage renal disease2,3,4. For decades, it has been known that female kidneys are less sensitive to AKI5,6. Acute tubular necrosis involves dynamic cell death propagation by ferroptosis along the tubular compartment7,8. Here we demonstrate abrogated ferroptotic cell death propagation in female kidney tubules. 17?-oestradiol establishes an anti-ferroptotic state through non-genomic and genomic mechanisms. These include the potent direct inhibition of ferroptosis by hydroxyoestradiol derivatives, which function as radical trapping antioxidants, are present at high concentrations in kidney tubules and, when exogenously applied, protect male mice from AKI. In cells, the oxidized hydroxyoestradiols are recycled by FSP19,10, but FSP1-deficient female mice were not sensitive to AKI. At the genomic level, female ESR1-deficient kidney tubules partially lose their anti-ferroptotic capacity, similar to ovariectomized mice. While ESR1 promotes the anti-ferroptotic hydropersulfide system, male tubules express pro-ferroptotic proteins of the ether lipid pathway which are suppressed by ESR1 in female tissues until menopause. In summary, we identified non-genomic and genomic mechanisms that collectively explain ferroptosis resistance in female tubules and may function as therapeutic targets for male and postmenopausal female individuals.
FSP1 (фермент, кодируемый геном AIFM2) участвует в механизмах подавления ферроптоза, регенерируя оксидированные производные эстродиола и тем самым усиливая антиферроптотическую активность в клетках. В почечных трубчатых лизатах мышей, свиней и людей экспрессия FSP1 была выше у самцов, а у самок возрастала после овариоэктомии.
|
Широкий обзор 5,4 миллионов получателей медицинской помощи Medicare продемонстрировал значительно более низкую частоту AKI у женщин 11. Аналогичным образом, многочисленные клинические исследования выявили более высокую частоту AKI и более высокую смертность, связанную с AKI, у мужчин 12-15, особенно по сравнению с женщинами в пременопаузе 16,17. Мы предположили, что такие половые различия связаны с чувствительностью к острому канальцевому некрозу (ATN) 1, отличительным признаком которого является гибель клеток в результате ферроптоза 18-20, формы некроза, катализируемого железом, и преобладающего типа гибели клеток в почечных канальцах при AKI 1,8,21. На наш взгляд, половые различия после AKI вызванного ишемически–реперфузионным повреждением (IRI), были даже более выраженными, чем ожидалось из литературы 16,22 (рис. 1а,б). Важно отметить, что половые различия были зафиксированы, когда мы сравнили изолированные почечные канальцы мышей-самцов и самок и оценили высвобождение LDH (рис. 1с). Мы отметили, что ранее описанный процесс гибели клеток в мужских канальцах (рис. 1d, Дополнительные рис. 1a, b и дополнительные видео 1 и 2), который приводит к потере целостности митохондрий (дополнительные рис. 1c–e и дополнительное видео 3), в женских канальцах отсутствовал (рис. 1e,f, Дополнительный рис. 2a,b и дополнительное видео 4). Хотя ингибитор ферроптоза ferrostatin-1 (Fer-1) предотвращал положительную реакцию на SYTOX в мужских канальцах, он не оказывал существенного влияния на женские канальцы (рис. 1g и дополнительное видео 5). Аналогичным образом, хотя Fer-1 снижал высвобождение LDH из мужских канальцев, он не защищал женские канальцы (рис. 1h). В качестве контроля были исследованы почечные канальцы с комбинированным некроптозом и пироптозно-дефицитным поражением, выделенными у мышей с двойным нокаутом Mlkl и Gsdmd, и не было выявлено существенных различий по сравнению с однопометниками дикого типа (дополнительный рис. 2с). В то время как ранее было продемонстрировано, что самцы мышей дикого типа защищены от IRI с помощью Fer-18 или его более мощного аналога UAMC-3203 23, эти небольшие молекулы не защищали самок мышей от повышения концентраций мочевины и креатинина в сыворотке крови и от структурных повреждений (рис. 1i-l и расширенные данные на рис. 1). 1a–e). Этот результат был согласован при различных исследованных дозах ишемии перед реперфузией (расширенные данные на рис. 1f–i). Трансгенные мыши Gpx4fl/flROSA26-CreERT2 погибают в течение 14 дней после активации рекомбиназы Cre 20. По сравнению с самцами–однопометниками, у таких мышей-самок был обнаружен меньший канальцевый некроз (расширенные данные, рис. 3a-c), а также более низкие концентрации креатинина и мочевины в сыворотке крови (рис. 1m, n) через 10 дней после применения тамоксифена, но не было существенной разницы в общей выживаемости (расширенные данные, рис. 3d).. В то же время не было обнаружено различий в экспрессии GPX4 в канальцах по признаку пола (расширенные данные, рис. 3е). В совокупности эти данные указывают на то, что в почечных канальцах самок прекращается размножение ферроптозных клеток, а ткань почечных канальцев эндогенно устойчива к ферроптозу.
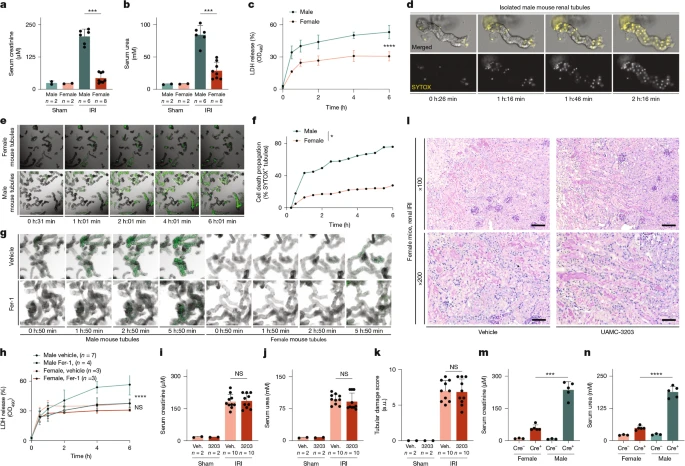 Fig. 1: Female mice are resistant to AKI and renal tubular ferroptosis propagation. Fig. 1: Female mice are resistant to AKI and renal tubular ferroptosis propagation.
Non-genomic anti-ferroptotic functions of oestradiol
Далее мы исследовали, как половые гормоны влияют на гибель ферроптозных клеток. В клеточных линиях, чувствительных к ферроптозу (клетки HT1080, клетки NIH-3T3 и клетки CD10), обработка тестостероном после индукции гибели клеток и предварительная обработка тестостероном в течение 16 часов не оказывали существенного влияния на индукцию ферроптоза всеми протестированными индукторами ферроптоза (FINs; erastin, RSL3, FIN56 и FINO2) или ферроптоцидом (FTC) (Дополнительные фиг. 3 и 4). Напротив, одновременное лечение 17β-эстрадиолом или его гидроксилированным производным 2-гидроксиоэстрадиолом (2OH-E2) защищало от ферроптоза, вызванного RSL3 (рис. 2а,б). В соответствии с ранее опубликованными анализами клеточных культур 24, 17β-эстрадиол защищал три чувствительные к ферроптозу клеточные линии от ферроптоза, вызванного erastin, FIN56, FINO2 и FTC (расширенные данные, рис. 4а–м). Сопоставимые эффекты были обнаружены после 16–часовой предварительной обработки (расширенные данные на рис. 4а-г). Мы также исследовали, насколько стойким был этот эффект после ферроптоза, вызванного RSL3, и не обнаружили снижения антиферроптозной активности по крайней мере до 6 часов лечения (расширенные данные на рис. 5а, б). Эти данные свидетельствуют о том, что устойчивость к ферроптозу обусловлена скорее эстрогеном, чем тестостероном. Учитывая, что эстрадиол и его гидроксилированное производное являются фенолами, мы предположили, что они ингибируют перекисное окисление липидов в качестве антиоксидантов, задерживающих радикалы (RTA), аналогично Fer-1 (и UAMC-3203) 25. Анализы FENIX26 не показали активности RTA в отношении холестерина, тестостерона и 17β-эстрадиола, но показали сильную активность 2OH-E2 и 4OH-E2, сравнимую с PMC положительного контроля (2,2,5,7,8-пентаметил-6-хроманола, мощного улавливателя радикалов) (рис. 2c–f и расширенные данные рис. 5c)., d). Затем мы разработали стратегию, основанную на жидкостной хроматографии и масс–спектрометрии (LC–MS), основанную на дериватизации эстрогенов (расширенные данные, рис. 5е). 5e) для непосредственного определения их уровней в ткани первичных почечных канальцев (методы). Как и ожидалось, содержание E2 и OH-E2 (пик, охватывающий как 2OH-E2, так и 4OH-E2) было выше в плазме мышей-самок по сравнению с мышами-самцами, а соотношение E2 к OH-E2 составляло 1:1 (рис. 2g и расширенные данные рис. 5f). Однако в почечных канальцах уровни E2 и OH-E2 были выше у самок мышей по сравнению с мышами-самцами, и, неожиданно, соотношение E2 к OH-E2 было существенно смещено в сторону OH-E2, демонстрируя накопление OH-E2 в этом отделе (фиг. 2h и расширенные данные на фиг.. 5f). Мы предположили, что при таком содержании 2OH-E2 может защищать ткани почечных канальцев от ферроптоза негеномным способом. Чтобы проверить это, мы обработали мужские и женские почечные канальцы экзогенным 2OH-E2. В то время как мужские канальцы демонстрировали значительно меньшее высвобождение LDH и замедление клеточной гибели, 2OH-E2 не обеспечивал дополнительной защиты женских канальцев (рис. 2i). Активность была сопоставима с Fer-1 (рис. 1h), что может быть понятно на основе аналогичной кинетики активности, с которой 2OH-E2 (kinh = 1,0 х 10 4 ± 0,1 х 10 4 М -1 s -1) и Fer-1 (kinh = 8,2 [ 10 4 ± 0,3 [ 10 4 M -1 s -1) вступают в реакцию с распространяющимися липидными пероксильными радикалами в фосфолипидных бислоях, как продемонстрировал анализ FENIX27. Антиферроптозная активность 2OH-E2, основанная на RTA, была подтверждена результатами исследования недавно созданной упрощенной структуры дигидробензола (5,6,7,8-тетрагидронафталин-2,3-диола), который обладает такой же активностью, как и 2OH-E2, в культуре клеток (расширенные данные на рис. 6a–c). Чтобы проверить эффективность экзогенного 2OH-E2 в условиях in vivo, мы применили 2OH-E2 к нашему стандартному анализу IRI почек. Как показано на фиг. 2k–n и расширенные данные Рис. 5g,h, 2OH-E2 действительно защищали мышей-самцов во всех системах считывания, протестированных на этой модели. В соответствии с этим открытием, мыши с удаленными яичниками стали чувствительны к IRI (рис. 2o–r и расширенные данные рис. 5i). Катехолы могут образовывать комплексы с железом, потенциально влияющие на его реактивность 28. Поэтому мы исследовали способность производных гидроксиоэстрогена связывать железо и обнаружили, что 4OH-E2 может функционировать как слабый хелатор железа, в то время как 2OH-E2 этого не делает (дополнительный рис. 5). Эти данные свидетельствуют о том, что негеномные антиферроптозные эффекты эстрогенов обусловлены активностью RTA, а не хелатообразующими свойствами железа.
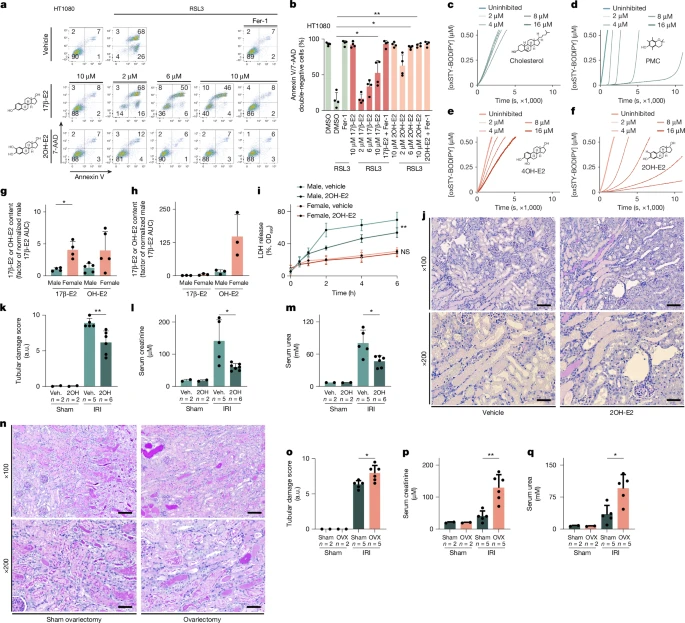 Fig. 2: 2OH-E2 functions as a potent RTA to protect against ferroptosis propagation and accumulates in kidney tubules. Fig. 2: 2OH-E2 functions as a potent RTA to protect against ferroptosis propagation and accumulates in kidney tubules.
FSP1 recycles hydroxyoestradiols
Мы задались вопросом, могут ли производные гидроксиоэстрадиола после окисления до соответствующих хинонов регенерироваться с помощью FSP1 (кодируемого AIFM2), как это было продемонстрировано для кофермента Q10 и витамина K10, 29. Добавление рекомбинантного FSP1 к тестам FENIX привело к усилению активности RTA среди всех протестированных производных эстрадиола (рис. 3a–c и расширенные данные рис. 6d–i). Поэтому мы предлагаем NADPH-зависимый регенеративный механизм регенерации эстрадиола (рис. 3d). Аналогичные эффекты были получены в бесклеточных системах, в которых аскорбат или супероксидный термический источник-1 (SOTS-1) были протестированы на их способность регенерировать производные эстрадиола (расширенные данные, рис. 6j–q). Мы сгенерировали опосредованный CRISPR–Cas9 нокаут AIFM2 (кодирующий FSP1) в клетках HT1080 (рис. 3e) и протестировали необходимую антиферроптозную дозу 2OH-E2 в родительских и нокаутных клетках (рис. 3f, g и расширенные данные рис. 7a). Для получения 50%-ной двойной негативности аннексина-V/7-AAD требуемая доза в родительских клетках составляла 750 нМ 2OH-E2, тогда как нокаутным клеткам требовалось не менее 2,5 мкм, а содержание восстановленного OH-E2, но не E2, было примерно в 100 раз ниже у мышей с дефицитом FSP1 (Рис. 3h и расширенные данные рис. 8a). В эндогенно устойчивых к ферроптозу клетках HT29 нокаут AIFM2 сенсибилизировал клетки к ферроптозу, индуцированному RSL3 (расширенные данные на фиг. 7b–e). Мы также исследовали специфический ингибитор FSP1 (viFSP1) в клетках HT1080 и HT29 с аналогичными результатами (расширенные данные на рис. 7f, g). Аналогичным образом, другие ингибиторы FSP1 сенсибилизировали устойчивые в других отношениях женские клеточные линии (клетки HT29 и HeLa) к ферроптозу (расширенные данные, рис. 7h, i). В соответствии с этими результатами, ингибитор ароматазы anastrozole повышал чувствительность клеток HeLa к ферроптозу, а дополнительная обработка viFSP1 не приводила к дополнительной чувствительности этих клеток (расширенные данные, рис. 7j). Однако описанные выше половые различия в почечных канальцах не были полностью устранены дефицитом FSP1 (рис. 3i), что побудило нас исследовать общую экспрессию FSP1 в мужских и женских почечных канальцах. В лизатах канальцев, полученных от мышей, свиней и человека, экспрессия FSP1 была выше у самцов (рис. 3j–l). В соответствии с этими данными, экспрессия FSP1 в канальцах самок увеличивалась после овариэктомии (рис. 3м). Мы подтвердили специфичность антител у мышей дикого типа, гетерозиготных и Aifm2-нокаутированных мышей (рис. 3n). В анализе высвобождения LDH из почечных канальцев ни нокаут Aifm2, ни три различные дозы viFSP1 не показали существенных различий (рис. 3o и расширенные данные рис. 8b), что указывает на наличие дополнительных антиферроптозных систем в канальцевом отделе. В соответствии с этой гипотезой, мы наблюдали незначительную тенденцию к сенсибилизации у самок мышей с дефицитом FSP1 (Aifm2-нокаутом) в модели IRI почек (рис. 3p-r и расширенные данные рис. 8c). Поэтому мы исследовали потенциальные компенсаторные механизмы в канальцах мышей с дефицитом FSP1. В то время как нокаут Aifm2 не повлиял на GPX4 и ACSL4, мы обнаружили повышенные уровни тиоредоксиновой системы (тиоредоксин (TRX) и пероксиредоксин 1 (PRX1)) у самцов и самок мышей (расширенные данные, рис. 8d, e). После ингибирования пути PRX1 (который также включает тиоредоксинредуктазу 1) с помощью FTC30 мы запустили гиперчувствительность, обнаружив необычно высокие уровни высвобождения LDH из изолированных канальцев, которые были полностью отменены добавлением Fer-1 у самок мышей с нокаутом по Aifm2 (Расширенные данные, рис. 8f). Однако FTC также сенсибилизировал женские канальцы дикого типа (расширенные данные, рис. 8g). Эти данные демонстрируют, что антиферроптозная активность отдельных систем в культивируемых клетках, таких как FSP1, не может быть легко экстраполирована на сложную среду in vivo, в которой сосуществуют несколько систем наблюдения за ферроптозом, совместно ингибирующих ферроптоз в канальцах женских почек. Таким образом, чтобы лучше понять регуляцию ферроптоза in vivo, помимо мощных негеномных функций производных гидроксиоэстрадиола, мы расширили наше исследование геномных функций эстрадиола, опосредованных через ESR1.
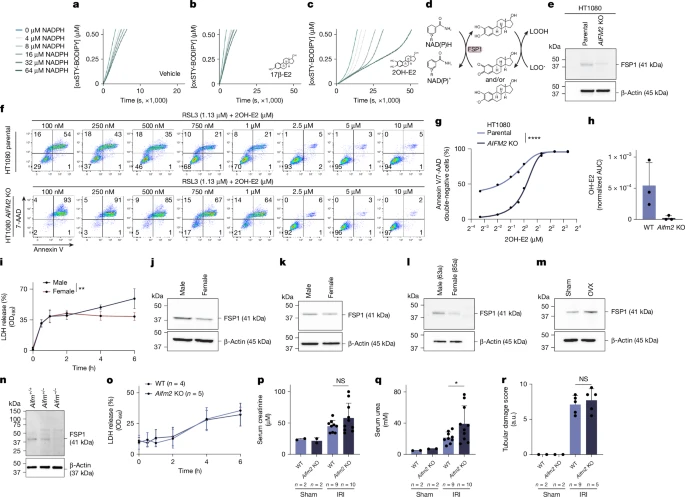 Fig. 3: FSP1 regenerates oxidized oestradiol derivatives to enhance anti-ferroptotic activity in cells. Fig. 3: FSP1 regenerates oxidized oestradiol derivatives to enhance anti-ferroptotic activity in cells.
Genomic anti-ferroptotic functions of oestradiol
Мы разводили гетерозиготных мышей с дефицитом ESR1 для получения родительских однопометников (как дикого типа, так и гетерозиготных) и мышей с дефицитом ESR1. Изолированные почечные канальцы самок мышей с дефицитом ESR1 продемонстрировали более высокое высвобождение LDH по сравнению с однопометниками дикого типа (рис. 4а), а обработка Fer-1 обратила это увеличение к уровню необработанных мышей дикого типа (рис. 4а). В соответствии с рис. 3j–m, экспрессия белка FSP1 в тубулярных лизатах мышей-мутантов ESR1 была повышена (рис. 4b). Как и ожидалось в эксперименте с канальцами, самки мышей с дефицитом ESR1 были значительно более чувствительны к IRI почек (рис. 4c–f). Примечательно, что в то время как у этих мышей фиксировались уровни 17β-эстрадиола у мышей дикого типа, гидроксиоэстрадиолы не обнаруживались в канальцах мышей с дефицитом ESR1 (рис. 4g–i). Поскольку дисфункция ESR1 коррелирует с отсутствием 2OH-E2 и гиперчувствительностью к ферроптозу, независимо от усиления регуляции FSP1, этот подход позволил нам дифференцировать геномные функции эстрадиолов от негеномных (рис. 4j). Как и ожидалось, мощный ферростатин проявлял защитные эффекты после IRI у самок мышей с дефицитом ESR1 (расширенные данные на фиг. 9a–d). В совокупности эти данные демонстрируют, что ESR1 на геномном уровне способствует антиферроптозному состоянию почечных канальцев у женщин. Однако регуляция FSP1 не смогла полностью объяснить половые различия в чувствительности к AKI что побудило нас исследовать другие геномно регулируемые, ESR1-зависимые системы регуляции ферроптоза.
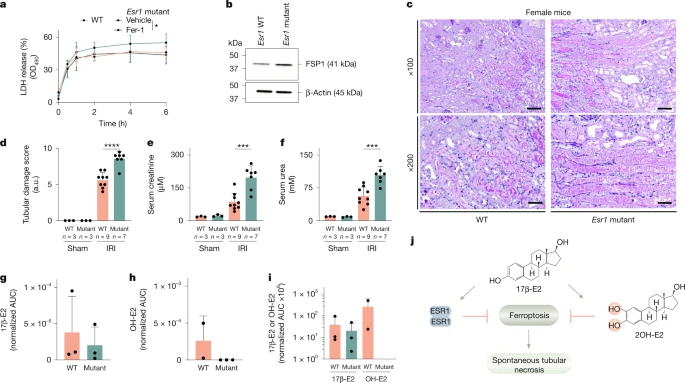 Fig. 4: Esr1 deficiency sensitizes to tubular ferroptosis and AKI. Fig. 4: Esr1 deficiency sensitizes to tubular ferroptosis and AKI.
Поскольку предполагается, что экспрессия ESR1 оказывает сильное влияние на гены, участвующие в выработке антиферроптозных гидроперсульфидов/полисульфидов 31,32, мы предположили, что они могут способствовать защите женских почечных канальцев, возможно, зависимым от ESR1 образом (рис. 5а). После оценки уровней экспрессии белка CSE, основного регулятора образования гидроперсульфидов, не было обнаружено различий между полами (рис. 5b,c). Однако гидроперсульфиды разлагаются под действием ETHE1 после SQR. Было обнаружено, что экспрессия белка в почечных канальцах повышается у мышей-самцов (рис. 5d) и мышей-самок с дефицитом ESR1 (рис. 5e), что свидетельствует о более эффективном обмене гидроперсульфидов у мышей-самцов. Действительно, более высокие уровни гидроперсульфида глутатиона GSSH, известного подавителя ферроптоза 31,32, присутствовали в женских канальцах (рис. 5f), в то время как уровни GSH и других гидроперсульфидов существенно не отличались (расширенные данные на рис. 5f). 9e–h). Аналогичным образом, добавление эстрогенов к клеткам HT29 приводило к повышению уровня GSSH, в то время как уровень GSH снова оставался неизменным (расширенные данные, рис. 9i). Действительно, канальцы, выделенные у мышей-самок с дефицитом CSE (мышей с нокаутом Cth), демонстрировали более высокие уровни высвобождения LDH по сравнению с однопометниками дикого типа (рис. 5g), в то время как у мышей-самцов с нокаутом Cth не было выявлено изменений (расширенные данные рис. 9j). В культуре клеток инкубация клеток HT1080 с трисульфидом глутатиона (GSSSG; предшественник гидроперсульфидов) защищала эти клетки как от ферроптоза, вызванного эрастином (расширенные данные, рис. 9k, l), так и от ферроптоза, вызванного RSL3 (рис. 5h,i). Аналогичным образом, мужские канальцы были защищены от высвобождения LDH после обработки GSSSG (рис. 5j и расширенные данные рис. 9m). Эти данные указывают на то, что ESR1-зависимое подавление гидроперсульфидной дегенерации представляет собой один из механизмов геномного эстроген-опосредованного антиферроптоза в почечных канальцах женщин. Более того, эти данные указывают на важность антиферроптозной способности гидроперсульфидной системы в условиях in vivo.
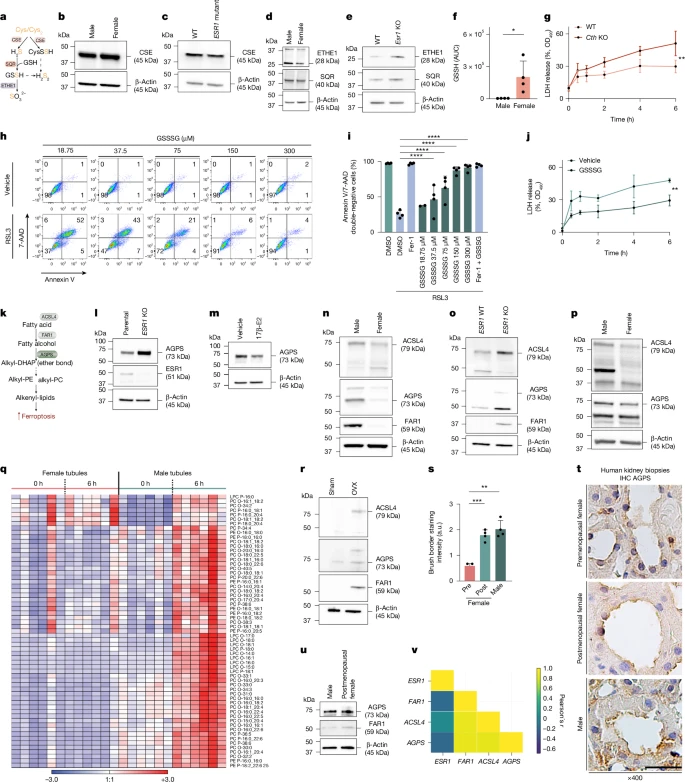 Fig. 5: ESR1 limits hydropersulfide degradation and ether lipid plasticity. Fig. 5: ESR1 limits hydropersulfide degradation and ether lipid plasticity.
В отличие от гидроперсульфидов, недавно было продемонстрировано, что пластичность эфирных липидов повышает чувствительность опухолей мышей к ферроптозу34, но потенциальная роль в остром повреждении тканей не была оценена. Поэтому мы исследовали ключевые ферменты в процессе производства эфиров и липидов (рис. 5к). Нокаут ESR1 в клетках HT29, которые, как известно, нечувствительны к классическим FINs, привел к заметному повышению активности AGPS, единственного известного белка, генерирующего эфирную связь, по сравнению с родительскими клетками (рис. 5l). И наоборот, мы наблюдали снижение уровня AGPS после инкубации с E2 (рис. 5м). В соответствии с предыдущим отчетом35, CRISPR–Cas9-опосредованный нокаут FAR1 в клетках CD10 и HT1080 не снижал чувствительность клеток к ферроптозу, вызванному каким–либо из протестированных FINs (расширенные данные, рис. 10a-f). Однако экспрессия канальцевых белков ACSL4, FAR1 и AGPS была повышена в мужских и женских канальцах с дефицитом ESR1 (рис. 5n,o). Хотя нам не удалось выявить антитела к свиному FAR1, аналогичные эффекты для ACSL4 и AGPS были зафиксированы в свежевыделенных свиных канальцах (рис. 5п), что позволяет предположить, что этот эффект сохранялся в ходе эволюции млекопитающих. Это побудило нас напрямую сравнить липидомы свежеизолированных мужских и женских канальцев с течением времени. Во-первых, мы обнаружили более высокие уровни эфирных липидов в канальцах мышей-самцов в исходных условиях (расширенные данные, рис. 10г). Важно отметить, что эфирные фосфолипиды были заметно повышены в процессе повреждения канальцев только в мужских почечных канальцах (рис. 5q), в то время как соответствующие эфирные фосфолипиды, использованные в качестве контроля, не демонстрировали сопоставимой картины (расширенные данные, рис. 10h). Эти данные указывают на то, что проферроптотическая пластичность эфирных липидов является специфической особенностью мужских, но не женских канальцев, и что путь выработки эфирных липидов подавляется ESR1-зависимым образом. Поэтому мы предположили, что это торможение будет утрачено после наступления менопаузы. Действительно, когда мы исследовали искусственную систему овариэктомии в постменопаузе у мышей, чтобы протестировать экспрессию AGPS и FAR1, были обнаружены более высокие уровни AGPS и FAR1 на уровне белка по сравнению с самками мышей, подвергшихся искусственной операции (рис. 5r). В соответствии с этим наблюдением, иммуногистохимический анализ AGPS в наборе биоптатов почек человека продемонстрировал экспрессию белка AGPS в кистевых отделах проксимальных почечных канальцев у мужчин и женщин в постменопаузе и, в гораздо меньшей степени, в образцах, полученных от женщин в пременопаузе (рис. 5, а, т). Аналогичным образом, в лизатах свежеизолированных почечных канальцев человека, полученных от пациентов женского или мужского пола в постменопаузе, экспрессия AGPS и FAR1 была сопоставимой (рис. 5u). В целом, наши данные согласуются с общедоступной базой данных одноклеточного транскриптома почек человека, в которой экспрессия ACSL4, FAR1 и AGPS в проксимальных канальцах была выше в образцах с AKI по сравнению с контрольными образцами здоровых людей (расширенные данные, рис. 10i). Наконец, эффекты ESR1 лучше всего изучаются в контексте рака молочной железы. Мы сравнили экспрессию ACLS4, FAR1 и AGPS, соответственно, в клеточных линиях рака молочной железы ESR1+ и ESR1- и обнаружили сильную обратную корреляцию всех трех генов с экспрессией ESR137 (рис. 5в и расширенные данные рис. 10j). Мы пришли к выводу, что эфирные липиды и их пластичность действительно участвуют в развитии гиперчувствительности у мужчин и способствуют повреждению почечных канальцев, в то время как у женщин этот проферроптозный сигнал подавляется до наступления менопаузы ESR1-зависимым образом. Достоверность этой корреляции отражена в исследовании пациенток в пременопаузе, подвергающихся гормональной депривации, которая приводит к заметному увеличению содержания циркулирующих видов эфирных липидов38. Таким образом, почечные канальцы мужчин и женщин в постменопаузе чувствительны к ферроптозу и АТФ за счет пластичности эфирных липидов, в то время как выработка гидроперсульфидов у женщин функционирует как антиферроптозная система.
Discussion
В 1988 году впервые было замечено, что ежедневные внутрибрюшинные инъекции нитрилотриацетата железа приводили к гибели всех самцов мышей в течение 6 дней, в то время как все самки и кастрированные самцы мышей пережили 3 месяца лечения39. Более того, недавно результаты исследований, связанных с ферроптозом после применения железа, показали роль железа в повреждении плотных органов, включая почки. Здесь мы определили геномные и негеномные механизмы, которые объясняют снижение чувствительности к ферроптозу у женщин. Мы подчеркиваем преобладающую роль ферроптоза в развитии ATN у самцов мышей (дополнительный рис. 1). В то время как эстрадиолы и гидроперсульфиды защищают канальцы самок, самцы обладают повышенной чувствительностью из-за повышенной пластичности эфирных липидов. Эти тонко взаимосвязанные антиферроптозные системы позволяют предположить, что воздействие на ферроптоз особенно полезно для профилактики AKI у мужчин и женщин в постменопаузе. В заключение, чувствительность к ферроптозу объясняет более высокую восприимчивость мужчин к AKI.
Примечательно, что экспрессия белка FSP1 положительно коррелирует с чувствительностью к ферроптозу, и что женские ткани, по-видимому, экспрессируют его в меньшей степени. Ранее мы продемонстрировали аналогичные парадоксальные эффекты для системы GPX4 в тканях, чувствительных к ферроптозу, таких как надпочечники40. Это указывает на пластичность антиферроптозных систем и согласуется с нашими данными об увеличении выработки гидроперсульфидов, которые могут обеспечивать устойчивость к ферроптозу в ответ на снижение экспрессии FSP1. Аналогичным образом, ESR1-зависимое подавление пластичности эфирных липидов может компенсировать снижение экспрессии FSP1.
Ограничение нашего исследования связано с нашим протоколом выделения канальцев, который выполняется с использованием модели ex vivo. Однако недавно распространение клеточной гибели было обнаружено непосредственно с помощью прижизненной продольной визуализации после IRI41,это подтверждает, что исследованная здесь схема распространения клеточной гибели происходит у мышей-самцов in situ аналогичным образом. Наконец, наши эксперименты указывают на роль ферроптоза при трансплантации почек и, возможно, других солидных органов, включая возможность целенаправленного воздействия на ферроптоз с целью предотвращения гибели клеток и некровоспаления42, преимущественно в органах мужчин и женщин в постменопаузе.
|
 Fig. 1: Female mice are resistant to AKI and renal tubular ferroptosis propagation.
Fig. 1: Female mice are resistant to AKI and renal tubular ferroptosis propagation.
 Fig. 2: 2OH-E2 functions as a potent RTA to protect against ferroptosis propagation and accumulates in kidney tubules.
Fig. 2: 2OH-E2 functions as a potent RTA to protect against ferroptosis propagation and accumulates in kidney tubules.
 Fig. 3: FSP1 regenerates oxidized oestradiol derivatives to enhance anti-ferroptotic activity in cells.
Fig. 3: FSP1 regenerates oxidized oestradiol derivatives to enhance anti-ferroptotic activity in cells.
 Fig. 4: Esr1 deficiency sensitizes to tubular ferroptosis and AKI.
Fig. 4: Esr1 deficiency sensitizes to tubular ferroptosis and AKI.
 Fig. 5: ESR1 limits hydropersulfide degradation and ether lipid plasticity.
Fig. 5: ESR1 limits hydropersulfide degradation and ether lipid plasticity.