The PINK1/Parkin pathway regulates mitochondrial morphology. | |
|
|
Болезнь Паркинсона ассоциируется с митохондриальной дисфункцией и в некоторых случаях с мутациями в специфичных генах, таких как parkin и PTEN-induced kinase 1 (. Дрозофилы с мутациями в генах parkin или Pink1 обнаруживают митохондриальную дисфункцию, однако неясно, каким образом эти мутации влияют на митохондрии. Авторы цитируемых работ высказали предположение о механизмах, посредством которых parkin и PINK1 влияют на митохондриальную функцию и показали роль этих генов в делении и защите митохондрий против митохондриальных токсинов. 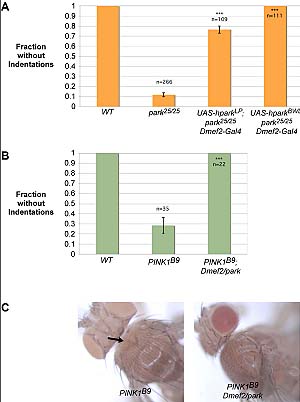 Haque с коллегами изучали роль PINK1 в утрате нейронов, индуцированной MTPT и его метаболитом МРР+ (митохондриальный токсин). Оба эти вещества используются для получения моделей (на животных) болезни Паркинсона. Авторы использовали небольшие интерферирующие РНК, которые даунрегулируют экспрессию Pink1 в первичных нейронах мышей и показали, что они снижают выживаемость нейронов в присутствии MPP+. И, напротив, сверхэкспрессия Pink1 имеет защитный эффект, но это требует активности PINK1 киназы. В случаях мутантного PINK1, когда активность киназы отсутствовала, защитного эффекта не наблюдали.
Интересно, что PINK1 мутант с отсутствием предполагаемого mitochondrial targeting motif также защищал нейроны от MPP+ токсичности, указывая на то, что таргетинг (позиционирование) для митохондрии не является необходимым условием защитного эффекта.
Haque с коллегами изучали роль PINK1 в утрате нейронов, индуцированной MTPT и его метаболитом МРР+ (митохондриальный токсин). Оба эти вещества используются для получения моделей (на животных) болезни Паркинсона. Авторы использовали небольшие интерферирующие РНК, которые даунрегулируют экспрессию Pink1 в первичных нейронах мышей и показали, что они снижают выживаемость нейронов в присутствии MPP+. И, напротив, сверхэкспрессия Pink1 имеет защитный эффект, но это требует активности PINK1 киназы. В случаях мутантного PINK1, когда активность киназы отсутствовала, защитного эффекта не наблюдали.
Интересно, что PINK1 мутант с отсутствием предполагаемого mitochondrial targeting motif также защищал нейроны от MPP+ токсичности, указывая на то, что таргетинг (позиционирование) для митохондрии не является необходимым условием защитного эффекта. PINK1 имеет сходное действие и in vivo: сверхэкспрессия дикого типа Pink1 в черной субстанции мозга защищает дофаминовые нейроны от нейротоксического эффекта при MPTP инъекциях. Но также как и в предыдущем случае, для этого необходима активность PINK1 киназы, но не mitochondrial targeting motif, что указывает на возможное действие PINK1 в цитоплазме.  Каким образом PINK1 защищает нейроны от митохондриальных токсинов неизвестно. Однако другое исследование (Poole A. et al.) дает некоторые ориентиры о его роли в поддержании митохондриальной морфологии. В данной работе авторы изучали роли PINK1 и parkin в митохондриальном делении и слиянии у Drosophila melanogaster. Оказалось, что для поддержания морфологической целостности митохондрии необходима динамическая регуляция этих оппозитных процессов. Авторы исследовали эффекты действия Mfn2 и Opa1, которые способствуют митохондриальному делению у parkin- или Pink1-мутантных мух.
Каким образом PINK1 защищает нейроны от митохондриальных токсинов неизвестно. Однако другое исследование (Poole A. et al.) дает некоторые ориентиры о его роли в поддержании митохондриальной морфологии. В данной работе авторы изучали роли PINK1 и parkin в митохондриальном делении и слиянии у Drosophila melanogaster. Оказалось, что для поддержания морфологической целостности митохондрии необходима динамическая регуляция этих оппозитных процессов. Авторы исследовали эффекты действия Mfn2 и Opa1, которые способствуют митохондриальному делению у parkin- или Pink1-мутантных мух. Мухи с мутациями в parkin- или Pink1 имеют фенотип, характеризующийся торакальным углублением, нарушениями передвижения (подъема) и полета в результате мышечной дегенерации. Сверхэкспресси Drp1 у Pink1 мутантов нормализует этот фенотип также как loss-of-function мутации в Opa1 или делеция Mfn2 у Pink1 и parkin мутантов. Более того, сниженная активность Drp1 или Mfn2 или Opa1 подавляет и усиливает соответственно аномалии глазных структур, являющиеся результатом сверхэкспрессии Pink1. 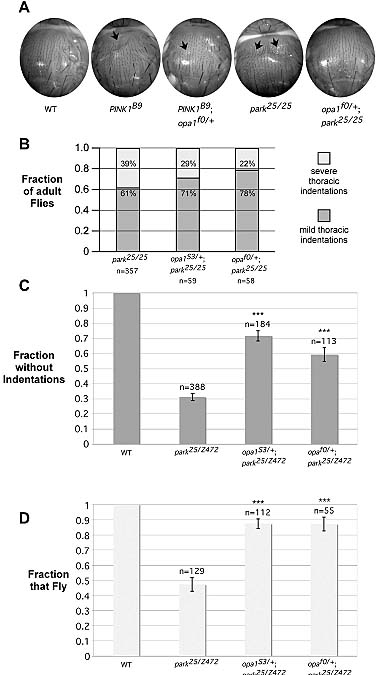 Эти находки подтверждают, что фенотип parkin- и Pink1 мутаций вызван нарушениями митохондриального деления. И, действительно, тяжелые дефекты митохондриальной морфологии в мышцах parkin- и Pink1 мутантных мух нормализовались при увеличении Drp1 дозы гена или снижении дозы Opa1 гена. Таким же образом, инактивация как parkin, так и Pink1 в клеточной линии Drosophila melanogaster при РНК интерференции вызывала изменения в структуре клеточных митохондрий, но эти изменения были обратимыми при инактивации Mfn2 и Opa1. Полученные результаты указывают, что PINK1/parkin путь способствует митохондриальному делению.
Эти находки подтверждают, что фенотип parkin- и Pink1 мутаций вызван нарушениями митохондриального деления. И, действительно, тяжелые дефекты митохондриальной морфологии в мышцах parkin- и Pink1 мутантных мух нормализовались при увеличении Drp1 дозы гена или снижении дозы Opa1 гена. Таким же образом, инактивация как parkin, так и Pink1 в клеточной линии Drosophila melanogaster при РНК интерференции вызывала изменения в структуре клеточных митохондрий, но эти изменения были обратимыми при инактивации Mfn2 и Opa1. Полученные результаты указывают, что PINK1/parkin путь способствует митохондриальному делению. Однако результаты этих работ не дают окончательного ответа о роли цитоплазматических функций PINK1 в дефектах митохондриального деления с последующей митохондриальной дисфункцией. Тем не менее, полученные данные доказывают существование двух путей, когда мутации в PINK1 и parkin могут вести к митохондриальной дисфункции и, возможно, к болезни Паркинсона. См. дополнительные рисунки: 1. 2. Дополнительный источник: Leo Pallanck & J. Timothy Greenamyre. Neurodegenerative disease: Pink, parkin and the brain. Nature 441, 1058 (29 June 2006) |