Пищевод и трахея являются соотв. дорсальным и вентральным производным общей трубки переденй кишки. Аномальное развитие этих органов м. привтодит к выраженным дефектам развития у людей. Наиболее частым уродством переденей кишки является тип С esophageal artesia with tracheoesophageal fistula (EA/TEF), который характеризуется образованием мерхнего пищеводного кармана, тогда как нижняя его часть часто сильно стенозировна, в результате пищевод аномально соединен с трахеей посредством фистулы (Brunner, van Bokhoven, 2005; Clark, 1999, del Rosario, Orenstein, 1998; Engum et al., 1995; Hicks, Mansfield, 1981; Sparey et al., 2000). Этиология и молекулярный патогенез EA/TEF остается неизвестным в основном из-за спорадичной природы. Feingold синдром, который проявляется дефектами, включающими атрезию кишечника, является одним из немногих таких заболеваний, которые связаны с молекулярным дефектом (мфт Bokhoven et al., 2005). Некоторые генетически модифицированные мутантные мыши обнаруживают набор уродств переденей кишки, указывающи х на то. что развитие переденей кишки регулируется с помощью сложной генетической сети (Дшештпегтп уе al., 1998; Mendelson et al., 1994; Minoo et al., 1999; Motoyama et al., 1998; Pepicelli et al., 1998).
Adriamycin является антинеопластическим антибиотиком с тератогенным потенциалом и широко используется для индукции EA/TEF и VACTERL (Vertebral, Anorectal, Cardiac, Trochoesophageal, Renal, Limb) ассоциаций у эмбрионов крыс и мышей (Beasley et al., 2000; Diez-Pardo et al., 1996; Ioannides et al,m 2002; Thompson et al., 1978). Важным уродством у обработанных adriamycin эмбрионов крыс является гипертрофия хорды с вентральным смещением ветвей, приводящим к длительным контактам с или с очень близким окружением энтодермы дорсальной части передней кишки (Mortell et al.,2004; Orford et al., 2001; Possoegel et al., 1999; Qi, Beasley, 1999, Qi et al., 2001; Williams et al., 2001). Однако, клеточые и молекулярные механизмы регуляции взаимодействия хорды и энтодермы плохо изучены. Хорда, сигнальная ткань, функционирует как организатор для соседних эмбриональных структур и постепенно становится осью развивающегося пожвоночного столба (Stemple, 2005). Хорда первоначально формируется в виде пластинки с клетками предшественниками, внедренными в дорсальную часть энтодермы передней кишки, следовательно, временно участвует в формировании крыши первичной кишечной трубки у грызунов и человека (Cleaver , Krieg, 2001; Jurand, 1974; Lampers et al., 1987; Muller, O'Rahilly, 2003; Sulik et al., 1994). По ходу развития клетки хордальной пластинки соединяются и складываются в палочковидную структуру, которая в конечном итоге отделяется от энтодермы (Cleaver, Krig, 2001; Jurand, 1974; Lamers et al., 1987; Muller, O'Rahilly, 2003; Sulik et al., 1994). Молекулярный мехенизм, регулирующий отсоединение хордальной пластинки от дорсальной части энтодермы кишки во времени неизвестен (Jurand, 1974; Sausedo, Schoenwolf, 1994).
В данной работе было установлено, что эмбрионы мышей с полной потерей
Noggin характеризуются типом С EA/TEF с выраженным сужением пищевода. Эти эмбрионы обнаруживают аномалии хорды, которые очень сходны с таковыми,описанными у крыс,обработанных adriamycin. Показано, что редукция дорсальной части передней кишки скорее всего ассоциирует со смещением дорсальных энтодермальных клеток в хорду с соотв. натрушением межклеточной адгезии и базальной мембраны. Эти клеточные дефекты устранялись путем упразденния функции Bmp7.
Noggin-Mediated Bmp7 Antagonism in the Pathogenesis of EA/TEF
Среди немногих Bmps, которые экспрессируются у гаструлирующих эмбрионов, экспрессия Bmp7 обнаруживатеся в тесной ассоциации с экспрессией Noggin в передней части первичной полоски и в узелке, где проспективные клетки хорды собраны в кластер, и Noggin и Bmp7 продолжают экспрессироваться в хордальной пластинке во время её отделения от крыши дорсальной части энтодермы передней кишки (Dudley, Robertson, 1997; Lyons et al., 1995; McMahon et al., 1998). C помощью иммуномечения очищенными антителами против фосфорилированного Smad1/5/8 (pSmad1) выявлялось усиление передачи сигналов Bmp в хорде Nog-/- эмбрионов на Е8.5 (11-12 сомитов) со снижением уровня на Е9.0 (17-18 сомитов), что согласуется с потерей функции Noggin и с критической ролью антогонизма Bmp во время разделения хорды и передней кишки. Напротив, не было выявлено эктопической передачи сигналов Bmp в дорсальной части энтодермы переденей кишки Nog-/- и в окружающей её мезенхиме.
Было предположено, что если Noggin-обусловленный антогонизм Bmp7 является критическим для их разделения, то устранение Bmp7 должно устранять аномальное отсоединение хорды, т.е. должно устранять дефекты и EA/TEF у мутантов Nog-/-. Действительно устранение Bmp7 у эмбрионов Nog-/- достоверно устраняло хордальные дефекты на Е9.5 и не налюдалось хордальных веточек у 8 из 9 Nog-/-; Bmp7p-/- эмбрионов, соответ. в передней кишке устранялись дефекты стеноза. У эти х двойных мутантов также обнаруживалась нормальная экспрессия Е-кадхерина в дорсальной части передней кишки и в Т клетках хорды.
Эти находки согласуются с недавним сообщением др. группы, в которой Bmp4+/- мог устранять фенотип TEF у Nog-/- примерно в 505 случаев (Que et al., 2006). Bmp4 преимущественно экспрессируется в вентральной мезодерме передней кишки во время ранних стадаий формирования паттерна передней кишки (Weaver et al., 1999)? а его способность восстанавливать способность к разделению пищевода и трахеи у Nog-/- указывает на то, что Bmp4 секретируется из вентральной мезодермы передней кишки и может вносить вклад в усиление передачи сигналов Bmp, наблюдаемое в хорде Nog-/-.
Кроме того, установлено что усиление передачи сигналов Bmp в хорде приводит к её продолжительному прикреплению к крыше дорсальной части энтодермы передней кишки (Fig. 6). Задержа и несоответ. отделение хорды приводит презумптивные энтодермальные клетки у Nog-/- в хорду, что согласуется с избирательной редукцией дорсальной части энтодермы передней кишки. В то время как молекулярная активность нерегулируемой передачи сигналов Bmp снижается, то это приводит к неправильному отдлению хорды, это скорее всего связано с нарушениями межклеточных взаимодействий между хордой и энтодермой передней кишки, т.к. разрывы базальной мембраны, обнаруживаются у Nog-/- эмбрионов (Fig. 1). Этот эффект скорее всего обусловлен эктопической передачей сигналов Bmp в хорду, т.к. мезенхима находится в тесной близи к дорсальной части энтодермы передней кишки и не обнаруживает передачи сигналов Bmp. Однако, нельзя исключить возможность, что интерстициальная мезенхима может косвенно вносить вклад в отсоединение хорды и/или в деыекты дорсальной части переденй кишки.
Спектр уродств переденей кишки, в особенности Type C EA/TEF, обычно обладает фислулами между суженным пищеводом и трахеей. Возможно предположить, что уменьшение дорсальной части передней кишки , которое происходит преимущественно в верхней области, д. приводить к сильному истончению пищевода, который может разрываться в наиболее слабой части, образуя фистулы с трахеей, находящейся поблизости. Это мнение согласуется с наблюдением, что образование фистул может происходить в разных местах вдоль трахеи и что небольшая фракция эмбрионов Nog
-/- обладает стенозом пищевода без TEF, как и ожидается. когда пищевод не прорывается. У людей благоприобретенные TEF, в противоположность врожденным TEF, могут возникать от разных причин, вызывающих повреждения пищевода и/или трахеи, такие как аспирация желудочного содержимого. присутствие инородного тела в пищеводе и длительная механическая вентиляция (Imamoglu et al., 2004; Pelc et al., 2001; Reed and Mathisen, 2003). Приобретенная TEF может также возникнуть как вторичное осложнение пищеводного или легочного озлокачествления.
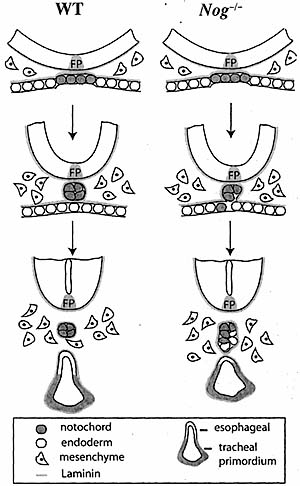 Fig. 6. Schematic diagram showing abnormal notochord detachment and dorsal foregut reduction in Nog'' embryos. The domain of tracheal primordium (green) is based on Nkx2.1 expression data. FP, floor plate. [Color figure can be viewed in the online issue, which is available at www.interscience.wiley.com.]
Fig. 6. Schematic diagram showing abnormal notochord detachment and dorsal foregut reduction in Nog'' embryos. The domain of tracheal primordium (green) is based on Nkx2.1 expression data. FP, floor plate. [Color figure can be viewed in the online issue, which is available at www.interscience.wiley.com.]
очевидно, что TEF могут возникать как следствие нарушений в пищеводе, но клеточные механизмы образования фистул остаются неясными.
Некоторые мутантные мыши, особенно с нарушенными путями передач сигналов Sonic hedgehog (Shh) или ретиноевой кислоты, ассоциируют с EA/TEF (Litingtung et al., 1998; Mendelsohn et al., 1994; Motoyama et al., 1998; Pepicelli et al., 1998). У Shh-/- мутантов дефекты пищевода прежде всего приписываются эктопическому апоптозу энтодермы переденей кишки (Y. Li and C. Chiang, unpublished observations), в то время как дефекты у Nog-/- эмбрионов, по-видимому, связаны с несоотв. отделением хорды от дорсальной части переденей киашки. Это указывает на то, что существуют, по крайней мере, два клеточных механизма EA/TEF.
Сайт создан в системе
uCoz  Fig. 6. Schematic diagram showing abnormal notochord detachment and dorsal foregut reduction in Nog'' embryos. The domain of tracheal primordium (green) is based on Nkx2.1 expression data. FP, floor plate. [Color figure can be viewed in the online issue, which is available at www.interscience.wiley.com.]
Fig. 6. Schematic diagram showing abnormal notochord detachment and dorsal foregut reduction in Nog'' embryos. The domain of tracheal primordium (green) is based on Nkx2.1 expression data. FP, floor plate. [Color figure can be viewed in the online issue, which is available at www.interscience.wiley.com.]