Почти все клетки позвоночных имеют неподвижную первичную ресничку, проецирующуюся с поверхности. У мышей тяжелые дефекты в сборке ресничек ведут к эмбриональной летальности в средине беременности, тогда как умеренные дефекты ведут к синдромам. включая кистозную болезнь почек, кисты и фиброз печени, полидаклитилю и дефеккты поджелудочной железы, головного мозга и глаз. Первычные реснички рассматриваются как сенсорные органеллы, которые воспринимают информацию о внеклеточной среде и передают её во внутриклеточную среду, контролируя тем самым некоторые аспекты клеточной физиологии, такие как пролиферацию и дифференцировку (Satir and Christensen, 2007).
Первичные реснички обнаруживаются в эпителиальных клетках, выстилающих почечные канальцы и протоки. Дефекты ресничек лежат в основе всех типов болезней кистоза почек у человека, включая аутосомно доминантную и аутосомно рецессивную поликистозную почечную болезнь (PKD). Считается, что повышенная пролиферация мутантных эпителиальных клеток (Igarashi and Somlo, 2002) вместе с дефектами планарной полярности клеток играют роль в возникновении PKD (Simons et al., 2005; Fishetr et al., 2006).
Большинство эукариотических ресничек и жгутиков собирается и поддерживается с помощью intraflagellar transport (IFT). Во время IFT крупные белковые комплексы, наз. IFT частицами транспортируются вдоль микротрубочек ресничек под мембраной ресничек и несут предшественники от места синтеза в теле клетки к месту сборки реснички. Частицы состоят приблизительно из 20 уникальных субъединиц, организованных в А и В комплексы (Rosenbaum and Witman, 2002; Scholey, 2003).
Здесь была охарактеризована функция IFT20, субъединицы комплекса В. Получали floxed аллель гена сборки ресничек ift20. Делеция этого гена особенно в клетках собирающих канальцев почек предупреждает образование ресничек и способствует быстрому увеличению постнатальных кист в почках. Делящиеся клетки собирающих канальцев на ранних стадиях образования кист неспособны правильно ориентировать свои митотические веретена вдоль канальцев, тогда как неделящиеся клетки обнаруживают неправильное положение своих центросом. На более поздних стадиях клетки, лишенные ресничек обнаруживают усиление передачи неканонических Wnt сигналов и повышенную скорость пролиферации. Следовательно, IFT20 играет роль, контролируя передачу Wnt сигналов и клеточную пролиферацию и необходим для собственно позиционирования центросом в неделящихся клетках и для корректной ориентации митотического веретена в делящихся клетках.
Polycystic kidney disease
Polycystic kidney disease (PKD) является совокупностью распространенных генетических болезней человека. Autosomal dominant polycystic kidney disease (ADPKD) является наиболее распространенной генетической причиной недостаточности почек (1). Два генетических локуса ответственны за клинический фенотип, PKD1 и PKD2 (1, 2). клинически болезнь характеризуется образованием кист в кортексе и медулле (3) (Fig. 1). Образование кист относительно позднее онтогенетическое событие , а скорость их роста коррелирует с прогрессированием болезни (4, 5). 50% страдающих индивидов доходят до end-stage renal disease (ESRD) обычно в середине 5-й декады (3). Прогностические факторы для ESRD включают семейную историю, гипертензию к моменту диагноза, крупные размеры почек и быстрая скорость роста кист (3). Внепочечными проявлениями являются двухстворчатость аортального клапана, пролапс митрального клапана, икристые (berry) аневризмы, печеночные кисты и аневризмы торакальной части аорты (6). Мутации в локусе PKD2 ассоциируют с небольшими кистозными почками и средней тяжестью почечной недостаточности (7).
Локусы
PKD1 и PKD2 кодируют polycystin-1 (PC-1) и 2 (PC-2), соотв. (8, 9). PC-1 является крупным трансмембранным белком. PC-2 является L-типом кальциевого канала, также наз. TRPP2. PC-2 модулирует передачу сигналов кальция в ответ на механические деформации (10). PC-1 и PC-2 формируют комплекс и собираются в ресничках эпителиальных клеток почек (11,12).
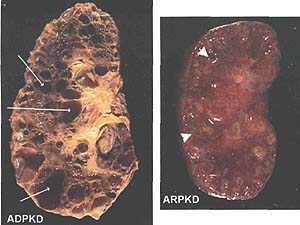 Fig. 1. Human cystic kidney disease: autosomal recessive polycystic kidney disease (ARPKD) and autosomal dominant polycystic kidney disease (ADPKD) kidneys. Pathological specimens of surgically removed polycystic kidneys. The ADPKD kidney is 18 cm long and 11 cm wide and characterized by large cysts (arrows) in the cortex and medulla. ARPKD kidney is 4 cm wide and 8 cm long. ARPKD cysts are small and found in the cortex and medulla (arrowheads).
Fig. 1. Human cystic kidney disease: autosomal recessive polycystic kidney disease (ARPKD) and autosomal dominant polycystic kidney disease (ADPKD) kidneys. Pathological specimens of surgically removed polycystic kidneys. The ADPKD kidney is 18 cm long and 11 cm wide and characterized by large cysts (arrows) in the cortex and medulla. ARPKD kidney is 4 cm wide and 8 cm long. ARPKD cysts are small and found in the cortex and medulla (arrowheads).
Autosomal recessive PKD (ARPKD) встречаются 1 на 24,000 живорожденных (13, 14). Ген PKHD1 располагается на хромосоме 6, он ассоциирует со всеми клиническими признаками болезни. Обычно распознают три клинические формы. Неонатальная форма характеризуется пульмональной атрезией и увеличенными почками. Смертность высока и вызывается респираторной недостаточностью (13,14). Инфантильная форма ассоциирует у увеличенными почками, при этом сканирование с помощью magnetic resonance imaging выявляет многочисленные микрокистозные структуры. Приблизительно 50% детей с этой формой болезни доходят до ESRD в конце их первой декады. Ювенильная форма ассоциирует с хронической болезнью почек с варьирующей тяжестью и прогрессирующей дисфункцией печени из-за цирроза. Цирроз является конечным результатом фиброза ductal пластинки и пролиферации желчных протоков (15). С усилением печеночной недостаточности для выживания необходима печеночная трансплантация (16).
Nephronophthisis
В спектр поликистозной почечной болезни входит, семейный nephronophthisis (NPHP). Кстати, идентифицировано 8 генетических локусов; действительно, как было показано. все они кодируют белки, которые собираются в ресничках. Клинически болезнь характеризуется полиурией, дефектами концентрации мочи, умеренной протеинурией и прогрессирующей почечной недостаточностью (17). Описанные внепочечные проявления - это умственная отсталость, прогрессирующая потеря зрения, дисфункция печени и повреждения мозжечка (17). NPHP1 (также наз. juvenile NPHP1) характеризуется малыми почками и образованием кист в медулле почек. Наследование аутосомно рецессивное, а генный продукт. ответственный за болезнь, nephrocystin-1, взаимодействует с продуктом гена NPHP2. NPHP2 также наз. детским NPHP, а его генный продукт наз. nephrocystin-2 или inversin. Мутации в inversin ассоциируют с медуллярной кистозной болезнью и situs inversus и пигментным ретинитом (17, 18).
NPHP3 или подростковый NPHP картирован в 3q21-q22 и наследуется аутосомно-рецессивным способом (17). Родственники с мутациями в NPHP3 обладают почечной кистозной болезнью, печеночным фиброзом и тапеторетинальной дегенерацией. Белковый продукт NPHP3, nephrocystin-3, ко-преципитируется с nephrocystin-1 и inversin (19). Эта находка указывает на то. что оба белка участвуют в общем сигнальном пути.
NPHP4 является ювенильной формой NPHP, в которой мутация сцеплена с lp36 (20). Мутации в nephrocystin-4 также ассоциируют с клинической нозологией, наз. синдром Senior-Loke (21). Этот синдром является комбинацией врожденной болезни почек, дегенерации пигментной сетчатки и врожденного amaurosis (21, 22). Др. клинические признаки включают гипертензию и умственную отсталость. NPHP4 также называется nephroretinin и локализуется в базальных тельцах ресничек и в центросомах делящихся клеток(23).
Обнаружены три дополнительные гена, которые дают клинические признаки NPHP или клинических нозологий, таких как синдром Joubert и синдром Meckel-Gruber. NPHP-5 (белок с названием IQCB1) также сцеплен с синдромом Senior-Loken и/или NPHP (24). IQCB1 является белком, содержащим IQ-домен, который взаимодействует с retinitis pigmentosa GTPase regulator (RPGR) и calmodulin (24). NPHP-6 клинически сцеплен с синдромом Joubert и NPHP в зависимости от мутации. Синдром Joubert генетически перекрывается с мутациями в NPHP-1 (25). NPHP-6 кодирует CEP290, ассоциируемый с центросомой белок, которые также локализуется в ресничках (26). Он обладает мотивами с гомологией с chromosome segregation ATPases, это указывает на то. что он может играть роль в митозах и функции митотического веретена. NPHP-7 кодирует Zn-finger белок, GLIS2, и у модельных мышей играет роль по предупреждению апоптоза и фиброза во время развития почек (27). Наконец, NPHP-8 кодирует RPGRIP1L и его дефекты ассоциируют с синдромом Joubert типа 7 а также с синдромом Meckel-Gruber (28-30). Meckel-Gruber синдром характеризуется фенотипически кистозной болезнью почек с варьирующими дефектами в ЦНС из-за энцефалоцеля, анэнцефалии, гидроцефалии, дисплазии печеночных протоков и полидактилии, искривлением длинных костей и расщеплением нёба (29).
Other cystic disease syndromes: cilia and planar cell polarity
На первый взгляд молекулярная природа дефектов, лежащих в основе различных кистозных болезней человека обнаруживают мало общего. Однако работы с модельными организмами в комбинации клеточно биологическим анализом привели к двум основным моделям развития кистозных болезней. Находка, что большинство белковых продуктов генов кистозной болезни локализуются в первичных ресничках, привела к цилиарной гипотезе кистозной болезни (1, 31, 32), такой как синдром Bardel-Biedl и oculo-facial-digital синдром (33). Альтернативная гипотеза заключается в том, что дефектная передача сигналов planar cell polarity (PCP) лежит в основе кистозной болезни почек. Интригующие недавние данные также подтвердили, что передача сигналов PCP может быть связана с функцией ресничек, создавая потенциальную связь между этими моделями (34).
Delineation of the planar polarity pathway in Drosophila
PCP впервые идентифицирована ии лучше всего изучена на плодовых мушках, Drosophila melanogaster. PCP это организация клеток в плоскости ткани, перпендикулярно апикально-базальной оси. Др. термин для такой организации это тканевая полярность. Хотя большинство тканей у Drosophila обнаруживают явную PCP, наиболее интенсивно PCP исследовали в крыльях и глазах (Fig. 2). PCP в крыльях проявляется в организованном распределении богатых актином выпячиваний, наз. волосками. Одиночные волоски исходят из дистальной части каждой клетки крыла и направлены дистально. В глазах мух PCP проявляется в планарной организации омматидий. Омматидии состоят из 8 фоторецепторов и дополнительных акцессорных клеток, которые на срезе формируют форму трапеции. Обычно, все омматидии в дорсальной половине глаза обращены дорсально и те, что в вентральной половине - вентрально. Мутации в PCP генах ведут к потере планарной организации (Fig. 2), оставляя незатронутой качества и апикально-базальную клеточную полярность (rev.35-37).
Генетические и биохимические исследования на Drosophila выявили три основные группы PCP генов. Первыми были открыты и лучше изучены стержневые (core) PCP гены. Core PCP гены включают frizzled (fz) (38), disheveled (dsh) (39-41), prickle (pk) (42), vang gogh (vang) (43)/strabismus (stbm) (44), flamingo (fmi) (45) и diego (dgo) (46). Fz является 7 раз пронизывающим трансмембранным рецептором, которые может связывать Wingless (Wg), но, по-видимому, функционирует Wg-независимым образом в передаче сигналов PCP у Drosophila . Dsh является цитоплазматическим белком, который также участвует как в передаче сигналов Wg, так и PCP. Остальные стрежневые PCP гены участвуют в передаче сигналов PCP. Fmi является гомофильной адгезивной молекулой (45) с 7 раз пронизывающим трансмембранным доменом. Vang является 4 раза пронизывающим трансмембранным белком (44), Pk является цитоплазматическим составным LIM доменовым белком (42) и Dgo является цитоплазматическим белком с ankyrin повторами (46).
Одной из наиболее удачных находок последних лет явилось наблюдение, что core PCP белки обнаруживают асимметричное расположение белка в плоскости эпителия развивающихся крыльев и глаз (Fig. 3). Имеются две разные подгруппы локализаций, 'distal group', которая
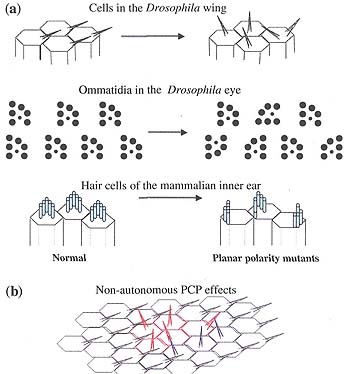 Fig. 2. Planar polarity and planar cell polarity (PCP) mutant phenotypes. (a) In normal flies, wing hairs (top) and photoreceptor clusters, called ommatidia (middle) show clear organization in the plane of the epithelium. In mammalian inner ears, the stereocilia also are organized in the planar of the tissue. In PCP mutants (right), this precise tissue organization is lost, with hairs on the wing pointing in all directions, and ommatidia or stereocilia showing randomized orientation, (b) Loss of the PCP gene fz in a patch of mutant tissue (red) disrupts the planar organization of mutant cells, and also disrupts the planar organization of wild-type cells on the distal side of the clone (blue), while wild-type cells on the proximal side are unaffected. This phenomena is termed domineering non-autonomy.
Fig. 2. Planar polarity and planar cell polarity (PCP) mutant phenotypes. (a) In normal flies, wing hairs (top) and photoreceptor clusters, called ommatidia (middle) show clear organization in the plane of the epithelium. In mammalian inner ears, the stereocilia also are organized in the planar of the tissue. In PCP mutants (right), this precise tissue organization is lost, with hairs on the wing pointing in all directions, and ommatidia or stereocilia showing randomized orientation, (b) Loss of the PCP gene fz in a patch of mutant tissue (red) disrupts the planar organization of mutant cells, and also disrupts the planar organization of wild-type cells on the distal side of the clone (blue), while wild-type cells on the proximal side are unaffected. This phenomena is termed domineering non-autonomy.
включает Dsh (47), Dgo (48) и Fz (49), и 'proximal group', которая включает Pk (50) и Vang (51). Fmi располагается как на проксимальной, так и дистальной сторонах клетки (45). Все core PCP белки первоначально кортикальные, а затем становятся ограниченными специфическими доменами. Существуют сложные биохимические и генетические взаимодействия между core PCP компонентами, со взаимно рецессивными взаимодействиями между проксимальными и дистальными членами, которые, как полагают, стабилизируют асимметричное распределение каждого комплекса. Асимметричная локализация core PCP молекул обнаружена также в глазах. В то время как в крыльях каждая клетка обнаруживает асимметричное распределение белков, в глазах лишь немногие клетки каждого из развивающихся омматидий обнаруживают поляризованное распределение core PCP белков (48, 52, 53). Наиболее важной локализацией, по-видимому, является расположение в предшественниках фоторецепторов R3 и R4, которые обнаруживают аналогичную локализацию с проксимо-дистальными интерфейсами в крыльях. 'Дистальной группы' белки накапливаются на R3 стороне R3/R4 интерфейса, а белки 'проксимальной группы" накапливаются на R4 стороне (Fig. 3).
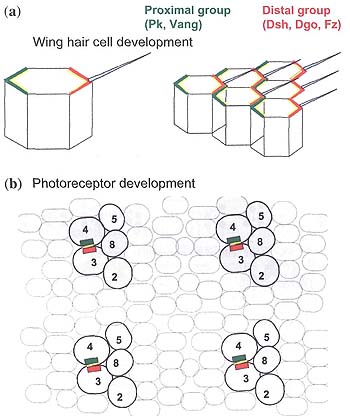 Fig. 3. Asymmetric distribution of core planar cell polarity (PCP) proteins. Diagram of the distribution of core PCP proteins in Drosophila. Top, core PCP protein distribution in the wing; bottom, distribution in the eye. (a) Although core PCP proteins have a non-asymmetric distribution initially, they become asymmetric at pupal stages, with a proximal group (Pk and Vang; green) and a distal group (Dsh and Fz; red). Fmi (yellow) becomes localized to both proximal and distal sides, (b) Core PCP proteins also show asymmetric distribution in the developing fly eye. Pk and Vang (green) are localized to the R4 side of the R3/R4 interface, and Dsh, Fz and Dgo localize on the R3 side (red). Fmi accumulates on both sides. This diagram is somewhat simplified, as there is some protein localization on the other photoreceptors; however, the intervening cells do not show asymmetric protein localization.
Fig. 3. Asymmetric distribution of core planar cell polarity (PCP) proteins. Diagram of the distribution of core PCP proteins in Drosophila. Top, core PCP protein distribution in the wing; bottom, distribution in the eye. (a) Although core PCP proteins have a non-asymmetric distribution initially, they become asymmetric at pupal stages, with a proximal group (Pk and Vang; green) and a distal group (Dsh and Fz; red). Fmi (yellow) becomes localized to both proximal and distal sides, (b) Core PCP proteins also show asymmetric distribution in the developing fly eye. Pk and Vang (green) are localized to the R4 side of the R3/R4 interface, and Dsh, Fz and Dgo localize on the R3 side (red). Fmi accumulates on both sides. This diagram is somewhat simplified, as there is some protein localization on the other photoreceptors; however, the intervening cells do not show asymmetric protein localization.
Интереснейший аспект передачи сигналов PCP заключается в том, что участки мутантной ткани могут менять планарную полярность соседней ткани дикого типа. Удивительно, но имеется направляющий компонент этой неавтономности. Мутации в Fz в крыльях мух нарушают ткань дикого типа только на дистальной стороне клона, тогда как мутации Vang нарушают полярность ткани дикого типа только на проксимальной стороне клона (38, 43). Это, как полагают, отражает передачу пространственной информации от одной клетки к следующей. Генетические исследования указывают на то, что сигнал неавтономности может передаваться посредством отдельного пути, чем автономной передачи сигналов PCP, т.к. потеря dsh, pk или dgo не вызывает неавтономных дефектов в PCP (54). Как клетки передают PCP информацию др. клеткам на сегодня очень важная тема (55-58).
Самостоятельная группа PCP генов, известных как Fat/Ds PCP группа состоит из
fat, dachsous (ds), four-jointed iff) и
atrophin (atro) (59-63) (Fig. 4). Fat и Ds являются огромными cadherins, которые соединяются др. с др. по типу, напоминающему взаимодействие рецептор-лиганд (64, 65). PCP дефекты
fat или
ds мутантов могут быть в значительной степени устранены экспрессией цитоплазматического домена Fat, это указывает на то, что цитоплазматический домен Fat содержит существенную информацию для PCP (64, 65).
 Fig. 4. Fat-Ds signaling. The large cadherin Ds binds to the cadherin Fat, inhibiting its function. Fat functions through the transcriptional corepressor Atro to regulate planar cell polarity (PCP) targets, such as Fj. As Fj loss of function has only weak PCP effects, there are clearly other, still unidentified transcriptional targets of Fat and Atro in PCP. Some models suggest core PCP genes are regulated by Fat signaling. Ds is expressed in gradients in the eye and wing imaginal disks, giving spatial information to the Fat receptor.
Fig. 4. Fat-Ds signaling. The large cadherin Ds binds to the cadherin Fat, inhibiting its function. Fat functions through the transcriptional corepressor Atro to regulate planar cell polarity (PCP) targets, such as Fj. As Fj loss of function has only weak PCP effects, there are clearly other, still unidentified transcriptional targets of Fat and Atro in PCP. Some models suggest core PCP genes are regulated by Fat signaling. Ds is expressed in gradients in the eye and wing imaginal disks, giving spatial information to the Fat receptor.
Цитоплазматический домен Fat соединяется с Atro, транскрипционным корепрессором со сходными PCP фенотипами (62), это указывает на то, что контроль PCP с помощью группы Fat/ Ds может быть связан с транскрипционной регуляцией мишеней. Единственной известной мишенью для Fat и Atro в PCP является
fj. Транскрипция
fj репрессируется с помощью Fat и Atro. fj кодирует локализованную в Гольдж киназу, которая может фосфорилировать cadherin повторы Fat и Ds, потенциально изменяя их связывание (66). Однако
fj мутанты обладают чрезвычайно слабым PCP фенотипом, указывая тем самым, что имеются др., пока не идентифицированные мишени, которые опосредуют Fat/Ds PCP сигнал. Ранние исследования предположили, что группа Fat/Ds генов расположена выше core PCP генов; , однако более недавние работы показали, что эти пути функционируют параллельно, чтобы регулировать PCP (67, 68). Точные взаимоотношения этих PCP регуляторов неясны и нуждаются в дальнейших исследованиях.
Потеря ft, ds, atro или fj ведет к четким неавтономным дефектам планарной полярности в окружающей ткани дикого типа. Важно, что потеря ds ведет к дефектам PCP, которые противоположны эффектам PCP от потери fat или atro (61, 62). Ds экспрессируется в виде градиента в крыльях и глазах, а генерация новых градиентов экспрессии белка Ds может реполяризовать PCP ткани. Эти и др. данные ведут к модели, в которой Ds соединение с Fat ингибирует активность Fat в PCP. Это взаимодействие связывания модифицируется с помощью Fj. Fat экспрессируется случайно в большинстве тканей; поэтому современная модель предполагает, что активность Fat регулируется с помощью градиентов экспрессии Ds и Fj, тем самым обеспечивается пространственный контроль PCP.
Стоящие ниже Fat/Ds и core PCP гены являются эффекторами PCP. Эти гены кодируют белки, которые как полагают, превращают PCP сигнал в физически ремоделированные клетки и часто это единственная функция в специфических тканях (rev. 36). Напр., inturned, fuzzy, fritz и multiple wing hair регулируют PCP только в крыльях (69), тогда как nemo и unpaired регулируют PCP только в глазах (70-72). Наконец. имеются гены, наз. PCP регуляторными, такие как, casein kinase 1 epsilon (CKIe) (73, 74), protein phosphatase 2A (PP2A) (75), G-protein alpha O (76), о положении которых в путях PCP ничего неизвестно. Интересно. что PP2A, Gao, CKIe, также как и core PCP белки Fz и Dsh также участвуют в передаче сигналов Wg (77). Ранние модели предполагали, что PCP регулируется с помощью неизвестного Wg-related гена (Wnt) у Drosophila и обозначали путь PCP как неканонический Wnt путь.
Однако многочисленные попытки идентифицировать такой Wnt оказывались безуспешными. Ни делеционные эксперименты. ни эксперименты с избыточной экспрессией не выявили непосредственной роли Wnts в передаче сигналов PCP. PCP фенотипы не появлялись у мух, лишенных Wnts, ни даже в клонах, лишенных всех пяти Wnt лигандов, присутствующих в крыловом диске, ни также у мух, лишенных Wg-связывающего домена Fz, необходимого для способности передавать PCP сигналы. Кроме того, избыточная экспрессия Wnts не меняла PCP в крыльях или животе (58, 68). Однако Wg контролирует экспрессию Ds, лиганда для Fat. Т.о., роль Wnts для передачи сигналов PCP у Drosophila может быть косвенной, потенциально посредством регуляции кассеты FaT/Ds.
Передача сигналов PCP у Drosophila также контролирует ориентированные клеточные деления. Ориентированные клеточные деления в крыльях мух ответственны за формирование обычно удлиненной формы крыла - без участия PCP генов, подобных fat и ds, крылья становятся более короткими и округлыми (78). Передача сигналов PCP с помощью Fz и Dsh также, как было показано, регулирует ориентированными клеточными делениями в нейробластах мух (79) и в нервной ткани позвоночных (80). Как передача сигналов PCP приводит к физической ориентации митотического веретена, неясно. Наблюдение, что неправильно ориентированные клеточные деления наблюдаются у PKD мутантов (81) (discussed below), является одним из ранних намеков, что болезнь кистоза почек может быть вызвана дефектной передачей сигналов PCP.
Conservation of the PCP pathway to vertebrates
Путь PCP, по-видимому, хорошо законсервирован в эволюции (rev. 36, 82-90). PCP позвоночных может участвовать в скоординированной организации волосковых клеток внутреннего уха и волос на спине мышей (Fig. 2). Потеря ортологов млекопитающих core PCP генов, таких как Vangl2, Celsrl, Fz3/6 и Dvll/2 нарушает организацию волосковых клеток внутреннего уха (91), в то время как организация шерсти на спине мышей (89, 90) нарушается у мутантов Vangl2, Celsrl и Fz6. Анализ PCP пути у млекопитающих осложнен дупликациями большинства РСР генов. Напр., дефекты закрытия нервной трубки обнаруживаются только у двойных мутантов Fz3, Fz6, из-за перекрывания функций гомологов (92).
Работы на позвоночных выявили роль PCP генов в регуляции поляризованных клеточных движений во время развития, особенно при конвергентном вытягивании (convergent extension). Конвергентное вытягивание приводит к удлинению и сужению ткани во время развития. Наиболее охарактеризованные движения конвергентного вытягивания связаны с интеркаляцией клеток. Мутации у позвоночных гомологов Drosophila PCP генов блокируют эти клеточные движения, приводя к образованию более широкой и короткой ткани (80, 93-95). Нарушение конвергентного вытягивания, как полагают, является причиной дефектов закрытия нервной трубки, обнаруживаемых у PCP мутантных мышей и рыбок данио. Интересно, что передача сигналов PCP полярности как при конвергентном вытягивании, так и ориентированных клеточных делениях имеют один и тот же финал - удлинение и сужение ткани во время развития.
Хотя Wg и Drosophila Wnts не играют роли в передаче сигналов PCP у мух, имеются доказательства. что неканонический Wnt путь участвует в PCP позвоночных. Имеются 19 Wnt лигандов у млекопитающих, большинство из которых передают сигналы преимущественно с помощью канонической передачи сигналов посредством связывания с Fz рецепторами и активирования Dsh гомолога (Dv1). Активация Dvl нарушает β-catenin disruption complex (состоящий из Axin, adenomatous polyposis coli, glycogen synthase kinase 3 и casein kinase), приводя к стабилизации β-catenin. Beta-catenin может транслоцироваться в ядро, где он активирует транскрипцию генов мишеней совместно с транскрипционными факторами T-cell factor/lymphocyte enhancer factor (rev. 96). Напротив, неканоническая передача сигналов Wnt не зависит от β-catenin. Ряд Wnts, по-видимому, регулирует неканоническую передачу сигналов. Напр., волосковые клетки неправильно ориентируются в улитке Wnt5a мутантных мышей (97) и Wnt5 и Wnt 11 необходимы для конвергентного вытягивания у рыб и лягушек (98-100). Неожиданно дефекты конвергентного вытягивания у Wnt 11 мутантов могут быть восстановлены с помощью экзогенной экспрессии Wnt11, подтверждая, что Wnt11 играет пермиссивную роль в PCP (98). Недавние исследования подтвердили, что способность специфических Wnt передавать сигналы посредством канонического или неканонического путей оказывается возможной из-за присутствия специфических корепрессоров или дополнительных киназ (101-103), это может отражать необходимость в более сложной регуляции PCP у позвоночных.
Интересно, что некоторые core PCP белки, включая Vang12, Dv12, Pk2, Fz3 и Fz6, как было показано, обнаруживают асимметричную локализацию у позвоночных (87, 90, 92, 104). Следовательно, поляризованная локализация PCP компонентов является законсервированным свойством PCP сигнального каскада. Однако существуют непростые взаимоотношения между локализацией белка, обнаруживаемой у Drosophila и локализацией PCP у позвоночных. Напр., хотя Vang проксимально локализован, а Fz дистально у Drosophila, у мышей Vang12, Fz и Fz6 обнаруживаются на той же самой стороне сенсорных клеток внутреннего уха.
PCP and cystic kidney disease
Одним из первых указаний на связь между кистозной болезнью почек и PCP послужило то, что ген, мутантный при NPHP, inversin, контролирует баланс между канонической и неканонической передачей сигналов Wnt (PCP) и связан с core PCP белком Diego (105). В то же самое время, однако, оставалось неясным, как передача сигналов PCP может приводить к образованию кист.
Недавнее элегантное исследование продемонстрировало механическую основу, необходимую для передачи сигналов PCP при нормальном развитии почек и показало, как нарушение передачи сигналов PCP может приводить к кистозным расширениям канальцев почек. Отслеживая клеточные клоны и проверяя клетки в митозах, было показано, что когда эпителиальные клетки в прямых сегментах канальцев наружной медуллы делятся, то обнаруживается высокая степень ориентированных клеточных делений (81). Фактически, 95% клеток делится под углом 34° от оси канальца. то привело авт. к модели, согласно которой ориентированные клеточные деления важны для образования обычно тонких удлиненных канальцев, которые составляют большую часть нефрона (Fig. 5). Чтобы определить, ассоциируют ли расширения канальцев и кисты при кистозной болезни почек с неправильно ориентированными делениями клеток. авт. исследовали две разные мышиные модели болезни поликистоза почек и обнаружили четкую потерю ориентированных клеточных делений у PKD мутантов. Учитывая известную роль передачи сигналов PCP в ориентированных клеточных делениях, авт. предположили. что некоторые формы кистозной болезни почек могут возникать из-за дефектов PCP.
Эта гипотеза недвно была подкреплена наблюдением, что мутанты по Fat4, ортологу Drosophila Fat, обладают многими PCP фенотипами, включая дефекты внутреннего уха и дефекты нервной трубки (106). Fat/Ds/Fj сигнальная кассета, по-видимому, действует тем же самым способом у мышей, что и у мух , т.к. у Fat4мутантов ген Fjx1, ортолог fj транскрипционно активируется, как и у мушиных fat мутантов. Важно, что Fat4 мутантные почки имеют расширенные канальцы и кисты. Анализ ориентированных клеточных делений показал, что потеря Fat4 ведет к рандомизации веретен при рождении. Кистозный фенотип Fat4 мутантных почек усиливается при потере Fj ортолога, fjx1, а также при потере одной копии core PCP гена Vang12, что также подтверждает гипотезу, что потеря передачи сигналов PCP ведет к образованию кист. Интересно, что Fat4 локализуется в первичной ресничке, органелле уже участвующей в поликистозной болезни почек и в передаче сигналов PCP у позвоночных.
Др. недавнее исследование также установило связь между Wnt9b и неканонической передачей сигналов PCP при развитии почек и при поликистозной болезни почек (CM Karner, R Chirumamilla, S Aoki, P Igarashi, JB Wallingford, TJ Carroll, unpublished data; T. Carroll, personal communication). Диаметр канальцев драматически уменьшается в ходе нормального эмбрионального развития
 Fig. 5. Defective spindle orientation in polycystic kidney disease. Normal tubules in the kidney undergo oriented cell divisions, resulting in an elongation of the tubule after division (top). If oriented cell division is lost, either through defective PCP or through mutations that give rise to PKD, tubules become broader and remain short (bottom).
Fig. 5. Defective spindle orientation in polycystic kidney disease. Normal tubules in the kidney undergo oriented cell divisions, resulting in an elongation of the tubule after division (top). If oriented cell division is lost, either through defective PCP or through mutations that give rise to PKD, tubules become broader and remain short (bottom).
со среднего диаметра в 11 cells/tubule на ст. E15, до приблизительно 4 cells/tubule на ст. P0. Потеря Wnt9b делает канальцы более широкими и ведет к образованию кист. Анализ клеточной формы показал, что эпителиальные клетки нормальных канальцев имеют удлиненную форму, перпендикулярную к оси канальца. Это согласуется с предыдущими наблюдениями над клетками, подвергающимися конвергентному вытягиванию и подтверждает, что. по крайней мере, один механизм лежащий в основе элонгации и сужения канальцев может быть механизмом клеточной интеркаляции.
Wnt9b мутанты не обнаруживают организованной формы клеток, это указывает на то, что движения конвергентного вытягивания могут быть дефектными. Существенно, что потеря Fat4 ведет к образованию кист, которые возникают преимущественно в медуллярной области, тогда как потеря Wnt9b ведет к появлении более кортикальных кист. Эти данные подтверждают существование частично перекрывающихся механизмов регуляции удлинения канальцев: конвергентного вытягивания и ориентированных клеточных делений, при этом каждый играет наиболее важную роль в разное время во время развития и в разных регионах почек.
Ciliary involvement in PCP and cystic kidney disease
Первичная ресничка является базирующимся на микротрубочках антенно-подобным выпячиванием с поверхности большинства клеток (rev. 33). Первичные реснички являются неподвижными и состоят из аксонемы, представленной 9 дублетами микротрубочек, окруженных мембраной реснички. Первичная ресничка закреплена на клетке с помощью базального тельца, структуры, которая также функционирует как одна из центриолей во время клеточных делений. В почках одиночная первичная ресничка обнаруживается на апикальной поверхности большинства эпителиальных клеток канальцев. Первичная ресничка участвует в регуляции клеточного цикла, передаче сигналов hedgehog, передаче сигналов Wnt и в передаче сигналов PCP.
Несколько линий доказательств указывают на то, что кистозная болезнь возникает из аномалий в структуре и/или функции первичной реснички (rev. 31). Белки, мутантные при ARPKD и ADPKD, обнаруживаются в первичных ресничках эпителиальных клеток почек. Белковые продукты генов, мутантных при др. кистозных болезнях почек, таких как NPHP и Bardet-Biedl синдром. также обнаруживаются в ресничках или ассоциированы с базальным тельцем. Важно, что мутантные мыши, содержащие укороченные или отсутствующие первичные реснички, теряют ориентированные клеточные деления и ведут к кистозной болезни почек (107).
Множество связей было также обнаружено между PCP и ресничками. Потеря PCP эффекторных генов
fuzzy и inturned, ведет к нарушениям цитоскелета (108) и дефектам цилиогенеза. Ассоциированные с ресничками белки, такие как inversin, реглуируют баланс между канонической передачей сигналов Wnt и неканонической передачей сигналов (PCP) , потенциально посредством регуляции Dsh (105, 109, 110). Столкновение с core PCP белком Dsh вызывает потерю ресничек в эпителиальных клетках бронхов из-за дефектов закреплении базальных телец (111). PCP белки Fat4 и Vang12 локализуются в основании ресничек (34, 106) культивируемых клеток. Почечные реснички проецируются в просвет канальцев и изгибаются в ответ на ток жидкости. Изгибание ресничек стимулирует увеличение цитозольной концентрации кальция (112), это ведет к предположению, что первичные реснички действуют как механосенсоры тока мочи в почечных канальцах и что потеря восприятия тока ведет к образованию кист. Однако недавние работы (107, 113) пошатнули мнение, что нормальная геометрия почечных канальцев поддерживается за счет механического изгибания ресничек в ответ на ток мочи (12). Важно, что потеря ресничек не ведет к образованию кист пока не будет индуцирована новая пролиферация. Сходным образом, если клеточная пролиферация блокирована у рыбок данио, то большинство дефектов, ассоциированных с потерей передачи сигналов PCP , супрессируется (114). Эти данные подчеркивают критическую роль того, что PCP участвует в нормальном развитии и регенерации.
Remaining questions and future directions
It is clear that PCP signaling has crucial roles in kidney development and function. While there have been many important insights gleaned from the analysis of PCP pathways in model organisms, we still do not understand the developmental context of these pathways in kidney development. What are the PCP cues for spindle orientation? How does PCP signaling lead to convergent extension of kidney tubules? Why are PCP genes often (but not always) localized to the cilia in kidney cells? Finally, although many loci for cystic kidney diseases have been identified, many still remain unidentified (F. Hildebrandt, personal communication). Given the intriguing links between PCP signaling and cyst formation, elements of the PCP pathway are prime candidates for these yet unidentified cystic kidney disease genes.
Сайт создан в системе
uCoz  Fig. 1. Human cystic kidney disease: autosomal recessive polycystic kidney disease (ARPKD) and autosomal dominant polycystic kidney disease (ADPKD) kidneys. Pathological specimens of surgically removed polycystic kidneys. The ADPKD kidney is 18 cm long and 11 cm wide and characterized by large cysts (arrows) in the cortex and medulla. ARPKD kidney is 4 cm wide and 8 cm long. ARPKD cysts are small and found in the cortex and medulla (arrowheads).
Fig. 1. Human cystic kidney disease: autosomal recessive polycystic kidney disease (ARPKD) and autosomal dominant polycystic kidney disease (ADPKD) kidneys. Pathological specimens of surgically removed polycystic kidneys. The ADPKD kidney is 18 cm long and 11 cm wide and characterized by large cysts (arrows) in the cortex and medulla. ARPKD kidney is 4 cm wide and 8 cm long. ARPKD cysts are small and found in the cortex and medulla (arrowheads).  Fig. 2. Planar polarity and planar cell polarity (PCP) mutant phenotypes. (a) In normal flies, wing hairs (top) and photoreceptor clusters, called ommatidia (middle) show clear organization in the plane of the epithelium. In mammalian inner ears, the stereocilia also are organized in the planar of the tissue. In PCP mutants (right), this precise tissue organization is lost, with hairs on the wing pointing in all directions, and ommatidia or stereocilia showing randomized orientation, (b) Loss of the PCP gene fz in a patch of mutant tissue (red) disrupts the planar organization of mutant cells, and also disrupts the planar organization of wild-type cells on the distal side of the clone (blue), while wild-type cells on the proximal side are unaffected. This phenomena is termed domineering non-autonomy.
Fig. 2. Planar polarity and planar cell polarity (PCP) mutant phenotypes. (a) In normal flies, wing hairs (top) and photoreceptor clusters, called ommatidia (middle) show clear organization in the plane of the epithelium. In mammalian inner ears, the stereocilia also are organized in the planar of the tissue. In PCP mutants (right), this precise tissue organization is lost, with hairs on the wing pointing in all directions, and ommatidia or stereocilia showing randomized orientation, (b) Loss of the PCP gene fz in a patch of mutant tissue (red) disrupts the planar organization of mutant cells, and also disrupts the planar organization of wild-type cells on the distal side of the clone (blue), while wild-type cells on the proximal side are unaffected. This phenomena is termed domineering non-autonomy.  Fig. 3. Asymmetric distribution of core planar cell polarity (PCP) proteins. Diagram of the distribution of core PCP proteins in Drosophila. Top, core PCP protein distribution in the wing; bottom, distribution in the eye. (a) Although core PCP proteins have a non-asymmetric distribution initially, they become asymmetric at pupal stages, with a proximal group (Pk and Vang; green) and a distal group (Dsh and Fz; red). Fmi (yellow) becomes localized to both proximal and distal sides, (b) Core PCP proteins also show asymmetric distribution in the developing fly eye. Pk and Vang (green) are localized to the R4 side of the R3/R4 interface, and Dsh, Fz and Dgo localize on the R3 side (red). Fmi accumulates on both sides. This diagram is somewhat simplified, as there is some protein localization on the other photoreceptors; however, the intervening cells do not show asymmetric protein localization.
Fig. 3. Asymmetric distribution of core planar cell polarity (PCP) proteins. Diagram of the distribution of core PCP proteins in Drosophila. Top, core PCP protein distribution in the wing; bottom, distribution in the eye. (a) Although core PCP proteins have a non-asymmetric distribution initially, they become asymmetric at pupal stages, with a proximal group (Pk and Vang; green) and a distal group (Dsh and Fz; red). Fmi (yellow) becomes localized to both proximal and distal sides, (b) Core PCP proteins also show asymmetric distribution in the developing fly eye. Pk and Vang (green) are localized to the R4 side of the R3/R4 interface, and Dsh, Fz and Dgo localize on the R3 side (red). Fmi accumulates on both sides. This diagram is somewhat simplified, as there is some protein localization on the other photoreceptors; however, the intervening cells do not show asymmetric protein localization.  Fig. 4. Fat-Ds signaling. The large cadherin Ds binds to the cadherin Fat, inhibiting its function. Fat functions through the transcriptional corepressor Atro to regulate planar cell polarity (PCP) targets, such as Fj. As Fj loss of function has only weak PCP effects, there are clearly other, still unidentified transcriptional targets of Fat and Atro in PCP. Some models suggest core PCP genes are regulated by Fat signaling. Ds is expressed in gradients in the eye and wing imaginal disks, giving spatial information to the Fat receptor.
Fig. 4. Fat-Ds signaling. The large cadherin Ds binds to the cadherin Fat, inhibiting its function. Fat functions through the transcriptional corepressor Atro to regulate planar cell polarity (PCP) targets, such as Fj. As Fj loss of function has only weak PCP effects, there are clearly other, still unidentified transcriptional targets of Fat and Atro in PCP. Some models suggest core PCP genes are regulated by Fat signaling. Ds is expressed in gradients in the eye and wing imaginal disks, giving spatial information to the Fat receptor.  Fig. 5. Defective spindle orientation in polycystic kidney disease. Normal tubules in the kidney undergo oriented cell divisions, resulting in an elongation of the tubule after division (top). If oriented cell division is lost, either through defective PCP or through mutations that give rise to PKD, tubules become broader and remain short (bottom).
Fig. 5. Defective spindle orientation in polycystic kidney disease. Normal tubules in the kidney undergo oriented cell divisions, resulting in an elongation of the tubule after division (top). If oriented cell division is lost, either through defective PCP or through mutations that give rise to PKD, tubules become broader and remain short (bottom).