Alport syndrome (AS) - это наследственный гломерулонефрит, который по-разному ассоциирован с потерей слуха и глазными аномалиями. Считается, что AS является генетически гетерогенным заболеванием, которое вызывается мутациями в гене коллагена типа IV α5 цепи (COL4A5), расположенном в Xq22.3 и кодирующем α5 цепь типа IV коллагена (1,2). первичным патологическим событием является потеря типа IV коллагеновой сети, состоящей из ,α3, α4 и α5 цепочек, которые являются важным компонентом glomerular basement membrane (GBM). Это приводит к характерному истончению, утолщению и расщеплению GBM (3,4). До сих пор четкий диагноз AS был возможен только при биопсии почек (5), которая обычно осуществлялась поздно после начала выраженных клинических симптомов это прогрессирующей болезни почек. Поэтому ранняя диагностика и упреждающее лечение стали очень важными (6). Был достигнут прогресс в понимании генетических основ AS (7,8) и улучшении лечения, хотя пациенты. страдающие от AS неизбежно достигали конечной стадии почечной болезни. Было продемонстрировано, что секреция α3-α4-α5 (IV) гетеродимеров с помощью подоцитов в заранее сформированную, аномальную, фильтрующую GBM является эффективным для восстановления отсутствующей коллагеновой IV сети, замедляет прогрессирование почечной болезни и удлиняет продолжительность жизни (9). В др. исследовании была идентифицирована missense мутация, c.368G>A (p.Gly123Glu), в гене COL4A5, который считается генетической причиной AS (10). Однако, точный механизм недостаточно изучен и необходимы новые стратегии лечения.
MicroRNAs (miRNAs) регулируют экспрессию генов и модулируют критические биологические процессы, включая дифференцировку, пролиферацию и апоптоз. Они действуют посредством разных механизмов, включая целенаправленную miRNA деградацию и репрессию трансляции (11,12). Аберрантная экспрессия miRNA ассоциирует с болезнями почек. Появляются доказательства из клиники и исследований на животных, демонстрирующие критическую роль miRNAs для патофизиологии почек (13). В предыдущем исследовании, miRNAs были изучены в контексте нефропатии, включая мембранозную нефропатию, иммуноглобулиновую (Ig)A нефропатию, lupus nephritis и трансплантации почек. Эти результаты демонстрируют, что miRNAs могут действовать как биомаркеры для ранней диагностики болезней почек (14-16). Секвенирование транскриптов является подходящей альтернативой для секвенирования генома в целом, т.к. они лишены не-кодирующих и повторяющихся последовательностей, которые содержат большинство геномов эукариот. Данные транскриптомов открывают возможность получения быстрой, незатратной и аккуратной генетической информации (17). Анализ транскриптома диабетических почек выявил множественные гены и пути, которые могут играть роль в патогенезе болезни или действовать как биомаркеры (18). Предыдущее исследование продемонстрировало, что ассоциированные с повреждениями альтерации транскриптома возникают в клетках паренхимы почек в ответ на стрессы от трансплантации (19). Анализ транскриптома, по-видимому, является эффективным и важным инструментом для изучения почечных болезней. Кроме того, белки пригодны для расширения информации о функциональной сети экспрессии генов. С успехами 2D гель электрофореза и isobaric tagging для технологий по относительной и абсолютной квантификации, анализ белков стал важным инструментом для исследований болезней (20). Протеомика экзосом появилась как мощный инструмент для понимания молекулярного состава экзосом и обнаружила потенциал ускорения обнаружения биомаркеров при диабетической нефропатии (21). При сравнении IgA нефропатии с нормальным контролем, Park et al (22) получили протеомную карту IgA нефропатии и идентифицировали 216 белковых точек с дифференциальной экспрессией. Следовательно, изучение белков может помочь пониманию молекулярной физиологии нефропатии и выявить раннем диагностические маркеры.
Индуцированные плюрипотентные стволовые клетки (iPSCs) могут быть использованы для создания плюрипотентных специфичных для пациента клеточных линий, которые помогут понять патогенез моделируемых болезней человека и могут быть использованы для получения генетической информации, связанной с патогенезом болезни, особенно для болезней, связанных с аномальным эмбриональным развитием (23,24). Проведены обширные исследования для идентификации iPSCs (25). Молекулярные механизмы, которые управляют индукцией, поддержанием и направленной дифференцировкой плюрипотентных клеток обеспечиваются транскрипционными факторами и не-кодирующими РНК, включая miRNAs и длинные не-кодирующие РНК (26,27).
В данном исследовании были успешно получены iPSCs из клеток почечных канальцев от пациентов с AS (AS-iPSCs) и нормальных контрольных (NC-iPSCs) людей (28). Затем была изучена регуляция miRNA, транскриптов и белков в iPSCs с целью лучшего понимания генетических механизмов AS. Более того, были идентифицированы белки в дополнение к miRNAs, а их транскрипты мишени стали предметом gene ontology (GO) и Kyoto Encyclopedia of Genes and Genomes (KEGG) функционального анализа. Вырисовываются сложные карты сетей miRNAs, транскриптов и белков, которые могут помочь в понимании патогенеза AS на генетическом уровне (Fig. 1).
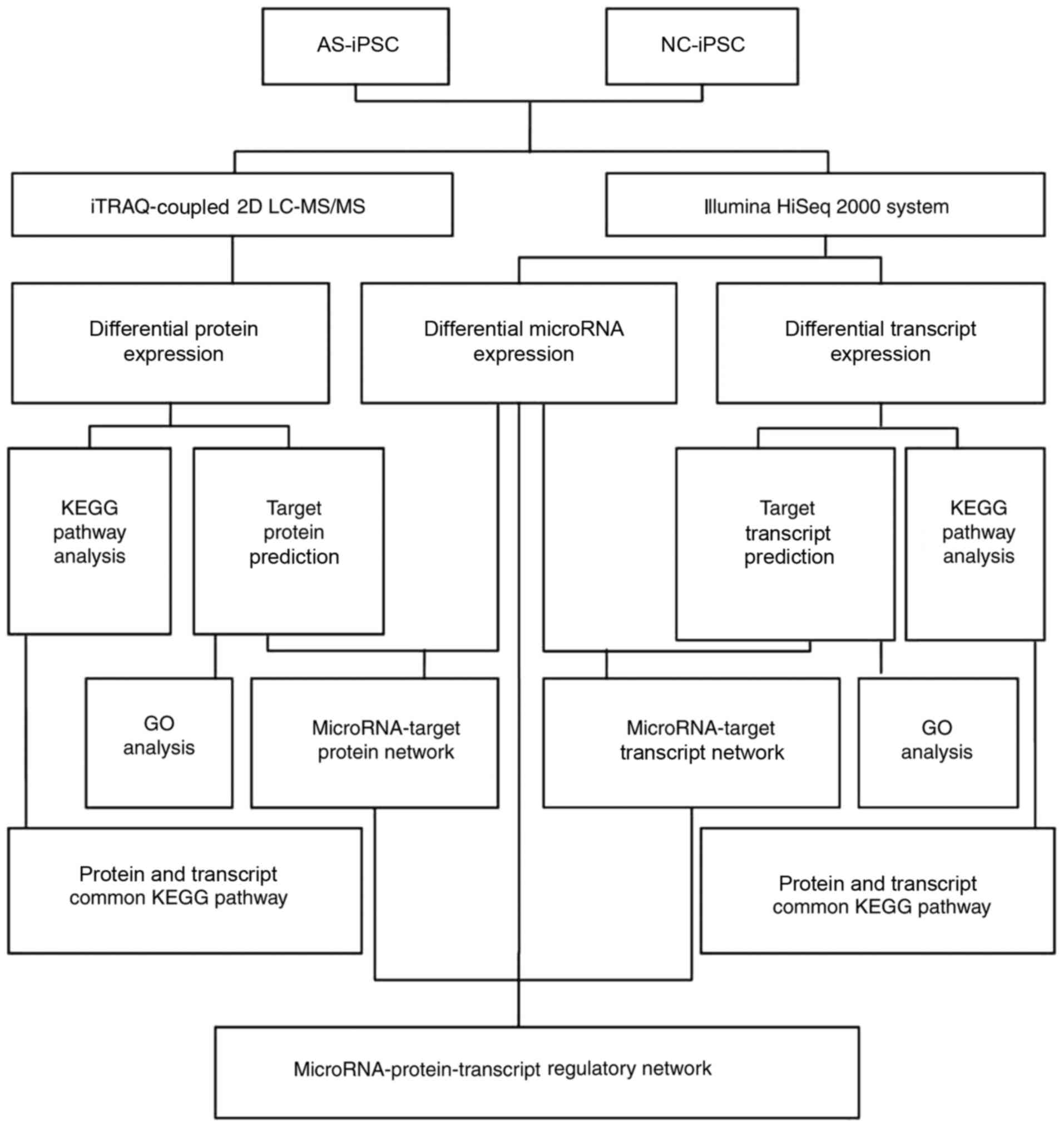 Figure 1.
Figure 1.
Schematic representation of the protocols of the present study. AS, Alport syndrome; GO, Gene Ontology; iPSC, induced pluripotent stem cell; KEGG, Kyoto Encyclopedia of Genes and Genomes; LC-MS/MS, liquid chromatography-tandem mass spectrometry; miRNA, microRNA; NC, normal control.
Итак, iPSCs были получены из клеток почечных канальцев. Система Illumina HiSeq™ 2000 и iTRAQ coupled 2D жидкостная хроматография вместе с масс-спектрометрией были использованы для получения последовательностей miRNAs, транскриптов и белков из AS iPSCs. Объединение данных экспрессии miRNA, транскриптов и белков использовали для конструкции регуляторных сетей и идентификации специфических miRNA мишеней среди транскриптов и белков. Относительная количественная протеомика с использованием технологии iTRAQ выявила 383 дифференциально экспрессирующихся белков, а высоко-производительное секвенирование выявило 155 дифференциально экспрессирующихся miRNAs и 1168 дифференциально экспрессирующихся транскриптов. Потенциальные мишени для miRNA были предсказаны с использованием miRanda, TargetScan и Pictar. Все мишени белки и транскрипты стали предметом сетевого анализа с помощью miRNAs. Gene ontology анализ miRNAs и их мишеней выявил функциональную информацию об iPSCs, включая биологические процессы и передачу клеточных сигналов. Kyoto Encyclopedia of Genes and Genomes анализ путей показал, что транскрипты и белки были прежде всего обогащены в метаболических путях и в путях молекул клеточной адгезии. Кроме того, карты сетей идентифицировали hsa-miRNA (miR) 4775 в качестве выдающейся miRNA, которая была ассоциирована с рядом мишеней. Сходным образом, идентифицированы ассоциированные транскрипты важного ELV like protein 1 A и epidermal growth factor receptor (EGFR). Анализ reverse transcription quantitative polymerase chain reaction был использован для подтверждения активации hsa-miR 4775 и EGFR. Интегрированный подход, использованный в данном исследовании, предоставил сложную молекулярную характеристику AS. Это улучшило понимание генетического патогенеза AS и облегчило идентификацию биомаркеров кандидатов для AS.
 Figure 1.
Figure 1.