Посещений: 
РОЛЬ КЛЕТОК НЕРВНОГО ГРЕБНЯ В ВОЗНИКНОВЕНИИ АНОМАЛИЙ ГЛАЗ
Генетичесик взаимодействия
Genetics Underlying the Interactions between Neural Crest Cells и Eye Development Jochen Weigele и Brenda L. BohnsackJ. Dev. Biol. 2020, 8(4), 26; https://doi.org/10.3390/jdb8040026
| |
|
Нервный гребень является популяцией мигрирующих стволовых клеток, которая вносит вклад в многочисленные структуры переднего сегмента глаз, включая роговицу, радужку, склеры, цилиарные тела, трабекулярную сетку и тракт оттока водянистой жидкости [1-6]. Важность этой популяции клеток для развития переднего сегмента глаза подчеркивается примерами потенциальных болезней слепоты, таких как Axenfeld–Rieger синдром и Peters аномалия (Figure 1A,B), которые обусловлены генетическими дефектами миграции и дифференцировки клеток нервного гребня [7-11]. Кроме того, животные модели демонстрируют, что клетки нервного гребня обладают критическими клеточно неавтономными эффектами. Нарушения передачи сигналов в клетках нервного гребня могут приводить к альтерациям формирования нейрального эпителия, происходящего из оптического бокала, приводя к микрофталмии, анофталмии и колобоме (Figure 1C,D) [6,12-14].

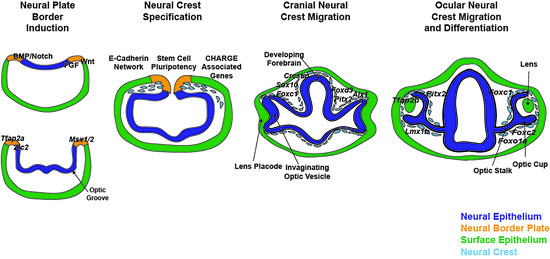
Figure 1. Clinical images of congenital ocular anomalies. (A) Axenfeld–Rieger syndrome is characterized by Rieger Anomaly (iris hypoplasia resulting in pseudopolycoria и corectopia (white arrowheads)) и Axenfeld Anomaly (anteriorization of Schwalbe’s line of the cornea (posterior embryotoxon, black arrows) with iris adhesions). These defects are due to abnormal migration и differentiation of neural crest cells into the anterior segment of the eye. Over 50% of individuals with Axenfeld–Rieger syndrome develop glaucoma which often requires surgery such as placement of a glaucoma drainage device (asterisk). (B) In Peters anomaly, there is a circumscribed central corneal opacification (outlined by dotted white line) with iris-corneal adhesions (black arrowhead). These anomalies are due to abnormal separation of the lens vesicle from the surface ectoderm resulting in absence of Descemet’s membrane и disruption of neural crest cell migration into the anterior segment. (C,D) Colobomas are due to incomplete closure of the ocular fissure и can affect the iris, zonules, retina, choroid, и optic nerve. Chorioretinal colobomas are inferior to the optic nerve и are characterized by an area that is devoid of retina и choroid (C, white arrows). In these types of coloboma, the macula (+) which accounts for central vision, is typically not affected. Optic nerve colobomas (D, white arrows) can cause severe vision loss especially if the entire optic nerve (outlined by black dotted line) is involved. Although the macula (+) may not be affected, the loss of the ganglion cell axons that comprise the optic nerve limits vision. Развитие нервного гребня сложный процесс, который характеризуется несколькими характерными событиями [15-17]. Сразу после гаструляции, эктодермальный зародышевый слой подразделяется и специфицируется посредством разных внеклеточных сигналов и систем на две территории: не нейральная эктодерма, которая дает эпидермис и нейральная эктодерма, которая формирует ЦНС [17-20]. Эти территории разделяются краем нервной пластинки, из которого специфицируются клетки нервного гребня во время закрытия нервной трубуки (Figure 2) [17,20,21]. Уникальность среди популяций стволовых клеток для клеток нервного гребня заключается в том, что клетки нервного гребня подвергаются эпителиально-мезенхимному переходу (EMT), отслаиваются от нервной трубки (Figure 3), и мигрируют в разные регионы эмбриона, давая болшой набор тканей и клеток (Figure 4 и Figure 5) [2,22,23]. Каждый из этих последовательных процессов, индукция края нервной пластинки, спецификация нервного гребня, миграция нервного гребня и дифференцировка нервного гребня контролируются перекрывающимися регуляторными сетями генов [15,17,24].
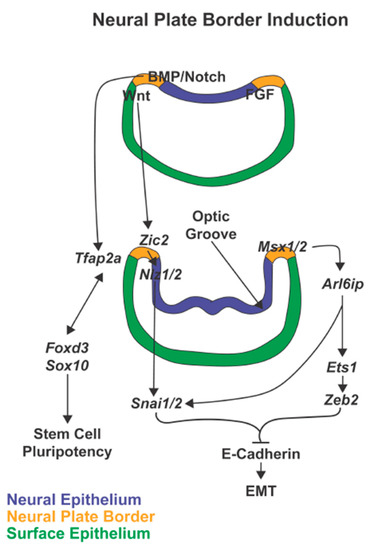
Figure 2. Neural plate border induction. In neural plate border induction, FGF followed by Notch и BMP signaling are expressed in the neural ectoderm while Wnt is expressed in the non-neural ectoderm. In the next phases of neurulation и optic groove formation, these signals then induce expression of the neural plate border specifiers, Msx1/2, Zic2, и Tfap2. These transcription factors, expressed within the neural plate border, trigger signaling cascades that maintain stem cell pluripotency и prepare the premigratory neural crest cells for epithelial-mesenchymal transition (EMT).
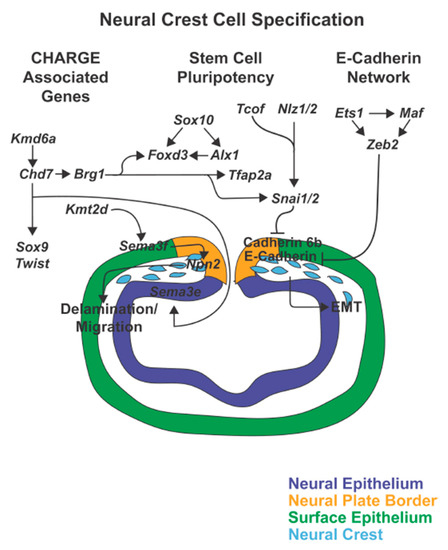 Figure 3. Neural crest cell specification. As the neural tube closes, genes including Sox10, Foxd3, Alx1, Tfap2a, Tcof, Nlz1/2, и Snai1/2 induce neural crest cell identity и maintain stem cell pluripotency. Simultaneously, Tcof, Nlz1/2, и Sna1/2, together with Ets1, Maf, и Zeb2 inhibit E-Cadherin и Cadherin 6b within the premigratory neural crest to trigger epithelial-mesenchymal transition (EMT). Furthermore, the CHARGE associated genes, Chd7, Kmd6a, Brg1, и Kmt2d regulate neural crest cell delamination и initiation of migration.
Figure 3. Neural crest cell specification. As the neural tube closes, genes including Sox10, Foxd3, Alx1, Tfap2a, Tcof, Nlz1/2, и Snai1/2 induce neural crest cell identity и maintain stem cell pluripotency. Simultaneously, Tcof, Nlz1/2, и Sna1/2, together with Ets1, Maf, и Zeb2 inhibit E-Cadherin и Cadherin 6b within the premigratory neural crest to trigger epithelial-mesenchymal transition (EMT). Furthermore, the CHARGE associated genes, Chd7, Kmd6a, Brg1, и Kmt2d regulate neural crest cell delamination и initiation of migration.
Jdb 08 00026 g004 550
Figure 4. Cranial neural crest cell migration. Following closure of the neural tube, cranial neural crest cells expressing foxd3, sox10, и crestin migrate between the neural epithelial-derived forebrain и optic vesicle и the surface epithelium. Sox4 within neural crest cells together with Sox11 и Zic2 regulate hh-patterning of the dorsal-ventral retina и subsequent expression of Pax2a и Vsx1/2. In addition, retinoic acid (RA) regulation of Pitx2 и Foxc1 within periocular neural crest cells is important for optic cup и anterior segment development.
Jdb 08 00026 g005 550
Figure 5. Ocular neural crest cell migration и differentiation. Neural crest cells surround the developing eye и enter into the ocular anterior segment between the surface epithelium и optic cup и through the ocular fissure. Pitx2 is important for corneal и iridocorneal angle development и function through the regulation of Tfap2b и Lmx1b. In addition, Pitx2 targets mesodermal cells и induces expression of MyoD и Myf5 which triggers extraocular muscle formation. Foxc1 also regulates anterior segment development by targeting Fgf19, Foxc2, GaInt4, и Foxo1a. Одновременно с закрытием нервной трубки, выпячивается оптический пузырек из развивающегося переднего мозга и затем инвагинирует, образуя двухслойный бокал (Figure 4) [25-27]. Клетки нервного гребня, преимущественно происходящие из prosencephalon и mesencephalon, мигрируют в около-глазную мезенхиму, которая окружает и поддерживает оптический бокал [10,11,28]. Параллельно дистальный край глазного бокала взаимодействует с лежащей поверх эктодермой, чтобы индуцировать формирование хрусталиковой плакоды, что сопровождается отделением хрусталикового пузырька [26,29]. В дальнейшем клетки нервного гребня проникают в глаз двумя путями: 1) через глазную щель на вентральном крае бокала и 2) между оптическим бокалом и лежащей поверх поверхностной эктодермой, чтобы дать начало кровеносным сосудам и структурам переднего сегмента [6,11,30].
Хотя клетки нервного гребня последовательно вносят вклад в эндотелий роговицы, строму роговицы, радужку, цилиарные тела и систему отвода водянистой жидкости, характер миграции этих клеток в глаз отличается у разных видов. Клетки нервного гребня мигрируют в виде трех волн у людей, двух волн у мышей и постоянно у эмбрионов кур [1,4,31]. У рыбок данио клетки нервного гребня мигрируют , по крайней мере, тремя волнами. Недавние исследования показали, что существуют две самостоятельные популяции sox10-позитивных клеток, которые мигрируют в глаз спустя 12–18 ч после отделения нервного гребня, и последующая популяция foxd3-позитивных клеток, которые мигрируют в передний сегмент на поздней эмбриональной и ранней личиночной стадии [11,32]. После миграции в передний сегмент глаза, сигналы, которые регулируют терминальную дифференцировку клеток нервного гребня, оказываются недостаточно изучены [33,34].
Как популяции стволовых клеток, клетки нервного гребня приобретают способность обнаруживать разнообразные сигналы во время специфических временных рамок, чтобы дифференцироваться в разнообразные наборы тканей и клеток. Напр., у эмбрионов рыбок данио клетки нервного гребня в пери-окулярной мезенхиме обнаруживают как перекрывающиеся, так и индивидуальные паттерны экспрессии foxc1a, foxc1b, eya2, foxd3, pitx2, sox10, lmx1b.1 и lmx1b.2, которые совпадают с возникающими потоками миграции клеток нервного гребня. Это означает отсутствие униформности внутри популяции клеток нервного гребня внутри около-глазной мезенхимы. Однако, остается спорным, действительно ли популяция клеток нервного гребня в целом гомогенна или гетерогенная смесь клеток, специфицированных с направлении определенной судьбы [35-38]. Поскольку развития нервного гребня является сложным процессом с вовлечением многочисленных ступеней, то здесь мы остановимся на генетике популяции этих стволовых клеток в контексте развития глаз.
2. Overview of Neural Crest Signaling Modules Развитие нервного гребня подразделяется на последовательные процессы, которые регулируются с помощью перекрывающихся регуляторных сетей генов, которые совместно формируют сигнальные модули [15,17,24,39].
Индукция края ранней нервной пластинки управляется с помощью Fgf путем активации генов, способствующих нейральному развитию, и поддерживается с помощью передачи сигналов Notch и Bmp в нейральной эктодерме и с помощью Wnt в не нейральной эктодерме. Совместно такая передача сигналов приводит к индукции спецификаторов края нервной пластинки (Figure 2) [17,19,20,40-43]. Эти транскрипционные факторы первоначально экспрессируются во время ранней гаструляции по краю нервной пластинки и являются критическими для спецификации нервного гребня. Внутри клеток нервного гребня перед миграцией экспрессия спецификаторов края нервной пластинки Msx1, Zic2 и Tfap2, поддерживается вместе с активацией дополнительных генов, необходимых для собственно EMT и последующей миграции клеток нервного гребня [17,44-46]. Эти гены могут быть подразделены на разные группы: 1) с CHARGE синдромом ассоциированные гены, 2) гены, регулирующие E-Cadherin в клетках нервного гребня во время EMT, и 3) гены, участвующие в поддержании плюрипотентности эмбриональных стволовых клеток и клональной специфичности клеток (Figure 3) [46-50]. Ассоциированные с CHARGE синдромом, гены регулируют отсоединение клеток от края нервной трубки посредством эпигенетических модификаций. Гены, участвующие в регуляции передачи сигналов E-Cadherin, ереключают экспрессию с E-Cadherin на N-Cadherin, это важная ступень в подготовке клеток к миграции [47,51,52]. Во время этих процессов, однако, клетки должны поддерживать свою плюрипотентность стволовых клеток , а также способность отвечать соотв. образом на внешние сигналы, чтобы дифференцироваться в специфические клоны клеток [46,53]. Став миграторными, дополнительные транскрипционные факторы управляют миграцией клеток нервного гребня от края нервной трубки к месту предназначения по всему телу (Figure 4) [28,54]. Сигналы к дифференцировке в окончательных местах расположения, таком как передний глазной сегмент , затем регулируют формирование разных наборов структур и тканей (Figure 5) [46].
Самыми роспространенными среди этих сигнальных модулей являются повторения генов на разных ступенях развития нервного гребня. Более того, многие из этих генов экспрессируются также в др. тканях, производных нейральной эктодермы. Избыточность путей показывает текучесть этих процессов, но также осложняет определение критических функций этих генов, особенно в контексте развития окончательного органа.
3. Neural Plate Border Genes
3.1. Msx Gene Family
Гены Msx кодируют транскрипционные факторы, которые обладают гомологией с muscle segment homeobox (msh) генами дрозофилы. Как семейство генов, они экспрессируются в разных тканях в ходе эмбриогенеза, хотя наиболее охарактеризованной является их роль в клетках краниального нервного гребня, а значит и в черепно-лицевом развитии [55,56]. Существует три идентифицированных члена этого семейства, Msx1, Msx2 и Msx3, обнаруживающих функциональное перекрывание, т.к. разрушение индивидуального гена приводит к скромным дефектам, тогда как разрушения множественных Msx генов вызывает тяжелые аномалии края нервной пластинки и спецификации нервного гребня [57-61]. Msx1 и Msx2 постоянно необходимы во время спецификации пре-миграторных клеток нервного гребня, т.к. активируют Arl6ip и далее нижестоящие мишени Snai1/2, Foxd3, Ets1 и Zeb2 (Figure 2) [58]. Этот путь приводит к подавлению экспрессии Е-Cadherin, что является существенным для запуска EMT [62]. Помимо этих ранних ролей, Msx1 кроме того, экспрессируется в пери-окулярной мезенхиме эмбрионов мышей и кур, тогда как Msx2 обнаруживается позднее в развитии при формировании из поверхностной эктодермы эпителия роговицы и хрусталика и происходящей из нейрального эпителия сетчатки [63,64]. Однако, нокдаун Msx1 и Msx2 приводит к образованию уродливого и увеличенного глазного бокала у мышей и к микрофталмии у рыбок данио [65]. Такая фенотипическая изменчивость может быть обусловлена межвидовыми различиями в роли Msx генов в развитии переднего мозга и клеток нервного гребня. Необходимо идентифицировать специфические мишени для генов Msx внутри глазного пузырька. Аномалии глазного бокала и колобомы обычно обнаруживаются у мышей и рыбок данио, у которых экспрессия генов, важных для спецификации нервного гребня, генетически нарушена [6,12-14]. Механизмы, лежащие в основе этих взаимодействий с нижестоящими мишенями внутри глазного пузырька будут рассмотрены далее.
3.2. Zic Gene Family Члены семейства Zic (zinc finger of the cerebellum) являются важными регуляторами развития нейроэктодермы и нервного гребня. Существует пять гомологов у кур, мышей и людей и семь в рыбок данио, Zic1, Zic2 и Zic3 изучены наиболее хорошо [66-68]. Zic1 и Zic3 работают вместе в индукции нейральной эктодермы, которая необходима для приобретения клетками нейральной и нервного гребня судьбы [69,70,71]. Однако, их главной ролью является участие в развитии переднего мозга скорее, чем тканей, происходящих из нервного гребня [72-75]. В противоположность Zic1 и Zic3, Zic2 является непосредственной мишенью для передачи сигналов Wnt внутри передней части нервной пластинки в средине гаструляции и инициирует спецификацию края нервной пластинки [76,77]. У мышей эти регулируемая с помощью Zic2 ступень необходима для генерации соотв. количества клеток нервного гребня [78,79]. В дальнейшем у мышей и рыбок данио Zic2 ингибирует E-Cadherin посредством Nlz1/2 и Snai1/2 , чтобы запустить EMT и выход из нервной трубки (Figure 2).
У рыбок данио экспрессия zic2b сохраняется в клетках нервного гребня, тогда как zic2a экспрессируется в ограниченном домене дистальной части глазного стебля [76-80]. Хотя комбинированный нокаут zic2a и zic2b приводит к колобоме с около-глазными кровоизлияниями и отеками, основным дайвером этого фенотипического отклонения является потеря zic2b [79]. Потеря Zic2b приводит к снижению экспрессии alx1 и в меньшей степени в клетках нервного гребня внутри около-глазной мезенхимы, включая клетки нервного гребня, негативные по crestin в области, соседствующей с глазной щелью [79]. Кроме того, zic2b ограничивает передачу сигналов hedgehog (hh) в нейральном эпителии, происходящем из pre-optic части диенцефалона, в глазном стебле и вентральной части сетчатки (Figure 4) [79]. Сходным образом, у рыбок данио, sox4 и sox11 действуют, ограничивая экспрессию hh в вентральной части переднего мозга, рядом с глазным пузырьком. Более того, нокдаун Sox4 или Sox11 приводит к колобомам у рыбок данио [81,82].В то время как оба эти SoxC транскрипционные экспрессируются в переднем мозге, sox4 экспрессируется также в клетках нервного гребня в около-глазой мезенхиме и вместе с zic2b могут оказывать не автономные эффекты на развитие глазного бокала [82]. Подавление zic2b, sox4 или sox11 вызывает неправильное расположение pax2a, vsx1, и vsx2, которые необходимы для дорсального и вентрального паттерна сетчатки и последующего закрытия глазной щели [79,81,82]. Однако, позднее в ходе развития во время дифференцировки клеток ретинальных ганглиев, zic2 противодействует экспрессии sox4 и sox11 при формировании проекций аксонов, не выявлено однако, взаимодействие zic2 и sox4 в нервном гребне [83].
3.3. TFAP2 Genes Tfap2 гены кодируют транскрипционный фактор член семейства белков AP-2, который также экспрессируется как в не нейральной эктодерме, так и в клетках нервного гребня во время эмбриогенеза [84,85]. Три гена, Tfap2a, Tfap2b, и Tfap2c, обнаруживают перекрывающуюся, но не идентичную экспрессию в клетках нервного гребня Xenopus и мышей, тогда как только tfap2a и tfap2c экспрессируются у рыбок данио в клетках нервного гребня, демонстрируя специфические отличия в функции генов [84-88]. Из трех генов ген Tfap2a является наиболее критическим для клеток нервного гребня и черепно-лицевого развития. Это подчеркивается Branchio-Oculo-Facial Syndrome у человека, который ассоциирует с мутациями TFAP2A и характеризуется черепно-лицевыми (расщепление губы, расщепление нёба, уродства ушей) и аномалиями глазs (анофталмия, микрофталмия, катаракта и колобома) [89,90]. На границе нервной пластинки, передача сигналов Bmp индуцирует экспрессию Tfap2a и Tfap2c [91]. В то время как Tfap2a является ключевым регулятором Foxd3 в спецификации нервного гребня, экспрессия Tfap2c является кратковременной и перекрывается с Tfap2a [17,85]. В пре-миграторных клетках нервного гребня, экспрессия Tfap2a не зависит от Foxd3. Однако, в ранних миграторных клетках, экспрессия Tfap2a становится синергичной с и зависит от Foxd3 и Sox10 [85,92,93] (Figure 2). Позднее во время миграции, экспрессия Tfap2a и Foxd3 подразделяется на самостоятельные популяции, объясняющие отличия в экспрессии нижестоящих маркеров нервного гребня и мутантных фенотипов [92,93]. По завершении миграции клеток нервного гребня у людей, мышей и рыбок данио, Tfap2a экспрессируется в носовых отростках и зачатках зубов [94]. Подобно Zic2b, Tfap2a также экспрессируется в около-глазной мезенхиме, которая окружает ранний глазной пузырёк у мышей и рыбок данио (Figure 4) [94,95]. Поскольку Tfap2a экспрессируется у рыбок данио и мышей в эпителии роговицы и хрусталика, то это происходит после завершения морфогенеза глазного бокала, включая и закрытие глазной щели. Как и у людей, Tfap2a у мутантных рыбок данио и мышей вызывает микрофталмию и колобому, указывая, что специфичная для нервного гребня экспрессия оказывает клеточно неавтономные эффекты на глазной бокал [94,95]. Однако, остается неясным, действительно ли Tfap2a функцияонирует посредством того же самого обеспечиваемого hedgehog пути Zic2.
4. CHARGE Syndrome Associated Genes С синдромом CHARGE ассоциированные гены регулируют эпигенетические механизмы, чтобы управлять правильным отсоединением премиграторных клеток нервного гребня от края нервной трубки [96]. Chd7, который является центральным в этом сигнальном каскаде, является helicase ДНК-связывающим белком. У людей аутосомно доминантные мутации CHD7 ассоциированы с синдромом CHARGE, сочетанием врожденных аномалий, включая колобому, дефекты сердца, атрезию хоан, задержку роста и развития, гипоплазию гениталий и аномалии ушей [97-99]. У мышей и Xenopus, Chd7 экспрессируется в пре-миграторных и мигрирующих клетках нервного гребня и экспрессия является чувствительной к дозе гена. Мыши, гетерозиготные по мутации Chd7, или Xenopus, у которых белок подвергся нокауту с помощью morpholino олигонуклеотидов, обнаруживают дезорганизацию и уменьшение количества клеток нервного гребня [48,100]. В клетказ нервного гребня, Chd7 активирует Sox9, Twist, и Snai1/2 , чтобы и дальше управлять миграцией (Figure 3). Кроме того, Chd7 работает совместно с комплексом BAF (SWI/SNF), который ответственен за ремоделирование хроматина. В комплексе BAF complex, Brg1 (Smarca4a) кодирует стержневую ATPase, а нокаут этого гена подавляет активность Tfap2a, Foxd3, и Snai1/2 [100]. Кроме того, у рыбок данио chd7 регулирует sema3e, который экспрессируется в заднем мозге, а избыточная экспрессия sema3e устраняет нокаутный chd7 фенотип [101]. В соответствии с этим мутации в SEMA3E были обнаружены у пациентов с синдромом CHARGE, а нокаут sema3e у рыбок данио фенокопирует нокаутный фенотип chd7.
Колобомы являются приметным признаком синдрома CHARGE, однако, остается неясным, действительно ли этот дефект глаз обусловлен нарушениями формирования глазного бокала, происходящего из нейральной эктодермы, и/или дефектами нервного гребня [102,103]. Помимо его роли в клетках нервного гребня, экспрессия Chd7 в нервной эктодерме необходима для развития глазного бокала и его ножки [103]. Необходимы дальнейшие исследования Chd7 в нервной эктодерме и клетках нервного гребня для развития глаз.
Более того, модификации состояния метилирования с помощью H3 lysine 4 (H3K4) метилазы (кодируемой геном Kmt2d) и X-сцепленной histone H3 lysine 27 (H3K27) деметилазы (кодируемой геном Kmd6a/Utx) также важны для регуляции отсоединения клеток нервного гребня и последующей миграции [104-106]. Мутации KMT2D или KMD6Aассоциированы с Kabuki Syndrome, которые обнаруживают общие характеристики с синдромом CHARGE, включая микрофталмию и колобому [107-109]. У Xenopus, мутации потери функции Kmt2d воспроизводят синдром Kabuki и показывают, что эта метилаза необходима для дисперсии мигрирующих клеток нервного гребня [105]. Более того, нокдаун Kmt2d в клетках нервного гребня ведет к снижению экспрессии sema3F в бранхиальных дугах, так что избыточная экспрессия sema3F устраняет нокдаун. Однако, этот эффект , скорее всего, косвенный, т.к. sema3F экспрессируется в соседних клетках не нервного гребня и действует как секретируемый лиганд для рецептора Neuropilin2 (Npn2), который экспрессируется в нервном гребне (Figure 3). [105,110,111]. Сходным образом, специфичный для нервного гребня conditional нокаут Kmd6a у мышей воспроизводит синдром Kabuki. Однако, лишь небольшой набор мишеней в этих клетках связан с деметилированием гистонов [104]. Наиболее заметно в клетках нервного гребня то, что Kmd6a регулирует экспрессию Chd7 и является мишенью передачи сигналов Notch, Wnt/β-Catenin пути и p53-based targets [112]. В то время как Notch и Wnt/β-Catenin выполняют хорошо известные роли в формировании границы ранней нервной пластинки и в последующей спецификации нервного гребня, может существовать перекрестная регуляция между p53 и Kmd6a в качестве варианта p53 аллеля, модифицируя фенотипическую тяжесть мутаций Kmd6a [112]. В отличие от Chd7, который играет роль как в нервной эктодрме, так и в клетках нервного гребня, Kmt2d и Kmd6a, по-видимому, обладают специфическими для нервного гребня функциями. Т.о., глазной фенотип при синдроме Kabuki , скорее всего, обусловлен клеточно не автономными эффектами клеток нервного гребня на глазной бокал, однако, специфический механизм, лежащий в основе действия этих генов, пока не установлен.
4.1. E-Cadherin in Neural Crest Cell EMT Инициация EMT является ключевой ступенью в спецификации пре-миграторных клеток нервного гребня [23]. Ограничение межклеточных взаимодействий и, в частности, деконструкция плотных и слипчивых соединений между эпителиальными клетками запускает морфологические изменения. При распаде слипчивых соединений, белок E-Cadherin отщепляется от плазматической мембраны и деградирует, тогда как транскрипция E-Cadherin мРНК подавляется. В таком состоянии высвобождается β-Catenin из плазматической мембраны, позволяя ему накапливаться в ядре и активировать транскрипцию в ответ на передачу сигналов Wnt [47,113].
Транскрипционный фактор, Zeb2 (Zinc Finger E-Box Binding Homeobox 2) является важным ингибитором инициации с помощью E-Cadherin EMT в клетках нервного гребня. Экспрессия Zeb2 может регулироваться с помощью Msx1 посредством Arl6ip1 и Ets1 [114,115]. Arl6ip1 кодирует ADP ribosylation factor-like 6 interacting protein, который взаимодействует с Arl6, чтобы регулировать внутриклеточный трафик [116]. Интересно, что мутации ARL6 у людей ассоциируют с синдромом Bardet–Biedel, характеризующимся дегенерацией сетчатки, но не дефектами нервного гребня [117,118]. Однако, у рыбок данио нокдаун Arl6ip1 снижает экспрессию foxd3, snai1b, sox10, и crestin и подавляет спецификацию субклонов нервного гребня [119]. Ets1 кодирует E26 специфичный для трансформации транскрипционный фактор, который нацелен на Zeb2 в пре-миграторных клетках нервного гребня (Figure 3) [120]. Ets1 в клетках не нервного гребня, как было установлено, взаимодействует с Maf, basic leucine zipper транскрипционным фактором, мутации которого вызывают Ayme-Gripp Syndrome [121,122]. Этот синдром характеризуется черепно-лицевыми аномалиями, нейросенсорной потерей слуха, низким ростом, задержкой развития и аномалиями глаз, включая врожденные катаракты и колобомы [122,123]. У мышей, Mafb экспрессируется в клетках нервного гребня и может соединяться с промотором Sox9 [124]. Т.о., Maf также, скорее всего, активен в клетках нервного грбеня и может действовать совместно с Ets1, чтобы регулировать Zeb2 во время спецификации нервного гребня.
Однако, Zeb2 экспрессируется как в нервной трубке, так и в пре-миграторных клетках нервного гребня. У эмбрионов кур, нокдаун Zeb2 вызывает длительное поддержание E-Cadherin в мигрирующих клетках нервного гребня. Это нарушает отсоединение, вызывая агрегацию слипчивых клеток нервного гребня по краю нервной трубки [17,125]. Сходным образом, у мышей и рыбок данио нокаут Zeb2 вызывает дефекты миграции клеток нервного гребня и фенотип, сходный с соотв. гаплонедостаточностью ZEB2 у людей, с синдромом Mowat–Wilson [126]. Это врожденное заболевание характеризуется аномалиями нервного гребня (черепно-лицевыми и аномалиями сердца и болезнью Hirschsprung) , а также нейральными дефектами (эпилепсией, возникновения corpus callosum, и задержкой развития) [127,128]. Поскольку аномалии галаз, включая колобому, также присутствуют, то остается неясным, действительно ли они обусловлены дефектами развития нейральных и/или клеток нервного гребня.
Snai1/2 кодирует транскрипционный фактор цинковые пальчики, который подавляет экспрессию cadherin и запускает EMT. Внутри пре-миграторных клеток нервного гребня экспрессия Snai1 вызывается с помощью передачи сигналов Wnt и Zic1/2, и вместе с Foxd3, Sox10 и Ets1 является ранним спецификатором клеток нервного гребня [45,119,129-131]. Передача сигналов Wnt регулирует экспрессию Snai1 посредством гена Tcof1 (Treacle ribosome biogenesis factor 1), который экспрессируется в пре-миграторных и мигрирующиих клетках нервного гребня и кодирует белок Treacle (Figure 3) [131]. Белок Treacle находится внутри ядра и участвует в транскрипции рибосомальной ДНК. Аутосомно доминантные мутации в TCOF1 приводят к возникновению Treacher Collins Syndrome, который характеризуется тяжелыми черепно-лицевыми аномалиями (микогнатия, микротия, гипоплазия средины лица, гипоплазия скул) и глазные аномалии, включая колобому [132,133]. У мышей Tcof1 экспрессируется в фронто-назальных отростках и в верхнечелюстной и нижнечелюстной мезенхиме, и его гаплонедостаточность вызывает меньшее количество мигрирующих клеток нервного грабня и воспроизводит болезнь человека [134]. В дополнение к передаче сигналов Wnt, Snai1/2 также регулируется с помощью Zic1/2 посредством генов Nlz1/2, которые кодируют NET семейства цинковые пальчики репрессоры транскрипции [130]. Nlz1 экспрессируется на стороне нейральной эктодермы по отношению к краю нервной пластинки и, по-видимому, демаркирует линию отсоединения клеток от нервного гребня [135,136]. Благодаря этому действию, Nlz1 косвенно передает сигналы посредством Snai1/2 в пре-мигратоные клетки нервного гребня, которые д. подвергнуться EMT [135].
Snai1 репрессирует E-cadherin внутри пре-миграторных клеток и продолжает экспрессироваться в мигрирующих клетках, включая около-глазную мезенхиму [137]. Snai2 индуцируется с помощью передачи сигналов Wnt после спецификации края нервной пластинки и репрессирует Cadherin 6b в пре-миграторных клетках нервного гребня вдоль дорсальной стороны нервной трубки (Figure 3) [138]. Cadherin 6b, подобно E-Cadherin, д. быть подавлен, чтобы инициировать временную и пространственную эмиграцию клеток нервного гребня с края нервной трубки [139]. Snai1 мутанты имеют клобому, а специфические эффекты этого гена в регуляции EMT указывают что его действие в клетках нервного гребня косвенно затрагивает закрытие глазной щели [140]. Напротив, Snai2 мутанты, по-видимому, не обнаруживают глазных аномалий [141]. Это может быть связано или с отсутствием экспрессии Snai2 в около-глазной мезенхиме или компенсацией функции за счет Snai1.
4.2. Maintaining Embryonic Stem Cell Pluripotency и Cell Lineage-Specificity Несмотря на приобретение свойств мезенхимных клеток и в конечном итоге способность к миграции, клетки нервного гребня должны оставаться в плюрипотентном состоянии, а также быть детерминированы в направлении специфической клеточной судьбы. В то время как спецификаторы края нервной пластинки обнаруживают продолжающуюся экспрессию, дополнительные факторы, включая Sox10, Foxd3, Snai1/2 и Ets1 активируются на этой стадии, чтобы поддерживать качества стволовых клеток в пре-миграторных клетках нервного гребня [53,142]. Однако, во время миграции и после миграции эти транскрипционные факторы направляют расхождение на субклоны и в конечном итоге потерю экспрессии триггеров терминальной дифференцировки.
Sox10 кодирует SRY-related HMG box транскрипционный фактор, который, как челнок переносит белки между цитоплазмой и ядром, чтобы регулировать клеточные судьбы [143,144]. Во время миграции Sox10 является одним из самых ранних специфических маркеров не дифференцированных клеток нервного гребня, однако, в клетках завершивших миграцию, Sox10 направляет клетки в направллении дифференцировки меланоцитов или глии [143-146]. У рыбок данио и мышей в черепно-лицевой области Sox10 экспрессируется внутри фарингеальных дуг и около-глазной мезенхиме [145,147-150]. У рыбок данио sox10 продолжает экспрессироваться в хрящах верхней и нижней челюсти во время ранней личиночной стадии, но отсутствует у молоди [11]. В то время как позитивные по sox10 клетки проникают в развивающийся глаз, его экспрессия оказывается коротко живущей и оказывается неясным, в какую из глазных тканей вносят вклад эти клетки нервного гребня [11,32]. У людей аутосомно доминантные nonsense и frame shift мутации в SOX10, ассоциируют с синдромом Waardenburg, который прежде всего характеризуется аномалиями пигментации и дезморфизмом средины лица [151,152]. Сходным образом, colorless мутанты рыбок данио, полученные с помощью ENU мутагенеза, обладали разными точковыми мутациями в аллеле sox10, приводящими к аномалиям пигментации. Однако, мутантные рыбки обнаруживали нормальное черепно-лицевое и глазное развитие и доживали до взрослого возраста [147]. Нпротив, morpholino олигонуклеотидами вызываемый нокдаун Sox10 у рыбок данио нарушал раннюю спецификацию нервного гребня, приводя к достоверно меньшей миграции клеток. Некоторые затронутые животные имели тяжелые черепно-лицевые аномалии, микрофталмию с колобомами и не выживали после вылупления (unpublished data, personal observation). Более того, гомозиготы по мутации Sox10 у мышей оказывались летальными в эмбриональной и на ранней постнатальной стадии [153,154]. Подобная фенотипическая изменчивость может быть обусловлена эффектами дозы гена и количеством остаточной активности у гетерозигот по сравнению с гомозиготами. Необходимы дополнительные исследования для выяснения роли Sox10 в развитии клеток нервного гребня и глазного пузыря.
Foxd3 кодирует forkhead winged-helix транскрипционный фактор, который участвует в изменении стволовых клеток от нативного состояния до четкого плюрипотентного состояния. Foxd3 действует путем модификации структуры хроматина, чтобы или понизить привлечение или репрессировать активацию энхансеров [38]. Подобно Sox10, Foxd3 является ранним маркером клеток нервного гребня, но направляет пост-миграторную дифференцировку в направлении приобретения судьбы нейронов, костей и хряща [155,156]. Foxd3 экспрессируется также внутри фарингеальных дуг и в около-глазной мезенхиме [30,92]. У рыбок данио foxd3-позитивные клетки проникают в развивающийся глаз позднее, чем очень маленькая популяция sox10-позитивных клеток. Во время эмбриогенеза и на ранних личиночных стадиях foxd3-позитивные клетки проникают в радужку и роговицу, однако, экспрессия подавляется на средней личиночной стадии [11]. Вариант аллеля человеческого FOXD3 оказался ассоциированным с аномалиями пигментации (vitiligo). Однако, эта мутация, расположеная в промоторном регионе, как было установлено, увеличивает транскрипционную активность in vitro и может также участвовать в аутоиммунные процессы, таких как Hashimoto’s thyroiditis [157]. Кстати, не выявлено мутаций гаплонедостаточности для FOXD3 при болезнях человека. Это коррелирует с нокаутом Foxd3 у животных и нокдауном у моделей, которые обнаруживают тяжелые дефекты нервного гребня, особенно с участием периферической нервной системы и хрящей, которые оказываются несовместимыми с жизнью. У рыбок данио с помощью morpholino олигонуклеотидов нокдаун Foxd3 вызывает микрофталмию с нарушениями миграции клеток нервного гребня в глаза [158-161]. Интересно, что в одном клиническом исследовании было установлено, что вариант FOXD3 с неизвестной патогенной значимостью выявлен у пациентов с аниридией и Peters Anomaly [162]. Необходимы дальнейшие исследования для определения роли Foxd3 ы развитии глаз и особенно в регуляции взаимодействий клеток нервного гребня с глазным бокалом.
Семейство генов Alx кодирует paired-class homeobox транскрипционные факторы и все три члена, Alx1, Alx3 и Alx4 выполняют разные роли в развитии нервного гребня [163]. Alx1 регулирует совместно Sox10 и Foxd3 во время ранней спецификации клеток нервного гребня и продолжает экспрессироваться в ходе всей миграции. Кроме того, Alx1 экспрессируется в около-глазной мезенхиме [164]. У людей мутации ALX1 приводят к фронто-назальной дисплазии и аномалиям глаз, включая микрофтламию и анофтралмию [165,166]. Соотв., нокаут alx1 у рыбок данио также вызывает микрофталмию и колобому. Напротив, alx3 и alx4 играют свои роли позднее в пост-миграторных клетках нервного гребня и экспрессируются только вограниченных областях окологлазной мезенхимы и глаз [164]. Соотв., мутации людей в ALX3 или ALX4 вызывают умеренную фронто-назальную дисплазию, но без глазных аномалий [167,168]. Т.о., ранние осуществление спецификации клеток нервного гребня и поддержания плюрипотентности с помощью Alx1 необходимо для нормального развития глазного бокала и закрытия глазной щели. Этот эффект Alx1, скорее всего, обусловлен не автономными эффектами на глазной бокал, обеспечиваемыми клетками нервного грабня. Однако, нижестоящие мишени и молекулярные события нуждаются в дальнейших исследованиях.
5. Cranial Neural Crest Cell Migration Gene Regulation После отсоединения от края нервной трубки клетки нервного гребня следуют по определенным путям по всему телу. Краниальные клетки нервного грабня, возникают между diencephalon и rhombencephalon, чтобы в конечном итоге внести вклад в большую часть черепно-лицевого скелета (frontal, nasal, mandible, maxillary, zygomatic), и многочисленные структуры глаз (строма роговицы, эпителий роговицы, трабекулярная сеть, склеры, строма радужки, uveal меланоциты, мышцы цилиарного тела) [6,34,169-171]. Клетки краниального нервного грабня, возникающие в районе диэнцефалона и передней части mesencephalon, мигрируют в виде потоков дорсально и вентрально к глазу, чтобы занять окологлазную мезенхиму и фронто-назальные отростки [11]. Клетки от задней части mesencephalon и rhombencephalon последовательно мигрируют в фарингеальные дуги [11,172]. Веутри этих потоков клетки краниального нервного грабня по молекулярным маркерам уже отличимы в соотв. субпопуляциях. Crestin, хорошо известный маркер мигрирующих клеток нервного гребня экспрессируется в дорсальной. не не в внетральной части окологлазной мезенхимы [173]. У рыбок данио имеется инициальная экспрессия sox10 и foxd3 во время ранней миграции в фарингеальные дуги и около-глазную мезенхиму, а время подавления этих транскрипционных факторов варьирует в зависимости от запуска окончательной дифференцировки [11,174]. Во время этого процесса экспрессия дополнительных транскрипционных факторов, включая pitx2, foxc1, eya2 и lmx1b, усиливается в клетках нервного гребня, чтобы регулировать миграцию в окончательны места предназначения и дифференцировки (Figure 4) [174].
Pitx2 кодирует paired-like homeodomain транскрипционный фактор, в первые обнаруженный в гипофизе в качестве регулятора prolactin. Однако, более поздние исследования продемоснстрировали, что Pitx2 является критическим для становления лево-правосторонней оси и последующего асимметричного развития сердца, легких и желудочно-кишеной системы [175-177]. Т.о., полный нокаут Pitx2 у мышей оказался гибельным для эмбрионов из-за тяжелых аномалий сердца. Тем не менее, эти м утанты обнаруживали и тяжелые аномалии глаз, включая микрофталмию и колобому [175,176]. Тканеспецифичный нокаут продемонстрировал, что эти глазные дефекты обусловлены клеточно неавтономными эффектами Pitx2 внутри клеток нервного гребня на развитие глазного бокала [178]. У людей автономно доминантные мутации в PITX2 очень широко ассоциируют с Axenfeld–Rieger Syndrome, который характеризуется определенным набором системных, черепно-лицевых и глазных аномалий, возникающих в результате нарушений миграции и дифференцировки клеток нервного гребня. Системные аномалии включают болезнь Hirschsprungs (отсутствие энтерической иннервации сегментов кишечника) и аномалии тракта оттока сердцп, вместе с гипоплазией средины лица с oligo/microdontia. Кроме того, обнаруживаются аномалии внешних глазных мышц и век, ассоциированные с Axenfeld–Rieger Syndrome [179,180]. В глазу обнаруживаются нити перекрытий, которые соединяют радужку с передней частью Schwalbe’s линии, которая демаркирует наружный край эндотелия роговицы. Кроме того, радужка гипопластична в результате corectopia (irregular pupil) и pseudopolycoria (multiple pupils) [181-184]. Интересно, что у небольшого количества пациентов присутствуют аномалии зрительного нерва, включая колобому и вид вьюнка (morning glory) (unpublished data, personal observation). Значительным источником болезненности является потеря зрения из-за глаукомы, которая затрагивает приблизитольно 50–75% пациентов и часто устойчивость к медицинскому лечению [185]. Реже мутации PITX2 ассоциируют с Peters Anomaly, которая характеризуется центральной непрозрачностью роговицы из-за неполного отсоединения хрусталикового пузырька от эпителия роговицы и неспособностью клеток нервного гребня мигрировать в передний сегмент глаза [186].
Pitx2 сначала экспрессируется в клетках нервного гребня после инициации миграции и вместе с морфогеном, retinoic acid (RA), управляет миграцией клеток нервного гребня вдоль разных потоков в фарингеальные дуги и около-глазную мезенхиму [176,187]. Нокдаун Pitx2 у рыбок данио не изменяет количество отсоединяемых клеток нервного гребня, но нарушает миграторные пути в черепно-лицевом регионе, приводя к апоптозу этих клеток [10]. Это приводит к уродствам верхней и нижней челюстей, а также к дисгенезу переднего сегмента глаз, колобоме и микрофталмии [10,176]. Нокдаун Pitx2 мыши и мыши, у которых RA неспособна обеспечивать экспрессию Pitx2 (т.e., нокаут множественных рецепторов RA), дает более тяжелые нарушения глаз, включая анофталмию, микрофталмию и дефекты зрительного нерва, такие как присоединение глаз непосредственно к вентральной части гипоталямуса [175,178,188]. Кондиционный нокаут Pitx2 нервного гребня дает сходный фенотип, указывая, что эти глазные дефекты обусловлены клеточно неавтономоной функцией Pitx2 в клетках нервного гребня [178]. Экспрессия Pitx2 в около-глазной мезенхиме активирует сигналы, которые вызывают морфогенетическое расширение глазного стебля, такие как нарушения этой ступени, приводящие к foreshortened глазного стебля и микрофталмии/анофталмии. Впоследствии экспрессия Pitx2 преимущественно сохраняется в околглазной мезенхиме, где она необходима для дифференцировки роговицы [178]. У мышей нокаут Pitx2 может вызывать некомпетентногсть глазных клеток нервного гребня формировать эндотелий и строму роговицы, приводя к уродствам и утолщениям роговицы. [176,178,189]. Важно, что Pitx2 интегрирует сигналы от RA и передачи сигналов Wnt, чтобы запускать миграцию и дифференцировку глазных клеток нервного гребня (Figure 4) [176,187]. RA, которая продуцируется дорсальной и вентральной частями сетчатки, воздействует целенаправленно на около-глазную мезенхиму посредством RA рецепторов (RAR) α и γ [34,176,190-192]. Внутри этих окологлазных клеток нервного гребня RA непосредственно активирует экспрессию Pitx2 посредством связывания реагирующих на RA элементов. Более того, поскольку Wnt путь не инициирует активацию, то сигнальные компоненты, β-catenin, и Lef1, соединяются с промотором Pitx2 и поэтому необходимы для поддержания экспрессии Pitx2. Однако, Pitx2 целенаправленно воздействует на Dkk2, внеклеточный антагонист, который сдерживает сигнальную активность Wnt, чтобы сформировать регуляторную петлю обратной связи в около-глазных клетках нервного гребня [187,193,194].
В дополнение к нижестоящим мишеням Pitx2 воздействует на Lmx1b, LIM-гомеодоменовый транскрипционный фактор, который экспрессируется в около-глазной мезенхиме и позднее концентрируется в презумптивных структурах переднего сегмента (радужка, роговица, трабекулярная сетчатая структура), глазной щели и hyaloid сосудистой сети (Figure 5) [195]. Lmx1b регулирует миграцию и жизнеспособность клеток нервного гребня в переднем сегменте, а Lmx1b мутантные мыши имеют микрофталмию с гипоплазией радужки и цилиарного тела [195]. У людей аутосомно доминантные мутации в LMX1B вызывают Nail–Patella Syndrome, который строго ассоциирует с open-angle glaucoma [196]. Однако, в отличие от Axenfeld–Rieger синдрома, затрагивающего индивидов, обладающих врожденными аномалиями глаз, которые подтверждают изначальную потребность в гене LMX1B для постнатального поддержания структуры и функции трабекулярной сети и склеры. Интересно, что как и в случае Pitx2, нокдаун с помощью morpholino олигонуклеотидов Lmx1b у рыбок данио вызывает колобомы, указывая на клеточно неавтономную роль этих двух факторов в развития глазного бокала [197]. Др. мишенью для Pitx2 в клетках нервного гребня является Tfap2b (Figure 5). В противоположность Tfap2a, который важен для индукции нейрального края, Tfap2b экспрессируется в около-глазной мезенхиме у мышей и играет независимую от Lmx1b роль в развития передней камеры [198]. Специфичный для нервного гребня нокаут Tfap2b у мышей приводит к аномальному развитию радужки, роговицы, табекулярной сети и цилиарного тела, приводя к закрытой angle-configuration. Потеря экспрессии Tfap2b вызывает отсутствие N-Cadherin в эндотелии роговицы и дезорганизации соединительных комплексов и к отеку роговицы. Более того, эти мутанты Tfap2b также обнаруживают снижение экспрессии специфичного для роговицы коллагена, Col8a2, и маркера эндотелия роговицы, Zp4, приводящего к снижению клеточной пролиферации [199]. Lmx1b и Tfap2b были идентифицированы как мишени для Pitx2, необходимы дальнейшие исследования по идентификации дополнительных нижестоящих факторов в переднем сегменте.
Хотя косоглазие и blepharophimosis редко описываются при синдроме Axenfeld–Rieger, у модельных животных около-глазные клетки нервного гребня вносят существенный вклад в формирование и организацию около-глазных мышц [179,180,200]. RA и Pitx2 регулируют экспрессию специфичного для мышц транскрипционных факторов, таких как Myf5, Myog и Myod1, которые необходимы для миогенеза и жизнеспособности около-глазных мышц [201,202]. Более того, Foxl2 в около-глазных клетках нервного гребня активирует экспрессию гладкомышечного alpha актина (кодируемого геном Acta2) в окологлазных мышцах мышей, а мутации в FOXL2 у людей ассоциированы с синдромом blepharophimosis. В то время как Myf5, Myog и Myod1 индуцируют дифференцировку миобластов и в конечном итоге экспрессию Acta2, прямая связь на молекулярном уровне между Pitx2 и Foxl2 в около-глазной мезенхиме не была установлена. Напротив, нокдаун Pitx2 у рыбок данио затрагивает мускулатуру челюстей, но не влияет на экспрессию myod ни на организацию около-глазных мышц. Однако, фенотипические отклонения глаз у нокаутных pitx2 мышей проявляются в виде анофталмии или тяжелой микрофталмии, более тяжелых, чем у рыбок данио и людей. Глаза сами по себе, как известно, важны для регуляции развития окологлазных мышц, т.к. генетические, токсические или хирургические вмешательства, ведущие к потре глазного пузырька приводят к дезорганизации, а в некоторых случаях и к агенезу окологлазных мышц [200,203]. Т.о., фенотип около-глазных мышц, наблюдаемый у pitx2 нокаутных мышей может быть прямо или косвенно связан с передачей сигналов клеток нервного гребня.
FoxC1 кодирует forkhead транскрипционный фактор, который влияет на черепно-лецевую и глазную миграцию клеток нервного гребня и дифференцировку [204]. Подобно Pitx2, Foxc1 не обязателен для отсоединения, но является критическим для жизнеспособности и миграции клеток нервного гребня [205]. Foxc1 затем экспрессируется в клетках нервного гребня из около-глазной мезенхимы и позднее в презумптивных структурах переднего сегмента [204]. Более того, аутосомно доминантные мутации FOXC1 также прежде всего вызывают синдром Axenfeld–Rieger [9,206]. У Foxc1 нокаутных мышей роговица утолщена и дезорганизована и часто хрусталик не отсоединен от роговицы, это сильно напоминает Peters Anomaly [207]. Нокдаун у рыбок данио гомолога Foxc1a также приводит к неправильному развитию роговицы и радужки и гипоплазию и колобому зрительного нерва. Кроме того, у рыбок данио обнаруживаются кровоизлияния в головной мозг, указывающие на отдельную роль Foxc1a в обеспечении целостности кровеносных сосудов. Соотв., пациенты с мутациями FOXC1 были также обнаруживают болезнь сосудов головного мозга с ранним началом [205].
Foxc1, подобно Pitx2, регулируется с помощью RA в около-глазной мезенхиме. Более того, Foxc1 и Pitx2 экспрессируются совместно в клетках нервного гребня и регулируют экспрессию др. др. Кроме того, регулятор транскрипции белок Pawr (PRKC apoptosis Wilm’s tumor 1 regulator) модулирует способность Pitx2 и Foxc1 активировать гены мишени [193]. Tgfβ2 передача сигналов от хрусталика, которая нацелена на его рецепторы (Tgfbr2) в около-глазной мезенхиме также регулирует экспрессию Foxc1 и Pitx2 и нокаутные Tgfβ2 мыши обнаруживают подобный Peters Anomaly фенотип, подобный таковому у Foxc1 нокаутных мышей [208-210]. Однако, основной эффект передачи сигналов Tgfβ2 заключается, скорее всего, в пост-миграторном контроле Foxc1 и Pitx2 позитивных клеток, направляя их дифференцировку в направлении эндотелия и стромы роговицы.
В клетках нервного гребня Foxc1, как было установлено, воздействует на гены мишени, включая Eya2, Ffg19, Foxo1a, Foxc2 и Galnt4 (Figure 5). Eya2 является транскрипционным фактором, экспрессирующимся в около-глазной мезенхиме и глазной щели у мышей и рыбок данио. Экспрессия Eya2, которая увеличивается за счет foxc1a, RA и nlx1, способствует ремоделированию около-глазной мезенхимы за счет индукции апоптоза клеток нервного гребня [211-213]. В презумптивной глазной ткани Foxc1 соединяется с промотором Fgf19, активируя транскрипцию генов, которые управляют развитием и поддержанием структур переднего сегмента с помощью передачи сигналов ERK1/2 [214]. Foxc1 также регулирует forkhead транскрипционный фактор Foxo1a. У рыбок данио и в культивируемых клетках трабекулярной сети человека, снижение Foxc1 ведет к снижению экспрессии Foxo1a, это нарушает реакцию на оксидативные стрессы и в конечном счетк сниеат жизнеспособность [215]. В около-глазной мезенхиме мышей Foxc1 вместе с Pitx2 и передачей сигналов Wnt взаимодействует с Foxc2, чтобы совместно регулировать раннее развитие роговицы. Foxc2 необходим в клетках нервного гребня, чтобы способствовать приобретению качественных особенностей роговицы и склер [216]. Однако, пока неизвестно, действительно ли Foxc2 выполняет ту же самую роль в развитии глаз людей. Galnt4 кодирует фермент, который инициирует сцепленное сmucin-type O гликозилирование и в конечном счете изменения гель-подобных свойств эпителиальных клеток, секретирующих муцин [212]. Хотя специфическая функция Galnt4 в клетках нервного гребня неизвестна, участие glycosylases в изменениях внеклеточного матрикса и обеспечении адгезии, подтверждает его роль в миграции. Итак, Foxc1 имеет разные мишени в клетках нервного гребня и глазах.
6. Summary/Conclusions Развитие нервного гребня является сложным процессом, который протекает в несколько ступеней и использует многочисленные сети регуляторных генов [15,17,24,39]. Генетические нарушения могут запускать каскад нижестоящих эффекторов, который может приводить к распространенным системным, черепно-лицевым и глазным аномалиям. Развитие глаз особенно чувствительно к собственно развитию клеток нервного гребня.
Т.к. микрофталмия, анофталмия и колобома обычно ассоциированы с нарушениями функции генов нервного эпителия в развитии переднего мозга и глазного бокала, то болезни у людей и животных моделей демонстрируют, что пертурбации спецификации или миграции клеток нервного гребня часто приводят к сходному фенотипу [6,12-14]. Такой общий фенотип с микрофталмией и колобомой указывает на генетические нарушения генов границы нервной пластинки (Msx1/2, Zic2, и Tfap2) или генов спецификации клеток нервного гребня [59,65,160]. Т.к. эти нарушения глаз происходят внутри происходящего из нервного эпителия глазного бокала, то очевидно, что клетки нервного гребня внутри около-глазной мезенхимы оказывают клеточно неавтономные эффекты на глазной бокал. Клетки нервного гребня ограничивают передачу сигналовt hedgehog в оптическом стебле и бокале, это является критическим для соотв. формирования паттерна сетчатки [81,82,217]. Невозможность устанавливать дорсо-вентральную ось сетчатки нарушает нормальный рост глазного бокала и предупреждает закрытие глазной щели.
Кроме того, генетические нарушения позднее миграции и дифференцировки клеток нервного гребня могут оказывать существенны эффекты на развития глаз. Гены Pitx2 и Foxc1 изучены лучше всего на примере аутосомно доминантных мутаций, часто ассоциированных с Axenfeld–Rieger Syndrome и менее распространенной Peters Anomaly [9,184,206]. Хотя в редких случаях эти болезни могут сопровождаться аномалиями зрительного нерва, такими как Morning Glory Disc и колобомы, в большинстве случаев аномалии касаются переднего сегмента. Однако, нокаут и нокдаун гена у модельных животных вызывают аномалии глазного бокала. Это расхождение может быть объяснено большей чувствительностью эффектов к дозе гена для формирования паттерна в глазном бокале по сравнению с миграцией и дифференцировкой клеток нервного гребня. Несмотря на это, Pitx2 и Foxc1 являются ключевыми регуляторами развития глаз и дальнецшие исследования необходимы для выявления нижестоящих мишеней в глазном бокале и клетках нервного гребня.
Поскольку врожденные аномалии глаз возникают довольно редко с частотой 1:5000 - 1:10000 живорожденных, понимание генетической регуляции развития клеток нервного гребня и патогенеза болезней важно [218].
|

 Figure 1. Clinical images of congenital ocular anomalies. (A) Axenfeld–Rieger syndrome is characterized by Rieger Anomaly (iris hypoplasia resulting in pseudopolycoria и corectopia (white arrowheads)) и Axenfeld Anomaly (anteriorization of Schwalbe’s line of the cornea (posterior embryotoxon, black arrows) with iris adhesions). These defects are due to abnormal migration и differentiation of neural crest cells into the anterior segment of the eye. Over 50% of individuals with Axenfeld–Rieger syndrome develop glaucoma which often requires surgery such as placement of a glaucoma drainage device (asterisk). (B) In Peters anomaly, there is a circumscribed central corneal opacification (outlined by dotted white line) with iris-corneal adhesions (black arrowhead). These anomalies are due to abnormal separation of the lens vesicle from the surface ectoderm resulting in absence of Descemet’s membrane и disruption of neural crest cell migration into the anterior segment. (C,D) Colobomas are due to incomplete closure of the ocular fissure и can affect the iris, zonules, retina, choroid, и optic nerve. Chorioretinal colobomas are inferior to the optic nerve и are characterized by an area that is devoid of retina и choroid (C, white arrows). In these types of coloboma, the macula (+) which accounts for central vision, is typically not affected. Optic nerve colobomas (D, white arrows) can cause severe vision loss especially if the entire optic nerve (outlined by black dotted line) is involved. Although the macula (+) may not be affected, the loss of the ganglion cell axons that comprise the optic nerve limits vision.
Figure 1. Clinical images of congenital ocular anomalies. (A) Axenfeld–Rieger syndrome is characterized by Rieger Anomaly (iris hypoplasia resulting in pseudopolycoria и corectopia (white arrowheads)) и Axenfeld Anomaly (anteriorization of Schwalbe’s line of the cornea (posterior embryotoxon, black arrows) with iris adhesions). These defects are due to abnormal migration и differentiation of neural crest cells into the anterior segment of the eye. Over 50% of individuals with Axenfeld–Rieger syndrome develop glaucoma which often requires surgery such as placement of a glaucoma drainage device (asterisk). (B) In Peters anomaly, there is a circumscribed central corneal opacification (outlined by dotted white line) with iris-corneal adhesions (black arrowhead). These anomalies are due to abnormal separation of the lens vesicle from the surface ectoderm resulting in absence of Descemet’s membrane и disruption of neural crest cell migration into the anterior segment. (C,D) Colobomas are due to incomplete closure of the ocular fissure и can affect the iris, zonules, retina, choroid, и optic nerve. Chorioretinal colobomas are inferior to the optic nerve и are characterized by an area that is devoid of retina и choroid (C, white arrows). In these types of coloboma, the macula (+) which accounts for central vision, is typically not affected. Optic nerve colobomas (D, white arrows) can cause severe vision loss especially if the entire optic nerve (outlined by black dotted line) is involved. Although the macula (+) may not be affected, the loss of the ganglion cell axons that comprise the optic nerve limits vision.  Figure 2. Neural plate border induction. In neural plate border induction, FGF followed by Notch и BMP signaling are expressed in the neural ectoderm while Wnt is expressed in the non-neural ectoderm. In the next phases of neurulation и optic groove formation, these signals then induce expression of the neural plate border specifiers, Msx1/2, Zic2, и Tfap2. These transcription factors, expressed within the neural plate border, trigger signaling cascades that maintain stem cell pluripotency и prepare the premigratory neural crest cells for epithelial-mesenchymal transition (EMT).
Figure 2. Neural plate border induction. In neural plate border induction, FGF followed by Notch и BMP signaling are expressed in the neural ectoderm while Wnt is expressed in the non-neural ectoderm. In the next phases of neurulation и optic groove formation, these signals then induce expression of the neural plate border specifiers, Msx1/2, Zic2, и Tfap2. These transcription factors, expressed within the neural plate border, trigger signaling cascades that maintain stem cell pluripotency и prepare the premigratory neural crest cells for epithelial-mesenchymal transition (EMT).
 Figure 3. Neural crest cell specification. As the neural tube closes, genes including Sox10, Foxd3, Alx1, Tfap2a, Tcof, Nlz1/2, и Snai1/2 induce neural crest cell identity и maintain stem cell pluripotency. Simultaneously, Tcof, Nlz1/2, и Sna1/2, together with Ets1, Maf, и Zeb2 inhibit E-Cadherin и Cadherin 6b within the premigratory neural crest to trigger epithelial-mesenchymal transition (EMT). Furthermore, the CHARGE associated genes, Chd7, Kmd6a, Brg1, и Kmt2d regulate neural crest cell delamination и initiation of migration.
Figure 3. Neural crest cell specification. As the neural tube closes, genes including Sox10, Foxd3, Alx1, Tfap2a, Tcof, Nlz1/2, и Snai1/2 induce neural crest cell identity и maintain stem cell pluripotency. Simultaneously, Tcof, Nlz1/2, и Sna1/2, together with Ets1, Maf, и Zeb2 inhibit E-Cadherin и Cadherin 6b within the premigratory neural crest to trigger epithelial-mesenchymal transition (EMT). Furthermore, the CHARGE associated genes, Chd7, Kmd6a, Brg1, и Kmt2d regulate neural crest cell delamination и initiation of migration.