Аномалия развития вен (DVA) головы представляет собой крайний вариант трансмедуллярной вены, состоящей из радиального комплекса медуллярных вен, напоминающих "голову Медузы", которые сходятся в "коллекторную" вену, в конечном итоге впадающую в глубокую или поверхностную церебральную венозную систему. DVA являются наиболее распространенной формой медленно текущих венозных пороков головного мозга, частота которых составляет 2,6-6,4%, и в подавляющем большинстве случаев протекают бессимптомно.1 Гистологически DVA состоят из расширенных венозных каналов, расположенных в белом веществе, с простыми или сложными вариациями венозной архитектуры и характера дренажа.2 DVA представляют собой менее эффективную форму венозного дренажа, зависящую от одной или нескольких коллекторных (собирающих) вен, и со временем под воздействием повышенного венозного давления могут вызывать ремоделирование сосудов с утолщением стенок сосудов и гиалинизацией микрососудов.2 Данные когортных исследований и серий случаев свидетельствуют о разнообразных клинических проявлениях симптоматических DVA.3,4 Мы провели полный обзор патогенеза DVA и обсудили подходы к визуализации и лечению симптоматических DVA.
Neurovascular and Genetic Pathogenesis
Нейроваскулярная гипотеза этиологии DVA основана на нейроваскулярной адаптации венозной сосудистой системы головного мозга в результате неспецифического повреждения в процессе васкулогенеза, приводящего к остановке развития медуллярных вен в конце первого триместра беременности.2,5 Венозная система головного мозга будет создавать компенсаторные пути для противодействия аномалиям поверхностного или глубокого венозного кровообращения в период венозной пластичности в утробе и раннем младенчестве.2,5 Эта особенность подтверждается наблюдением DVA как в утробе, так и в перинатальном периоде.6 В последние годы генетические исследования расширили наши представления о патогенезе DVA. Генетический анализ DVA, ассоциированных со спорадической кавернозной мальформацией головного мозга (CCM) ), позволяет предположить, что DVA может быть промежуточным поражением. При DVA может присутствовать соматическая активирующая мутация в гене PIK3CA, приводящая к усилению функции, которая является генетическим предшественником спорадической CCM.7 Приобретенная мутация второго типа в комплексе CCM (KRIT1, CCM2, PDCD10) или MAP3K3 приводит к формированию спорадической CCM,7 это подтверждается наблюдением, что спорадические CCMs часто развиваются на территории венозного дренажа при DVA.8 С другой стороны, наследственные CCMs развиваются преимущественно за счет мутации в комплексе CCM (локусы генов CCM1, CCM2, CCM3) или в локусе MAP3K3, что приводит к образованию множественных бссимптомных CCMs, которые могут приобретать дополнительную мутацию в PIK3CA, способствующую развитию поражения.7
Symptomatic DVA
Симптоматическая CCM - "зонтичный" термин, охватывающий широкий спектр осложнений, связанных с DVAs. Систематический обзор преимущественно низкоуровневых данных (т.е. серий случаев или исследований типа "случай-контроль") показал, что поразительно 61% DVA протекает бессимптомно: 23% с неспецифической клинической картиной, 6% с очаговым неврологическим дефицитом, 6% с кровоизлиянием, 4% с судорогами и менее 1% с инфарктом.1 Однако, учитывая наш клинический опыт, такая частота симптоматических DVA, скорее всего, завышена из-за погрешности отчетности. Действительно, в популяционном исследовании большинство DVA, т.е. 98%, выявлялись случайно, и только 2% DVA были симптоматическими и объяснялись кровоизлиянием или инфарктом.1 Естественное течение болезни пациентов с DVA предполагает очень низкий риск кровоизлияния после первых признаков - от 0% до 1,28% в год.1 За последнее десятилетие передовые методы визуализации помогли нам лучше понять DVA. Для исследования симптоматических DVAs следует применять оптимизированные протоколы визуализации, адаптированные к клинико-патологическим особенностям.
Coexisting CCM or Capillary Telangiectasia
CCMs представляют собой сосудистые синусоидальные поражения, выстланные одним эндотелиальным слоем на фоне коллагенового матрикса. CCMs не имеют артериальных и венозных коммуникаций. Они тесно связаны со спорадическими DVAs, частота их сосуществования составляет от 2% до 33% (рис. 1). Распространенность CCMs с DVA также положительно коррелирует с увеличением возраста.
4 SWI является идеальной последовательностью для выявления DVA с CCM из-за повышенной контрастной заметности дезоксигемоглобина в венозной крови и наличия продуктов крови в CCMs . Последовательность SWI на высокопольной магнитно-резонансной томографии 7 Т является более чувствительной для отображения DVA меньшего размера, связанных со спорадическими CCMs, которые в противном случае могут быть не видны на МР-томограммах 3 Т.
9.
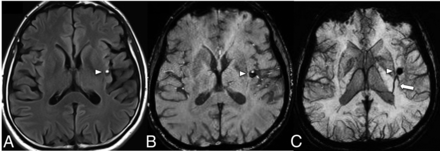
FIG 1.
FLAIR (A) shows a mixed-signal-intensity CCM (arrowhead) in the left insular cortex with an internal blood-fluid level and no perilesional edema. A collector vein of a DVA (arrow) is seen from the ventricular ependyma to the CCM, which is barely visible on the SWI (B) and becomes more conspicuous on the susceptibility-weighted MIP image (C).
Что касается формирования CCM при DVA, то недавно была предложена генетическая модель формирования СКК на основе "гипотезы двух ударов "7 . Однако более механическая модель формирования CCM de novo вокруг DVA основана на сочетании венозного застоя и венозной ишемии вследствие нарушения венозного оттока, что приводит к высвобождению местных ангио-генетических факторов и пролиферации эндотелия. Новообразованные хрупкие сосуды склонны к кровоточивости, что приводит к первоначальному петехиальному кровоизлиянию, а повторные циклы реэндотелизации и кровоизлияния в конечном итоге приводят к классическому мультилобулярному виду CCMs на МР-томограммах.10
Запущенный ангиогенез, формирующий хрупкие сосуды, склонные к кровоизлияниям, а также повторяющиеся циклы ангиогенеза и микрокровоизлияний в конечном итоге приводят к формированию CCMs.
10 К развитию CCMs на территории дренирования DVA предрасполагают следующие анатомические факторы: инфра-тенториальное расположение DVA, дренирование коллектора в глубокую вену, перекручивание дренирующей вены, более 5 мозговых вен, впадающих в коллектор, стеноз более 55% мозговых (medullary) вен и острый угол между мозговой и коллекторной венами, равный~106,5°.
8,11,13 Следует отметить, что большинство из перечисленных анатомических факторов способствуют снижению оттока при DVA, что подтверждает венозную застойную модель формирования CCMs вблизи DVA. Системные факторы, такие как тяжелые инфекционные заболевания, хронические воспалительные расстройства, лучевое воздействие/лечение, также связаны с формированием CCMs.
12 Считается, что провоспалительное состояние способствует образованию тромбов при DVA, повышая венозное давление и создавая условия для формирования CCMs.
12 Топографическое расположение CCM имеет большое значение, поскольку корковое или юкста-кортикальное расположение или вовлечение лимбических структур более склонно к возникновению судорог.
14 CCMs ствола мозга могут вызывать краниальную нейропатию за счет вовлечения ядер черепных нервов, интра-аксиальных черепных нервов или даже прямого распространения на цистернальные черепные нервы (рис. 2).
15 Предрасположенность CCMs к геморрагическим кровоизлияниям зависит от истории предыдущих кровоизлияний и может быть количественно проанализирована с помощью гемосидеринового бремени CCM и его эволюции во времени на количественном картировании восприимчивости (QSM).
16,17 Более высокое среднее значение восприимчивости на QSM положительно коррелирует с возрастом пациента и предшествующими геморрагическими эпизодами, в то время как у пациентов с клинически стабильной CCM среднее значение восприимчивости ниже (рис. 3).
16,17
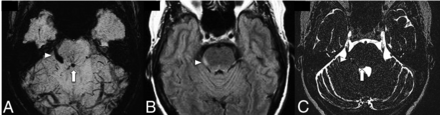
FIG 2.
A patient with right facial pain and dysesthesia. SWI (A) shows a posterior pontine DVA (arrow) and an associated CCM (arrowhead) involving the intra-axial and cisternal segments of the right trigeminal nerve. FLAIR (B) demonstrates hyperintense edema along the right lateral aspect of the pons (arrowhead). Coregistered T2 sampling perfection with application-optimized contrasts by using different flip angle evolutions (SPACE sequence; Siemens) (C) confirms CCM involvement of the right trigeminal nerve.
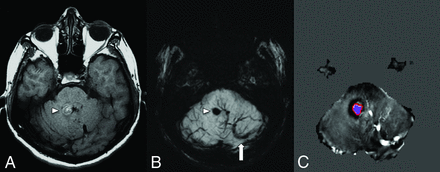
FIG 3.
A middle-aged patient with new-onset ataxia. T1WI (A) and SWI MIP (B) show a CCM in the right superior cerebellar peduncle (arrowheads) and a large left cerebellar DVA with the collector vein (arrow) draining into the transverse sinus. Quantitative susceptibility mapping (C) analysis of the CCM shows a high mean susceptibility value of 858?parts per billion (with threshold). An ROI with a red boundary represents the exclusive object boundary, and the purple area represents thresholded pixels (150 parts per billion). SWIM (Siemens) parameters: TE = 20.00?ms; TR = 27.00?ms; flip angle = 150; resolution = 0.937 x 0.937 x 2.5 mm. Images courtesy of Dr E. Mark Haacke.
Реже капиллярные телеангиэктазии могут наблюдаться на территории венозного дренажа при DVA. Капиллярные телеангиэктазии представляют собой скопления расширенных капилляров с промежуточной нормальной паренхимой мозга и чаще всего локализуются в стволе мозга, но могут встречаться и в супратенториальной части мозга. Капиллярная телеангиэктазия имеет более доброкачественный естественный анамнез, чем CCMs, и для ее выявления требуется проведение SWI и Т1-взвешенной последовательности с усилением gadolinium для диагностики. Таким образом, сосуществующая капиллярная телеангиэктазия с DVA может быть недооценена.
Parenchymal Abnormalities
Паренхима головного мозга на территории венозного дренажа при DVA может быть связана с избыточностью белого вещества (WMH), микро-кровотечениями, минерализацией, метаболическими нарушениями и даже может быть более склонна к образованию демиелинизирующих бляшек у пациентов с предшествующими демиелинизирующими заболеваниями, такими как рассеянный склероз. Дренаж при DVA имеет относительно большую венозную территорию по сравнению с физиологически нормальными кортикальными или медуллярными венами и опирается обычно на более или равную 1 коллекторную вену. На территории венозного дренажа DVA обычно имеется только глубокий или поверхностный дренажный путь, а не несколько поверхностных и глубоких дренажей. Со временем нарушенная венозная гемодинамика может способствовать прогрессирующему утолщению и гиалинизации венозных стенок DVA, что приводит к повышению сопротивления, снижению пластичности и венозной гипертензии, вызывающей очаговый отек и глиоз в прилежащем белом веществе или минерализацию прилежащего серого вещества. Частота возникновения WMH вокруг DVA составляет 12,5% (скорректированная распространенность - 7,8% после исключения пациентов с умеренными и хроническими заболеваниями белого вещества), и они чаще встречаются при перивентрикулярном расположении DVA.18 WMH, связанные с DVA, статистически достоверно чаще наблюдались при сопутствующих микрокровоизлияниях, что подтверждает идею о наличии общего патогенетического (т.е. венозного застойного) процесса.19
Базальные ганглии и глубокие ядра мозжечка являются областями мозга с повышенными метаболическими потребностями. Наличие DVA в этих областях с течением времени может приводить к усилению минерализации в пораженной структуре глубокого серого вещества (рис. 4).
20 Метаболические нарушения могут встречаться и на территории венозного дренажа DVA. В небольшой серии случаев, включавшей 22 пациента, было обнаружено, что у 76% пациентов с DVA на FDG-PET/CT scans были выявлены метаболические изменения в виде гипометаболизма, который значительно чаще встречался у пожилых пациентов (рис. 5).
21 В последующем более крупном исследовании, включавшем 54 пациента с 57 DVA, метаболические нарушения были выявлены у 38% пациентов; в этом исследовании гипометаболизм чаще встречался в DVA, дренирующих серое вещество, а не белое вещество.
22 Гипометаболизм отмечался в областях, соответствующих неврологическим симптомам; например, гипометаболизм наблюдался в зрительных путях у пациентов со зрительными симптомами и соответствующей DVA.
23 Что особенно интересно, структурные аномалии (т.е. WMH) не наблюдались у этих пациентов с аномалиями на функциональных изображениях.
21,22 И этот вывод подтверждает идею о том, что DVA имеют менее надежный венозный дренажный путь.
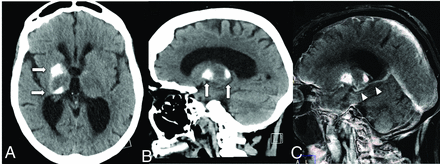
FIG 4.
Noncontrast CT of the head (A and B) shows dystrophic calcification of the anterior right putamen and pulvinar of the thalamus (arrows). CTV MIP sagittal image (C) shows a right basal ganglia DVA (arrowheads) with the collector vein draining into the ipsilateral internal cerebral vein (arrows).
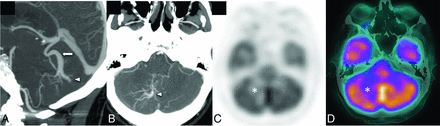
FIG 5.
A patient with headache and ataxia. CTA sagittal and axial MIP images (A and B) show a right cerebellar hemisphere DVA (arrowheads) with the collector vein (arrow) draining into the vein of Galen. Corresponding [18F] FDG-PET/CT attenuation-corrected image (C) and a fused PET/CT image (D) show moderate reduction of [18F] FDG uptake in the right cerebellar hemisphere in the venous territory of the large DVA (asterisk).
Взаимосвязь между DVA и демиелинизацией изучена недостаточно хорошо. Демиелинизация - это аутоиммунное заболевание с периваскулярным характером воспалительной реакции, обусловленной лимфоцитарной и моноцитарной инфильтрацией. Паренхима мозга вокруг DVA может быть более уязвимой для образования демиелинизирующих бляшек у пациентов с предшествующими демиелинизирующими заболеваниями, такими как РС (рис. 6).24 Согласно предложенной теории, венозный застой может приводить к более высокой и длительной лимфоцитарной инфильтрации и, следовательно, к большей степени нейровоспалительной реакции, чем в мозге с нормальным венозным дренажем.
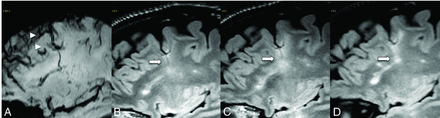
FIG 6.
A patient with MS with an SWI (A) demonstrating a DVA. FLAIR at 6-month (B), 1-year (C), and 2-year (D) follow-up shows an enlarging demyelinating plaque (arrows) centered around the DVA.
В редких случаях DVA могут наблюдаться в областях с пороками развития коры головного мозга (полимикрогирия, пахигирия, очаговая кортикальная дисплазия). Неясно, является ли сосуществование этих двух образований случайным или обусловлено общим повреждением на пути развития церебральных вен с нарушением нормального развития коры и нормального развития коры и дуральных венозных синусов. Истинная частота встречаемости ассоциации полимикрогирии и DVA неизвестна, поскольку исследования основывались на сериях случаев с небольшим объемом выборки. Однако маловероятно, что DVA способствует эпилептогенезу. В серии случаев, проведенной Striano et al25 , только у 4 из 1020 пациентов с эпилепсией были обнаружены сопутствующие DVA. Неясно, имеют ли DVA и кортикальная дисплазия общий цереброваскулярный патогенез, однако DVA вряд ли могут представлять собой эпилептогенный очаг. Тем не менее важно выявить наличие DVA в области кортикальной дисплазии. В контексте нейрохирургической резекции очаговой кортикальной дисплазии (FCD) неосознанная или непреднамеренная резекция DVA может привести к катастрофическому венозному инфаркту из-за ее уязвимости к гемодинамическим изменениям, что еще раз подчеркивает, что DVA являются "неприкасаемыми" поражениями.
Flow-Related Complications
Как уже упоминалось выше, DVA связаны с менее гибким венозным дренажем головного мозга, поскольку ни глубокие, ни поверхностные венозные пути не сформированы. Таким образом, ограниченное количество коллекторных вен дренирует относительно большую территорию паренхимы мозга. Поэтому коллекторные вены могут быть перегружены за счет многочисленных расширенных медуллярных вен, питающих их. Нарушение баланса между притоком и оттоком крови может привести к развитию неврологических осложнений, связанных с потоком. Осложнения, связанные с оттоком крови, встречаются в 71% случаев симптомных DVA, хотя это исследование, вероятно, было предвзятым, поскольку в него направляли пациентов из нейрососудистого центра.
3 Осложнения, связанные с оттоком крови, включают усиление притока крови из артериовенозного шунта, например DVA, дренирующего AVM (рис. 7), или феномен "микро-шунтирования" в результате усиления артериального кровотока в DVA, что приводит к раннему венозному наполнению. Осложнения, связанные с оттоком крови из DVA, могут быть обусловлены стенозом или тромбозом коллекторной вены DVA. При ангиографии DVA с микро-шунтом наблюдается раннее венозное заполнение DVA, обусловленное усиленным артериолярным притоком крови. Этот феномен наиболее часто встречается при DVA больших размеров или DVA со сложной ангиоархитектурой. Перфузионные методы MRI, такие как DSC и артериальное спин-лабирование, позволяют лучше охарактеризовать микроциркуляцию при DVA.
26-29 При перфузии DSC нормальные DVA соответствуют гемодинамике мозговых вен и дурального венозного синуса, с повышенными относительными CBV и CBF. При DVA с нарушением венозного оттока может наблюдаться повышенная МТТ (рис. 8).
26. В когортном исследовании Jung et al.27 продемонстрировали, что в области вокруг DVA с повышенной интенсивностью сигнала на Т2 и FLAIR наблюдаются повышенные относительные CBV и МТТ по сравнению с нормальным белым веществом. Этот вывод подтверждает гипотезу о наличии симптоматических DVA с микро-шунтом, приводящим к венозному застою и, со временем, к перивенулярному глиозу вокруг DVA.
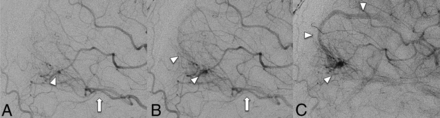
FIG 7.
DSA cerebral catheter angiogram in the arterial phase image (A) demonstrates a left occipital AVM nidus (arrowhead) supplied by the left posterior cerebral artery (arrow). Subsequent late arterial (B) and early venous (C) images show the AVM nidus (arrowhead) draining into a right occipital DVA (arrowhead), with an early venous filling of the collector vein (arrowhead). The patient underwent stereotactic radiation treatment with successful obliteration of the AVM nidus with preservation of the DVA venous architecture.
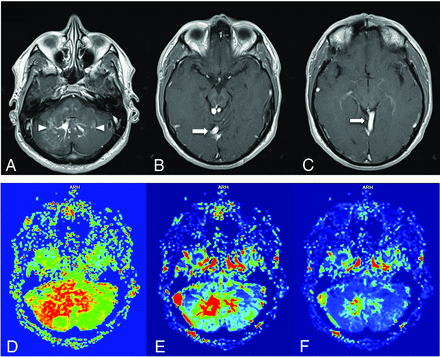
FIG 8.
A patient with headache and ataxia. Contrast-enhanced T1WI (A-C) shows the DVA medusa veins in the cerebellar hemispheres (arrowheads) with a pair of draining veins and ultimately a common collector vein (arrows) draining into the right tentorial venous sinus. DSC MRI perfusion demonstrates a pronounced and asymmetrically increased MTT (D) in the right cerebellar hemisphere, consistent with venous hypertension. CBV (E) and CBF (F) images shows expected increased cerebral blood volume and flow in the DVA medusa veins.
Венозный тромбоз может возникать в DVA, приводя к венозной ишемии или кровотечению. Незначительное количество сообщений о тромбированных DVA в более ранней литературе может быть связано с их недостаточным распознаванием и освещением. Заметная избыточная плотность коллекторных вен на неконтрастной CT может быть признаком тромбированной DVA и является основанием для дальнейшего исследования с помощью CT или MRV. Обзор литературы, посвященный небольшому числу случаев тромбированных DVA, свидетельствует о наличии сходных способствующих коагуляции факторов риска, таких как прием оральных контрацептивов, послеродовой период или отсутствие идентифицируемого риска.
2 В настоящее время нет данных, свидетельствующих о том, что DVA более подвержены тромбозу, чем нормальные церебральные вены. Однако рентгенологу важно выявить тромбированную DVA, поскольку лечение аналогично лечению тромбоза вен или дурального синуса: При лечении тромбированных DVA используется антикоагуляция, направленная на предотвращение прогрессирования тромба, ограничение образования нового тромба и облегчение реканализации коллекторной вены (рис. 9). Стандартные меры предосторожности для начала антикоагуляции остаются неизменными, за исключением потенциального риска кровотечения при наличии сопутствующей CCM. DVA с обструкцией венозного оттока вследствие сужения или перекручивания коллекторных вен также может привести к усилению венозного застоя. Нейрососудистое вмешательство может рассматриваться в избирательных случаях, когда консервативное лечение не дает результатов. Недавно сообщалось о случае установки спасательного венозного стента (шунта) у пациента с понтомедуллярной DVA с обструкцией венозного оттока, несмотря на консервативное лечение с применением антикоагуляции
30.
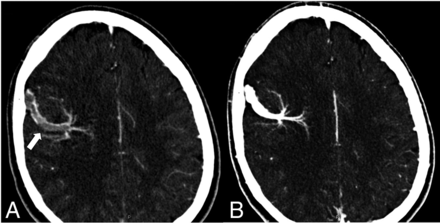
FIG 9.
A young patient presented with a sudden onset of severe headaches after a marathon race. Presentation CTV (A) shows thrombosis of a DVA collector vein (arrow) overlying the right frontal cerebral convexity. The patient was placed on antiplatelet medication, and a follow-up CTV (B) showed a resolution of the thrombus.
Спонтанное кровоизлияние, связанное с DVA, встречается редко и должно объясняться наличием CCM, обструкцией венозного оттока или шунтом, связанным с микроаневризмой, если не доказано обратное, что еще раз подчеркивает, что DVA являются неприкасаемыми поражениями, которые не следует удалять, облучать или эмболизировать. Визуализация сосудов и распознавание DVA имеют первостепенное значение, поскольку часто DVA может быть замаскирована или искажена гематомой. Когда рассматривается вопрос о хирургической эвакуации церебральной гематомы, необходимо постараться сохранить DVA.
Mechanical Effect
В редких случаях коллекторная вена DVA может приводить к механическому воздействию на соседние структуры. В задней черепной ямке коллекторные вены, расположенные вблизи зоны входа корешков черепных нервов, могут приводить к нейроваскулярным конфликтам, таким как невралгия тройничного нерва. Процедура нейрососудистой декомпрессии требует повышенного внимания, поскольку венозная стенка коллекторной вены DVA более хрупкая, чем артериальная, и должна быть сохранена. В редких случаях коллекторная вена DVA может препятствовать оттоку CSF в церебральный акведук (рис. 10).
31 В зависимости от степени обструкции и возникающей гидроцефалии в качестве лечения может потребоваться шунтирование CSF или эндоскопическая вентрикулостомия с отведением CSF.
32
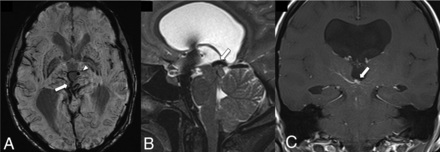
FIG 10.
A midline midbrain DVA with the collection vein (arrow) obstructs the cerebral aqueduct leading to ventriculomegaly. SWI (A) shows the radially oriented medullary veins in the midbrain and an associated microbleed in the left anterior thalamus (arrowhead). T2-SPACE (B) and gadolinium-enhanced T1-weighted (C) images depict the location of a large collector vein obstructing the entrance into the cerebral aqueduct. Images courtesy of Dr Arjuna Somasundaram and Dr Christian Schwindack. Syndromic Association
В большинстве случаев DVA встречаются спорадически и изолированно, однако DVA могут быть частью синдрома у пациентов с мутациями в общих внутриклеточных сигнальных путях RAS-MAPK и PI3K/AKT/mTOR, которые являются факторами фенотипического развития сосудистых аномалий и опухолей
33. К наиболее известным синдромам, связанным с DVA, относятся blue rubber bleb nevus syndrome (BRBNS), constitutional mismatch repair deficiency syndrome (CMMRD) и недавно описанный cerebrofacial venous metameric syndrome (CVMS). BRBNS в основном носит спорадический характер, однако в нескольких случаях отмечается аутосомно-доминантное наследование, обусловленное соматическими мутациями
TIE2/TEK, которые кодируют специфический для эндотелиальных клеток тирозинкиназный рецептор, функционирующий через сигнальный путь PI3K/AKT/mTOR. Синдром характеризуется множественными резидуальными венозными аномалиями, расположенными в коже, головном мозге и висцеральных органах. В старой литературе корреляция между DVA и BRBNS была недооценена из-за особенностей техники визуализации и не унифицированного использования DVA в качестве описательной терминологии.
34 Известно, что CMMRD также ассоциируется с DVA. Это аутосомно-рецессивная биаллельная (гомозиготная) зародышевая мутация в генах репарации несоответствия (
MLH1, MSH2, MSH6 и PMS2).
35 CMMRD проявляется в виде неопластических и неопухолевых процессов, таких как DVA. Онкологические проявления CMMRD варьируют в ЦНС, наряду с опухолями кишечника и гематологическими злокачественными новообразованиями.
35 Существует устойчивая ассоциация CMMRD с DVA, что было предложено в качестве потенциального количественного фактора для CMMRD, и это является дополнительным подтверждением генетической основы DVA.
35 При CVMS венозные аномалии лица в 20%-28% случаев ассоциируются с DVA, причем большинство DVA являются ипсилатеральными и находятся в том же метамере, что и поверхностная венозная аномалия (рис. 11).36,37 Ассоциация между DVA и венозными аномалиями головы и шеи может иметь общий патогенез развития.
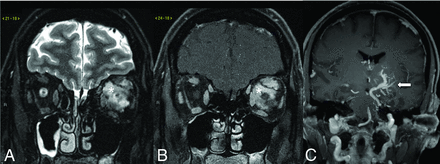
FIG 11.
CVMS in a patient with a left orbital venous malformation depicted on the coronal T2-weighted fat saturated (A) and coronal post-gadolinium-enhanced T1-weighted fat saturated (B) images, which show an infiltrative T2-weighted hyperintense intraconal lesion with avid contrast enhancement (asterisk). Coronal gadolinium-enhanced T1-weighted image (C) reveals a large left basal ganglia DVA (arrow) with the collector vein draining in the left superior petrosal sinus. CONCLUSIONS
Симптоматические DVA могут приводить к разнообразным клиническим заболеваниям, которые можно классифицировать по их патофизиологическому механизму. Нейровизуализация играет фундаментальную роль в характеристике ангиоархитектуры DVA и оценке состояния паренхимы, окружающей DVA, с помощью обычных, современных или функциональных методов визуализации. Точное определение патофизиологического механизма, вызывающего симптоматические DVA, имеет решающее значение для лечения и прогноза.
 FIG 1.
FLAIR (A) shows a mixed-signal-intensity CCM (arrowhead) in the left insular cortex with an internal blood-fluid level and no perilesional edema. A collector vein of a DVA (arrow) is seen from the ventricular ependyma to the CCM, which is barely visible on the SWI (B) and becomes more conspicuous on the susceptibility-weighted MIP image (C).
FIG 1.
FLAIR (A) shows a mixed-signal-intensity CCM (arrowhead) in the left insular cortex with an internal blood-fluid level and no perilesional edema. A collector vein of a DVA (arrow) is seen from the ventricular ependyma to the CCM, which is barely visible on the SWI (B) and becomes more conspicuous on the susceptibility-weighted MIP image (C).
 FIG 2.
A patient with right facial pain and dysesthesia. SWI (A) shows a posterior pontine DVA (arrow) and an associated CCM (arrowhead) involving the intra-axial and cisternal segments of the right trigeminal nerve. FLAIR (B) demonstrates hyperintense edema along the right lateral aspect of the pons (arrowhead). Coregistered T2 sampling perfection with application-optimized contrasts by using different flip angle evolutions (SPACE sequence; Siemens) (C) confirms CCM involvement of the right trigeminal nerve.
FIG 2.
A patient with right facial pain and dysesthesia. SWI (A) shows a posterior pontine DVA (arrow) and an associated CCM (arrowhead) involving the intra-axial and cisternal segments of the right trigeminal nerve. FLAIR (B) demonstrates hyperintense edema along the right lateral aspect of the pons (arrowhead). Coregistered T2 sampling perfection with application-optimized contrasts by using different flip angle evolutions (SPACE sequence; Siemens) (C) confirms CCM involvement of the right trigeminal nerve.
 FIG 3.
A middle-aged patient with new-onset ataxia. T1WI (A) and SWI MIP (B) show a CCM in the right superior cerebellar peduncle (arrowheads) and a large left cerebellar DVA with the collector vein (arrow) draining into the transverse sinus. Quantitative susceptibility mapping (C) analysis of the CCM shows a high mean susceptibility value of 858?parts per billion (with threshold). An ROI with a red boundary represents the exclusive object boundary, and the purple area represents thresholded pixels (150 parts per billion). SWIM (Siemens) parameters: TE = 20.00?ms; TR = 27.00?ms; flip angle = 150; resolution = 0.937 x 0.937 x 2.5 mm. Images courtesy of Dr E. Mark Haacke.
FIG 3.
A middle-aged patient with new-onset ataxia. T1WI (A) and SWI MIP (B) show a CCM in the right superior cerebellar peduncle (arrowheads) and a large left cerebellar DVA with the collector vein (arrow) draining into the transverse sinus. Quantitative susceptibility mapping (C) analysis of the CCM shows a high mean susceptibility value of 858?parts per billion (with threshold). An ROI with a red boundary represents the exclusive object boundary, and the purple area represents thresholded pixels (150 parts per billion). SWIM (Siemens) parameters: TE = 20.00?ms; TR = 27.00?ms; flip angle = 150; resolution = 0.937 x 0.937 x 2.5 mm. Images courtesy of Dr E. Mark Haacke.
 FIG 4.
Noncontrast CT of the head (A and B) shows dystrophic calcification of the anterior right putamen and pulvinar of the thalamus (arrows). CTV MIP sagittal image (C) shows a right basal ganglia DVA (arrowheads) with the collector vein draining into the ipsilateral internal cerebral vein (arrows).
FIG 4.
Noncontrast CT of the head (A and B) shows dystrophic calcification of the anterior right putamen and pulvinar of the thalamus (arrows). CTV MIP sagittal image (C) shows a right basal ganglia DVA (arrowheads) with the collector vein draining into the ipsilateral internal cerebral vein (arrows).
 FIG 5.
A patient with headache and ataxia. CTA sagittal and axial MIP images (A and B) show a right cerebellar hemisphere DVA (arrowheads) with the collector vein (arrow) draining into the vein of Galen. Corresponding [18F] FDG-PET/CT attenuation-corrected image (C) and a fused PET/CT image (D) show moderate reduction of [18F] FDG uptake in the right cerebellar hemisphere in the venous territory of the large DVA (asterisk).
FIG 5.
A patient with headache and ataxia. CTA sagittal and axial MIP images (A and B) show a right cerebellar hemisphere DVA (arrowheads) with the collector vein (arrow) draining into the vein of Galen. Corresponding [18F] FDG-PET/CT attenuation-corrected image (C) and a fused PET/CT image (D) show moderate reduction of [18F] FDG uptake in the right cerebellar hemisphere in the venous territory of the large DVA (asterisk).
 FIG 6.
A patient with MS with an SWI (A) demonstrating a DVA. FLAIR at 6-month (B), 1-year (C), and 2-year (D) follow-up shows an enlarging demyelinating plaque (arrows) centered around the DVA.
FIG 6.
A patient with MS with an SWI (A) demonstrating a DVA. FLAIR at 6-month (B), 1-year (C), and 2-year (D) follow-up shows an enlarging demyelinating plaque (arrows) centered around the DVA.
 FIG 7.
DSA cerebral catheter angiogram in the arterial phase image (A) demonstrates a left occipital AVM nidus (arrowhead) supplied by the left posterior cerebral artery (arrow). Subsequent late arterial (B) and early venous (C) images show the AVM nidus (arrowhead) draining into a right occipital DVA (arrowhead), with an early venous filling of the collector vein (arrowhead). The patient underwent stereotactic radiation treatment with successful obliteration of the AVM nidus with preservation of the DVA venous architecture.
FIG 7.
DSA cerebral catheter angiogram in the arterial phase image (A) demonstrates a left occipital AVM nidus (arrowhead) supplied by the left posterior cerebral artery (arrow). Subsequent late arterial (B) and early venous (C) images show the AVM nidus (arrowhead) draining into a right occipital DVA (arrowhead), with an early venous filling of the collector vein (arrowhead). The patient underwent stereotactic radiation treatment with successful obliteration of the AVM nidus with preservation of the DVA venous architecture.
 FIG 8.
A patient with headache and ataxia. Contrast-enhanced T1WI (A-C) shows the DVA medusa veins in the cerebellar hemispheres (arrowheads) with a pair of draining veins and ultimately a common collector vein (arrows) draining into the right tentorial venous sinus. DSC MRI perfusion demonstrates a pronounced and asymmetrically increased MTT (D) in the right cerebellar hemisphere, consistent with venous hypertension. CBV (E) and CBF (F) images shows expected increased cerebral blood volume and flow in the DVA medusa veins.
FIG 8.
A patient with headache and ataxia. Contrast-enhanced T1WI (A-C) shows the DVA medusa veins in the cerebellar hemispheres (arrowheads) with a pair of draining veins and ultimately a common collector vein (arrows) draining into the right tentorial venous sinus. DSC MRI perfusion demonstrates a pronounced and asymmetrically increased MTT (D) in the right cerebellar hemisphere, consistent with venous hypertension. CBV (E) and CBF (F) images shows expected increased cerebral blood volume and flow in the DVA medusa veins.
 FIG 9.
A young patient presented with a sudden onset of severe headaches after a marathon race. Presentation CTV (A) shows thrombosis of a DVA collector vein (arrow) overlying the right frontal cerebral convexity. The patient was placed on antiplatelet medication, and a follow-up CTV (B) showed a resolution of the thrombus.
FIG 9.
A young patient presented with a sudden onset of severe headaches after a marathon race. Presentation CTV (A) shows thrombosis of a DVA collector vein (arrow) overlying the right frontal cerebral convexity. The patient was placed on antiplatelet medication, and a follow-up CTV (B) showed a resolution of the thrombus.
 FIG 10.
A midline midbrain DVA with the collection vein (arrow) obstructs the cerebral aqueduct leading to ventriculomegaly. SWI (A) shows the radially oriented medullary veins in the midbrain and an associated microbleed in the left anterior thalamus (arrowhead). T2-SPACE (B) and gadolinium-enhanced T1-weighted (C) images depict the location of a large collector vein obstructing the entrance into the cerebral aqueduct. Images courtesy of Dr Arjuna Somasundaram and Dr Christian Schwindack.
FIG 10.
A midline midbrain DVA with the collection vein (arrow) obstructs the cerebral aqueduct leading to ventriculomegaly. SWI (A) shows the radially oriented medullary veins in the midbrain and an associated microbleed in the left anterior thalamus (arrowhead). T2-SPACE (B) and gadolinium-enhanced T1-weighted (C) images depict the location of a large collector vein obstructing the entrance into the cerebral aqueduct. Images courtesy of Dr Arjuna Somasundaram and Dr Christian Schwindack.  FIG 11.
CVMS in a patient with a left orbital venous malformation depicted on the coronal T2-weighted fat saturated (A) and coronal post-gadolinium-enhanced T1-weighted fat saturated (B) images, which show an infiltrative T2-weighted hyperintense intraconal lesion with avid contrast enhancement (asterisk). Coronal gadolinium-enhanced T1-weighted image (C) reveals a large left basal ganglia DVA (arrow) with the collector vein draining in the left superior petrosal sinus.
FIG 11.
CVMS in a patient with a left orbital venous malformation depicted on the coronal T2-weighted fat saturated (A) and coronal post-gadolinium-enhanced T1-weighted fat saturated (B) images, which show an infiltrative T2-weighted hyperintense intraconal lesion with avid contrast enhancement (asterisk). Coronal gadolinium-enhanced T1-weighted image (C) reveals a large left basal ganglia DVA (arrow) with the collector vein draining in the left superior petrosal sinus.