Уже более 100 лет лабораторная мышь (Mus musculus) служит квинтэссенцией животной модели для изучения заболеваний человека1. В частности, для изучения нарушений развития мыши сыграли решающую роль, поскольку они представляют собой практически идеальную для генетического анализа систему млекопитающих, в которой эмбрион легко доступен6.
В самом начале своего развития генетика мышей опиралась на спонтанные или индуцированные мутации, приводящие к видимым физическим дефектам, которые затем можно было картировать. Однако впоследствии методы генного таргетинга открыли путь к "обратной генетике" (т.е. к анализу фенотипических эффектов намеренно сконструированных мутаций)6. Благодаря таким систематическим усилиям, как Международный консорциум нокаутных мышей, в настоящее время доступны модели нокаутов для тысяч генов7. Кроме того, благодаря редактированию генома8,9 все более практичным становится удаление отдельных регуляторных элементов10.
Фенотипирование также стало более сложным. Традиционные исследования синдромов с нарушением развития обычно фокусируются на одном органе на определенном этапе (например, комбинируя анализ экспрессии, гистологию и визуализацию для изучения видимого порока развития)1. Анализ мышей, включая батарею стандартизированных тестов, отражает более системный подход11 , однако выявленные с помощью таких тестов фенотипы (например, поведенческие или электрофизиологические) могут потребовать многих лет дополнительной работы для того, чтобы связать их с молекулярными и клеточными коррелятами. Кроме того, часто бывает так, что намеренно сконструированная мутация не приводит к выявлению каких-либо отклонений12. В таких случаях остается неизвестным, действительно ли отсутствует фенотип, или же используемые методы просто недостаточно чувствительны. Таким образом, фенотипирование стало "ограничителем скорости" в генетике мышей.
Одноклеточное молекулярное профилирование открывает потенциальный путь к преодолению этих барьеров. В качестве первого шага мы и другие исследователи применили секвенирование РНК одиноxhs[ клетоr (scRNA-seq) для профилирования развития мыши дикого типа в масштабе целого эмбриона3,13-18. Применяя scRNA-seq к мутантам мыши, несколько групп успешно выяснили, как специфические мутации влияют на транскрипционные сети и приводят к изменению решений о клеточной судьбе в отдельных органах19. Однако до сих пор не существует четкой схемы анализа таких данных в масштабе целого эмбриона.
scRNA-seq of 101 mouse embryos
Мы поставили перед собой задачу создать scRNA-seq целых эмбрионов как масштабируемую структуру для систематического молекулярного и клеточного фенотипирования генетических моделей мышей. Мы собрали 103 эмбриона мышей, включая 22 различных мутанта и 4 штамма дикого типа на эмбриональный день (E)13.5, и, как правило, по 4 реплики на штамм (рис. 1а). Мутанты были выбраны таким образом, чтобы представлять спектр фенотипической тяжести - от установленных плейотропных нарушений до нокаутов отдельных регуляторных элементов.
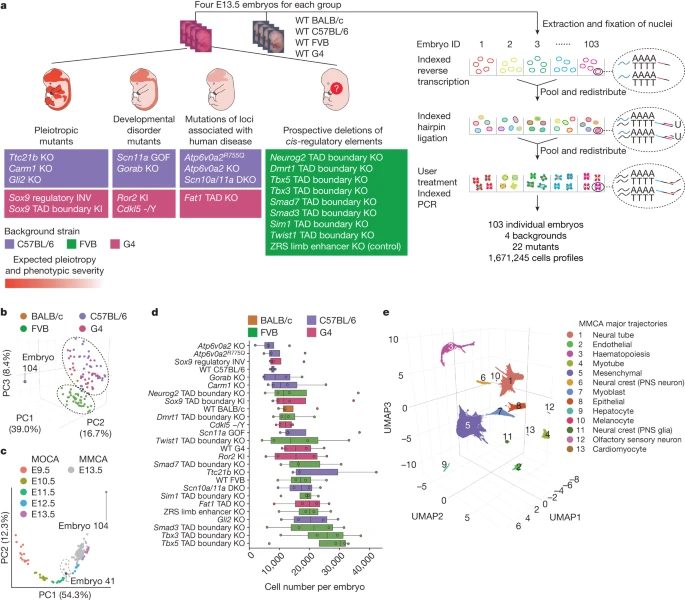
Fig. 1:
Single-cell transcriptional profiling of 103 whole mouse embryos staged at E13.5.
a, Categories of mutants (left) analysed by whole-embryo profiling with sci-RNA-seq3 (right). WT, wild type. KI, knock-in; DKO, double KO. ?/Y, hemizygous b, Embeddings of pseudobulk RNA-seq profiles of MMCA embryos in PCA space with visualization of the top three PCs. Datapoints are coloured by background strain of the embryo. The black dashed ovals highlight two major groups corresponding to FVB versus other backgrounds. Embryo 104 is a clear outlier. c, Embeddings of pseudobulk RNA-seq profiles of MOCA3 and MMCA embryos in PCA space defined solely by MOCA, with MMCA embryos (grey) projected onto it. The top two PCs are visualized. Coloured points correspond to MOCA embryos of different stages (E9.5–E13.5), and grey points to MMCA embryos (E13.5). The dashed line highlights five MMCA embryos that are co-localized with E11.5 or E12.5 embryos from MOCA. Three are from Scn11a-GOF (embryos 33, 34 and 36), Carm1-KO (embryo 101) and wild-type (embryo 41) C57BL/6 strains. d, Number of cells profiled per embryo for each strain. Centre lines show medians; box limits indicate 25th and 75th percentiles; replicates (n = 3 for wild-type C57BL/6, n = 4 for all others) are represented by dots. Genotypes are listed by median cell number in ascending order. e, Three-dimensional UMAP visualization of wild-type subset of MMCA dataset (215,575 cells from 15 embryos). Cells are coloured by major-trajectory annotation. PNS, peripheral nervous system.
Мы разделили мутантов на четыре категории (рис. 1а и дополнительная табл. 1). Первая категория - плейотропные мутанты - включала эмбрионы с нокаутами генов развития, экспрессирующихся в нескольких органах (Ttc21b KO, Carm1 KO и Gli2 KO), и две мутации регуляторного ландшафта Sox9, предположительно имеющие плейотропный эффект (knock-in границы топологического ассоциирующего домена (TAD) Sox9; регуляторная инверсия (INV) Sox9)5,20-22. Вторая категория - мутанты с нарушениями развития - состояла из эмбрионов, предназначенных для моделирования конкретных заболеваний человека (Scn11a gain of function (GOF), Ror2 knock-in, Gorab KO и Cdkl5 -/Y (hemizygous))23-25. В третью категорию вошли эмбрионы с мутациями локусов, ассоциированных с заболеваниями человека (двойной нокаут Scn10a/Scn11a, нокаут Atp6v0a2, нокаут Atp6v0a2R755Q и нокаут Fat1 TAD)26,27. В четвертую категорию вошли эмбрионы с перспективными делециями цис-регуляторных элементов, в том числе границ TAD вблизи факторов транскрипции развития (Smad3, Tbx5, Neurog2, Sim1, Smad7, Dmrt1, Tbx3 и Twist1)4. В качестве положительного контроля в четвертую категорию вошел нокаут-мутант дистального энхансера ZRS (zone of polarizing activity regulatory sequence), у которого специфически не развиваются дистальные структуры конечностей28. За исключением Scn11a GOF, все мутанты были гомозиготными.
Для подтверждения правильности стадий мы использовали наш предыдущий атлас клеток органогенеза мыши (MOCA), охватывающий период от E9.5 до E13.5 (см. 3). После фильтрации дублетов мы профилировали 1 671 245 ядер (16 226 ± 9 289 на эмбрион; 64 279 ± 18 530 на штамм; среднее число уникальных молекулярных идентификаторов: 843 на клетку; медиана обнаруженных генов: 534; частота дублирования 75%). Ниже мы будем называть этот набор данных атласом мутантных клеток мыши (MMCA).
В результате применения анализа главных компонент (PCA) к профилям ‘pseudobulk’ эмбрионов были получены две группы, соответствующие генетическому фону (рис. 1б), причем эмбрионы FVB кластеризовались отдельно от эмбрионов C57BL/6J, G4 и BALB/c. Однако эмбрионы, соответствующие отдельным мутантам, не группировались отдельно, что позволяет предположить, что ни один из них не был поражен серьезными, глобальными аберрациями. Единственное отклонение (эмбрион 104) было аберрантным в отношении восстановления клеток (n = 1 047) и их внешнего вида (расширенные данные рис. 1а).
Для подтверждения правильности определения стадий мы использовали наш предыдущий атлас клеток органогенеза мыши (MOCA), охватывающий период от E9,5 до E13,5 (см. рис. 3). В результате PCA профилей ‘pseudobulk’ 61 эмбриона дикого типа из MOCA был получен первый компонент (главная компонента 1 (PC1)), сильно коррелирующий с возрастом развития (рис. 1в). При проецировании профилей ‘pseudobulk’ 103 эмбрионов MMCA на эту вставку большинство эмбрионов MMCA кластеризовались с эмбрионами E13.5 MOCA по PC1, что соответствует точной постановке. Однако пять эмбрионов MMCA оказались ближе к эмбрионам E11.5 или E12.5 MOCA. Четыре из них были оставлены, поскольку их задержка могла быть объяснена мутантным генотипом, а один эмбрион дикого типа (C57BL/6; эмбрион 41) был отнесен ко второму выбросу. Мы удалили клетки из двух эмбрионов с отклонениями (эмбрионы 104 и 41), а также клетки с высокой долей чтений, картирующих митохондриальный геном (более 10%) или рибосомальные гены (более 5%). В результате осталось 1 627 857 клеток, полученных от 101 эмбриона (рис. 1д).
Для облегчения интеграции данных мы проецировали клетки всех генотипов на "эталонную вставку", полученную от дикого типа (Methods and Extended Data Fig. 1b,c). Всего было выделено 13 основных траекторий, 8 из которых в дальнейшем были разбиты на 59 подтраекторий (рис. 1е, расширенные данные рис. 2а и дополнительная табл. 2), что в целом соответствует ожидаемым траекториям движения клеток на данном этапе развития. Они также в целом соответствовали нашим аннотациям MOCA, хотя и с некоторыми поправками, описанными в других работах17,29. Более высокая детализация для некоторых типов клеток, вероятно, является следствием более глубокой выборки клеток ст. E13.5 в новых данных (расширенные данные, рис. 2б).
Мутант-специфические изменения в составе клеточных типов
При анализе полученных данных мы использовали три подхода: количественная оценка грубых различий в составе клеточных типов (этот раздел); исследование более тонких различий в распределении клеточных состояний в пределах аннотированных траекторий и субтраекторий; анализ степени общности фенотипических признаков у мутантов.
Для систематической оценки различий в составе клеточных типов мы сначала изучили доли клеток, отнесенных к каждой из 13 основных траекторий. Эти соотношения в основном совпадали у разных генотипов (расширенные данные рис. 3а), однако у некоторых мутантов наблюдались существенные различия. Например, по сравнению с диким типом C57BL/6 доля клеток в траектории нервной трубки уменьшилась с 37,3% до 33,7% и 32,6% в штаммах Gli2-KO и Ttc21b-KO, соответственно, а доля клеток в мезенхимальной траектории уменьшилась с 44,1% до 37,1% в штамме Gorab-KO. Эти изменения в целом соответствуют грубым фенотипам, связанным с этими мутациями20,25,30, но с оговоркой о существенной межиндивидуальной гетерогенности (расширенные данные рис. 3б). Мы также наблюдаем различия в составе основных траекторий между четырьмя штаммами дикого типа. Например, у мышей дикого типа FVB и G4 по сравнению с эмбрионами дикого типа BALB/c и C57BL/6 наблюдается меньшее количество мезенхимальных клеток и большее количество клеток нервной трубки (расширенные данные рис. 3в). Далее мы проверили технические эффекты (например, экспериментальную партию), которые могли бы повлиять на показатели восстановления клеточных типов (расширенные данные рис. 4а-в).
Далее мы попытались исследовать композиционные различия на уровне субтраекторий. Для каждой комбинации фона и субтраектории мы провели регрессию для выявления мутаций, которые номинально предсказывали долю клеток, попадающих в эту субтраекторию (без поправки Pменее 0,05; бета-биномиальная регрессия; Методы). В результате анализа 22 мутантов было выявлено 300 номинально значимых изменений (рис. 2а и дополнительная табл. 3). Из-за ограниченного числа реплицированных эмбрионов на штамм мы не можем однозначно назвать такие изменения, особенно на небольших траекториях (Methods и Extended Data Fig. 4d). Тем не менее, следует отметить две закономерности.
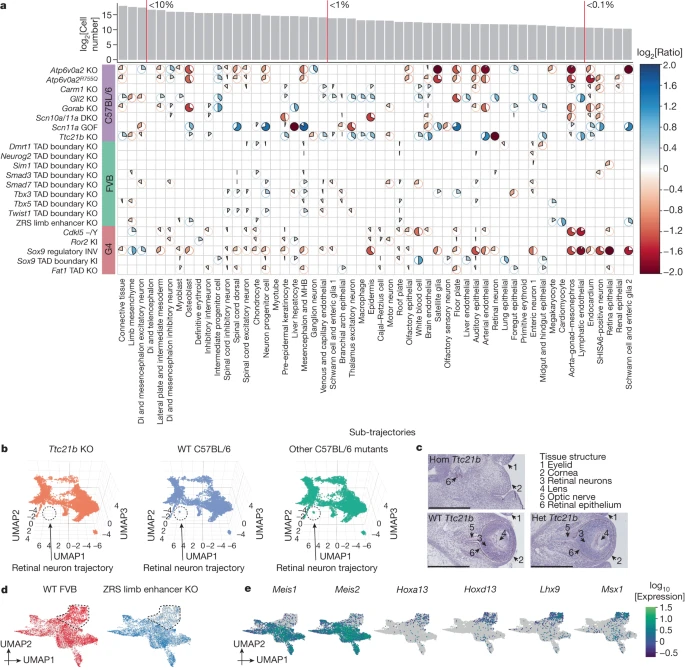
Fig. 2:
Cell composition changes for individual mutants across developmental trajectories.
a, The heatmap shows log2-transformed ratios of cell proportions between each mutant type (y axis) versus the pooled reference (consisting of wild type and other mutants from the same strain; cell counts from replicates were merged) across individual sub-trajectories (x axis). Only nominally significant results are shown (Methods). The pie colour and direction correspond to whether the log2-transformed ratio is >0 (blue, clockwise) or <0 (red, anticlockwise); the pie size and colour intensity correspond to the scale of the log2-transformed ratio. log2-transformed ratios that were >2 or
Во-первых, Atp6v0a2 KO и Atp6v0a2R755Q, различные мутанты одного и того же гена26 , демонстрируют весьма согласованные модели изменений как в отношении того, какие субтраектории являются номинально значимыми, так и в отношении направления и величины изменений. Такая согласованность подтверждает правильность данного аналитического подхода.
Во-вторых, мутанты значительно различаются по количеству субтраекторий, номинально значимых для композиционных различий. В крайнем случае, 30 из 54 субтраекторий были номинально изменены мутацией Sox9 regulatory INV, что согласуется с широкой ролью SOX9 в развитии31,32. В крайнем случае, нокауты границ TAD демонстрировали очень незначительные изменения, что соответствует малому количеству грубых фенотипов у таких мутантов12. Тем не менее, все нокауты с границей TAD демонстрировали некоторые номинальные изменения, в том числе специфические (например, траектории эпителия легких и гепатоцитов печени были специфически снижены в нокаутах с границей TAD Dmrt1 и Tbx3, соответственно).
Было несколько экстремальных примеров (например, когда субтраектория, казалось, была полностью утрачена). Например, Ttc21b, который кодирует цилиарный белок и нокаут которого связан с фенотипами мозга, костей и глаз20,33 , показал заметное снижение траекторий нейронов сетчатки (log2[ratio] = -7,16; рис. 2б), хрусталика (log2[ratio] = -2,40) и эпителия сетчатки (log2[ratio] = -1,65) (расширенные данные рис. 5а-в). Окрашивание гематоксилином и эозином подтверждает эти закономерности, поскольку у гомозиготного мутанта Ttc21b наблюдается видимое разрушение структур, которое можно обнаружить в глазу дикого типа в возрасте E13.5. В частности, у гомозиготного мутанта отсутствуют нейроны сетчатки, хрусталик и зрительный нерв (рис. 2в). Эпителий сетчатки также был делокализован и уменьшен (рис. 2в и расширенные данные рис. 5в).
Далее мы исследовали положительный контроль - нокаут усилителя конечности ZRS, хорошо изученный мутант, у которого при рождении наблюдается потеря дистального строения конечности28. У этого мутанта номинально изменены восемь субтраекторий, в основном мезенхимные. Хотя уменьшение количества мезенхимных клеток конечности было скромным (24%, или log2[ratio] = -0,39), при совместном сшивании клеток мезенхимы конечности из эмбрионов ZRS limb enhancer KO и FVB дикого типа была выявлена субпопуляция, специфически экспрессирующая маркеры дистальной мезенхимы ранней эмбриональной почки конечности, такие как Hoxa13 и Hoxd13 (рис. 2d,e и Extended Data Fig. 5d). Подобной гетерогенности не наблюдалось для семи других номинально измененных субтраекторий (Extended Data Fig. 5e), что свидетельствует о специфичности данного фенотипа.
Transcriptional heterogeneity within cell types
Далее мы попытались разработать более чувствительный подход для выявления отклонений в транскрипционных программах внутри траекторий клеточных типов. Для этого мы разработали локальную клеточную эвристику neighbourhood enrichment specificity score (lochNESS), которая рассчитывается на основе "соседства" каждой клетки в субтраектории совместной сборки данного мутанта (все реплики) по сравнению с объединенным диким типом (все реплики всех фонов). Вкратце, lochNESS берет выровненные характеристики PC каждой субтраектории и находит ближайших соседей для каждой клетки из других эмбрионов. Для каждой мутантной клетки рассчитывается кратность изменения наблюдаемого и ожидаемого числа мутантных клеток в ее окрестностях (рис. 3а и методы; аналогичная методика разработана самостоятельно в работе 34).
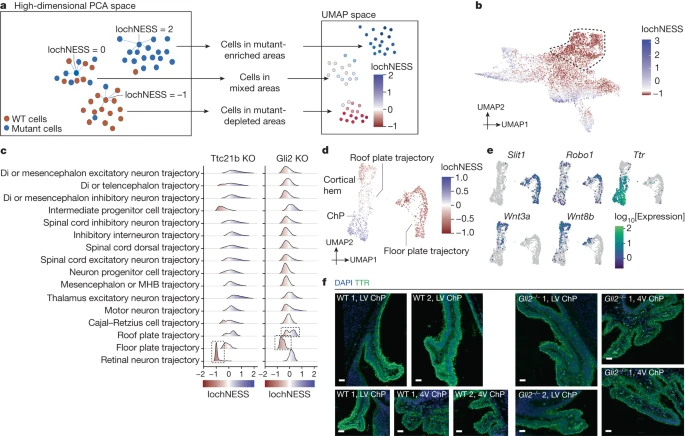
Fig. 3:
LochNESS highlights mutant-related changes.
a, A schematic of lochNESS calculation and visualization. b, UMAP of the limb mesenchyme trajectory from ZRS limb enhancer KO and wild-type cells, coloured by lochNESS. The colour scale is centred at the median. Cells corresponding to a subset of ZRS limb enhancer KO cells with more extreme loss in Fig. 2d are outlined with a dashed line. c, Distribution of lochNESS in the neural tube sub-trajectories of Ttc21b-KO and Gli2-KO mutants. The dashed outlines highlight shifted distributions of the retinal neuron sub-trajectory of the Ttc21b-KO mutant and the floor and roof plate sub-trajectories of the Gli2-KO mutant. d, UMAP of co-embedded cells of floor plate and roof plate sub-trajectories from the Gli2-KO mutant and pooled wild type, coloured by lochNESS. e, The same as in d, but coloured by selected marker gene expression. f, Immunofluorescence staining of TTR (ChP marker) in brain regions (LV, lateral ventricle; 4V, fourth ventricle) in sections from the wild type and the Gli2-KO mutant (Methods). Scale bars, 50µm.
Визуализация lochNESS во встроенном пространстве позволяет выделить области с обогащением или обеднением мутантными клетками. Например, возвращаясь к эмбрионам с нокаутом энхансера конечности ZRS, мы наблюдаем заметно низкий уровень lochNESS в дистальной мезенхиме ранней эмбриональной почки конечности (рис. 2d и 3b). Это подчеркивает ценность lochNESS, поскольку в пределах субтраектории (мезенхима конечности) эффект обнаруживается и приписывается подмножеству клеток, не требующему маркировки.
В целом распределение lochNESS для одних мутантов (например, для большинства нокаутов границы TAD) является непримечательным, а для других - аберрантным (например, для плейотропных мутантов, таких как Sox9 regulatory INV; Extended Data Fig. 6a). После проведения дополнительных проверок качества (Methods и Extended Data Fig. 6b-d) мы изучили lochNESS для каждого мутанта в каждой субтраектории. В соответствии с ранее проведенным анализом, наши данные показывают низкий уровень lochNESS для субтраектории нейронов сетчатки у мышей Ttc21b-KO (рис. 3c и расширенные данные рис. 6e). Мы также наблюдаем сильное смещение в сторону низкой lochNESS для субтраектории пластинки дна у мышей Gli2-KO и незначительное изменение для траектории пластинки крыши, которая формируется противоположно пластинке дна вдоль дорсально-вентральной оси развивающейся нервной трубки35 (рис. 3c и расширенные данные рис. 6e).
Для дальнейшего изучения этого вопроса мы выделили и повторно проанализировали клетки, соответствующие донной пластинке и пластинке крыши (расширенные данные рис. 7а). В пределах пластины дна клетки Gli2-KO постоянно демонстрировали низкий уровень lochNESS (рис. 3д). При этом между диким и мутантным типами было обнаружено лишь несколько дифференциально экспрессированных генов, а также не было выявлено значительно обогащенных путей. Например, такие гены, как Robo1 и Slit1, участвующие в наведении аксонов нейронов, специфически экспрессируются в пластине дна по сравнению с пластиной крыши (рис. 3е), но не экспрессируются дифференциально между клетками дикого типа и Gli2-KO в пластине дна нервной трубки. В качестве альтернативы можно предположить, что неспособность обнаружить существенную дифференциальную экспрессию может быть обусловлена мощностью, поскольку в Gli2-KO было меньше клеток пластины дна (примерно на 60%). В целом эти наблюдения согласуются с установленной ролью Gli2 в индукции пластинки дна, с его ролью активатора SHH в формировании дорсо-вентральном паттерна нервной трубки и с предыдущей демонстрацией того, что нокауты Gli2 не могут должным образом индуцировать пластинку дна35,36.
Менее ожидаемо, что мы выявили две субпопуляции клеток, производных крышевой пластинки, одна из которых была обеднена, а другая обогащена в эмбрионах Gli2-KO (рис. 3д и расширенные данные рис. 7а-в). Для аннотирования этих субпопуляций мы исследовали гены, экспрессия которых предсказывалась с помощью lochNESS (Methods). Группа клеток крышевой пластинки, обогащенная мутантами, была отмечена цилиальными генами и Ttr, маркером хороидного сплетения (ХС), тогда как группа, обедненная мутантами, была отмечена генами, связанными с WNT (например, Rspo1/2/3 и Wnt3a/8b/9a), что указывает на то, что это область, близкая к ХС бокового желудочка, а именно кортикальная кайма (рис. 3е, расширенные данные рис. 7д и дополнительные табл. 4 и 5). Мы также сопоставили три кластера, представленные на рис. 7а в расширенных данных, с пространственными транскриптомными данными эмбрионов мыши E13.537 (рис. 7е в расширенных данных). В соответствии с нашей аннотацией, кластер 1 соотносится с дном нервной трубки, кластер 2 - с боковым желудочком ChP, а кластер 3 - с ChP (как в боковом (переднем), так и в четвертом (заднем) желудочках). Затем мы изучили маркерные гены, которые еще больше разделяют боковые и четвертые желудочки, и обнаружили, что помимо маркера крышевой пластинки Lmx1a кластер 3 экспрессирует маркер четвертого желудочка Meis1, а кластер 2 - маркеры боковых желудочков Otx1 и Emx2 (Extended Data Fig. 7f и Supplementary Table 4).
Для экспериментального подтверждения этих наблюдений мы изучили развитие нервной трубки и головного мозга у мутанта Gli2-KO и эмбрионов дикого типа в возрасте E13.5. На корональных срезах мутанта мы наблюдали серьезные дефекты развития, включая деформацию долей переднего мозга и задержку развития нервной трубки (расширенные данные рис. 8а). Иммунофлуоресцентная визуализация экспрессии Pax6 выявила сильно нарушенную форму нервной трубки, что подтверждает хорошо описанный фенотип "дорсализации" нервной трубки (расширенные данные рис. 8б) и согласуется с заметным уменьшением доли клеток донной пластинки у мутанта Gli2-KO (рис. 3д). Переходя к менее ожидаемому наблюдению увеличения ChP, мы обнаружили, что в боковом желудочке, а также в четвертом желудочке нарушена картина окрашивания экспрессии Ttr. В то время как у дикого типа в пределах одного клеточного слоя наблюдается внутренний и внешний сигнал Ttr, у мутанта наблюдается "двойной DAPI" слой, что свидетельствует о неупорядоченной организации ткани (рис. 3f и расширенные данные рис. 8c,d). С поправкой на общий меньший размер мутантов Gli2-KO в возрасте E13.5 мы провели количественную оценку клеток, позитивных по экспрессии Ttr в боковом и четвертом желудочках, и обнаружили пропорциональное увеличение их количества у мутанта по сравнению с диким типом (дополнительная табл. 6), что также соответствует заметному увеличению доли клеток ChP у этого мутанта (рис. 3д). Таким образом, мы смогли подтвердить как ожидаемое уменьшение величины донных пластинок, так и неожиданное увеличение количества ChP, образующегося в крыше, у мутанта. Примечательно, что относительно тонкие и противоположные эффекты на эти субпопуляции пластинок крыши были пропущены при нашем первоначальном анализе соотношения типов клеток и выявлены только с помощью гранулярности lochNESS.
Распределения LochNESS могут быть подвергнуты систематическому скринингу для выявления субтраекторий, демонстрирующих специфические для мутантов сдвиги. Например, несмотря на то, что у всех нокаутных мутантов с границей TAD глобальные распределения lochNESS не отличаются друг от друга, при построении графика этих распределений по субтраекториям выявляется несколько смещенных распределений (расширенные данные рис. 9а, б). Например, несколько эпителиальных субтраекторий, включая траектории предэпидермальных кератиноцитов, эпидермиса, ветвистой дуги и легочного эпителия, наиболее смещены в клетках нокаута Tbx3 TAD border, и дальнейший анализ предварительно подтверждает роль Tbx3 в развитии эпидермиса и легких38 (Methods, Extended Data Fig. 9c,d и Supplementary Table 7).
Mutant-specific and mutant-shared effects
Плейотропия, когда один ген влияет на несколько несвязанных между собой признаков, является широко распространенным явлением в генетике развития, которое, однако, остается малоизученным39. Несмотря на то, что в данном случае мы провели молекулярное профилирование "целого эмбриона" всего 22 мутантов, мы попытались выяснить, можно ли различить специфические для мутантов и общие для мутантов эффекты в рамках каждой основной траектории. Вкратце, внутри совместного набора клеток из всех эмбрионов данного фона мы вычислили
k ближайших соседей, как показано на рис. 3а, а затем рассчитали наблюдаемое и ожидаемое соотношение каждого генотипа среди
k ближайших соседей клетки. Балл сходства" между одним генотипом и всеми остальными определяется как среднее значение этих соотношений в клетках данного генотипа (Методика). Для оценки устойчивости наблюдаемого сходства или несходства можно также рассчитать баллы сходства между отдельными эмбрионами. Например, для мезенхимальной траектории мутантов C57BL/6 баллы сходства, как правило, выше при попарном сравнении особей с одним и тем же генотипом (рис. 4а и расширенные данные рис. 10а-в). Пары особей с мутацией
Scn11a-GOF демонстрировали наиболее экстремальные показатели сходства, что согласуется с нашим предыдущим наблюдением о том, что они кластеризовались с эмбрионами E12.5, а не E13.5 (рис. 1в). После дальнейшего анализа мы считаем, что наиболее простым объяснением является неправильная постановка помета, а не специфическая для мутации глобальная задержка развития (расширенные данные рис. 10d-g и дополнительное примечание 1).

Fig. 4:
Similarity scores identify mutant-shared and mutant-specific effects.
a, A heatmap showing similarity scores between individual C57BL/6 embryos in the mesenchymal trajectory. The rows and columns are grouped by genotype and labelled by embryo id and genotype. b, UMAP of the lateral plate and intermediate mesoderm sub-trajectory for mutants from the C57BL/6 background strain, coloured and labelled by subcluster and detailed cell type (marker genes in Supplementary Table 4). c, Boxplots showing the composition of the top six subclusters for individual Atp6v0a2-KO, Atp6v0a2R755Q and Gorab-KO embryos (blue, n = 4 each genotype) and other C57BL/6 embryos (red, n = 23). Centre lines show medians; box limits indicate 25th and 75th percentiles; replicates are represented by dots. d, The same as in b, but coloured by log-transformed expression of selected marker genes.
Мы также отметили, что показатели сходства между тремя мутантами (Atp6v0a2 KO, Atp6v0a2R755Q и Gorab KO) соответствуют общим эффектам, в частности, в мезенхимной, эпителиальной, эндотелиальной, гепатоцитарной траекториях и траектории нервного гребня (глии периферической нервной системы); в других основных траекториях, таких как нервная трубка и кроветворение, нокауты Atp6v0a2 и Atp6v0a2R755Q показали высокие баллы сходства друг с другом, но не с нокаутом Gorab (рис. 4а и расширенные данные рис. 4а). 4a и расширенные данные рис. 10a,c,f). У человека мутации в ATP6V0A2 и GORAB вызывают перекрывающиеся нарушения соединительной ткани, что отражается в неправильной регуляции мезенхимальной траектории у мутантов Atp6v0a2 и Gorab25,26. Однако только для заболевания, связанного с ATP6V0A2, характерен выраженный фенотип центральной нервной системы, что согласуется с изменениями траектории развития нервной трубки, наблюдаемыми только у мутантов Atp6v0a2 (Extended Data Fig. 10a,c,f).
Для дальнейшего изучения фенотипического обмена между этими мутантами мы провели совместное культивирование клеток латеральной пластинки и субтраектории промежуточной мезодермы из штаммов C57BL/6. С помощью маркерных генов и пространственного картирования мы определили идентичность большинства субкластеров, выявив несколько подмножеств, по которым мыши Atp6v0a2-KO, Atp6v0a2R755Q и Gorab-KO распределены одинаково по сравнению с другими генотипами C57BL/6 (рис. 4б и расширенные данные рис. 11). Некоторые подмножества обогащены клетками этих мутантов (например, проэпикард, мезенхима печени и мезенхима легкого), в то время как другие обеднены (например, гладкая мускулатура желудочно-кишечного тракта; рис. 4c,d и дополнительная табл. 4). Хотя по отдельности эти сдвиги в соотношении типов клеток между двумя мутантами Atp6v0a2- и Gorab-KO в этих подгруппах мезенхимы, происходящей из мезодермы боковой пластинки, хотя и незначительны, но, вероятно, объясняют их высокие оценки мезенхимального сходства (рис. 4в).
В целом эти анализы показывают, как совместный анализ мутантов, подвергнутых скринингу scRNA-seq в целых эмбрионах, позволяет выявить общие молекулярные и клеточные фенотипы. Это касается как глобального сходства (Atp6v0a2 KO против Atp6v0a2R755Q), так и случаев, когда специфические аспекты фенотипов разделяются между ранее неродственными мутантами (Atp6v0a2 мутанты против Gorab KO).
Mesenchymal stalling in a Sox9 regulatory mutant
Около половины профилированных мутантов моделируют нарушения регуляторных, а не кодирующих последовательностей. Среди них выделяется регуляторный мутант Sox9 INV, у которого заметно смещено распределение лохнесс, особенно в мезенхиме (рис. 5а и расширенные данные рис. 6а). Sox9 кодирует плейотропный транскрипционный фактор, играющий ключевую роль в развитии скелета, мозга, а определении пола и других систем, которое осуществляется с помощью сложного регуляторного ландшафта
40-42. Для данного мутанта характерна инверсия 1-мегабазовой области вверх по течению, содержащей несколько дистальных энхансеров и границу TAD, что приводит к перемещению этих элементов в TAD с Kcnj2, кодирующим калиевый канал5 (рис. 5б). Как и нокаут Sox9, гомозиготный Sox9-регулятор INV является перинатально летальным, с обширными скелетными фенотипами, включая порок развития пвальцев, расщелину неба, искривление костей и задержку оссификации. Помимо потери 50% экспрессии Sox9, инверсия вызывает выраженную мисэкспрессию
Kcnj2 в зачатках пальцев в соответствии с диким типом Sox
95. Однако степень снижения экспрессии
Kcnj2 и Sox9 в других местах, а также молекулярные и клеточные корреляты распространенного скелетного фенотипа еще предстоит глубоко изучить.
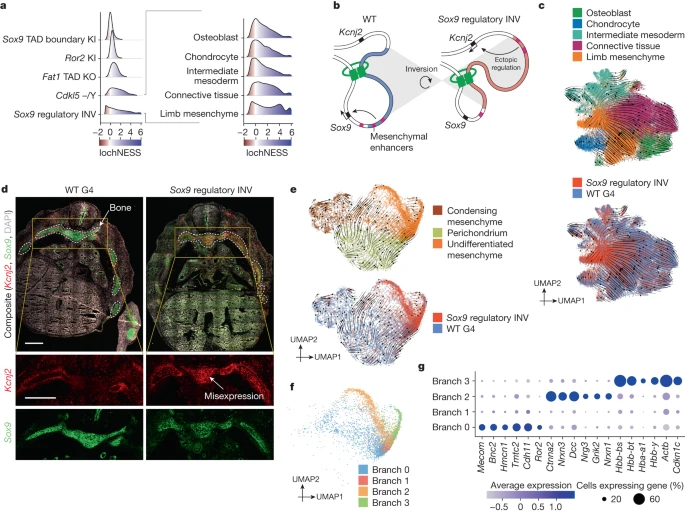
Fig. 5:
Apparent stalling and redirection of mesenchyme differentiation in the Sox9 regulatory INV mutant. a, LochNESS distributions for all G4 mutants in the mesenchymal trajectory (left) and the Sox9 regulatory INV mutant in mesenchymal sub-trajectories (right). b, Model of the Sox9 regulatory INV mutation depicting ectopic Kcnj2 regulation through enhancer adoption. c, RNA velocity of mesenchymal G4 wild-type and Sox9 regulatory INV cells coloured by sub-trajectories (top) or genotype (bottom). d, Sox9 regulatory INV heterozygous mutant and littermate wild-type RNAscope images (red: Kcnj2; green: Sox9), with insets below highlighting a region corresponding to developing bone (area outlined with white dots line). Scale bars, 500 ?m. e, RNA velocity of G4 wild-type and Sox9 regulatory INV cells in the limb mesenchymal sub-trajectory labelled by annotation (top) or genotype (bottom). f, The same as in e, but coloured by branch number. g, Dot plot of the top differentially expressed genes in the four branches shown in f.
На уровне мезенхимных субтраекторий последовательно наблюдались сдвиги в распределении lochNESS для регуляторных INV Sox9, но мезенхима конечностей и соединительная ткань были особенно обогащены клетками с чрезвычайно высоким lochNESS (рис. 5а, справа). Примечательно, что два из трех основных энхансеров (E250 и E195), известных как движущие силы хондрогенеза, опосредованного Sox9 в мезенхимных стволовых клетках, расположены в пределах инвертированной области40 (рис. 5б). Анализ клеточного состава (рис. 2а) показал, что в мутантах Sox9-регуляторной INV значительно больше клеток, относящихся к мезенхиме конечностей, за счет остеобластов, боковой пластинки и промежуточной мезодермы, хондроцитов и соединительнотканных траекторий. Этот сдвиг также виден на вкраплениях с равномерной аппроксимацией и проекцией многообразия (UMAP) (рис. 5в), к чему мы еще раз обратимся ниже.
Эти изменения в клеточном составе сопровождались снижением экспрессии Sox9 и повышением экспрессии Kcnj2 в кости (совокупность хондроцитов, остеобластов и мезенхимы конечности; Extended Data Fig. 12a), хотя количество клеток, экспрессирующих Kcnj2, в целом было невелико. Это позволяет предположить, что регуляторная инверсия Sox9 приводит к увеличению экспрессии Kcnj2 (за счет принятия энхансера Sox9) и уменьшению экспрессии Sox9 (за счет перестановки границ) не только в закчатках пальцев, но и в скелетной мезенхиме в целом. Чтобы подтвердить это, мы провели гибридизацию РНК in situ (RNAscope) на срезах развивающихся костей грудной клетки в возрасте E13.5, сравнивая гетерозиготную мышь Sox9 regulatory INV с сородичами дикого типа. В соответствии с данными scRNA-seq, полученными на гомозиготных мутантах, наши данные свидетельствуют об увеличении уровня Kcnj2 в развивающейся кости в соответствии с паттерном Sox9, наряду с потерей экспрессии Sox9 (рис. 5d и расширенные данные рис. 12b).
Поскольку инвертированная регуляторная область Sox9 также содержит множество энхансеров, активных в других тканях (например, E161 в легком и E239 в коре головного мозга)40 , мы задались вопросом, наблюдаются ли подобные закономерности и в других тканях. Действительно, как scRNA-seq, так и количественное определение RNAscope показали повышенный уровень Kcnj2 во всех других исследованных тканях. В то время как снижение экспрессии Sox9, очевидное в костях, не наблюдалось в большинстве других тканей с помощью scRNA-seq, RNAscope показал снижение экспрессии Sox9 в теленцефалоне и легком (расширенные данные рис. 12а,б). В совокупности эти данные свидетельствуют о выраженных изменениях в мезенхиме, связанных со снижением уровня Sox9, наряду с более широким увеличением экспрессии Kcnj2. Как и ожидалось, исходя из роли Sox9 в хондрогенезе, были снижены регуляции основных путей, связанных с пролиферацией и дифференцировкой хондроцитов43-46; менее ожидаемо, что несколько путей, связанных с иммунитетом, были повышены (расширенные данные рис. 12c).
Для более детального изучения очевидного накопления мезенхимы конечности в Sox9-регуляторной INV (рис. 5c и расширенные данные рис. 12d) мы провели повторный анализ мутантных клеток и клеток дикого типа из субтраектории мезенхимы конечности, который выявил субпопуляции конденсирующейся мезенхимы, перихондрия и недифференцированной мезенхимы (расширенные данные рис. 12e,f). Анализ скорости РНК позволил предположить, что большая часть "накопления" мезенхимы конечностей у мутантных эмбрионов приходится на клетки, которые задерживаются или замирают в недифференцированном или стволовом состоянии (рис. 5c,e и расширенные данные рис. 12e). Это накопление еще более очевидно на интегральных видах субтраектории мезенхимы конечности, где мы наблюдаем ветви, сильно обогащенные регуляторными клетками Sox9 мутанта INV, в пределах недифференцированной мезенхимы (рис. 5е и расширенные данные рис. 12г,з).
Для дальнейшего изучения этих ветвей мы провели субкластеризацию недифференцированных клеток мезенхимы из мутанта и дикого типа (рис. 5f,g). Примечательно, что наиболее дифференциально экспрессируемые гены в "ветви 2" были в основном нейронными (например, несколько нейрексинов и нейрегулин 3), что подтверждается анализом обогащения набора генов (расширенные данные рис. 12i, j). Анализ клеточного состава показал, что эти нейроноподобные клетки не ограничиваются мутантом Sox9 regulatory INV, а встречаются и у эмбрионов дикого типа, хотя и гораздо реже (Extended Data Fig. 12g,h). Чтобы подтвердить эту неожиданную "нейроподобную" ветвь мезенхимальных клеток, а также оценить их анатомическое распределение, мы сопоставили эти клетки с пространственными транскриптомными данными эмбрионов мыши E13.537. Поразительно, что при таком анализе клетки ветви 2 располагались вдоль нервной трубки и областей мозга (расширенные данные рис. 13а). Для устранения опасений, что при отображении одноклеточных данных на не одноклеточные пространственные карты могут возникнуть артефакты, мы также интегрировали наши данные с пространственными транскриптомными данными sci-space47 (E14.5), поскольку они имеют одноядерное разрешение. Результаты совпадают: мезенхимальные клетки ветви 2 обогащены в областях мозга, клетки ветви 0 обогащены в областях зачатков конечностей, а клетки ветвей 1 и 3 распределены диффузно, но в значительной степени исключены из областей головного мозга (расширенные данные, рис. 13б).
В совокупности эти анализы подтверждают существование нейроподобного подмножества мезенхимы (присутствующего у дикого типа и увеличенного у мутантов с регуляторной системой Sox9 INV). Это наблюдение согласуется с сообщениями о том, что мезенхимальные стволовые клетки могут дифференцироваться до состояния нейронов in vitro48.
DISCUSSION
В данной работе мы поставили перед собой задачу создать scRNA-seq целых эмбрионов как новую парадигму для систематического и масштабируемого фенотипирования мутантов развития мыши. На основе данных, полученных для 22 мутантов в одном эксперименте, мы разработали аналитические подходы для выявления отклонений в составе клеточных типов, тонких различий в экспрессии генов внутри клеточных типов (lochNESS) и общих субфенотипов между мутантами (оценка сходства). В целом полученные результаты обнадеживают и показывают, как систематический, не зависящий от результатов вычислительный анализ данных, полученных в масштабе целого эмбриона, может в некоторых случаях выявить молекулярные и клеточные фенотипы, которые не учитываются при обычном фенотипировании.
Мы подчеркиваем, что одновременный анализ многих мутантов оказался крайне важным для контекстуализации конкретных наблюдений (то есть для понимания того, насколько специфичным или неспецифичным было то или иное явное отклонение) на фоне десятков генотипов и более чем 100 эмбрионов. Это также позволило нам обнаружить общие аспекты фенотипов между ранее не связанными генотипами (например, между мутантами Gorab и Atp6v0a2). В перспективе профилирование дополнительных мышиных мутантов может позволить провести дальнейшую "декомпозицию" плейотропии развития - малоизученного явления - на "базисные векторы".
Анализ различных мутантов позволил получить разнообразные результаты, свидетельствующие о целесообразности использования scRNA-seq целых эмбрионов для фенотипирования. Например, аномальный фенотип глаз у мутантов Ttc21b был описан ранее, но считался, вероятно, вторичным по отношению к более общему дефекту черепно-лицевой области20,33. Анализ scRNA-seq мутантов E13.5 Ttc21b показал, что многочисленные траектории движения клеток сетчатки практически отсутствуют. Детальный гистологический анализ подтвердил это, что позволяет предположить, что аномалия глаза, вероятно, не является вторичным эффектом, а, скорее, передача сигналов гиперактивного SHH оказывает первичное влияние на развитие сетчатки у этого мутанта.
Целесообразность проведения скрининга scRNA-seq целых эмбрионов была также продемонстрирована неожиданным обнаружением у мутанта Gli2-KO как обедненной, так и обогащенной клеточной популяции производных клеток пластинки крыши. Дорсализация" нервной трубки в отсутствие SHH-сигнализации хорошо описана20,35,36 и была подтверждена в нашем гистологическом анализе этой линии (расширенные данные рис. 8). Однако до сих пор у мышей Gli2-KO не было описано изменений в пластинке крыши или ее производных36. Напротив, scRNA-seq целых эмбрионов выявил, что производные пластинки крыши у мутанта изменяют свой состав (первичный вывод) и развитие тканей (вывод, основанный на вторичном подтверждении), что иллюстрирует, как этот подход может потенциально дать новое представление даже о хорошо изученных путях развития. Однако из-за того, что наш набор данных охватывает только одну временную точку, остается неясным, вызывает ли неправильная экспрессия Gli2 структурные изменения непосредственно в производной ткани или на более ранних этапах формирования пластинки крыши.
Наше исследование MMCA имеет ограничения. Во-первых, мы профилировали только четыре реплики для каждого мутанта в одной временной точке развития. На основе имитационного анализа аналитического подхода, учитывающего только соотношение клеток, четырех реплик каждого мутанта, вероятно, достаточно для обнаружения небольших изменений в обильных типах клеток (например, 10%-ное изменение для типов клеток с 10%-ным содержанием), но только больших изменений в более редких типах клеток (например, 25%-ное изменение для типов клеток с 1%-ным содержанием; расширенные данные рис. 4б). Таким образом, для выявления более тонких изменений в модельных организмах, таких как мыши, для которых невозможно провести очень большое число реплик, могут оказаться необходимыми более сложные стратегии, такие как lochNESS, которая основана не на подсчете типов клеток, а непосредственно учитывает распределение клеток, относящихся к разным генотипам, в сложном вкраплении. Важно отметить, что наш анализ клеточного состава, включающий как клетки дикого типа, так и мутантные клетки одного и того же штамма для получения объединенного эталона, предполагает, что соотношение клеток недиких генотипов примерно соответствует, по крайней мере в целом, соотношению клеток дикого типа. Это предположение может быть более проблематичным при изучении биологически родственных мутантов. Следует отметить, что в параллельно опубликованных в этом номере исследованиях аналогичный подход применяется для генетических и экологических возмущений у рыбок данио (ссылка 49), что позволяет профилировать десятки-сотни реплицированных эмбрионов каждого генотипа и количественно оценивать фенотипическую изменчивость.
Во-вторых, профилирование лишь небольшой части клеток, присутствующих в эмбрионах E13.5, потенциально ограничивает чувствительность. Однако для каждого конкретного мутанта мы имели более 1,5 млн клеток других генотипов (дикого типа или других мутантов), что облегчало выявление мутант-специфических фенотипов для редких типов клеток (например, в сетчатке (Ttc21b KO) и пластинке крыши (Gli2 KO)).
В-третьих, мы не смогли детально изучить все мутанты, а также тщательно исследовать другие аспекты данных (например, различия между штаммами дикого типа). Мы предполагаем, что в будущем для извлечения полной пользы из этих данных будет необходим вклад сообщества и опыт в данной области. Для облегчения этой задачи мы создали интерактивный браузер, позволяющий исследовать мутантоспецифические эффекты на экспрессию генов в траекториях и субтраекториях вместе с исходными данными (https://atlas.gs.washington.edu/mmca_v2/). Кроме того, некоторые из выявленных здесь фенотипов, вероятно, не были описаны ранее из-за недостаточной разрешающей способности традиционного фенотипирования. Необходимо разработать новые стратегии вторичной валидации для подтверждения тонких дефектов в молекулярных программах или незначительных изменений в относительных пропорциях конкретных типов клеток. Перспективным подходом может стать дополнение scRNA-seq целых эмбрионов быстро развивающимися методами мечения антителами целых мышиных тел и трехмерной визуализации50.
В-четвертых, наши результаты подчеркивают важность хорошо подобранного контроля; хотя данные, полученные на эмбрионах дикого типа, могут быть использованы в качестве контрольных для будущих исследований других мутантов, это чревато эффектом партии, и более безопасной стратегией было бы всегда включать хорошо подобранный, "линейный" контроль дикого типа при профилировании эмбрионов мутантов.
В 2011 г. Международный консорциум по фенотипированию мышей поставил перед собой задачу добиться "функционализации" всех белок-кодирующих генов мыши, создав тысячи линий нокаутных мышей51. В принципе, представленный здесь подход к фенотипированию с помощью scRNA-seq в целых эмбрионах может быть распространен на все менделевские гены или даже на все 20 000 нокаутов мышиных генов.
МЕТОДЫ...
Краткое содержание отчета
Более подробную информацию о дизайне исследования можно найти в отчете Nature Portfolio Reporting Summary, ссылка на который приведена в данной статье. https://atlas.gs.washington.edu/mmca_v2/.
Доступность кода
Весь код находится в свободном доступе в публичном репозитории GitHub по адресу https://github.com/shendurelab/MMCA.
 Fig. 1: Single-cell transcriptional profiling of 103 whole mouse embryos staged at E13.5.
a, Categories of mutants (left) analysed by whole-embryo profiling with sci-RNA-seq3 (right). WT, wild type. KI, knock-in; DKO, double KO. ?/Y, hemizygous b, Embeddings of pseudobulk RNA-seq profiles of MMCA embryos in PCA space with visualization of the top three PCs. Datapoints are coloured by background strain of the embryo. The black dashed ovals highlight two major groups corresponding to FVB versus other backgrounds. Embryo 104 is a clear outlier. c, Embeddings of pseudobulk RNA-seq profiles of MOCA3 and MMCA embryos in PCA space defined solely by MOCA, with MMCA embryos (grey) projected onto it. The top two PCs are visualized. Coloured points correspond to MOCA embryos of different stages (E9.5–E13.5), and grey points to MMCA embryos (E13.5). The dashed line highlights five MMCA embryos that are co-localized with E11.5 or E12.5 embryos from MOCA. Three are from Scn11a-GOF (embryos 33, 34 and 36), Carm1-KO (embryo 101) and wild-type (embryo 41) C57BL/6 strains. d, Number of cells profiled per embryo for each strain. Centre lines show medians; box limits indicate 25th and 75th percentiles; replicates (n = 3 for wild-type C57BL/6, n = 4 for all others) are represented by dots. Genotypes are listed by median cell number in ascending order. e, Three-dimensional UMAP visualization of wild-type subset of MMCA dataset (215,575 cells from 15 embryos). Cells are coloured by major-trajectory annotation. PNS, peripheral nervous system.
Fig. 1: Single-cell transcriptional profiling of 103 whole mouse embryos staged at E13.5.
a, Categories of mutants (left) analysed by whole-embryo profiling with sci-RNA-seq3 (right). WT, wild type. KI, knock-in; DKO, double KO. ?/Y, hemizygous b, Embeddings of pseudobulk RNA-seq profiles of MMCA embryos in PCA space with visualization of the top three PCs. Datapoints are coloured by background strain of the embryo. The black dashed ovals highlight two major groups corresponding to FVB versus other backgrounds. Embryo 104 is a clear outlier. c, Embeddings of pseudobulk RNA-seq profiles of MOCA3 and MMCA embryos in PCA space defined solely by MOCA, with MMCA embryos (grey) projected onto it. The top two PCs are visualized. Coloured points correspond to MOCA embryos of different stages (E9.5–E13.5), and grey points to MMCA embryos (E13.5). The dashed line highlights five MMCA embryos that are co-localized with E11.5 or E12.5 embryos from MOCA. Three are from Scn11a-GOF (embryos 33, 34 and 36), Carm1-KO (embryo 101) and wild-type (embryo 41) C57BL/6 strains. d, Number of cells profiled per embryo for each strain. Centre lines show medians; box limits indicate 25th and 75th percentiles; replicates (n = 3 for wild-type C57BL/6, n = 4 for all others) are represented by dots. Genotypes are listed by median cell number in ascending order. e, Three-dimensional UMAP visualization of wild-type subset of MMCA dataset (215,575 cells from 15 embryos). Cells are coloured by major-trajectory annotation. PNS, peripheral nervous system.
 Fig. 2: Cell composition changes for individual mutants across developmental trajectories.
a, The heatmap shows log2-transformed ratios of cell proportions between each mutant type (y axis) versus the pooled reference (consisting of wild type and other mutants from the same strain; cell counts from replicates were merged) across individual sub-trajectories (x axis). Only nominally significant results are shown (Methods). The pie colour and direction correspond to whether the log2-transformed ratio is >0 (blue, clockwise) or <0 (red, anticlockwise); the pie size and colour intensity correspond to the scale of the log2-transformed ratio. log2-transformed ratios that were >2 or
Fig. 2: Cell composition changes for individual mutants across developmental trajectories.
a, The heatmap shows log2-transformed ratios of cell proportions between each mutant type (y axis) versus the pooled reference (consisting of wild type and other mutants from the same strain; cell counts from replicates were merged) across individual sub-trajectories (x axis). Only nominally significant results are shown (Methods). The pie colour and direction correspond to whether the log2-transformed ratio is >0 (blue, clockwise) or <0 (red, anticlockwise); the pie size and colour intensity correspond to the scale of the log2-transformed ratio. log2-transformed ratios that were >2 or
 Fig. 3: LochNESS highlights mutant-related changes.
a, A schematic of lochNESS calculation and visualization. b, UMAP of the limb mesenchyme trajectory from ZRS limb enhancer KO and wild-type cells, coloured by lochNESS. The colour scale is centred at the median. Cells corresponding to a subset of ZRS limb enhancer KO cells with more extreme loss in Fig. 2d are outlined with a dashed line. c, Distribution of lochNESS in the neural tube sub-trajectories of Ttc21b-KO and Gli2-KO mutants. The dashed outlines highlight shifted distributions of the retinal neuron sub-trajectory of the Ttc21b-KO mutant and the floor and roof plate sub-trajectories of the Gli2-KO mutant. d, UMAP of co-embedded cells of floor plate and roof plate sub-trajectories from the Gli2-KO mutant and pooled wild type, coloured by lochNESS. e, The same as in d, but coloured by selected marker gene expression. f, Immunofluorescence staining of TTR (ChP marker) in brain regions (LV, lateral ventricle; 4V, fourth ventricle) in sections from the wild type and the Gli2-KO mutant (Methods). Scale bars, 50µm.
Fig. 3: LochNESS highlights mutant-related changes.
a, A schematic of lochNESS calculation and visualization. b, UMAP of the limb mesenchyme trajectory from ZRS limb enhancer KO and wild-type cells, coloured by lochNESS. The colour scale is centred at the median. Cells corresponding to a subset of ZRS limb enhancer KO cells with more extreme loss in Fig. 2d are outlined with a dashed line. c, Distribution of lochNESS in the neural tube sub-trajectories of Ttc21b-KO and Gli2-KO mutants. The dashed outlines highlight shifted distributions of the retinal neuron sub-trajectory of the Ttc21b-KO mutant and the floor and roof plate sub-trajectories of the Gli2-KO mutant. d, UMAP of co-embedded cells of floor plate and roof plate sub-trajectories from the Gli2-KO mutant and pooled wild type, coloured by lochNESS. e, The same as in d, but coloured by selected marker gene expression. f, Immunofluorescence staining of TTR (ChP marker) in brain regions (LV, lateral ventricle; 4V, fourth ventricle) in sections from the wild type and the Gli2-KO mutant (Methods). Scale bars, 50µm.
 Fig. 4: Similarity scores identify mutant-shared and mutant-specific effects.
a, A heatmap showing similarity scores between individual C57BL/6 embryos in the mesenchymal trajectory. The rows and columns are grouped by genotype and labelled by embryo id and genotype. b, UMAP of the lateral plate and intermediate mesoderm sub-trajectory for mutants from the C57BL/6 background strain, coloured and labelled by subcluster and detailed cell type (marker genes in Supplementary Table 4). c, Boxplots showing the composition of the top six subclusters for individual Atp6v0a2-KO, Atp6v0a2R755Q and Gorab-KO embryos (blue, n = 4 each genotype) and other C57BL/6 embryos (red, n = 23). Centre lines show medians; box limits indicate 25th and 75th percentiles; replicates are represented by dots. d, The same as in b, but coloured by log-transformed expression of selected marker genes.
Fig. 4: Similarity scores identify mutant-shared and mutant-specific effects.
a, A heatmap showing similarity scores between individual C57BL/6 embryos in the mesenchymal trajectory. The rows and columns are grouped by genotype and labelled by embryo id and genotype. b, UMAP of the lateral plate and intermediate mesoderm sub-trajectory for mutants from the C57BL/6 background strain, coloured and labelled by subcluster and detailed cell type (marker genes in Supplementary Table 4). c, Boxplots showing the composition of the top six subclusters for individual Atp6v0a2-KO, Atp6v0a2R755Q and Gorab-KO embryos (blue, n = 4 each genotype) and other C57BL/6 embryos (red, n = 23). Centre lines show medians; box limits indicate 25th and 75th percentiles; replicates are represented by dots. d, The same as in b, but coloured by log-transformed expression of selected marker genes.
 Fig. 5: Apparent stalling and redirection of mesenchyme differentiation in the Sox9 regulatory INV mutant. a, LochNESS distributions for all G4 mutants in the mesenchymal trajectory (left) and the Sox9 regulatory INV mutant in mesenchymal sub-trajectories (right). b, Model of the Sox9 regulatory INV mutation depicting ectopic Kcnj2 regulation through enhancer adoption. c, RNA velocity of mesenchymal G4 wild-type and Sox9 regulatory INV cells coloured by sub-trajectories (top) or genotype (bottom). d, Sox9 regulatory INV heterozygous mutant and littermate wild-type RNAscope images (red: Kcnj2; green: Sox9), with insets below highlighting a region corresponding to developing bone (area outlined with white dots line). Scale bars, 500 ?m. e, RNA velocity of G4 wild-type and Sox9 regulatory INV cells in the limb mesenchymal sub-trajectory labelled by annotation (top) or genotype (bottom). f, The same as in e, but coloured by branch number. g, Dot plot of the top differentially expressed genes in the four branches shown in f.
Fig. 5: Apparent stalling and redirection of mesenchyme differentiation in the Sox9 regulatory INV mutant. a, LochNESS distributions for all G4 mutants in the mesenchymal trajectory (left) and the Sox9 regulatory INV mutant in mesenchymal sub-trajectories (right). b, Model of the Sox9 regulatory INV mutation depicting ectopic Kcnj2 regulation through enhancer adoption. c, RNA velocity of mesenchymal G4 wild-type and Sox9 regulatory INV cells coloured by sub-trajectories (top) or genotype (bottom). d, Sox9 regulatory INV heterozygous mutant and littermate wild-type RNAscope images (red: Kcnj2; green: Sox9), with insets below highlighting a region corresponding to developing bone (area outlined with white dots line). Scale bars, 500 ?m. e, RNA velocity of G4 wild-type and Sox9 regulatory INV cells in the limb mesenchymal sub-trajectory labelled by annotation (top) or genotype (bottom). f, The same as in e, but coloured by branch number. g, Dot plot of the top differentially expressed genes in the four branches shown in f.