Посещений: 
АНОМАЛИИ СЕТЧАТКИ
Роль фактора NR2E3
Nuclear Receptor Subfamily 2 Group E Member 3 (NR2E3): Role in Retinal Development and Disease Maria Toms, Natasha Ward and
Mariya Moosajee
 Genes 2023, 14(7), 1325; https://doi.org/10.3390/genes14071325
|
NR2E3 is a nuclear hormone receptor gene required for the correct development of the retinal rod photoreceptors. Expression of NR2E3 protein in rod cell precursors suppresses cone-specific gene expression and, in concert with other transcription factors including NRL, activates the expression of rod-specific genes. Pathogenic variants involving NR2E3 cause a spectrum of retinopathies, including enhanced S-cone syndrome, Goldmann-Favre syndrome, retinitis pigmentosa, and clumped pigmentary retinal degeneration, with limited evidence of genotype-phenotype correlations. A common feature of NR2E3-related disease is an abnormally high number of cone photoreceptors that are sensitive to short wavelength light, the S-cones. This characteristic has been supported by mouse studies, which have also revealed that loss of Nr2e3 function causes photoreceptors to develop as cells that are intermediate between rods and cones. While there is currently no available cure for NR2E3-related retinopathies, there are a number of emerging therapeutic strategies under investigation, including the use of viral gene therapy and gene editing, that have shown promise for the future treatment of patients with NR2E3 variants and other inherited retinal diseases. This review provides a detailed overview of the current understanding of the role of NR2E3 in normal development and disease, and the associated clinical phenotypes, animal models, and therapeutic studies.

|
NR2E3 (Nuclear Receptor subfamily 2 group E member 3; OMIM #604485), ранее известный как PNR, кодирует фоторецептор-специфический сиротский рецептор ядерных гормонов, необходимый для нормального развития фоторецепторов сетчатки [1]. Ген расположен на хромосоме 15q23 и состоит из 8 кодирующих экзонов. NR2E3 имеет две изоформы: (i) полноразмерный транскрипт, содержащий все 8 экзонов, продуцирующий белок размером 410 аминокислот (аа), и (ii) второй транскрипт, сохраняющий интрон 7, кодирующий белок меньшего размера - 367 аа, в котором отсутствует участок, кодируемый экзоном 8 [2]. Патогенные варианты NR2E3 характеризуются значительной клинической гетерогенностью и ассоциируются с рядом ретинопатий, при этом четкая корреляция между генотипом и фенотипом отсутствует [1]. Общим признаком заболеваний, связанных с NR2E3, является аномально увеличенное количество фоторецепторов колбочек, чувствительных к коротковолновому (синему) свету, - S-конусов, что подтверждается психофизическими, электрофизиологическими [3,4] и гистопатологическими [5] исследованиями пациентов, а также исследованиями на животных [6]. Несмотря на то что многое еще предстоит выяснить, достигнут значительный прогресс в понимании роли NR2E3 в развитии и заболевании сетчатки, а в последние годы - в разработке эффективных методов лечения благодаря многообещающим доклиническим терапевтическим исследованиям.
2. NR2E3 Structure
Белок NR2E3 входит в большое семейство лиганд-модулируемых факторов транскрипции - ядерных рецепторов. В геноме человека насчитывается 48 ядерных рецепторов, среди которых есть эндокринные, adopted orphan, and orphan (сиротские) рецепторы [7]. NR2E3 - сиротский рецептор, имеющий консервативную структурную организацию со всеми др. ядерными рецепторами и состоящий из нескольких ключевых областей: А/В, ДНК-связывающего, шарнирного и лиганд-связывающего доменов [8,9]. На N-конце высоко изменчивый А/В-домен включает в себя лиганд-независимую активаторную функцию (AF-1). За ним следует наиболее консервативная область - ДНК-связывающий домен, состоящий из двух цинковых пальчиков Cys4, содержащих Р-бокс, который, как предполагается, позволяет рецептору связываться с уникальными участками элементов ответа ДНК и регулировать экспрессию генов, и D-бокс, который, как предполагается, участвует в межбелковых взаимодействиях. Петлевой домен соединяет ДНК-связывающий и лиганд-связывающий домены и содержит сигнал ядерной локализации, который может перекрываться с ДНК-связывающим доменом.
С-концевой лиганд-связывающий домен ядерных рецепторов обычно состоит из 12 α-спиралей, которые складываются в консервативный гидрофобный карман, в котором может связываться лиганд, что неизвестно в случае NR2E3. Помимо этой лиганд-зависимой активаторной функции (AF-2), лиганд-связывающий домен также необходим для гомо- и гетеродимеризации. Tan et al. установили кристаллическую структуру лиганд-связывающего домена NR2E3 в состоянии отсутствия связывания лиганда и обнаружили, что он имеет димерное расположение, причем каждый мономер образован канонической антипараллельной трехслойной α- спиральной сэндвич-укладкой, состоящей из 8 α-спиралей [7,10]. Установлено, что лиганд-связывающий карман заполнен боковыми цепями гидрофобных и ароматических остатков, а спираль AF-2 занимает канонический сайт связывания ко-фактора. Сделан вывод, что лиганд-связывающий домен NR2E3 имеет авто-репрессиуемую конфигурацию.
3. NR2E3 Function
3.1. Rod and Cone Photoreceptor Differentiation
Считается, что появление NR2E3 в эволюционном плане совпадает по времени с появлением палочковых и колбочковых фоторецепторов [1]. До этого у ранних предков позвоночных существовал только один тип фоторецепторных клеток, который, как считается, по своей структуре был более похож на колбочки, чем на палочки [11]. Палочки и колбочки различаются по нескольким ключевым параметрам, включая их форму, фотопигменты, распределение в сетчатке и характер синаптических связей [12]. Как правило, сетчатка человека содержит ~5% колбочек и ~95% палочек [13]. Наибольшая плотность колбочек наблюдается в макуле, тогда как палочки сосредоточены в периферической части сетчатки. Палочки содержат один тип зрительного пигмента - родопсин, обеспечивающий высокочувствительное зрение при низкой освещенности [12]. Колбочки человека, напротив, содержат по одному из трех альтернативных пигментов (S-, M- и L-опсины), которые реагируют на короткие (S), средние (M) и длинные (L) длины волн (т.е. синий, зеленый, красный, соответственно) для цветного и ярко освещенного зрения с высоким разрешением. Популяция фоторецепторных клеток с S-конусом обычно является наименее распространенной среди подтипов фоторецепторных клеток, составляя 5-10% от мозаики колбочек [14]. Морфологически S-конусы отличаются от M- и L-конусов более длинным и широким внутренним сегментом, соединяющимся с наружным сегментом, и имеют наибольшую плотность ~2000 клеток мм2, расположенных непосредственно за центральной ямкой [15].
В процессе эмбрионального развития палочки и колбочки дифференцируются из общих фоторецепторных клеток-предшественников [5]. Их дифференцировка контролируется несколькими транскрипционными факторами, в том числе NR2E3, которые обеспечивают локализацию специфических для палочек и колбочек генов в соответствующем типе фоторецепторов (рис. 1) [16]. Исследования на животных моделях и у пациентов с вариантами NR2E3 позволяют предположить, что роль этого гена в дифференцировке фоторецепторов двойная: он подавляет экспрессию колбочковых генов, таких как OPNSW1 (синий опсин), GNAT2 и GNB (субъединицы колбочкового трансдуцина), и способствует активации экспрессии палочковых генов, таких как субъединица GNB1 палочкового трансдуцина [17] и родопсин [18,19]. NR2E3 экспрессируется исключительно в палочках и впервые обнаруживается в незрелых палочках на крае центральной ямки, начиная с 11,7-й недели жизни плода [20]. Без экспрессии NR2E3 предшественники фоторецепторов дифференцируются в тип фоторецепторных клеток "по умолчанию" - S-конусы [18].
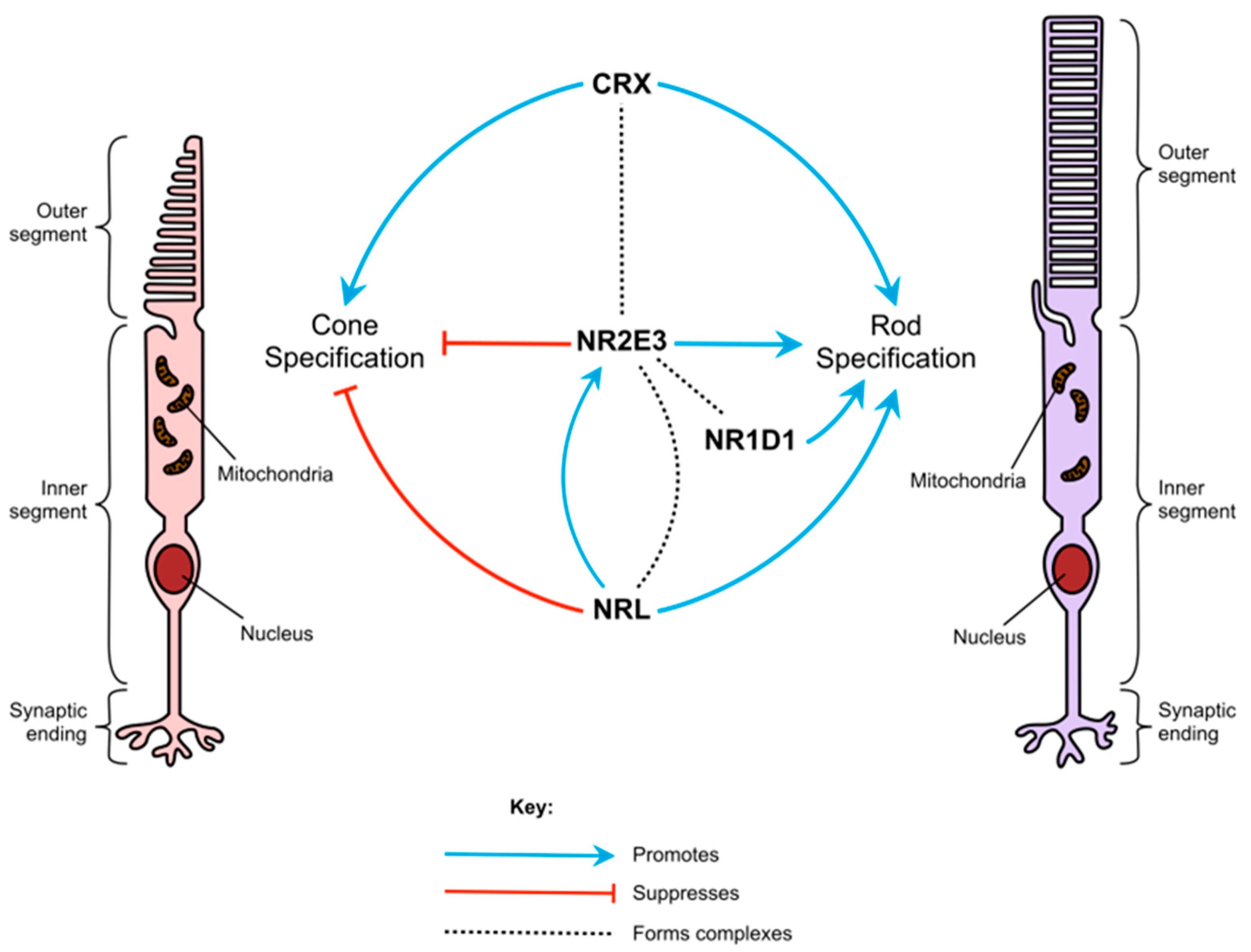 Figure 1. The role of NR2E3 in photoreceptor cell specification. A schematic representation of how NR2E3 and other transcription factors interact to regulate rod and cone photoreceptor specification.
Кроме NR2E3, основными факторами, участвующими в дифференцировке палочек, являются CRX, NRL и NR1D1 [16,21]. Имеются данные о том, что факторы транскрипции, кодируемые этими генами, наряду с NR2E3, взаимодействуют между собой, образуя многобелковые транскрипционные регуляторные комплексы [21]. CRX способствует экспрессии как палочко-, так и колбочко-специфических транскриптов, а патогенные варианты CRX могут вызывать ряд ретинопатий, в том числе такие ранние заболевания, как врожденный амавроз Лебера [22] и cone-rod дистрофия [23]. Как NRL, так и NR2E3 ограничены палочками и предшественниками палочек и подавляют транскрипты, специфичные для колбочек [1]. NRL также повышает экспрессию NR2E3 и других палочко-специфических транскриптов. Удаление Nrl у мышей также приводит к развитию фоторецепторов в виде S-конусов, а не палочек [19].
Ни NR1D1, ни NR2E3 по отдельности не оказывают существенного влияния на активность промоторов, специфичных для палочек [21]. Однако при совместном действии NR1D1 и NR2E3 синергично повышают активность промотора родопсина. NR2E3 также может связываться с промоторными областями генов, специфичных для палочек, только в присутствии CRX [24]. Эти взаимодействия указывают на то, что NR2E3 является частью сложной сети сигналов, определяющих судьбу клеток-предшественников фоторецепторов. Эта сложность может отчасти объяснять большое разнообразие фенотипов, наблюдаемых у пациентов и на животных моделях заболеваний.
3.2. Role in the Adult Retina and Other Tissues
NR2E3 продолжает экспрессироваться во взрослой сетчатке, и в ряде исследований было показано, что он участвует в поддержании сетчатки [17,25,26]. В сетчатке зрелой мыши NR2E3 регулирует набор генов, отличающихся от тех, которые задействованы в процессе развития; в их число входят несколько генов, отвечающих за поддержание и выживание фоторецепторов, например, гены Opnsw1 и Gnb1, связанные с фототрансдукцией [14]. Кроме того, Olivares et al. обнаружили, что Nr2e3 вовлечен в несколько генных сетей в сетчатке взрослого человека и регулирует гены, связанные с возрастной макулярной дегенерацией, включая Flt1, Abca1 и Alcam [25].
Экспрессия белка Nr2e3 обнаружена в клетках печени мыши, что свидетельствует о более широком распространении его роли, чем считалось ранее [27]. Однако роль NR2E3 в печени и других тканях изучена недостаточно хорошо. Повышенный уровень NR2E3 ассоциировался с хорошими клиническими исходами у больных раком печени [28], а потеря NR2E3 коррелировала с развитием заболеваний печени и рака [27]. Экспрессия NR2E3 выявила аналогичную связь у больных раком молочной железы, где он, по-видимому, регулирует рецептор эстрогена α [29].
4. Clinical Phenotype
В настоящее время идентифицировано более 80 болезнетворных вариантов NR2E3, вызывающих различные ретинопатии, большинство из которых наследуются по аутосомно-рецессивному типу (рис. 2 и табл. 1). К числу рецессивно наследуемых заболеваний относятся enhanced S-cone syndrome (ESCS; MIM #268100), синдром Гольдмана-Фавра (GFS; MIM #268100), пигментный ретинит (RP; MIM #611131) и слипшаяся пигментная дегенерация сетчатки (CPRD). Кроме того, NR2E3 ассоциирован с аутосомно-доминантной формой RP.
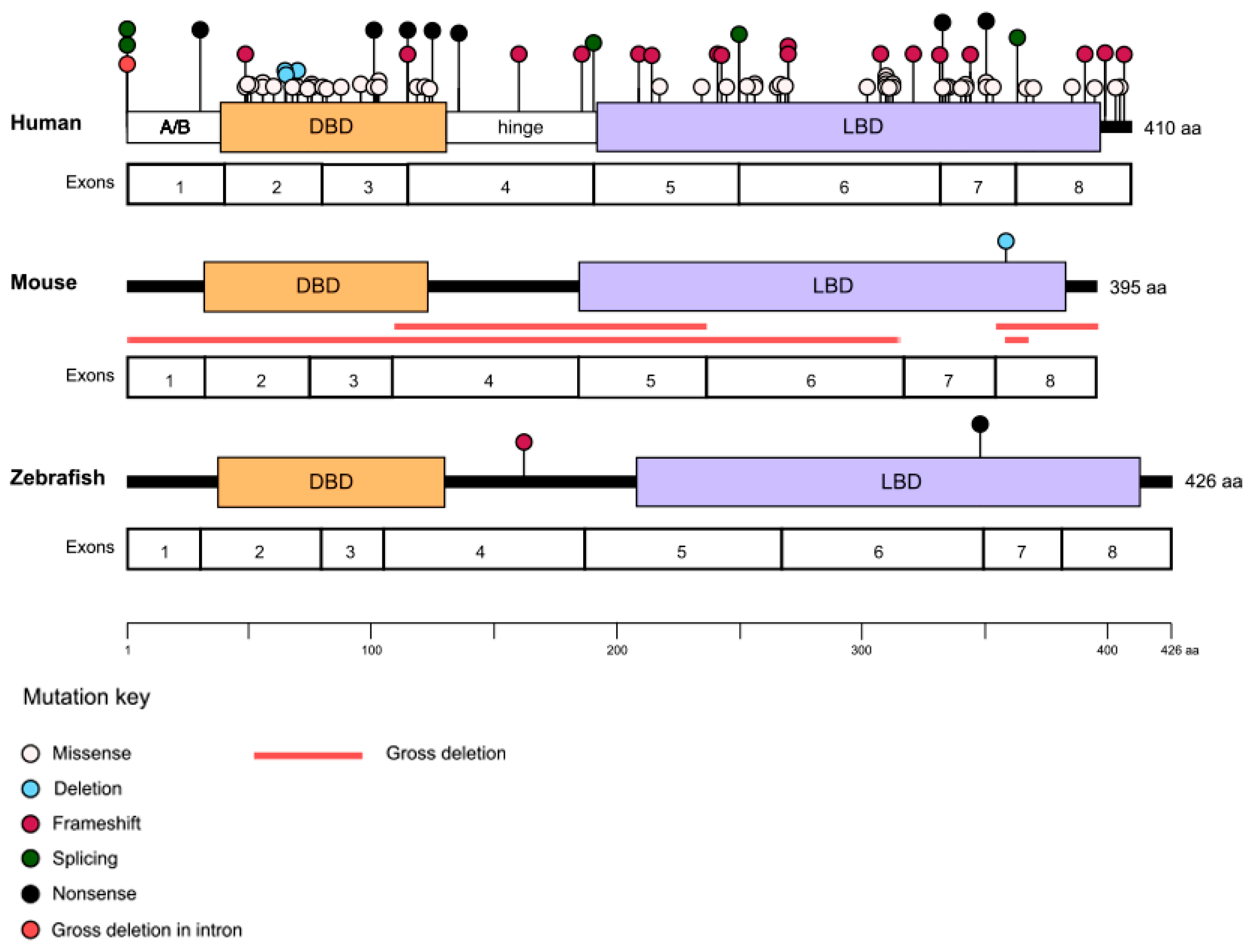 Figure 2. Pathogenic variants in NR2E3. The types and locations of the variants identified to date are marked on the human, mouse, and zebrafish NR2E3 proteins with the corresponding exons displayed underneath. Approximate locations of the A/B domain, DNA binding domain (DBD), hinge domain, and ligand binding domain (LBD) are marked on the human protein.
Патогенные варианты NR2E3 были первоначально описаны у пациентов с ESCS - состоянием развития, вызывающим повышенную чувствительность к синему свету, раннюю ночную слепоту (никталопию) и аномальные ЭРГ-ответы, обусловленные избытком S-конусов и недостатком функциональных палочек [30]. Пациенты также имеют различную степень чувствительности к зеленому и красному свету (из-за разного количества М- и L-конусов). Зрительные функции у пациентов с этими вариантами сильно варьируют, даже в пределах одной семьи, и могут варьировать от нормальных до сильно сниженных [31]. Дополнительные клинические признаки включают гиперметропию, астигматизм, макулярные отверстия, ослабление сосудов и дегенеративные изменения, в том числе субретинальные белые точки или желтые пятна и характерные комковатые или монетовидные отложения пигмента, наблюдаемые в средней периферической части дна [31,32,33]. Изображения сетчатки, полученные у пациентов с ESCS, представлены на рис. 3А-С. GFS сходен с ESCS, и в настоящее время считается, что эти заболевания имеют одинаковый клинический спектр [33,34], причем GFS представляет собой более тяжелую форму. Помимо усиления функции S-конуса, раннего развития никталопии и слипшейся пигментации глазного дна, для GFS характерны дегенеративные изменения в стекловидном теле, макулярный и периферический ретиношизис (расщепление слоев сетчатки), задняя субкапсулярная катаракта [35]. Еще одним заболеванием, относящимся к фенотипическому спектру NR2E3, является CPRD, которое имеет общие клинические признаки с ESCS и GFS (т.е. сгустковую пигментацию по всей средней периферии глазного дна и никталопию в раннем возрасте), а ответы ЭРГ более сходны с таковыми у пациентов с RP [33,36]. Однако оценка 11 подтвержденных пациентов с NR2E3, имеющих CPRD, ESCS и GFS, выявила функциональные дефекты в виде незначительной или отсутствующей функции палочек, независимо от диагноза [33]. В том же исследовании было установлено, что патогенные варианты NR2E3 составляют примерно половину случаев CPRD. При всех NR2E3-ассоциированных заболеваниях со временем происходит дегенерация фоторецепторов, и пациенты часто страдают от прогрессирующего снижения зрения [37,38]. Однако последующие оценки около 50 пациентов показали, что у многих из них острота зрения с наилучшей коррекцией остается стабильной в течение длительного времени [31]. В данном исследовании продолжительность наблюдения варьировала от 0 до 34 лет, в среднем 6,1 года.
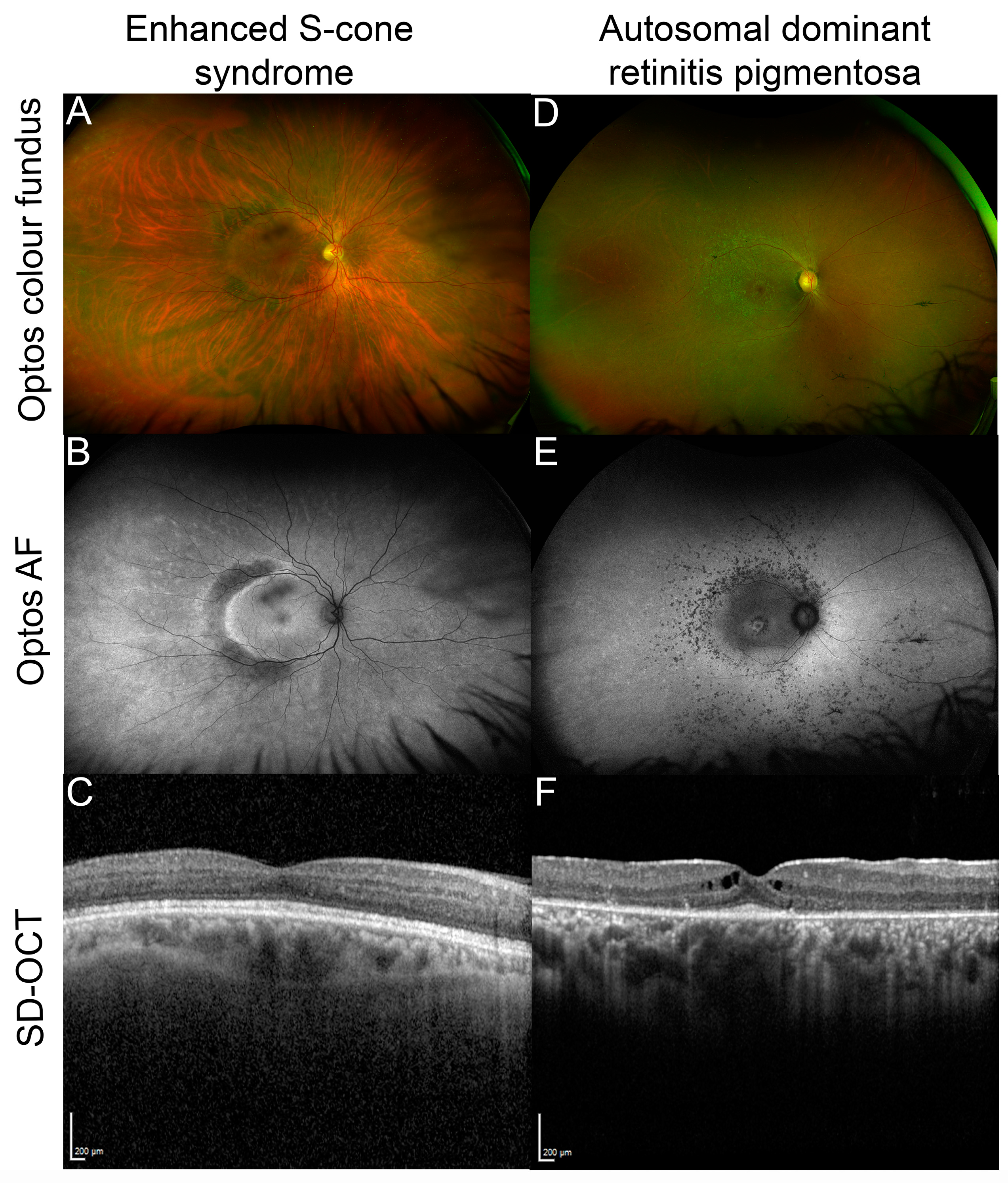 Figure 3. Examples of NR2E3 patient retinal phenotypes. (A) Optos color fundus image of enhanced S-cone syndrome with (B) corresponding optos fundus autofluorescence (FAF) image showing diffuse peripheral hypoautofluorescence with a half-ring of pronounced hyper-AF along the temporal macular rim and (C) spectral domain optical coherence tomography (SD-OCT) through the macula of the same patient. (D) Optos color fundus image of autosomal dominant NR2E3-related retinitis pigmentosa with (E) corresponding optos FAF image that shows nummular hypoautofluorescent areas around the arcades, a hyperAF ring at the macula and another more diffuse ring along the arcades, and (F) SD-OCT through the macula of the patient showing cystoid macular edema and a restricted ellipsoid zone.
ESCS, GFS и CPRD связаны с общими рецессивными биаллельными вариантами NR2E3, причем пациенты демонстрируют значительную клиническую гетерогенность даже при наличии идентичных мутаций [39]. Большинство патогенных вариантов NR2E3 находятся либо в ДНК-, либо в лиганд-связывающих доменах белка (рис. 2) [8,40]. Так, наиболее распространенным вариантом NR2E3, встречающимся у пациентов, является миссенс-мутация в экзоне 6 c.932G>A p.(Arg311Gln), которая происходит в лиганд-связывающем домене [30,33]. Однако есть и исключения, в том числе один из наиболее распространенных вариантов NR2E3, зарегистрированный в США, c.119-2A>C, который находится в каноническом сплайс-акцепторном сайте интрона 1 и, как было показано, вызывает пропуск экзона 2 [41]. Установить четкую корреляцию генотип-фенотип среди рецессивно наследуемых заболеваний NRE23 пока не удалось [8,33,39-42]. Высокая фенотипическая вариабельность может быть обусловлена целым рядом факторов, включая сложные взаимодействия между NR2E3 и другими молекулами, участвующими в определении судьбы фоторецепторных клеток, наличие генов-модификаторов и влияние окружающей среды.
Также были выявлены варианты NR2E3, вызывающие как аутосомно-рецессивный [43], так и аутосомно-доминантный RP [44]. RP - распространенная форма наследственного заболевания сетчатки, характеризующаяся прогрессирующей потерей палочковых фоторецепторов (проявляющейся никталопией и выпадением периферических полей) с последующей дегенерацией колбочек, приводящей к потере центрального зрения. У пациентов с NR2E3-RP ночная слепота обычно является первым симптомом, проявляющимся в детском или подростковом возрасте [43,44]. При типичном RP костные спикулоподобные пигментные отложения наблюдаются в средней периферической части сетчатки, однако у некоторых пациентов отмечается и слипшаяся пигментация [37,43,45]. Изображения сетчатки, полученные от пациента с аутосомно-доминантным RP, связанным с NR2E3, представлены на рис. 3D-F.
Таблица 1. Опубликованные варианты NR2E3 у пациентов и связанные с ними фенотипы.
Для аутосомно-доминантного RP существует генотип-фенотипическая ассоциация, причем все случаи связаны с миссенс-вариантом NR2E3 c.166G>A p.(Gly56Arg), который находится в первом цинковом пальчике ДНК-связывающего домена [44]. Установлено, что этот вариант является причиной 1-2% случаев аутосомно-доминантного RP в Северной Америке [51] и имеет частоту 3,5% в большой испанской когорте [37]. Функциональный анализ показал, что отсутствие ДНК-связывания, но конкуренция за образование димеров может объяснять доминантно-негативную активность, проявляемую мутантным белком p.(Gly56Arg) [45]. Кроме того, было обнаружено, что мутантный белок NR2E3 p.(Gly56Arg) демонстрирует in vivo отчетливое межбелковое взаимодействие с CRX, сравнимое с таковым у NR2E3 дикого типа и не похожее на таковое у белков с биаллельными рецессивными вариантами, расположенными в ДНК-связывающем домене [100]. Escher et al. исследовали семью с аутосомно-доминантным RP, обусловленным гетерозиготным вариантом p.(Gly56Arg), в которой два члена семьи, носители сложных гетерозиготных вариантов (p.Gly56Arg/p.Arg311Gln), имели ESCS-подобный фенотип [45]; было высказано предположение, что вариант p.(Arg311Gln) может оказывать благоприятное модифицирующее действие на p.(Gly56Arg) вследствие повышения экспрессии фоторецептор-специфических генов, вызванного нарушением связывания ко-репрессоров.
5. Animal Models
Одной из широко используемых животных моделей NR2E3 является мышь rd7, которая первоначально считалась имеющей рецессивно наследуемую делецию 380 п.н. в кодирующей области Nr2e3, приводящую к сдвигу рамки считывания преждевременного стоп-кодона [101]. Однако позже, в 2006 г., Chen et al. сообщили о 10-кратном увеличении специфического для фоторецепторов транскрипта Nr2e3 длиной 9 кб, который, как оказалось, возникает в результате анти-смысловой вставки длинного вкрапленного ядерного элемента (LINE-1) (или L1) в экзон 5. Эта вставка L1 впоследствии блокирует сплайсинг, что приводит к неполному сплайсингу транскриптов и накоплению мутантного Nr2e3 в ядрах фоторецепторов [102]. Эти мыши страдают прогрессирующей дегенерацией фоторецепторов, начиная с 12 месяцев, и имеют 1,5-2-кратное увеличение числа S-конусов [1]. В возрасте 1 месяца в наружном ядерном слое сетчатки мышей rd7 появляются узоры в виде волн, завитушек и розеток, которые постепенно исчезают между 5 и 16 месяцами [101]. ЭРГ нормальна до 5 месяцев, после чего наблюдается прогрессирующее снижение сигналов как для палочек, так и для колбочек. В возрасте 16 месяцев в сетчатке можно увидеть крапчатый пигмент, а также уменьшение толщины наружного ядерного слоя. Сетчатка этих мышей также включала некоторые клетки, являющиеся промежуточными между палочками и колбочками [1]. Cheng et al. обнаружили, что 50% клеток, экспрессирующих S-опсин у мыши rd7, также экспрессируют Nrl, чего не наблюдается у мышей дикого типа. В сетчатке rd7 клетки, которые должны развиться в палочки, демонстрируют пониженную экспрессию генов, специфичных для палочек (таких как Rho, Gnb1 и Pde6b), и повышенную экспрессию генов, специфичных для колбочек (таких как Opnsw, Gnb3 и Pde6c), по сравнению с диким типом [18].
Недавнее продольное исследование с использованием оптической когерентной томографии в спектральной области (SD-OCT) для сравнения сетчатки мышей rd7 и пациентов с ESCS показало, что прогрессирование заболевания хорошо коррелирует между этими двумя видами, и выявило на сканах пациентов характеристики, которые могут быть эквивалентны завиткам и розеткам, наблюдаемым у мышей [103].
Ранее была создана дополнительная модель мыши с нокаутом Nr2e3 (Nr2e3-/-) путем абляции экзонов 1-6, демонстрирующая фенотип и профиль экспрессии генов, аналогичный мыши rd7 [104]. В последние годы Aisa-Marin и др. с использованием системы CRISPR/Cas9 D10A nickase [2] создали две новые мышиные модели. Аллель Δ27 представляет собой внутрикадровую делецию 27 п.н. в экзоне 8, которая уничтожает домен димеризации, в то время как аллель ΔE8 (полная делеция экзона 8) приводит к образованию только короткой изоформы, в которой отсутствует С-концевая часть LBD, участвующая в репрессорной активности.
В обеих моделях наблюдались инвагинации сетчатки, сходные с розетками, обнаруженными у мыши rd7, однако модель ΔE8 демонстрировала RP-подобный фенотип с прогрессирующей дегенерацией сетчатки, а Δ27 - более ESCS-подобное заболевание с дефектами развития.
Для изучения роли NR2E3 были использованы рыбки данио. Xie et al. использовали CRISPR/Cas9 для создания нокаутной линии nr2e3 с делецией 37 п.н. c.485_521del, вызывающей сдвиг рамки с преждевременным стоп-кодоном (p.Leu162Glnfs*30) [105]. У этих рыб экспрессия родопсина и палочковые фоторецепторы отсутствовали уже через 10 дней после оплодотворения, и в возрасте 6 и 10 месяцев они по-прежнему отсутствовали. Другие гены, специфичные для палочек, такие как gnat1 и pde6b, не экспрессировались ни на уровне мРНК, ни на уровне белка. У этих рыб обнаружена селективная дегенерация L- и M-конусов, причем их наружные сегменты начинают укорачиваться примерно в возрасте 1 месяца. Однако на количество UV- и S-конусов этот вариант, по-видимому, не влияет. Линия рыбок данио nr2e3 Sanger Sa15662, несущая нонсенс-мутацию в экзоне 6 (c.1036A>T, p.[Lys346*]), также демонстрирует отсутствие палочковидных фоторецепторов (рис. 4) (неопубликованные данные).
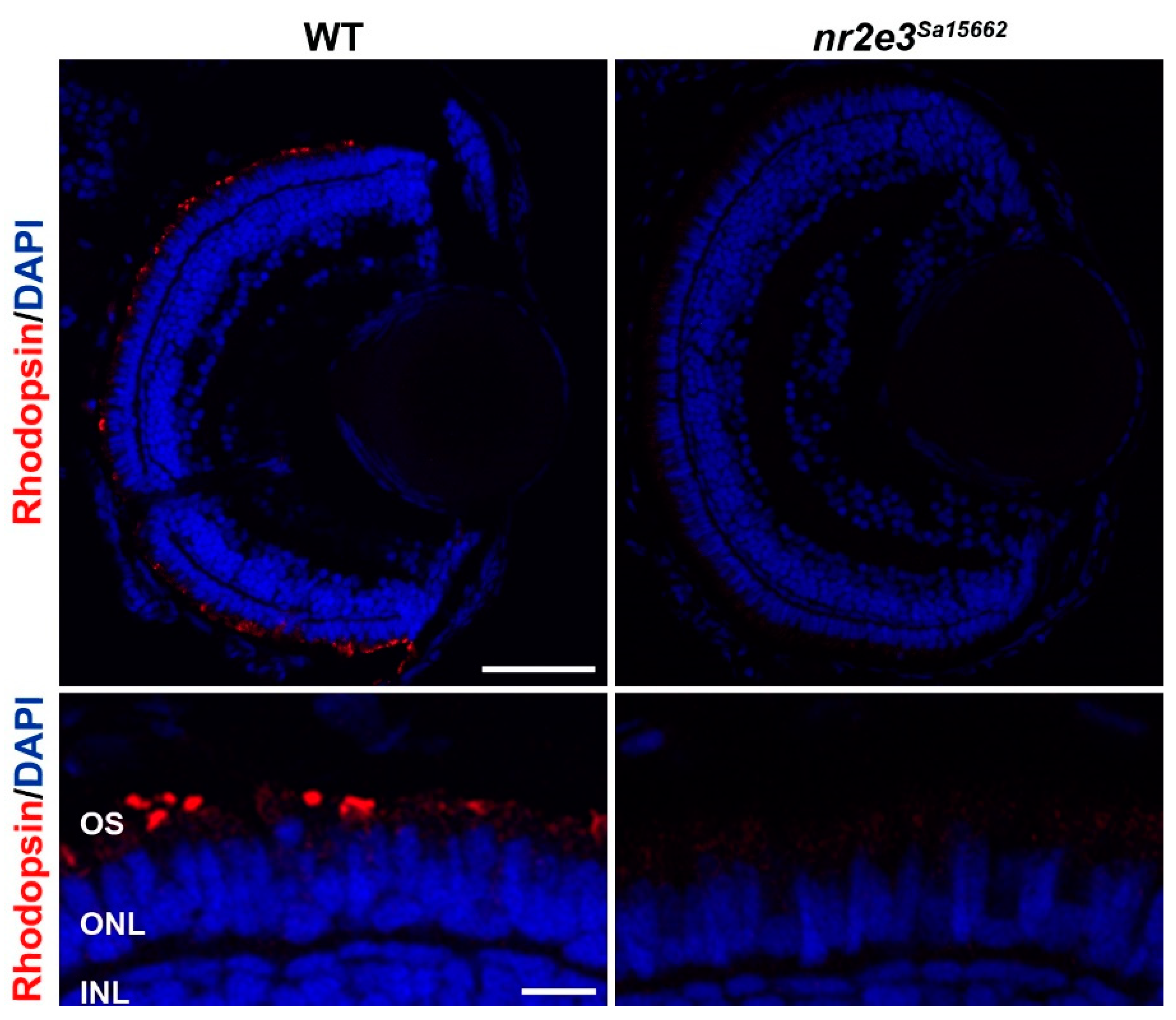
Figure 4. Lack of rod differentiation in nr2e3 mutant zebrafish. Immunohistochemical staining for rhodopsin shows a lack of rod photoreceptors (red) in the nr2e3Sa15662 mutant retina at 5 days post fertilization. Nuclei are counterstained with DAPI (blue). Scale bars are 50 µm (top) and 10 µm (bottom). Retinal layers are indicated: photoreceptor outer segments (OS), outer nuclear layer (ONL), and inner nuclear layer (INL). Image kindly prepared by Dr. Manuela Lahne from Prof. Mariya Moosajee's group.
Как и у человека, экспрессия nr2e3/Nr2e3 у рыбок данио и мышей в основном ограничена фоторецепторами, хотя у рыбок данио экспрессия nr2e3 транзиторно экспрессируется как в палочковых, так и в колбочковых предшественниках во время раннего развития фоторецепторов [105]. За исключением изначально нормальной ЭРГ, модель мыши rd7, по-видимому, достаточно точно фенотипирует пациентов с патогенными вариантами NR2E3 [38]. Модель рыбок данио не столь точно имитирует человеческое заболевание, поскольку в ней не наблюдается увеличения развития S- и UV-конусов. Однако отсутствие развития палочковых клеток и прогрессирующая дегенерация L- и M-конусов напоминают человеческих пациентов с вариантами NR2E3. Различия между пациентами, мышами rd7 и моделями рыбок данио nr2e3, скорее всего, связаны с эволюционной историей палочек и колбочек. Считается, что S-конусы млекопитающих наиболее близки к УФ-конусам teleost, в то время как М-конусы teleost эволюционно ближе к палочкам млекопитающих, чем к колбочкам [11].
6. Treatments
Хотя в настоящее время не существует утвержденных методов лечения первичных генетических дефектов, связанных с NR2E3, несколько стратегий лечения заболеваний сетчатки, связанных с NR2E3, и других наследственных ретинопатий находятся в стадии разработки и уже показали свою перспективность. Стратегия лечения, вероятно, будет зависеть от клинического фенотипа, при этом эффекты развития в спектре ESCS, такие как малое количество или отсутствие палочковых фоторецепторов, представляют собой более сложную задачу, поскольку идеальным окном для терапевтического вмешательства может быть пренатальный период. Напротив, позднее начало RP обеспечивает более длительный и доступный период времени для потенциального вмешательства.
Одним из ведущих направлений лечения многих наследственных заболеваний сетчатки является использование вирусной генотерапии для замены дефектного гена. Начато клиническое испытание фазы 1/2 (NCT05203939) по тестированию генотерапии AAV-NR2E3 (OCU400) у взрослых с аутосомно-рецессивной и доминантной NR2E3-ретинопатией. В основу исследования положена работа Li et al. [26], в которой изучалось использование AAV-векторов для избыточной экспрессии Nr2e3 в 5 различных мышиных моделях RP путем субретинального введения неонатальным мышам или взрослым мышам. Было обнаружено, что этот метод уменьшает дегенерацию сетчатки, вызванную мутациями в нескольких генах, а также в NR2E3, что позволяет рассматривать его как потенциальную терапию широкого спектра действия при различных ретинопатиях. Кроме того, субретинальная доставка Nr1d1 с помощью экспрессионных конструкций позволила ослабить дегенерацию сетчатки у мыши rd7, что еще раз доказывает благотворное влияние генов-модификаторов на прогрессирование заболевания [106]. Интересно, что введение в стекловидное тело антагониста Nr2e3 фоторегулина-1 предотвращает гибель фоторецепторов в мышиных моделях дегенерации палочек Pde6brd1 и RhoP23H [107], причем аналогичные результаты были получены в экспериментах по нокауту Nrl в сетчатке взрослого человека [108]. Это свидетельствует о заметных различиях в роли Nr2e3 в развивающейся и взрослой сетчатке.
Потенциально агностическим подходом к генотерапии пациентов с поздними стадиями RP является использование оптогенетики, предполагающей трансдукцию светочувствительных ионных каналов, называемых канальными родопсинами или родственными фоточувствительными молекулами, которые могут открывать существующие ионные каналы на оставшихся клетках сетчатки, включая ганглиозные и биполярные клетки [109,110]. В настоящее время проводятся клинические испытания (NCT02556736; NCT03326336; NCT04945772). Однако, хотя эти методы и могут в некоторой степени восстановить светочувствительность пациентов, они вряд ли приведут к получению зрения высокого разрешения.
В доклинических условиях для исправления патогенных вариантов NR2E3 в индуцированных плюрипотентных стволовых клетках (iPSC), полученных от двух пациентов с ESCS, использовалось редактирование генов CRISPR/Cas9 с применением стратегии гомологично-направленной репарации (HDR) [111]. Пациент 1 имел гомозиготный вариант сайта сплайсинга c.119-2A>C, а пациент 2 - сложные гетерозиготные варианты p.(Arg73Ser) и p.(Arg311Gln). Они достигли относительно высокой эффективности (~72-83% клонов, прошедших первоначальный скрининг, показали встраивание HDR-кассеты) при минимальном вне-целевом мутагенезе. Поскольку большинство патогенных вариантов NR2E3 представляют собой точечные мутации или небольшие делеции, а не крупные indels или сложные перестройки, CRISPR/Cas9 может быть применим для лечения заболеваний, связанных с NR2E3, в будущем.
Частый аутосомно-доминантный RP-ассоциированный вариант NR2E3, p.(Gly56Arg), был направлен на антисмысловые олигонуклеотиды (AONs), предназначенные для связывания и подавления экспрессии транскриптов мутантной мРНК путем индуцирования расщепления РНКазы-H1 [112]. Перед обработкой AONs клетках RPE-1 избыточно экспрессировали дикий или мутантный NR2E3. Все AONs показали общий нокаут как мутантного, так и дикого типа NR2E3 на уровне мРНК и белка, хотя для большинства AONs наблюдался преимущественный нокаут, специфичный для мутантного белка. Хотя данное исследование показало доступность области для AON-индуцированного нокдауна, необходимы дальнейшие модификации для повышения аллель-специфичности, чтобы обеспечить эффективность этого терапевтического подхода в будущем.
Хотя маловероятно, что описанные генные методы лечения смогут устранить дефекты развития фоторецепторов у взрослых пациентов с заболеванием типа ESCS, NR2E3 продолжает экспрессироваться во взрослой жизни, и усиление его функции или функции генов-модификаторов с помощью таких методов лечения может способствовать поддержанию нормальной функции фоторецепторов и продлению выживаемости. В качестве альтернативы для пациентов с ESCS или поздней стадией RP наиболее подходящим вариантом лечения может стать терапия стволовыми клетками для замещения утраченных фоторецепторов [113,114]. Однако в сетчатке пациентов с дефектами развития имплантированные клетки могут не сформировать правильных синаптических связей.
Хотя в настоящее время не существует утвержденного лечения генетических дефектов, лежащих в основе нарушений NR2E3, связанные с ними осложнения заболевания, такие как гиперметропия и ретиношизис, должны контролироваться и при необходимости лечиться, чтобы уменьшить дальнейшую потерю зрения. Например, макулярный ретиношизис и кистоидный макулярный отек можно эффективно лечить с помощью перорального ингибитора карбоновой ангидразы - ацетазоламида [115,116].
7. Future Perspectives
Несмотря на разнообразие исследований, посвященных изучению NR2E3 и его роли в развивающейся и зрелой сетчатке, в наших представлениях все еще имеются существенные пробелы. Высокий уровень гетерогенности заболевания, особенно среди пациентов с рецессивными мутациями, свидетельствует о сложных взаимодействиях этого гена, которые еще предстоит изучить. Необходимо более глубокое понимание механизмов, лежащих в основе заболевания, и корреляций между генотипом и фенотипом, чтобы лучше обосновать генетическое консультирование и наиболее эффективные подходы к лечению. Дальнейшему изучению функции NR2E3 будет способствовать использование iPSCs, которые уже были получены от пациентов с патогенными вариантами NR2E3. Органоиды сетчатки, полученные из iPSCs, воспроизводят улучшенный фенотип S-конусов и используются для терапевтических исследований in vitro [111,117-119]. Для моделирования заболеваний in vivo система CRISPR/Cas9 может быть использована для создания животных моделей более высокого порядка, несущих специфические мутации, что может способствовать проведению доклинических терапевтических работ. В последние годы было отмечено, что NR2E3 является важным модификатором заболеваний сетчатки, и, помимо лечения пациентов с NR2E3-связанными заболеваниями, добавление гена NR2E3 может быть использовано в качестве терапии широкого спектра при различных других ретинопатиях, что особенно перспективно для значительной части пациентов, которым до сих пор не поставлен молекулярный диагноз.
|



 Figure 4. Lack of rod differentiation in nr2e3 mutant zebrafish. Immunohistochemical staining for rhodopsin shows a lack of rod photoreceptors (red) in the nr2e3Sa15662 mutant retina at 5 days post fertilization. Nuclei are counterstained with DAPI (blue). Scale bars are 50 µm (top) and 10 µm (bottom). Retinal layers are indicated: photoreceptor outer segments (OS), outer nuclear layer (ONL), and inner nuclear layer (INL). Image kindly prepared by Dr. Manuela Lahne from Prof. Mariya Moosajee's group.
Figure 4. Lack of rod differentiation in nr2e3 mutant zebrafish. Immunohistochemical staining for rhodopsin shows a lack of rod photoreceptors (red) in the nr2e3Sa15662 mutant retina at 5 days post fertilization. Nuclei are counterstained with DAPI (blue). Scale bars are 50 µm (top) and 10 µm (bottom). Retinal layers are indicated: photoreceptor outer segments (OS), outer nuclear layer (ONL), and inner nuclear layer (INL). Image kindly prepared by Dr. Manuela Lahne from Prof. Mariya Moosajee's group.