Дефекты в сложном процессе морфогенеза сердца лежат в основе врожденных пороков сердца (ВПС), которые встречаются у 1 из 100 новорожденных [1]. Сердце происходит из мезодермы, центрального из трех эмбриональных зародышевых листков, и зарождается в передней части раннего эмбриона как трубчатая структура с венозным (приток) и артериальным (отток) полюсами. Сердечные клетки предшественники, расположенные в splanchnic мезодерме, над будущей эндодермой передней кишки, постепенно способствуют росту сердца. Эти клетки, известные как второе поле сердца (SHF), в конечном итоге дают начало миокарду желудочковой перегородки, правого желудочка и отводящих путей на артериальном полюсе и миокарду предсердий, включая миокард межпредсердной перегородки, на венозном полюсе. Развертывание клеток SHF совпадает с морфогенезом петли сердца - важным консервативным процессом, во время которого сердечная трубка поворачивается вправо, чтобы правильно расположить будущие области окончательного сердца. Последующие этапы развития сердца включают пролиферацию кардиомиоцитов, стимулирующую морфогенез камер, развитие коронарных артерий и системы сердечной проводимости, координирующей сердечный ритм, и разделение сердца. Во время септации в результате формирования желудочковой и предсердной перегородок образуется четырехкамерное сердце, а эмбриональный тракт оттока делится на отводящие пути левого и правого желудочков, восходящую аорту и легочный ствол. Таким образом, первоначально трубчатое эмбриональное сердце приобретает независимые правое атриовентрикулярное и левое вентрикулоартриальное соединения. Сепарация сердца завершается при рождении, когда легочный проток и межпредсердное отверстие закрываются, совпадая с легочной перфузией, изолируя легочный и системный круги кровообращения.
Удлинение сердечной трубки путем добавления клеток SHF создает шаблон для сердечной септации, и поэтому нарушение развертывания SHF у пациентов и животных приводит к спектру распространенных форм ВПС [2, 3]. Они включают дефекты межжелудочковой и межпредсердной перегородки, а также дефекты оттока или конотрункулярные дефекты и приводят к невозможности правильного разделения системного и легочного кровообращения. Таким образом, изучение программ развития, определяющих нормальное развертывание клеток предшественников сердца, необходимо для понимания того, как дефекты в этих процессах приводят к ВПС, а также для направления кардиомиоцитов, полученных из стволовых клеток, на приобретение различных региональных судеб для тестирования лекарств и восстановления тканей после повреждения сердца. Здесь мы рассматриваем вклад SHF в развитие сердца и его участие в ВПС, уделяя особое внимание роли двух факторов транскрипции T-box, связанных с ВПС у человека, TBX1 и TBX5.
2. Early heart development and the second heart field
Зарождающиеся мезодермальные клетки-предшественники сердца выходят из примитивной полоски во время гаструляции и мигрируют в передне-боковую область эмбриона (рис. 1А). Были выявлены две различные волны в клетках предшественниках, которые независимо активируют ген, кодирующий ранний мезодермальный транскрипционный фактор MESP1 [4-6]. Первая волна генерирует клетки-предшественники первого сердечного поля (FHF), которые дифференцируются и формируют двусторонние сердечные примордии, сходящиеся в вентральной средней линии по мере закрытия передней кишки, давая начало сердечному полумесяцу и в конечном итоге миокарду левого желудочка и предсердия.
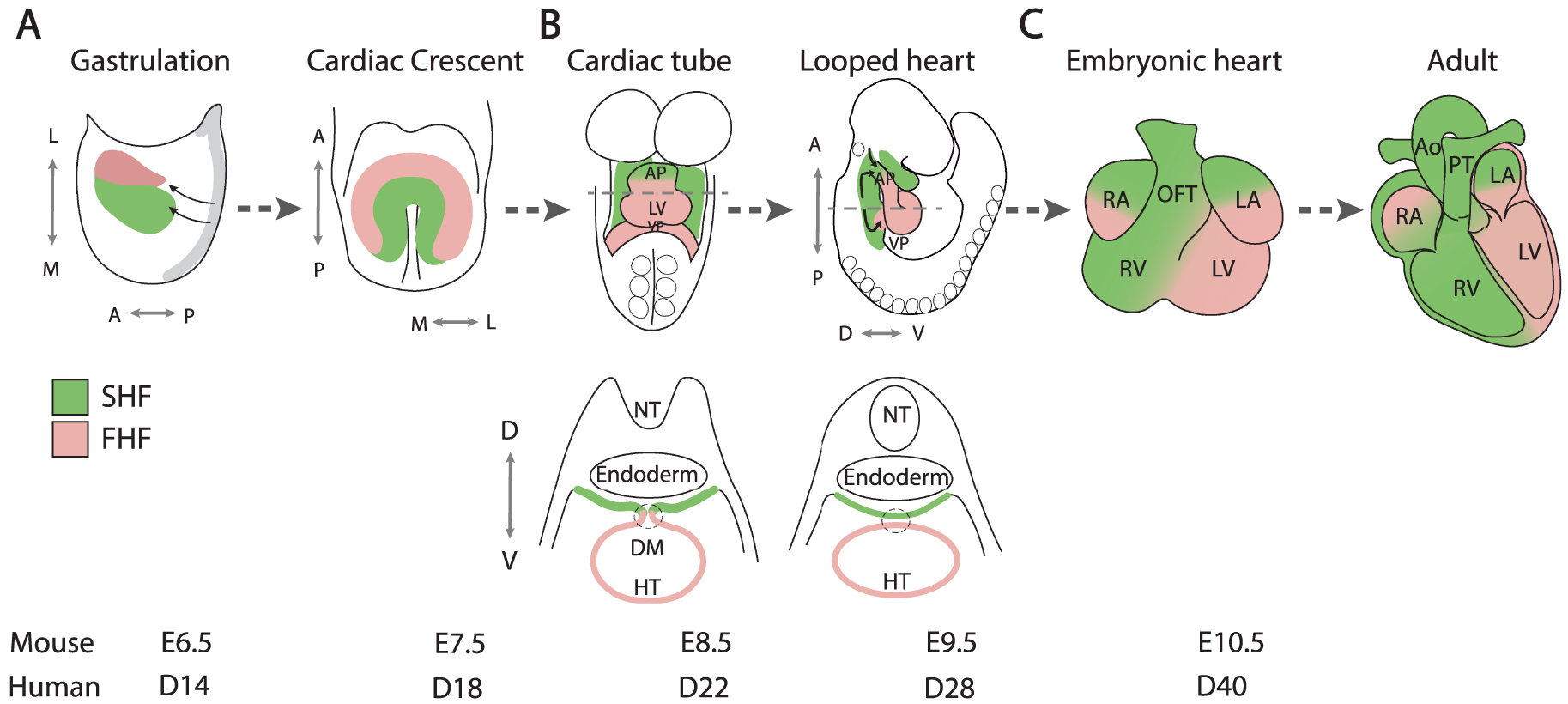
Figure 1.
Cardiac development. Cartoon showing the contribution of first (pink) and second (green) heart field progenitor cells to the developing mouse heart. (A) Heart tube morphogenesis, (B) heart tube looping and elongation and (C) chamber growth and cardiac septation. FHF, first heart field; SHF, second heart field; L, lateral; M, medial; A, anterior; P, posterior; D, dorsal; V, ventral; AP, arterial pole; VP, venous pole; HT, heart tube; RA, right atrium; LA, left atrium; RV, right ventricle; LV, left ventricle; NT, neural tube; DM, dorsal mesocardium; OFT, outflow tract; Ao, aorta; PT, pulmonary trunk; E: mouse embryonic day, D: human embryonic day.
Сердечный полумесяц трансформируется в переходную линейную сердечную трубку, которая впоследствии удлиняется и образует петлю вправо, формируя эмбриональное сердце в середине беременности у мыши, что соответствует 5-й неделе развития человека (рис. 1B). Удлинение сердечной трубки происходит за счет постепенного добавления клеток SHF, полученных в результате второй волны экспрессии Mesp1, расположенных в фарингеальной мезодерме дорсомедиально к ранней сердечной трубке, включая дорсальную стенку перикардиальной полости [5]. Впервые SHF был идентифицирован в 2001 году в результате анализа трансгена-ловушки энхансера Fgf10, экспрессирующегося в фарингеальной мезодерме мыши [7], и экспериментов по маркировке клеток у птичьих эмбрионов [8, 9]. Эти результаты были основаны на первых эмбриологических данных о добавлении экстракардиальных клеток к растущим сердечным столбам [10, 11]. Изначально клетки распределялись по всей длине сердечного примордия, но после разрушения дорсального мезокарда, отделяющего сердечную трубку от дорсальной перикардиальной стенки, добавление SHF стало ограничиваться артериальным и венозным полюсами (рис. 1B). Генетическое отслеживание и ретроспективные эксперименты по изучению линий показали, что первое и второе поля сердца соответствуют отдельным генетическим линиям, определяемым их исключительным вкладом в развитие путей оттока и левого желудочка соответственно, и что клетки предшественники SHF, добавляющиеся к артериальному и венозному полюсам, являются клонально родственными [12-14]. Последующие эксперименты по маркировке и генетический анализ линий выявили прогрессивное добавление клеток-предшественников SHF к удлиняющейся сердечной трубке, дающее начало последовательному правому желудочку, проксимальному и дистальному оттоку, миокарду предсердий, а также гладкомышечным клеткам легочного ствола (рис. 1С) [15-18]. Были установлены клональные связи между этими субпопуляциями SHF и бранхиомерными скелетными мышцами головы и шеи, что согласуется с существованием общих клеток-предшественников сердечной и скелетной мышц в мезодерме глотки [19-22]. Это подтверждается недавней идентификацией многолинейных клеток предшественников, способствующих развитию скелетных мышц и миокарда, с помощью анализа РНК-секвенирования одиночных клеток [23]. Этот революционный подход позволил получить беспрецедентные сведения о гетерогенности и траекториях развития популяций клеток предшественников сердца [24]. Среди них - идентификация популяции клеток FHF, названной юкстакардиальным полем, расположенной на латеральной границе между эмбрионом и вне-эмбриональной мезодермой, которая способствует росту раннего сердечного примордия вдоль его вентролатерального края, в отличие от вклада SHF вдоль дорсомедиального края [25-27]. Одноклеточная транскриптомика также выявила различия в экспрессии генов между левыми и правыми клетками SHF, что согласуется с недавним выводом о том, что SHF является движущей силой морфогенеза петли [28, 29]. Дефекты в петлеобразовании сердца или в предварительном установлении эмбриональной латеральности были связаны со спектром ВПС [29, 30]. Динамическая визуализация с помощью двухфотонной и лазерной сканирующей флуоресцентной микроскопии позволила подтвердить траектории, по которым движутся клетки-предшественники сердца во время роста раннего сердца. Эти эксперименты выявили временную задержку между развертыванием клеток первого и второго сердечных полей и различные модели поведения клеток в юкстакардиальном и втором сердечных полях во время сборки сердечной трубки [6, 31]. Кроме того, количественные морфометрические методы позволяют с высоким разрешением понять сложные события, связанные с ранним развитием сердца [32].
3. TBX1 and arterial pole development
Клетки предшественники, добавляющиеся к артериальному полюсу сердца, известному как переднее SHF, дают начало миокарду правого желудочка и отводящего тракта. По мере того как эти клетки сближаются с растущим артериальным полюсом, они проходят через переходную зону, в которой экспрессия генов клеток предшественников снижается, а дифференцировка миокарда активируется (рис. 2А) [33, 34]. В то время как отсутствие развертывания SHF приводит к тяжелым ранним летальным фенотипам, более легкие дефекты этого процесса приводят к образованию слишком короткого тракта оттока, который не позволяет нормально выровнять левый желудочек и восходящую аорту во время септации сердца. Следовательно, дефекты передней части SHF способствуют развитию конотрункулярных ВПС, которые составляют 30% ВПС, начиная от частичного вентрикулоатриального несоответствия, как в случае переориентированной аорты и тетралогии Фалло, и заканчивая двойным выходом из правого желудочка (рис. 2B). Дефект роста восходящей аорты также был связан с транспозицией больших артерий [35].
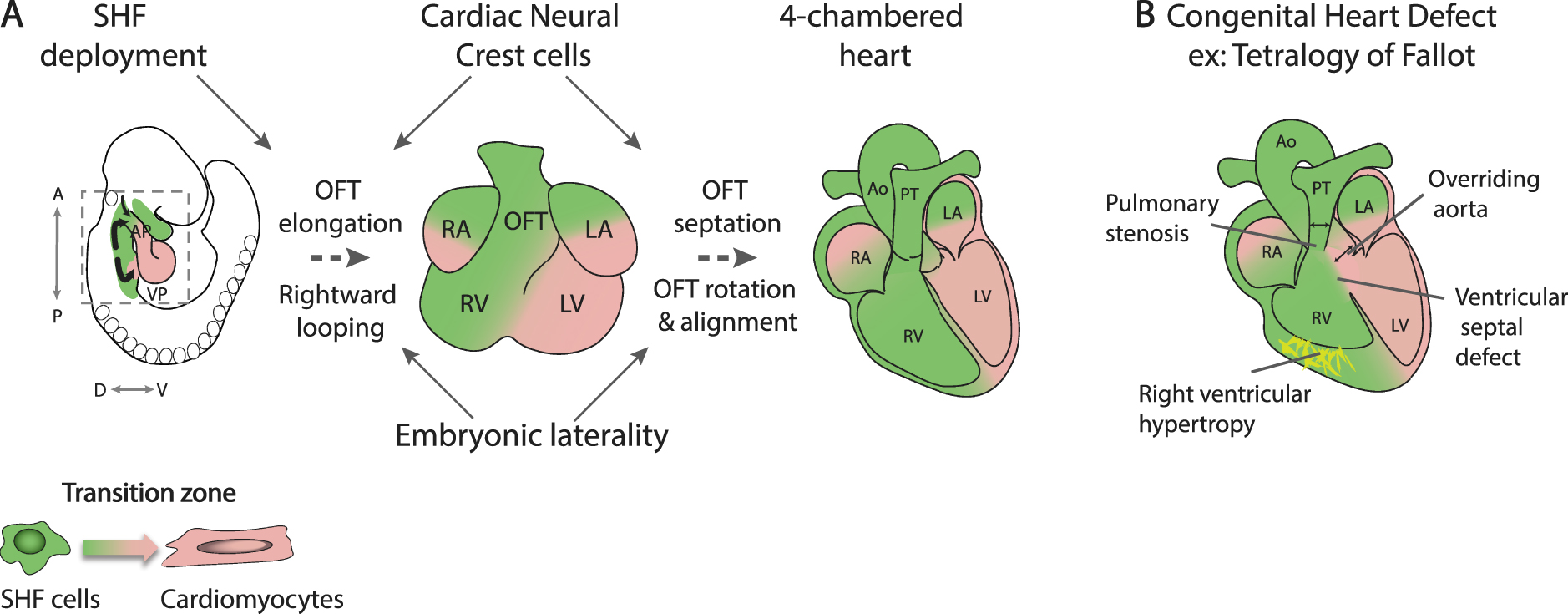
Figure 2.
Arterial pole development and outflow tract septation. (A) While SHF cells contribute to the myocardial wall of the outflow tract at the transition zone, SHF addition is regulated by cardiac neural crest cells that also mediate outflow tract septation. Embryonic laterality impacts on rightward looping and ventriculoarterial alignment. (B) An example of a conotruncal congenital heart defect, tetralogy of Fallot. SHF, Second heart field; AP, arterial pole; VP, venous pole; A, Anterior; P, Posterior; D, Dorsal; V, ventral; RA, right atrium; LA, left atrium; RV, right ventricle; LV, left ventricle; OFT, outflow tract; Ao, aorta; PT, pulmonary trunk.
Работы многих групп по всему миру выявили критические транскрипционные регуляторы, межклеточные сигнальные пути и эпителиальные особенности, которые поддерживают статус клеток предшественников SHF и регулируют прогрессивную дифференцировку на полюсах сердца [36-39]. Помимо экспрессии Fgf10, SHF-клетки демаркируются экспрессией транскрипционных факторов ISL1, TBX1 и энхансера из локуса Mef2c [7, 15, 16, 40]. Эти транскрипционные факторы объединяют активность сигнальных событий, включая аутокринную сигнализацию из фарингеальной мезодермы, а также обмен сигналами с окружающими типами клеток, в частности с прилегающей вентральной фарингеальной эндодермой и производными мезенхимы нервного гребня. Удлинение сердечной трубки регулируется балансом между способствующими пролиферации сигналами FGF и способствующими дифференцировке сигналами BMP; экспрессия FGF10 в SHF, например, действует вместе с FGF8 для контроля развития артериального полюса [41]. По мере дифференцировки клеток SHF в переходной зоне экспрессия Fgf10 снижается под действием NKX2-5, который блокирует ISL1-опосредованную активацию интронного энхансера Fgf10 [42]. Было показано, что клетки SHF в дорсальной стенке перикарда представляют собой атипичный эпителий с апикальными плотными и слипчивыми соединениями и высокодинамичными базальными филоподиями, более характерными для мезенхимных клеток [43]. Эпителиальные свойства клеток SHF становятся важным регуляторным узлом, контролирующим развертывание SHF, и регулируются молекулами клеточной адгезии и компонентами пути плоскостной клеточной полярности, такими как WNT5A и VANGL2, а также TBX1, необходимым для фокальной адгезии и филоподиальной активности в SHF [33, 38, 43, 44]. Более того, анализ апикальных стыков, формы клеток и распределения актомиозина в SHF позволил предположить биомеханические модели, определяющие развертывание SHF, включая механизмы подталкивания и притяжения, обусловленные плоскостной клеточной полярностью, а также эпителиальную схему натяжения, способствующую пролиферации в задней области дорсальной стенки перикарда [45, 46].
Клетки сердечного нервного гребня, как и SHF, перемещаются через глоточную область в развивающийся артериальный полюс сердца, играя важную роль в разделении эмбрионального тракта оттока на легочный ствол и восходящую аорту [47]. Таким образом, устранение клеток нервного гребня приводит к сохранению общего артериального ствола из-за нарушения септации тракта оттока; абляция клеток сердечного нервного гребня также приводит к укорочению тракта оттока за счет уменьшения области развертывания SHF (рис. 2А) [48, 49]. Это наблюдение на птичьих эмбрионах было одним из первых, показавших значимость добавления SHF для петлеобразования сердца и выстраивания тракта оттока. Эти фенотипы отражают обмен сигналами между SHF и клетками нервного гребня, когда они сходятся на артериальном полюсе сердца, организуя нормальное удлинение путей оттока. Т-боксный транскрипционный фактор TBX1 был идентифицирован как критический регулятор развития SHF, способствующий пролиферации клеток предшественников и задерживающий дифференцировку в SHF [40]. TBX1 является основным геном, связанным с делецией 22q11.2 или синдромом Ди Джорджа, характеризующимся черепно-лицевыми и сердечно-сосудистыми дефектами, включая различные конотрункулярные ВПС [50, 51]. На одиночных клетках РНК-секвенирующие эксперименты показали, что Tbx1 контролирует миогенные траектории от многолинейной популяции прародительских клеток к судьбам сердечной и скелетной мышц [23].
У эмбрионов с нулевым Tbx1 наблюдается общий артериальный ствол, связанный с дефектом развития клеток нервного гребня сердца; кроме того, клетки, дающие начало миокарду у основания легочного ствола, выходного отверстия правого желудочка, не вносят вклад в артериальный полюс сердца мутантов Tbx1 [40, 52, 53]. Недоразвитие субпульмонального миокарда было предложено в качестве основного механизма, приводящего к тетралогии Фалло [54]. Действительно, тетралогия Фалло генетически неоднородна, но основной известной генетической причиной является гаплонедостаточность TBX1, 22q11.2 DS, составляющая более 15 % пациентов [50]. Более того, устранение SHF у птичьих эмбрионов приводит к фенотипу, сходному с тетралогией Фалло [55]. Различные генетические программы были определены в сублегочном и субаортальном миокарде, что отражает более ранние различия в распределении клеток предшественников в SHF; недавно было показано, что Pparg и Dlk1 демаркируют сублегочный и субаортальный миокард соответственно [53, 56, 57]. Будущий субпульмональный миокард, первоначально расположенный в нижней стенке среднего отводящего тракта, во время септации отводящего тракта становится расположенным вентрально за счет вращения стенки миокарда против часовой стрелки под действием продолжающегося добавления клеток SHF (рис. 2А) [58, 59].
Генетические исследования выявили мутации, ассоциированные со спорадическими и семейными ВПС, включая мутации в генах, кодирующих факторы транскрипции T-box и регуляторы хроматина [60]. В качестве примера можно привести TBX1 и CHD7, последний из которых вовлечен в сердечно-сосудистые дефекты, связанные с синдромом CHARGE. CHD7 - это АТФ-зависимый реконструирующий хроматин регулятор, необходимый для нормального вклада линий нервного гребня и SHF в развитие сердца, включая регуляцию экспрессии Fgf10 в SHF через интронный энхансер, связанный с ISL1 [61]. Интеграция генетических исследований с набором данных РНК-секвенирования одиночных клеток может дать дополнительные сведения о механизме, и, например, показала важность клеток предшественников отводящих путей при тетралогии Фалло [62]. Однако на сегодняшний день генетические дефекты составляют лишь одну треть случаев ВПС, что позволяет предположить важное, но малоизученное влияние внутриутробного воздействия факторов окружающей среды. Действительно, недавние исследования на мышах выявили, что SHF является мишенью кратковременной гипоксии беременности, материнского дефицита железа и пренатального воздействия алкоголя, что в каждом случае приводит к снижению развертывания клеток-предшественников SHF и укорочению OFT, в результате чего развивается ряд конотрункулярных ВПС [63, 64, 65].
4. TBX5 and cardiac septation
Эксперименты по маркировке красителями и генетическому отслеживанию линий показали, что субпульмональный миокард берет начало из
Hoxb1-экспрессирующих клеток в заднелатеральной области дорсальной стенки перикарда, что соответствует расположению пролиферативных многолинейных клеток предшественников [23, 53, 66]. Снижение экспрессии
Hoxb1 необходимо для нормального развития артериального полюса и правого желудочка [67]. Сердечные клетки предшественники генетических линий
Isl1, Hoxb1, Tbx1, Wnt5a и Mef2c enhancer способствуют развитию не только артериального, но и венозного полюса сердца, внося критический вклад в формирование структур предсердной перегородки, включая первичную предсердную перегородку и дорсальный мезенхимный выступ, который соединяет предсердную перегородку с атриовентрикулярными подушками (рис. 3А) [53, 67-70]. Дефекты развития дорсального мезенхимального выступа приводят к дефектам межпредсердной перегородки типа primum - одному из классов дефектов атриовентрикулярной перегородки [71].
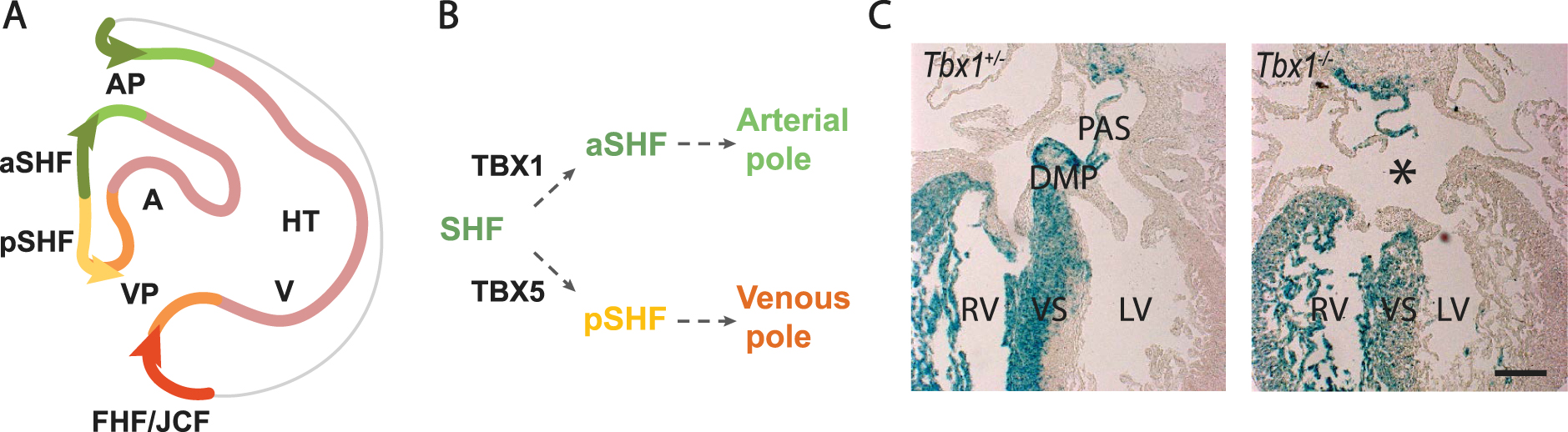
Figure 3.
Venous pole development and atrial septation. (A) Scheme of the region boxed in Figure 2A, showing progenitor cell segregation into anterior SHF (aSHF) and posterior SHF (pSHF) domains contributing to the arterial and venous poles. Note the contribution of first heart field (FHF) cells from the juxtacardiac field (JCF) to the venous pole. (B) Diagram showing that Tbx1 expression is maintained in the aSHF, while Tbx5 is activated in the pSHF. (C) Left: the SHF genetic lineage (blue) labelled by a conditional ?-galactosidase reporter gene activated by Cre recombinase in the SHF, showing labeling in the right ventricle (RV), interventricular septum (VS) and atrial septal structures: the primary atrial septum (PAS) and dorsal mesenchymal protrusion (DMP). Right: the DMP fails to form in Tbx1 mutant hearts resulting in a primum type atrial septal defect (asterisk). AP, arterial pole; VP, venous pole; A, atrium; V, ventricle; RV, right ventricle; LV, left ventricle; HT, heart tube. Scale bar in C: 100 µm
В отличие от передней части SHF, который сохраняет раннюю генетическую программу SHF, клетки задней части SHF активируют Tbx5, ключевой регулятор программы дифференцировки FHF и венозного полюса, под влиянием сигнализации ретиноевой кислоты [72, 73]. Уровень Tbx5 повышается в TBX1-позитивной фарингеальной мезодерме по мере разрушения дорсального мезокарда и сегрегации клеток предшественников к альтернативным полюсам (рис. 3B). Переходная совместная экспрессия TBX1 и TBX5 сопровождается снижением регуляции программы передней части SHF и установлением транскрипционной границы в дорсальной стенке перикарда, отделяющей TBX1-позитивные предшественники артериального полюса в переднем SHF от TBX5-позитивных предшественников венозного полюса в медиальном заднем SHF [73]. Мутации в TBX5 приводят к синдрому Холта-Орама, характеризующемуся ВПС межпредсердной перегородки и дефектами передних конечностей [74]. Недавно было показано, что TBX5 активирует энхансер Aldh1a2, кодирующий фермент биосинтеза ретиноевой кислоты, что указывает на механизм обратной связи между TBX5 и сигналом ретиноевой кислоты по мере формирования заднего домена SHF в дорсальной стенке перикарда [75]. Граница между передним и задним доменами нарушается в отсутствие Tbx1, что приводит к нарушению развития дорсального мезенхимного выступа и дефектам межпредсердной перегородки у 30 % эмбрионов с нулевым Tbx1, это потенциально объясняет низкую частоту дефектов межпредсердной перегородки у пациентов с DS 22q11.2 (рис. 3C) [53]. Аналогичные дефекты межпредсердной перегородки наблюдаются у условно мутантных эмбрионов мышей, лишенных Tbx5 в SHF [76]. Задняя часть SHF имеет общие линии с легочной мезенхимой, и обмен сигналами между SHF и соседней легочной эндодермой играет важную роль в развитии венозного полюса [75, 77]. TBX5 активирует экспрессию лигандов Wnt в задней части SHF, которые передают сигналы легочной эндодерме, в свою очередь контролируя время дифференцировки в заднем SHF через сигнальный путь Hedgehog [78, 79].
Клетки, экспрессирующие как Tbx5, так и программу SHF, также были идентифицированы в области межжелудочковой перегородки с использованием подхода, основанного на репортерах пересекающихся линий [4]. Условная инактивация с помощью рекомбиназы Cre, управляемой энхансером Mef2c, показала, что Tbx5 необходим в линии SHF для формирования мышечной желудочковой перегородки, а также для образования перегородки предсердий [76, 80]; более того, транскрипционные факторы MEF2C и TBX5 кореллируют гены-мишени, необходимые для развития желудочковой перегородки [81]. Таким образом, структуры предсердной и межжелудочковой перегородок формируются в местах, где экспрессия Tbx5 и программа SHF транзиторно перекрываются, это позволяет предположить, что это определяет пограничную программу в развивающемся сердце, необходимую для запуска морфогенеза перегородки. На предсердную и желудочковую ВПС приходится более 50 % ВПС [82]. Дальнейшее изучение этой регуляторной программы, действующей на границе между областями сердца, будет иметь большое значение для углубления нашего понимания происхождения ВПС перегородки.
5. Conclusions and perspectives
С момента открытия SHF было получено множество доказательств важности этой пространственно-временной гетерогенной популяции клеток предшественников в этиологии ВПС, влияющей на развитие сердечных полюсов и перегородок. В то время как серьезные дефекты удлинения сердечной трубки приводят к ранней эмбриональной летальности, более легкие нарушения образования клеток на полюсах сердца приводят к дефектам несовпадения и неспособности разделить системное и легочное кровообращение при рождении, способствуя развитию спектра распространенных форм ВПС, встречающихся у пациентов. Технологические достижения, такие как одноклеточная транскриптомика и количественные морфометрические подходы, а также динамическая визуализация и создание различных моделей органоидов сердца, полученных из стволовых клеток, позволяют получить новое представление о регуляции развития ВПС [31, 83]. Текущие задачи включают выяснение регуляторных сетей, контролирующих различные субпопуляции SHF, вовлеченные в ВПС, определение путей, влияющих на региональный морфогенез сердца и сердечную перегородку, а также раскрытие механизмов болезни, посредством которых генетические и экологические факторы взаимодействуют в SHF и вызывают ВПС.
 Figure 1.
Cardiac development. Cartoon showing the contribution of first (pink) and second (green) heart field progenitor cells to the developing mouse heart. (A) Heart tube morphogenesis, (B) heart tube looping and elongation and (C) chamber growth and cardiac septation. FHF, first heart field; SHF, second heart field; L, lateral; M, medial; A, anterior; P, posterior; D, dorsal; V, ventral; AP, arterial pole; VP, venous pole; HT, heart tube; RA, right atrium; LA, left atrium; RV, right ventricle; LV, left ventricle; NT, neural tube; DM, dorsal mesocardium; OFT, outflow tract; Ao, aorta; PT, pulmonary trunk; E: mouse embryonic day, D: human embryonic day.
Figure 1.
Cardiac development. Cartoon showing the contribution of first (pink) and second (green) heart field progenitor cells to the developing mouse heart. (A) Heart tube morphogenesis, (B) heart tube looping and elongation and (C) chamber growth and cardiac septation. FHF, first heart field; SHF, second heart field; L, lateral; M, medial; A, anterior; P, posterior; D, dorsal; V, ventral; AP, arterial pole; VP, venous pole; HT, heart tube; RA, right atrium; LA, left atrium; RV, right ventricle; LV, left ventricle; NT, neural tube; DM, dorsal mesocardium; OFT, outflow tract; Ao, aorta; PT, pulmonary trunk; E: mouse embryonic day, D: human embryonic day.
 Figure 2.
Arterial pole development and outflow tract septation. (A) While SHF cells contribute to the myocardial wall of the outflow tract at the transition zone, SHF addition is regulated by cardiac neural crest cells that also mediate outflow tract septation. Embryonic laterality impacts on rightward looping and ventriculoarterial alignment. (B) An example of a conotruncal congenital heart defect, tetralogy of Fallot. SHF, Second heart field; AP, arterial pole; VP, venous pole; A, Anterior; P, Posterior; D, Dorsal; V, ventral; RA, right atrium; LA, left atrium; RV, right ventricle; LV, left ventricle; OFT, outflow tract; Ao, aorta; PT, pulmonary trunk.
Figure 2.
Arterial pole development and outflow tract septation. (A) While SHF cells contribute to the myocardial wall of the outflow tract at the transition zone, SHF addition is regulated by cardiac neural crest cells that also mediate outflow tract septation. Embryonic laterality impacts on rightward looping and ventriculoarterial alignment. (B) An example of a conotruncal congenital heart defect, tetralogy of Fallot. SHF, Second heart field; AP, arterial pole; VP, venous pole; A, Anterior; P, Posterior; D, Dorsal; V, ventral; RA, right atrium; LA, left atrium; RV, right ventricle; LV, left ventricle; OFT, outflow tract; Ao, aorta; PT, pulmonary trunk.
 Figure 3.
Venous pole development and atrial septation. (A) Scheme of the region boxed in Figure 2A, showing progenitor cell segregation into anterior SHF (aSHF) and posterior SHF (pSHF) domains contributing to the arterial and venous poles. Note the contribution of first heart field (FHF) cells from the juxtacardiac field (JCF) to the venous pole. (B) Diagram showing that Tbx1 expression is maintained in the aSHF, while Tbx5 is activated in the pSHF. (C) Left: the SHF genetic lineage (blue) labelled by a conditional ?-galactosidase reporter gene activated by Cre recombinase in the SHF, showing labeling in the right ventricle (RV), interventricular septum (VS) and atrial septal structures: the primary atrial septum (PAS) and dorsal mesenchymal protrusion (DMP). Right: the DMP fails to form in Tbx1 mutant hearts resulting in a primum type atrial septal defect (asterisk). AP, arterial pole; VP, venous pole; A, atrium; V, ventricle; RV, right ventricle; LV, left ventricle; HT, heart tube. Scale bar in C: 100 µm
Figure 3.
Venous pole development and atrial septation. (A) Scheme of the region boxed in Figure 2A, showing progenitor cell segregation into anterior SHF (aSHF) and posterior SHF (pSHF) domains contributing to the arterial and venous poles. Note the contribution of first heart field (FHF) cells from the juxtacardiac field (JCF) to the venous pole. (B) Diagram showing that Tbx1 expression is maintained in the aSHF, while Tbx5 is activated in the pSHF. (C) Left: the SHF genetic lineage (blue) labelled by a conditional ?-galactosidase reporter gene activated by Cre recombinase in the SHF, showing labeling in the right ventricle (RV), interventricular septum (VS) and atrial septal structures: the primary atrial septum (PAS) and dorsal mesenchymal protrusion (DMP). Right: the DMP fails to form in Tbx1 mutant hearts resulting in a primum type atrial septal defect (asterisk). AP, arterial pole; VP, venous pole; A, atrium; V, ventricle; RV, right ventricle; LV, left ventricle; HT, heart tube. Scale bar in C: 100 µm