Пользователи: 
МИКРОГЛИЯ, ХАРАКТЕРИСТИКИ
Причины или последствия связанных с микроглией нарушений головного мозга
Microglia Signatures: A Cause or Consequence of Microglia-Related Brain Disorders? Alessandra Mirarchi ,Elisabetta Albi and Cataldo Arcuri
 Int. J. Mol. Sci. 2024, 25(20), 10951; https://doi.org/10.3390/ijms252010951
|
Microglia signatures refer to distinct gene expression profiles or patterns of gene activity that are characteristic of microglia. Advances in gene expression profiling techniques, such as single-cell RNA sequencing, have allowed us to study microglia at a more detailed level and identify unique gene expression patterns that are associated, but not always, with different functional states of these cells. Microglial signatures depend on the developmental stage, brain region, and specific pathological conditions. By studying these signatures, it has been possible to gain insights into the underlying mechanisms of microglial activation and begin to develop targeted therapies to modulate microglia-mediated immune responses in the CNS. Historically, the first two signatures coincide with M1 pro-inflammatory and M2 anti-inflammatory phenotypes. The first one includes upregulation of genes such as CD86, TNF-?, IL-1?, and iNOS, while the second one may involve genes like CD206, Arg1, Chil3, and TGF-?. However, it has long been known that many and more specific phenotypes exist between M1 and M2, likely with corresponding signatures. Here, we discuss specific microglial signatures and their association, if any, with neurodegenerative pathologies and other brain disorders.

|
Микроглия, паренхимные макрофаги головного мозга, играет ключевую роль в физиологическом функционировании центральной нервной системы (ЦНС) и в различных неврологических заболеваниях, включая инсульт, опухоли мозга, болезнь Альцгеймера (AD) и amyotrophic lateral sclerosis (ALS) [1,2]. Помимо их традиционной роли в иммунном надзоре и очистке от клеточного мусора, последние исследования выявили их активное участие в формировании нейронного развития. Микроглия влияет на такие процессы, как нейрогенез и обрезка синапсов, тем самым способствуя тонкой настройке архитектуры мозга [3-7].
Несмотря на их значение как многозадачных клеток, в наших знаниях существует значительный пробел в отношении молекулярного разнообразия микроглии в нормальных физиологических условиях. Этот пробел особенно заметен на этапах развития, когда микроглия выполняет жизненно важные не-иммунные функции.
Кроме того, микроглия имеет транскриптомное сходство с другими миелоидными клетками, которые могут инфильтрировать паренхиму мозга при заболеваниях [8,9]. Поэтому крайне важно провести систематическое сравнение микроглии с этими родственными иммунными клетками, чтобы лучше понять их отличительные характеристики и функции, особенно в контексте неврологического здоровья и болезни.
Микроглия, как и многие другие тканевые макрофаги, отличается своей долгоживущей, само-обновляющейся природой, происходящей из эритро-миелоидных предшественников в желточном мешке [4,10,11]. У мышей микроглия мигрирует в мозг примерно на 9-й эмбриональный день (E9), и предполагается, что закрытие гематоэнцефалического барьера (BBB) около E13.5 служит для удержания микроглии в паренхиме мозга [12]. Несмотря на столь сложный путь развития, исследования с использованием данных объемного секвенирования РНК (RNA-seq) позволили выявить поэтапную программу дифференцировки микроглии [13]. Однако эти исследования часто опираются на общие поверхностные маркеры, потенциально упуская гетерогенность микроглии, включая переходные популяции во время развития, что может привести к недооценке сложности развития микроглии.
Кроме того, хотя было замечено, что зрелая микроглия имеет неоднородное распределение и различную морфологию в различных областях мозга [14], что, по-видимому, коррелирует с профилями экспрессии генов, специфичными для данного региона [15-17], остается открытым вопрос, существуют ли четко определенные молекулярные подтипы микроглии во взрослом мозге. Если такие подтипы существуют, то их распределение по различным областям мозга остается интригующим и не раскрытым аспектом биологии микроглии.
2. Origin of Microglia
В настоящее время известно, что предшественники микроглиальных клеток зарождаются в желточном мешке. У мышей клетки-предшественники микроглии появляются между эмбриональными днями E7.0 и E9.0, совпадая с начальной «примитивной» волной кроветворения. Важно отметить, что клетки, экспрессирующие маркеры кроветворения и макрофагов/микроглии, становятся различимыми в развивающемся мозге с дня E9.5 [12], а постнатальные кроветворные предшественники не играют роли в поддержании взрослых микроглиальных клеток [12]. За исключением макрофагов хороидного сплетения, не паренхимные макрофаги (менингеальные и периваскулярные) зарождаются в желточном мешке и сохраняются на протяжении всей жизни без участия предшественников костного мозга [8].
Развитие микроглиальных клеток у мышей тесно связано с рецептором колониестимулирующего фактора-1 (CSF-1R), в отличие от макрофагов и циркулирующих моноцитов [12]. Природа предшественников микроглии и паттерны экспрессии их генов до конца не изучены [10,18,19]. Участие циркулирующих моноцитов в популяции взрослых микроглиальных клеток ограничивается некоторыми патологическими состояниями, вероятно, связанными с привлечением моноцитов из кровотока вследствие изменения проницаемости гематоэнцефалического барьера [20-22].
У человека амебоидные микроглиальные клетки проникают в стенку головного мозга из лептоменингеальной ткани и просвета желудочков, начиная с 4,5 недели беременности [23]. Во время раннего развития мозга эти клетки проникают в кору головного мозга и белое вещество в амебоидной форме. В дальнейшем микроглиальные клетки мигрируют и колонизируют паренхиму, приобретая разветвленную морфологию, характерную для взрослого мозга, и выполняя свои функции. Специфические молекулярные сигналы оркеструют все события, касающиеся функций микроглии, во временном и пространственном отношении.
Microglia Signature
3.1. Region-Specific Gene Expression Promfiles of Microglia
Популяция микроглии в мозге имеет неоднородные характеристики. В мышиных моделях микроглия демонстрирует уникальную транскрипционную идентичность, зависящую от региона [17,24]. Недавний прогресс в области секвенирования одноклеточных клеток позволил более детально понять разнообразие и региональную гетерогенность микроглии мышиного мозга [25,26]. Интригующе, но эти данные указывают на то, что разнообразие микроглии наиболее выражено в развивающемся, пожилом или травмированном мозге, а при использовании мышиной модели рассеянного склероза (MS), а также тканей мозга человека, страдающего MS, различные активированные субпопуляции микроглии были обнаружены при демиелинизирующих поражениях [26]. Другие исследовательские группы дополнили эти наблюдения, используя передовые методы, и обнаружили сопоставимые результаты в тканях мозга здорового человека [27,28].
При сравнении микроглии из гиппокампа, коры головного мозга, стриатума и мозжечка мыши наблюдается региональное разнообразие транскрипционных паттернов. Выделяются три различных транскриптомных кластера, характерных для мозжечка, гиппокампа и коры/стриатума головного мозга. Рассматривая связанные с ними биологические процессы, было замечено, что кластер микроглиальных генов гиппокампа участвует в регуляции производства энергии, в то время как кластеры коры головного мозга и мозжечка связаны с генами, регулирующими иммунный ответ. В соответствии с этим анализ мотивов связывания транскрипционных факторов выявил чрезмерную представленность транскрипционных факторов, регулирующих биоэнергетические гены в гиппокампальном кластере, и факторов, регулирующих иммунные и воспалительные гены в мозжечковом кластере [17].
Примечательно, что, по-видимому, существуют различия в статусе иммунной активации микроглии, связанной с корковым и мозжечковым кластерами. Микроглия из коры головного мозга демонстрирует повышенную экспрессию генов, кодирующих тормозные иммунорецепторы, такие как триггерные рецепторы, экспрессируемые на миелоидных клетках 2 (Trem2) и SiglecH. И наоборот, микроглия из мозжечка демонстрирует повышение уровня генов, кодирующих активирующие иммунорецепторы, что говорит о более иммуноактивированном микроглиальном фенотипе, хотя и отличном от фенотипов, индуцированных липополисахаридом ( LPS) или IL-43. Важно отметить, что около трети генов микроглиального сенсома, входящих в состав гомеостатической микроглиальной генной сигнатуры, демонстрируют дифференциальную экспрессию в микроглии, полученной из разных областей мозга. В заключение следует отметить, что хотя микроглия из разных областей мозга имеет общую экспрессию отдельных специфических генов, что более важно, она также демонстрирует экспрессию набора специфических генов, что указывает на уникальные и специфические функции микроглии, связанные с каждой областью [17]. В качестве дополнительного подтверждения этого факта в предыдущих работах были показаны различные фенотипы микроглии при сравнении регионов в пределах базальных ганглиев [16]. Анализ транскриптома показал, что микроглия в вентральной тегментальной области ( VTA) демонстрирует наиболее значительные различия по сравнению с микроглией в substantia nigra pars compacta и nucleus accumbens. В VTA дифференциально экспрессируемые гены микроглии в основном связаны с метаболическими процессами, включая гликолиз, окислительное фосфорилирование и глюконеогенез. Микроглия в substantia nigra pars compacta и VTA демонстрирует ограниченный вклад в гомеостаз и иммунологический надзор, о чем свидетельствуют наблюдения за плотностью клеток, содержанием лизосом и разветвлением клеток. Несмотря на эти региональные различия, профиль экспрессии микроглии в разных регионах свидетельствует о сохранении канонических функций микроглиальных клеток.
При исследовании микроглии наряду с макрофагами, расположенными в хороидном сплетении, периваскулярных пространствах и субдуральных менингиальных оболочках (meninges), была выявлена интересная высокая степень сходства. Этого сходства не наблюдалось с периферическими моноцитами. Если сопоставить транскриптомы моноцитов с транскриптомами микроглии и не паренхиматозных макрофагов, то более 400 дифференциально экспрессируемых генов оказались общими как для паренхимы (микроглии), так и для не паренхиматозных макрофагов, среди них Iba1, C-X3-C мотив хемокинового рецептора 1 (Cx3cr1) и Csf1r. Помимо этого общего набора генов, микроглия и не паренхимальные макрофаги также экспрессируют различные, отдельные наборы генов, и в этом контексте было идентифицировано более 2300 генов [8].
3.2. The Human Homeostatic Microglia Signature (Figure 1)
В недавнем исследовании была определена генная подпись для гомеостатической микроглии человека, полученная из когорты 39 взрослых посмертных доноров в возрасте от 34 до 102 лет [29]. Эта генная подпись включает более 1200 генов, которые демонстрируют значительную дифференциальную экспрессию в очищенной микроглии по сравнению с клеточным лизатом, полученным из цельной теменной коры. Анализ генной онтологии показал, что эти гены связаны с врожденной иммунной системой, охватывая такие функции, как распознавание патогенов и само-распознавание, инфламмасома, клеточная адгезия и подвижность (C3XCR1), а также иммунная сигнализация и модуляция (P2RY12, HLA-DR и C1QA-C). Кроме того, аполипопротеин Е (APOE) и TREM2, известные как гены риска нейродегенеративных заболеваний, обогащены в микроглии, очищенной в мозге взрослого человека. Кроме того, высоко экспрессируются два транскрипционных фактора - интерферон-регулирующий фактор 8 (IRF8) и PU.1, которые также играют фундаментальную роль в онтогенезе и развитии мышиной микроглии.
В другом исследовании [30] были проанализированы транскриптомы микроглии, выделенной из внешне здоровой ткани мозга, полученной во время нейрохирургических операций у 19 17-летних пациентов с опухолями, острым инсультом или эпилепсией. 30 самых высоко экспрессируемых генов в этом наборе данных связаны с такими функциями, как синаптическое ремоделирование (C1QA-C и C3), подвижность и разветвление микроглии (CX3CR1 и P2RY12), а также иммунный ответ (HLA-DRA и HLA-B). При сравнении профилей экспрессии генов, характерных для всей коры головного мозга и микроглии, было выявлено более 800 гомеостатических генов микроглии человека, включая P2RY12, CX3CR1 и несколько рецепторов комплемента, таких как C1QA, C1QB, C1QC и C3. Более того, эти гомеостатические сигнатурные гены в микроглии человека существенно совпадают с транскриптомными наборами данных, связанными с различными неврологическими заболеваниями, включая AD и болезнь Паркинсона (PD), где многие из гомеостатических микроглиальных сигнатурных генов демонстрируют дифференциальную экспрессию. Это указывает на решающую роль микроглии в патофизиологии этих заболеваний [31].
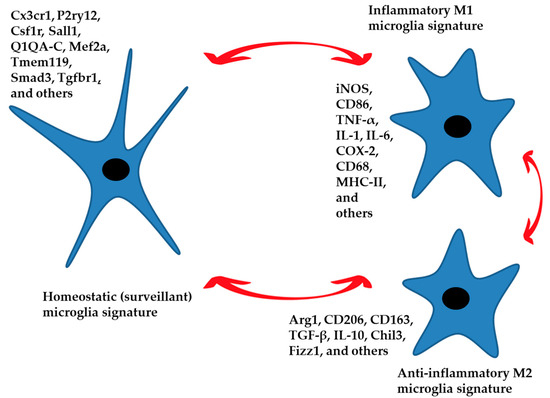 Рисунок 1. Гомеостатическая сигнатура микроглии выполняет функции контроля и наблюдения за состоянием нервной паренхимы. Эти функции являются региоспецифичными. В ответ на специфические внешние стимулы может формироваться воспалительный фенотип, вызывающий защитную реакцию. Противовоспалительный фенотип приводит к разрешению повреждения путем ограничения воспалительного ответа и возвращения микроглии в гомеостатическое состояние наблюдения. Старение и нейродегенеративные заболевания также могут вызывать воспалительный фенотип. Три фенотипа, представленные на рисунке, характеризуются специфическими признаками с многочисленными промежуточными состояниями между M1 и M2, которые подталкивают микроглии к более или менее воспалительной или противовоспалительной функции. Перечислены маркеры экспрессии генов для каждого состояния.
Гомеостатические генные сигнатуры микроглии сохраняются у разных видов [31,32]. При сравнении двух различных генных сигнатур, характеризующих гомеостатическую микроглию человека, с несколькими сигнатурами гомеостатической микроглии мыши, очевидно совпадение более чем на 50%, в зависимости от конкретных наборов данных, использованных для сравнения [31,32]. Такие гены, как APOC1, MPZL1, SORL1, CD58, ERAP2, GNLY и S100A12, тесно связанные с врожденной иммунной системой, уникально экспрессируются в микроглии человека и либо отсутствуют, либо экспрессируются в минимальной степени в микроглии мыши. Значительное совпадение между транскриптомами мыши и человека согласуется с идентификацией аналогичных эпигенетических ландшафтов и специфических для микроглии регуляторных областей [32]. Таким образом, последние исследования позволили выявить генные сигнатуры, характерные для гомеостатической микроглии как у мышей, так и у человека, что заложило основу для расширенной идентификации и изучения микроглии в мышиных и человеческих тканях.
3.3. M1 Microglia Signature
Микроглия M1 играет ключевую роль в защитных механизмах организма, являясь мощными эффекторными клетками, способными уничтожать внутриклеточные микроорганизмы и опухолевые клетки (рис. 1). Кроме того, они выделяют значительное количество провоспалительных цитокинов, способствуя непреднамеренному повреждению здоровых тканей. Для микроглии М1 характерна повышенная продукция окислительных метаболитов и провоспалительных цитокинов, таких как фактор некроза опухоли-α (TNF-α), IL-6, IL-1β и IL-12 [33]. Постоянный выброс провоспалительных цитокинов, реактивных форм кислорода (ROS) и нерегулируемый выброс глутамата могут оказывать нейротоксическое действие, хотя вопрос о микроглие индуцированной нейротоксичности остается открытым. Некоторые авторы [34] утверждают, что микроглиальные клетки играют полезную роль в разрешении многочисленных заболеваний ЦНС, и доказывают, что микроглия становится вредоносной из-за снижения экспрессии важнейших рецепторов (CD200R, CX3CR1 и TREM2) или мутаций, особенно при старении и нейродегенеративных заболеваниях; по сути, этот эффект возникает в сценариях, когда микроглия отклоняется от своих врожденных свойств и становится либо толерогенной, либо гиперактивной [35,36].
У пожилых животных наблюдается снижение подвижности микроглии и процессов ветвления клеток. Это снижение может привести к менее эффективному наблюдению и потенциально ослабленной защите от повреждения тканей. Кроме того, данные in vitro свидетельствуют о том, что в стареющем мозге микроглия демонстрирует повышенную экспрессию молекул главного комплекса гистосовместимости (MHC) класса II и становится менее чувствительной к таким регуляторным сигналам, как колониестимулирующий фактор 1 (CSF1) или трансформирующий фактор роста (TGF)-β1 [37]. В течение жизни цитокиновая стимуляция и системное воспаление могут обучать микроглии, повышая их реактивность [38]. Процесс столкновения с различными вредными стимулами называется праймингом. В сочетании с этим праймингом повреждение ДНК и постепенное накопление мутаций в результате старения может привести к развитию у микроглии фенотипа повышенной чувствительности. Это приводит к усилению иммунной реактивности и повышению устойчивости к регуляторным механизмам [37].
При нейродегенеративных заболеваниях активация микроглиальных toll-подобных рецепторов (TLR) компонентами погибших клеток может вызвать высвобождение провоспалительных медиаторов, включая IL-1β, TNF-α, оксид азота (NO), ROS и IL-6. Эти медиаторы, действуя каскадно, способны ускорить дегенерацию нейронов. Примечательно, что воспаление, вызванное эндогенными молекулами, такими как белковые агрегаты и остатки погибших нейронов, может служить катализатором прогрессирования нейродегенеративных заболеваний, таких как MS и AD [39]. Однако очевидна многогранность микроглиальных эффектов. С одной стороны, в контексте MS микроглия активно способствует нейродегенеративным и нейровоспалительным процессам, выделяя медиаторы воспаления и способствуя активности и инфильтрации лейкоцитов в ЦНС. С другой стороны, микроглия также играет важную роль в восстановлении ЦНС, вырабатывая нейротрофические факторы и очищая миелиновые обломки от ингибиторов. Кроме того, есть данные, свидетельствующие о том, что микроглия М1 может оказывать положительное влияние на регуляцию нейрогенеза путем секреции нейротрофических медиаторов, таких как TGF-β и инсулиноподобный фактор роста (IGF)-1 [40].
3.4. M2 Microglia Signature
Макрофаги M2, которые иногда подразделяют на подтипы M2a, M2b и M2c, помогают в восстановлении ран и смягчают вредные иммунные реакции [41] (рис. 1). Вопрос о том, может ли эта номенклатура быть связана с микроглией, является спорным. Однако фенотип микроглии М2 увеличивает продолжительность жизни нейронов и минимизирует травмы мозга за счет экспрессии высоких уровней хитиназы 3-подобной 3 (Chil3) и аргиназы-1 (Arg-1), которые предотвращают распад внеклеточного матрикса, обнаруженного в зоне воспаления, (FIZZ)1, которая поддерживает формирование внеклеточного матрикса. Более того, микроглия М2 увеличивает выработку IL-10, TGF-β и IGF-1 [42]. Фермент Arg-1 превращает аргинин в орнитин, способствуя заживлению ран. Используя аргинин, который также является субстратом для индуцибельной синтазы оксида азота (iNOS), Arg-1 может эффективно конкурировать с iNOS, тем самым снижая выработку оксида азота [43]. Следовательно, iNOS и Arg-1 служат четкими индикаторами для различения фенотипов M1 и M2, соответственно.
Другой способ описания функций и фенотипов - по цитокинам, которые вызывают этот фенотип, т. е. М2 [42]. В этом контексте не все цитокины, определяющие фенотип М2 в макрофагах, действуют в микроглии, а некоторые маркеры М2, обнаруженные в макрофагах, не экспрессируются в микроглиальных клетках.
CD206, также известный как рецептор маннозы, обычно используется в качестве маркера для характеристики микроглии М2 - подмножества активированных микроглий, выполняющих противовоспалительные и тканевосстановительные функции [44]. Однако выявление эксклюзивных маркеров для М2 микроглии, не экспрессирующихся в М2 макрофагах, является сложной задачей из-за общих фенотипических признаков и молекулярных маркеров между этими двумя типами клеток, обусловленных их общим происхождением как клеток врожденного иммунитета. Потенциальным маркером, специфичным для микроглии (как M1, так и M2) по сравнению с макрофагами, является TMEM119. Этот маркер был идентифицирован как специфичный для резидентной микроглии в мозге и обычно не экспрессируется периферическими макрофагами [45]. Маркером, специфичным для М2-макрофагов, который обычно не экспрессируется М2-микроглией, является CD163. CD163 - это поверхностный рецептор, присутствующий на М2-макрофагах и используемый в качестве отличительного маркера этих клеток [46].
Конечно, из-за разного происхождения и реакции микроглии и макрофагов их роль в облегчении или усугублении патологии также может различаться.
Chen and Trapp (2015) недавно назвали микроглии важнейшими защитниками ЦНС во время развития, взросления и болезни [47]. Они описывают, как активность микроглии регулируется по мере необходимости, позволяя микроглии переходить от фенотипа M1 к фенотипу M2, причем последний играет жизненно важную роль в содействии восстановлению [47]. В норме иммунные реакции тщательно регулируются, чтобы инициироваться и разрешаться должным образом, поддерживая гомеостаз тканей. Однако в патологических условиях эти иммунные реакции становятся нерегулируемыми, что приводит к дисбалансу, который смещается либо в сторону чрезмерного воспаления, либо в сторону подавления.
В другом исследовании было высказано предположение, что glatiramer acetate может стимулировать микроглиальные клетки к экспрессии IGF-1 для оказания нейропротекторного действия [48]. В исследовании экспериментального аутоиммунного энцефаломиелита (EAE) на мышиной модели MS [49] сообщалось о повышенной экспрессии хитиназы-подобного 3 (Ym1), регулируемой IL-4, вырабатываемым ЦНС. В соответствии с этим клинические признаки EAE усугублялись у химерных мышей, лишенных IL-4, что, вероятно, связано с уменьшением количества микроглии М2 [47].
Kigerl et al. (2009) изучали влияние кондиционированной среды, полученной из под макрофагов костного мозга, на выживание и рост нейритов клеток дорсального корешкового ганглия в модели повреждения спинного мозга мыши [50]. Они обнаружили, что кондиционированная среда, полученная от макрофагов, активированных интерфероном-γ и LPS, вредила нейронам, в то время как среда, полученная от макрофагов, активированных IL-4, способствовала росту нейритов. Эти данные также могут свидетельствовать о том, что поляризация резидентной микроглии в сторону активированного фенотипа M2 может способствовать восстановлению центральной нервной системы, ограничивая вторичное повреждение, опосредованное воспалением.
3.5. Microglia and Aging (Figure 2)
В пожилом возрасте в головном мозге сохраняется низкоуровневое воспаление, характеризующееся повышенной экспрессией MHC-II, рецепторов комплемента и провоспалительных цитокинов при одновременном снижении активности противовоспалительных генов [51]. Кроме того, в мозге происходит накопление реактивных форм кислорода/азота и смещенных собственных молекул, что влияет на функционирование микроглии. Даже в нормальных условиях пожилые микроглии обычно вырабатывают более высокий уровень цитокинов [52], но при воздействии воспалительных триггеров пожилые микроглии проявляют повышенную реактивность, вырабатывая большее количество цитокинов в течение длительного времени [53]. Такой повышенный воспалительный ответ, вероятно, способствует длительному недомоганию пожилых людей во время болезней или инфекций, часто сопровождающемуся такими симптомами, как снижение когнитивных способностей и/или депрессия [38]. Более того, это хроническое воспаление может способствовать развитию возрастных нейродегенеративных заболеваний [54].
 Рисунок 2. В процессе старения микроглиальные реакции становятся менее интенсивными. В то время как молодые и взрослые микроглии осуществляют эффективные и адекватные реакции, стареющие микроглии уже не отвечают на стимулы должным образом. Этот измененный ответ обусловлен определенной сигнатурой, которая приводит к так называемой сенесцентной микроглии, а затем к дистрофической микроглии. Дистрофическая микроглия может способствовать нейродегенерации.
Микроглия, полученная от пожилых мышей в возрасте 24 месяцев, демонстрирует отчетливую генетическую сигнатуру по сравнению с более молодыми мышами [55,56]. Этот генный паттерн связан с такими процессами, как презентация антигенов, сигнальные пути, связанные с фагосомами и лизосомами, окислительное фосфорилирование и другие. Это контрастирует с транскрипционным профилем микроглии при острой активации, который в основном включает сигнальные пути NF-κB, что обычно не наблюдается в пожилой микроглии [55]. Это позволяет предположить, что функциональное состояние пожилой или длительно активированной микроглии отличается от состояния, вызванного острым воспалительным ответом. Более того, экспрессия специфических гомеостатических генов, таких как P2ry12 и Tmem119, снижена в возрастной микроглии [55]. Активация инфламмасомы NLRP3 также вносит значительный вклад в провоспалительное состояние возрастной микроглии, и истощение этого фактора уменьшает активацию микроглии, наблюдаемую при старении, увеличение экспрессии провоспалительных цитокинов, вызванное воспалением, и снижение памяти [57,58].
В стареющем мозге человека и грызунов микроглия накапливает гранулы липофусцина, которые представляют собой крупные и не-перевариваемые соединения. Эти гранулы содержат фрагменты миелина и ненасыщенные жирные кислоты, а также белки и углеводы [59,60]. Более того, недавние исследования [61] показали, что примерно половина микроглии в стареющем мозге накапливает липидные капли. Это подмножество микроглии было названо микроглией, накапливающей липидные капли (LDAM), и было обнаружено, что оно демонстрирует отчетливую транскриптомную сигнатуру , связанную с повышенным высвобождением CCL3, CXCL10, IL-6, повышенной продукцией ROS и реактивных видов азота (RNS) и нарушением фагоцитарной активности [61]. Следовательно, этот фенотип можно считать показателем дисфункциональной микроглии.
Ключевой особенностью возрастной микроглии является снижение ее способности к фагоцитозу. В недавнем исследовании, проведенном на возрастной микроглии, было отмечено увеличение экспрессии CD22 как негативного регулятора фагоцитоза [62]. Примечательно, что ингибирование CD22 приводило к усилению клиренса обломков миелина или неправильно сформованных белков, таких как амилоидные олигомеры и фибриллы синуклеина. Кроме того, это вмешательство позволило обратить вспять повышенную экспрессию воспалительных факторов и улучшить когнитивные функции у пожилых мышей. Эти результаты подчеркивают связь между возрастным нарушением фагоцитарной функции микроглиальных клеток и когнитивным снижением.
Несмотря на стабильность количества микроглиальных клеток в процессе старения как у людей, так и у мышей [63], микроглия в стареющем мозге демонстрирует измененные морфологические и функциональные характеристики. В пожилом мозге человека [60] некоторые микроглии демонстрируют дистрофическую морфологию, характеризующуюся потерей тонких отростков, образованием цитоплазматических сфероидов, фрагментацией или формированием бисера [64]. Примечательно, что эта тяжелая форма морфологического старения микроглии наблюдается только у человека, но не у грызунов, что, вероятно, связано с различиями в продолжительности жизни и влиянием окружающей среды [65]. Тем не менее, микроглия у пожилых грызунов также претерпевает специфические морфологические изменения, свидетельствующие о старческом фенотипе [58,66]. Эти морфологические изменения приводят к снижению способности отдельных микроглий сканировать территориальные домены, уменьшая объем мозга, охваченный этими процессами.
Анализ паттернов экспрессии генов в микроглии пожилых людей и мышей выявил лишь ограниченное число генов со значительным совпадением [29]. Такое расхождение может быть объяснено несколькими факторами, включая различия в продолжительности жизни видов, наличие разнообразных патологий у людей-доноров и повышенную сложность микроглиальных функций в центральной нервной системе человека в связи с ее большей общей сложностью. Было обнаружено, что некоторые гены (например, ERAP1, ERAP2 и CD58) гораздо менее распространены в микроглии мыши по сравнению с микроглией человека [67]. В процессе старения многие гены, связанные с актиновым цитоскелетом, молекулами клеточной адгезии и рецепторами клеточной поверхности, которые являются частью микроглиального сенсома (например, IL6R, P2RY12 и TLR10), снижают свою экспрессию. Напротив, гены с повышенной экспрессией при старении включали IGF2R, CD163, транскрипционный фактор RUNX3, модуляторы интегринов DOCK1 и DOCK5, рецепторы CXCR4 и сосудистый эндотелиальный фактор роста A (VEGFA). Пуринергический рецептор P2RY12, способствующий хемотаксису микроглии, также был снижен в возрастной микроглии человека, что подчеркивает изменения в чувствительности и движении микроглии с возрастом. Однако при сравнении профилей экспрессии генов пожилых микроглий человека и грызунов очевидны как различия, так и значительные совпадения [67].
Так называемая с болезнью ассоциированная микроглия (DAM) рассматривается как «защитная» микроглия, основная роль которой заключается в локализации и очистке повреждения [60] и характеризуется снижением экспрессии генов, связанных с гомеостатической микроглией, например Cx3cr1 и пуринергических рецепторов P2ry12/P2ry13 и Tmem119 [67,68]. Количество DAM увеличивается с возрастом, составляя около 3 % всех микроглиальных клеток у старых мышей (20 месяцев). Эти клетки дополнительно отличаются увеличением количества генов, связанных с фагоцитозом, лизосомной активностью и путями, вовлекающими липидный обмен. Фенотип DAM запускается молекулами опасности, обнаруженными на апоптотических клеточных телах, а также обломками миелина, продуктом распада липидов и внеклеточными белковыми сгустками. Этот процесс опирается на сигналы TREM2 и демонстрирует совпадение между старением и заболеваниями ЦНС (раздел 3.6).
Понимание связанных со старением изменений в микроглии имеет решающее значение для смягчения их пагубных последствий и содействия здоровому старению. Однако взаимосвязь между изменениями микроглии и старением сложна. Изменения микроглии могут как способствовать процессу старения, так и быть его результатом. Как уже упоминалось, микроглия способствует развитию хронического воспаления низкой степени тяжести в ЦНС, известного как воспаление. Это постоянное воспалительное состояние может ускорять процесс старения и способствовать развитию возрастных заболеваний, в том числе нейродегенеративных расстройств. Провоспалительная микроглиальная активность может повреждать нейроны и другие клетки, что приводит к снижению функции ЦНС. По мере старения микроглии снижают свою фагоцитарную эффективность, что приводит к накоплению клеточного мусора, дисфункциональных белков и других продуктов жизнедеятельности. Это накопление может создать токсичную среду, способствующую дальнейшему клеточному старению и дисфункции. Важно отметить, что микроглия также участвует в обрезке и поддержании синапсов. Возрастные изменения в функции микроглии могут нарушать синаптический гомеостаз, что приводит к снижению когнитивных способностей и другим неврологическим нарушениям, связанным со старением.
Старение влияет на весь организм, в том числе на системную иммунную функцию. Изменения в периферических иммунных клетках и циркулирующих медиаторах воспаления могут влиять на поведение микроглии и способствовать ее измененному состоянию [69,70]. Такая связь между системой и ЦНС может усугублять микроглиальную дисфункцию. Старение также связано с широко распространенными эпигенетическими изменениями, в том числе в микроглии. Эти изменения могут изменять экспрессию генов и клеточные функции, способствуя формированию старческого фенотипа микроглии. Эпигенетические изменения могут быть как причиной, так и следствием процессов клеточного старения. Наконец, возрастное усиление окислительного стресса и митохондриальной дисфункции может влиять на здоровье и активность микроглии. Эти изменения могут привести к возникновению петли обратной связи, когда поврежденная микроглия еще больше способствует окислительному стрессу и воспалению, закрепляя цикл старения.
Olah и др. (2018) [56] использовали секвенирование РНК (RNA-seq) для профилирования экспрессии генов микроглии, выделенной из мозга пожилых и молодых людей. Анализ данных подтвердил, что микроглия пожилых людей демонстрирует значительно отличающийся транскрипционный профиль по сравнению с молодыми: увеличение экспрессии провоспалительных генов и снижение противовоспалительных генов, что свидетельствует о состоянии хронического воспаления, которое может способствовать воспалению, снижение экспрессии генов, связанных с фагоцитозом и очисткой от клеточного мусора, что указывает на потерю функции поддержания гомеостаза мозга и изменения в энергетическом метаболизме. Исследование также выявило потенциальные биомаркеры для ранней диагностики нейродегенеративных заболеваний с помощью протеомного анализа. Используя масс-спектрометрию, исследователи профилировали белки, экспрессируемые в микроглии, и сравнили белковые профили между молодыми и пожилыми людьми, подтвердив данные, полученные с помощью транскрипционного анализа [56]. Интеграция транскрипционных и протеомных данных в этом исследовании позволяет получить более полное представление о связанных со старением изменениях в микроглии. Результаты показывают, что у возрастной микроглии не только значительно изменяются профили экспрессии генов, но и изменяются уровни белков, что отражает воспалительный профиль и сниженную способность поддерживать гомеостаз мозга.
3.6. Pathological (Neurodegenerative) Signature of Microglia (Figure 3)
Многочисленные микроглиальные сигнатуры были идентифицированы как связанные с различными патологиями с транскрипционной точки зрения. Правда, вышеупомянутая DAM может рассматриваться как защитная микроглия, но чаще всего она ассоциируется со многими патологиями.
В модели AD анализ CD45+ клеток мозга с помощью одноклеточного РНК-секвенирования выявил три кластера микроглии [71]. Один из этих кластеров был легко идентифицирован у сопоставимых по возрасту животных дикого типа. В этих клетках снижена регуляция генов, связанных с гомеостатической микроглией ( TMEM119, AND P2RY12 и CX3CR1), и повышена регуляция различных генов ( CLEC7A, ITGAX, CD9 и CD63), включая гены, связанные с факторами риска развития AD ( TREM2, DAP12, APOE, CTSD и LPL). Среди двух кластеров DAM один демонстрировал более высокую экспрессию этих сигнатурных маркеров, что, по мнению авторов, означало, что кластер с более низкой экспрессией был промежуточным [71]. Интересно, что предложенная промежуточная сигнатура не зависела от TREM2, который необходим для развития DAM [71]. Промежуточная сигнатура была связана с уменьшением количества гомеостатических генов и увеличением других генов, связанных с сигнатурой ( DAP12, APOE, CTSB, CTSD, B2M, LYZ2 и FTH1), в то время как сигнатура DAM была связана с дальнейшим повышением регуляции генов DAM. Предполагаемые DAM in situ, обогащенные CD11c+, были обнаружены рядом с бляшками в мышиной модели патологии AD; у людей LPL+ микроглия, также рассматриваемая как предполагаемая DAM, была обнаружена рядом с бляшками в посмертных образцах от людей с AD. Эти клетки также были обнаружены в спинном мозге мышиной модели ALS, и их распространенность увеличивалась по мере прогрессирования заболевания. Все эти данные свидетельствуют о частичном совпадении возрастной сигнатуры и патологической сигнатуры (DAM) микроглии, а также о предсказуемом совпадении различных микроглиальных сигнатур, характерных для конкретных патологий.
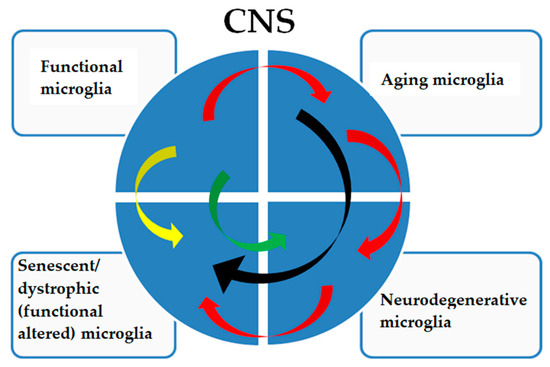 Figure 3. The pathological signatures of microglia show a complex relationship. Functional microglia in adults are subjected to physiological aging phenomena (red arrows), which can directly determine a senescent/dystrophic phenotype (black arrows) with a decreased ability to perform their functions and with cognitive and physical decline that is not caused by a neurodegenerative pathology. Aging microglia can also acquire a neurodegenerative signature (red arrows) with a frankly neurodegenerative phenotype, which will consequently determine a dystrophic phenotype (red arrows), worsening the pathology. Furthermore, functional microglia can acquire a senescent/dystrophic phenotype (yellow arrow), a prelude to non-aging neurodegenerative diseases or acquire a neurodegenerative signature such as, but not limited to, in type II microgliopathies (green arrow).
Специфическая микроглиальная сигнатура характерна для болезни Nasu–Hakola, которая считается микроглиопатией I типа. При этом заболевании функциональные микроглии демонстрируют функциональные изменения (рис. 3, желтая стрелка), не полностью коррелирующие с нейродегенеративной или возрастной сигнатурой [72]. При микроглиопатиях II типа специфические сигнатуры, например аллельные варианты TREM2, прямо предрасполагают (рис. 3, зеленая стрелка) к AD-подобным нейродегенеративным фенотипам [73].
Многие исследования показали, что многочисленные гены, связанные с риском развития ранней стадии AD, экспрессируются преимущественно в микроглии [73,74]. К ним относятся гены, кодирующие TREM2, ATP-связывающий кассетный субсемейства A член 7 (ABCA7) [75], члены мембраноспасающего 4-доменного субсемейства A (MS4A) 74, CD133 [76], аллель ε4 APOE (APOE4) [77,78], PU.1 [79] и другие. Кроме того, рецептор комплемента CR1, экспрессируемый в микроглии, был связан с поздним началом AD [80,81], что отражает участие микроглии в фагоцитозе синапсов и вносит свой вклад в патогенез AD.
Однако провоспалительная сигнатура в микроглии, ассоциированной с амилоидными бляшками [67,82], отсутствовала в микроглии, расположенной в зонах без бляшек, что указывает на то, что нейровоспаление, связанное с DA, в первую очередь происходит в микроглии, ассоциированной с бляшками [83]. Такие гены, как Axl, APOE, Clec7a, Itgax, Lgals3 и Cst7, в настоящее время признаны частью общей сигнатуры нейродегенеративных заболеваний и DAM, наблюдаемой многими исследовательскими группами. Эти исследования подчеркивают, что клеточное перепрограммирование микроглии в ответ на нейродегенерацию связано с уникальными транскрипционными программами, лежащими в ее основе. Микроглия DAM была обнаружена и при других заболеваниях, включая ALS, фронто-темпоральную деменцию и мышиную модель тяжелой нейродегенерации, что позволяет предположить, что фенотип экспрессии DAM обычно вызывается нарушением гомеостаза мозга [67]. Хотя микроглия DAM была связана с амилоидными бляшками, остается неясным, играют ли они вредную или защитную роль. Врожденные иммунные клетки признаны за их роль в смягчении последствий DA путем уменьшения накопления амилоида-β на начальных стадиях заболевания [84]. Однако по мере старения микроглии их способность очищать мозг от амилоида-β может уменьшаться [85,86]. Кроме того, по мере накопления амилоида-β микроглиальные клетки приобретают более нейротоксичный фенотип [64,87,88], характеризующийся экспрессией IL-1β, IL-6, TNF и CCL3 [87]. Нейротоксичность микроглиальных клеток также может быть связана с экспрессией ими tau, вызванной отложением амилоида-β в мозге, который, как известно, является нейротоксичным [89].
Так называемый микроглиальный нейродегенеративный фенотип (MGnD) характеризуется подавлением гомеостатических генов (таких как Cx3cr1, Olfm3, P2ry12, Csf1r, Tmem119, Tgfb1, Mafb, Mef2a и Sall1) и повышением воспалительных генов (включая APOE, Csf1, Itgax и другие) [90,91]. Такой генетический профиль вызывает активацию путей, которые управляют высвобождением цитокинов, фагоцитозом и хемотаксисом/миграцией, оснащая MGnD для защитной реакции на повреждение нейронов. Переход от гомеостатического состояния микроглии к состоянию MGnD контролируется сигналом TREM2-APOE. Хотя MGnD и микроглия, ассоциированная с болезнью (DAM), имеют функциональное сходство, их транскрипционные сигнатуры отличаются [90].
MS - еще одно воспалительное заболевание, поражающее центральную нервную систему (ЦНС), в котором микроглия играет важную роль [92,93]. В мышиной модели MS EAE микроглия демонстрирует транскрипционный профиль, который похож на тот, что наблюдается в моделях AD и ALS [90,94,95]. Этот профиль может определять прогрессирование заболевания. Например, микроглия продуцирует хемокины, такие как Ccl2, которые привлекают воспалительные CCR2+ моноциты из кровотока. Микроглия уникально экспрессирует CX3CR1 в мозге - рецептор, важный для иммуномодуляции в нормальных условиях; его генетическое удаление приводит к нейротоксичности [96]. Кроме того, снижение экспрессии Cx3CR1 в микроглии коррелирует с прогрессированием заболевания при EAE [90]. Этот измененный фенотип микроглии при EAE также способствует воспалению, активируя астроциты. У пациентов с MS микроглия теряет маркер P2RY12, что указывает на переход от гомеостатического к провоспалительному состоянию. Затем они экспрессируют маркеры, связанные с фагоцитозом (например, макросиалин/CD68), презентацией антигенов (молекулы MHC I и II класса и CD86) и выработкой реактивных форм кислорода (например, легкая цепь цитохрома b-245/CYBA) [97]. Minocycline, направленный на микроглию [98], показал положительный эффект в клинических испытаниях MS [99], но ухудшил симптомы ALS [100], возможно, из-за его различного воздействия на микроглиальный фенотип. Это свидетельствует о том, что MS и ALS имеют сходную, но не идентичную сигнатуру, и миноциклин может влиять на нее по-разному.
Многие из микроглиальных изменений, наблюдаемых при ALS, были также обнаружены в мышиной модели AD, что позволяет предположить наличие общего микроглиального ответа при различных нейродегенеративных заболеваниях. Одно из первых описаний DAM-сигнатуры появилось в результате исследования мышиной модели ALS с SOD1. В этой модели микроглия демонстрировала активацию путей, включающих APOE, tau и пресенилин 2, при этом APOE был одним из наиболее значительно повышающихся транскриптов во время прогрессирования заболевания [101]. В одном из последующих исследований также было обнаружено усиление APOE-сигнализации в микроглии как у человека с ALS, так и у мышей с SOD1. В этом исследовании также было обнаружено, что сигнатура гомеостатических микроглий исчезает уже за два месяца до начала выявляемой патологии в мышиной модели SOD1 [102]. Исследования также выявили механизмы, приводящие к таким изменениям микроглиальной сигнатуры при ALS. Связанная с ALS гибель нейронов активирует TREM2-APOE-сигнализацию в микроглии в ответ на апоптотические нейроны. Этот сигнал приводит к экспрессии miR-155, известного про-воспалительного сигнала [90]. Было обнаружено, что генетическая делеция APOE предотвращает индукцию miR-155 в микроглии. Важно отметить, что удаление miR-155 генетически восстанавливало гомеостатическую сигнатуру микроглии, продлевая выживаемость мышей с SOD1 [102].
Помимо AD, другие тауопатии, такие как прогрессирующий супрануклеарный паралич [103] и фронтотемпоральная деменция [104], характеризуются отчетливыми микроглиальными признаками. При этих заболеваниях активированная микроглия способствует патологическому накоплению tau, белка, связанного с нейрофибриллярной дегенерацией. Недавние исследования показывают, что при прогрессирующем надъядерном параличе и фронтотемпоральной деменции микроглия экспрессирует гены, связанные с хроническим воспалением, такие как TGFβ и IL-6, способствующие прогрессированию патологического tau. Это указывает на двунаправленную связь между воспалением и дисфункцией белка.
Помимо вышеупомянутых TREM2-APOE путей, микроглия при ALS демонстрирует провоспалительный фенотип с экспрессией таких генов, как секретируемый фосфопротеин 1, Ccl3 и Ccl4, которые, как и Ccl2, способствуют инфильтрации периферических моноцитов [105]. Эти гены ассоциируются с прогрессированием заболевания и потерей гомеостатической функции микроглии, что причастно к нейротоксичности, опосредованной воспалением. Дополнительной особенностью микроглии при ALS является повышенная экспрессия молекул, участвующих в липидном обмене, таких как ABCA1 и APOE [105], что позволяет предположить роль микроглии в управлении измененным накоплением липидов, наблюдаемым при этих заболеваниях.
Все большее внимание уделяется изучению роли микроглии при болезни Хантингтона - другом нейродегенеративном заболевании, характеризующемся дегенерацией нейронов в базальных ганглиях [106]. Микроглиальная сигнатура при HD включает активацию генов, связанных с воспалением, таких как IL-1β, TNF-α и NLRP3, это указывает на активацию инфламмасомного пути. Это особенно важно, поскольку хроническая активация инфламмасом может ускорить нейродегенерацию. Помимо воспаления, микроглия при HD демонстрирует нарушения в генах, участвующих в реакции на окислительный стресс, таких как HMOX1 (гемовая оксигеназа 1), что указывает на их ограниченную способность справляться с нейротоксической средой, создаваемой мутантами белка хантингтина [107].
При спиноцеребеллярной атаксии, которая включает дегенерацию нейронов мозжечка, микроглия демонстрирует изменения в транскрипционном профиле, влияющие на гены, связанные с клеточной подвижностью и миграцией [108,109], такие как CX3CR1, в дополнение к увеличению молекул, связанных с презентацией антигенов, таких как MHC-II. Это позволяет предположить, что, помимо воспаления, микроглия при этих заболеваниях может способствовать аберрантной активации адаптивного иммунного ответа, усугубляя нейродегенерацию.
Недавно выяснилось, что даже заболевания, не относящиеся к нейродегенеративным, такие как глаукома, характеризуются сильной микроглиальной активацией [110]. Микроглиальная сигнатура в этом контексте показывает экспрессию генов, вовлеченных в ответ на повреждение нейронов и воспаление, таких как AIF1 (Iba1), вместе с провоспалительными молекулами, такими как IL-6 и Ccl2. Это подчеркивает, как микроглия может способствовать дегенерации зрительного нерва, и позволяет предположить, что модулирование этих клеток также может иметь терапевтические преимущества при глазных заболеваниях.
3.7. Aging and Neurodegenerative Signature
Подводя итог, можно сказать, что сигнатуры стареющей и нейродегенеративной микроглии (DAM или MGnD) имеют как общие, так и специфические черты [51,55,80], причем последние особенно важны при нейродегенеративных заболеваниях, характерных для старения, таких как AD, HD и другие деменции. Микроглия играет центральную роль в иммунном ответе мозга, и ее дисфункция является ключевым элементом в патогенезе этих заболеваний. Общими чертами возрастной и патологической микроглии являются провоспалительная активация, фактически, обе сигнатуры показывают увеличение провоспалительных цитокинов (IL-1β, TNF-α и IL-6), которые могут способствовать хроническому нейровоспалению и нейродегенерации, и изменение фагоцитоза, со снижением фагоцитарной способности и способности удалять клеточный мусор, аномальные белки, такие как амилоид-β, tau иα-синуклеин, и поврежденные нейроны. Другими общими аспектами являются повышенный уровень ROS с окислительным повреждением нейронов и самой микроглии, а также дисрегуляция внутриклеточной сигнализации, например NF-κB и MAPK.
Две сигнатуры микроглии - возрастная и патологическая (DAM/MGnD) - также демонстрируют специфические черты [71]. Стареющая микроглия может вступать в состояние старения, характеризующееся ассоциированным со старением секреторным профилем [64,66], который высвобождает воспалительные и проапоптотические факторы и, как правило, демонстрирует снижение подвижности и сложности ветвления, ограничивая свою способность отслеживать и реагировать на изменения в нейронном окружении. Они демонстрируют снижение фено-типической пластичности, теряя способность переходить из активного в неактивное состояние, что негативно сказывается на их реактивности на травму или инфекцию.
Патологическая микроглия проявляет аберрантную, чрезмерную или дисфункциональную реактивность, способствуя хроническому нейровоспалению и дегенерации нейронов. При таких заболеваниях, как AD и HD, патологическая микроглия взаимодействует с патологическими белковыми агрегатами (амилоид-β, tau и α-синуклеин) [85,86], но часто со сниженной фагоцитарной эффективностью, способствуя накоплению этих агрегатов. Это также приводит к увеличению выработки нейротоксических молекул, таких как NO и ROS, которые могут вызывать прямое повреждение нейронов и усугублять нейродегенерацию. Кроме того, происходят изменения в липидном обмене, которые влияют на функции клеточных мембран и внутриклеточную сигнализацию.
3.8. APOE Microglia Signature
Примечательна связь между APOE и микроглией (рис. 4). Липиды становятся все более признанными факторами, вносящими значительный вклад в баланс иммунных клеток, благодаря их разнообразному распределению внутри этих клеток. Отдельные области в плазматической мембране клетки, известные как липидные плотики обладают способностью инициировать взаимодействие рецепторов и процессы передачи сигнала [111,112]. И наоборот, липиды, находящиеся во внутриклеточных компартментах, такие как сигнальные мессенджеры [113] или митохондриальные липиды [114], могут модулировать иммунный ответ, влияя на метаболические пути. Метаболизм липидов также играет важную роль в контроле состояния и функции микроглии. Например, полиненасыщенные жирные кислоты ряда n-3, такие как docosahexaenoic и eicosatetraenoic кислоты, способны сдвигать микроглию в сторону фагоцитарного фенотипа, снижая при этом маркеры воспаления за счет метаболического перепрограммирования [115-117].
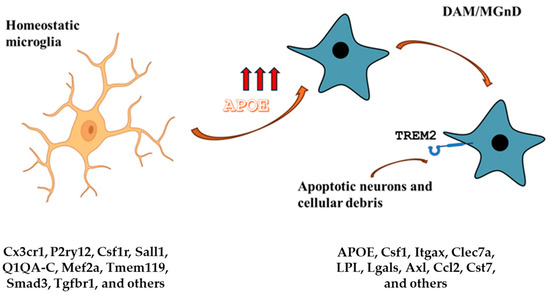 Figure 4. APOE and microglia. The homeostatic microglia signature is characterized by low APOE expression. On the other hand, DAM and MGnD signatures are characterized by high APOE expression and TREM2 signaling. The APOE-Trem2 axis regulates the microglia responses and in APOE or TRE2M knockout mice, the microglia response to brain tissue damage is severely blunted. The DAM signature is conserved in aging and neurodegenerative diseases and is triggered by apoptotic neurons and other cellular debris that accumulate in brain tissue damage. Gene expression markers for each condition are listed. APOE-mediated lipid metabolism also has an impact on microglial function.
Белок APOE участвует в транспорте липидов в организме человека и имеет различные генетические изоформы: APOE ε2, APOE ε3 и APOE ε4 [118]. APOE является наиболее значимым фактором риска, связанным с распространенностью AD и возрастом, в котором проявляется заболевание, а наличие варианта APOE ε4 ассоциируется с повышенным риском развития AD.
В двух недавних исследованиях связь между микроглией и APOE изучалась с помощью взаимодополняющих подходов. В первом исследовании с помощью метода gain-of-function с использованием Cx3cr1creERT2/+ мышей индуцировали экспрессию APOE3 или APOE4 именно в микроглии и макрофагах, связанных с ЦНС (CAMs) [119]. Второй метод, основанный на утрате функции, с использованием мышей Cx3cr1creERT2/+, скрещенных с мышами, экспрессирующими floxed-версии APOE3 или APOE4, позволил удалить APOE3 или APOE4 конкретно в микроглии и CAMs [120].
В исследовании Liu et al. (2023) [119], экспрессировавших APOE3 или APOE4 в микроглии и CAMs мышей APP/PS1, было обнаружено, что экспрессия APOE3 увеличивает количество микроглии, связанной с бляшками, и снижает уровень нерастворимого амилоида, тогда как APOE4 оказывает противоположное действие. Одноклеточное секвенирование показало, что APOE3 способствует развитию реактивной и MGnD транскриптомной сигнатуры, в то время как APOE4 вызывает транскриптомную сигнатуру, связанную со стрессом, и митохондриальную дисфункцию. Более того, экспрессия APOE3 уменьшала с амилоид-β ассоциированный астроглиоз коры, в то время как APOE4 способствует активации астроцитов амилоид-β-независимым образом.
Аналогично, во втором исследовании [120] микроглия мышей с нокаутом APOE4 показала повышенную экспрессию гомеостатических генов по сравнению с мышами с нокаутом APOE3, а у мышей с нокаутом APOE3, подвергшихся воздействию апоптотических нейронов, микроглия вызвала мощный фагоцитарный ответ, а микроглия APOE4 не смогла вызвать такой ответ. Удаление APOE4 в микроглии восстановило этот ответ, усилив экспрессию генов, реагирующих на болезнь. В моделях AD удаление APOE4 из микроглии уменьшило патологию tau и потерю нейронов, восстановило реактивность микроглии и уменьшило патологию амилоида. Оба исследования позволили сделать вывод, что APOE4 поддерживает микроглию в состоянии покоя, ухудшая ее способность защитно реагировать на патологию AD и усугубляя нейродегенерацию.
И старение, и APOE4 связаны с усилением воспаления мозга. Микроглия, как правило, переходит в провоспалительное состояние, выделяя такие воспалительные цитокины, как IL-1β, TNF-α и IL-6. Фагоцитарная способность микроглии снижается как с возрастом, так и при наличии APOE4. Это снижает способность микроглии очищать клетки от мусора, аномальных белков и апоптотических нейронов, способствуя накоплению амилоидных бляшек и нейродегенерации. Оба фактора могут повышать уровень окислительного стресса в микроглии, что приводит к дальнейшему повреждению клеток и дисфункции нейронов. Изменения внутриклеточных сигнальных путей наблюдаются как в стареющей, так и в APOE4-микроглии, что влияет на их способность адекватно реагировать на стимулы и поддерживать гомеостаз мозга.
У микроглии APOE4 наблюдаются изменения в липидном обмене, что негативно сказывается на функционировании клеточных мембран и внутриклеточной сигнализации. APOE4 ассоциируется с более нейротоксичными микроглиями, которые могут способствовать нейродегенерации за счет выработки токсичных веществ и активации проапоптотических путей в нейронах. Микроглия с APOE4 демонстрирует повышенное взаимодействие с амилоидными бляшками, но сниженную способность к их фагоцитозу, что способствует накоплению амилоида-β и прогрессированию AD.
Эти общие и специфические черты рисуют сложную картину старения и APOE4-измененных микроглий, подчеркивая важность понимания их динамики для разработки целевых методов лечения нейродегенеративных заболеваний, таких как AD.
Krasemann и др. (2017) [90] раскрыли важнейшую находку, связывающую приобретение микроглией фенотипа, ассоциированного с нейродегенерацией, с APOE и его опосредованием через TREM2-сигнализацию. Апоптотические клетки эффективно поглощаются микроглией во время развития нервной системы [121], что приводит к повышению экспрессии APOE, которая негативно связана с понижением регуляции гомеостатических генов [106]. Микроглия как на этапах развития, так и при нейродегенеративных заболеваниях может иметь сходные регуляторные механизмы, запускаемые отмирающими нейронами. Авторы предположили, что микроглия MGnD, амилоидные бляшки и дистрофические нейриты создают микросреду, богатую APOE, что потенциально может играть важную роль в прогрессировании AD и других нейродегенеративных заболеваний.
В этом контексте сигнальный путь TREM2-APOE играет важную роль в определении транскрипционного фенотипа дисфункциональной микроглии при заболеваниях, являясь центральным в индукции фенотипа MGnD. Активация TREM2 под действием APOE вызывает значительные изменения в экспрессии генов микроглии, а в моделях нейродегенеративных заболеваний, например у мышей APP-PS1 (модель AD), активация этого сигнального пути ассоциируется с увеличением патологических амилоидных бляшек. TREM2 - рецептор, экспрессирующийся на поверхности микроглии и играющий ключевую роль в регуляции фагоцитоза и воспалительного ответа [122]. Его активация происходит путем связывания специфических лигандов, присутствующих на поверхности апоптотических нейронов или высвобождающихся при нейродегенерации. После активации TREM2 передает внутриклеточные сигналы через адаптерный белок DAP12. Это приводит к активации различных внутриклеточных сигнальных путей и транскрипционных факторов, которые модулируют экспрессию генов, включая APOE. Индукция APOE способствует дальнейшему развитию фенотипа MGnD, характеризующегося усилением воспалительного ответа и подавлением гомеостатических генов. Кроме того, существует петля обратной связи, в которой APOE также может влиять на активность TREM2. APOE связывается с поврежденными нейронами и апоптотическими обломками, облегчая распознавание и фагоцитоз TREM2. Эта петля обратной связи поддерживает активацию TREM2 и индукцию APOE, способствуя сохранению нейродегенеративного фенотипа микроглии. Взаимосвязь TREM2-APOE можно считать специфической для микроглии сигнатурой, особенно в контексте нейродегенеративных заболеваний. Действительно, она существенно влияет на транскрипционный профиль микроглии, способствуя переходу от гомеостатического состояния к состоянию, связанному с нейродегенерацией. В моделях нейродегенеративных заболеваний, таких как AD, микроглия, связанная с амилоидными бляшками, демонстрирует фенотип MGnD, характеризующийся активацией TREM2-APOE пути. Индукция APOE тесно связана с сигналом TREM2 и накоплением амилоидных бляшек, что предполагает ключевую роль в патогенезе AD. Отсутствие APOE в фагоцитирующих микроглиях может предотвратить переход к нейродегенеративному фенотипу и поддерживать гомеостатическое состояние.
Сигнализация APOE подавляет ключевые транскрипционные факторы, участвующие в регуляции гомеостатической микроглии, такие как PU.1, MEF2a и SMAD3. Этот механизм модулирует фенотип микроглии через взаимодействие со специфическими для микроглии энхансерами [84,90].
Сигнатура TREM2-APOE не только характеризует функциональное и транскрипционное состояние микроглии, но и играет важнейшую роль в прогрессировании нейродегенеративных заболеваний, что делает ее потенциальной мишенью для целенаправленных терапевтических вмешательств.
3.9. Specific Microglia Signature
Прионные заболевания, включая болезнь Creutzfeldt–Jakob, представляют собой группу редких, но смертельных нейродегенеративных заболеваний, характеризующихся накоплением прионов в головном мозге. В предыдущих исследованиях использовались мышиные модели прионных заболеваний и образцы человеческого мозга, пораженного этими патологиями, что позволило выявить характерный признак микроглии. Она характеризуется снижением экспрессии генов, связанных с фагоцитозом, противовоспалительным ответом и очисткой от клеточного мусора. Микроглия в мозге, пораженном прионными заболеваниями, демонстрирует повышенную экспрессию провоспалительных генов, которые могут способствовать прогрессированию нейродегенерации. Исследование также выявило морфологические изменения в микроглии и модификацию важных сигнальных путей, в том числе связанных с белком TREM2. Выявленные молекулярные пути могут представлять собой потенциальные терапевтические мишени для модуляции активности микроглии и замедления прогрессирования заболевания [123,124].
Микроглиальные сигнатуры демонстрируют значительные различия в транскрипционных, функциональных и морфологических профилях между мужчинами и женщинами. Исследования по секвенированию РНК показали, что мужские и женские микроглии экспрессируют разные уровни специфических генов, участвующих в иммунном ответе, фагоцитозе, воспалении и гомеостазе. Например, провоспалительные гены, как правило, более выражены в микроглии мужчин, чем женщин. Мужские и женские микроглии могут по-разному реагировать на внешние раздражители, такие как травма или инфекция. Как правило, микроглия мужчин демонстрирует более выраженную воспалительную реакцию, в то время как микроглия женщин может иметь более модулированную и защитную реакцию. Гендерные различия в микроглии могут способствовать изменению риска и прогрессирования нейродегенеративных заболеваний. Например, при AD женская микроглия может более эффективно очищать амилоидные бляшки, чем мужская [125-127].
Физические упражнения оказывают нейропротекторное и противовоспалительное действие на центральную нервную систему, включая микроглии. Регулярная физическая активность ассоциируется с уменьшением выработки микроглией провоспалительных цитокинов. Это может способствовать уменьшению воспалительного процесса в мозге, что особенно полезно в контексте нейродегенеративных заболеваний, таких как AD и HD. Физические упражнения могут способствовать формированию противовоспалительного и нейропротекторного фенотипа микроглии. Микроглия может экспрессировать более высокие уровни генов, связанных с выработкой противовоспалительных цитокинов и фагоцитозом, улучшая способность микроглии удалять клеточный мусор и неправильно сформованные белки [128,129].
. Conclusions
Под сигнатурами микроглии понимаются специфические профили активности микроглии или экспрессии генов. Комплексный анализ профилей экспрессии генов и белков позволяет выявить специфические гены и белки, характеризующие различные состояния активации микроглии, в том числе связанные с провоспалительными и противовоспалительными состояниями. Такой подход вносит вклад в базу знаний о динамике активации микроглии как в физиологических, так и в патологических условиях. Вопрос о том, являются ли эти сигнатуры причиной или следствием связанных с микроглией нарушений в мозге, весьма актуален, поскольку понимание того, являются ли изменения в микроглии первичной причиной патологий мозга (например, нейродегенеративных заболеваний, таких как AD) или же они являются вторичным ответом на такие патологии, может существенно повлиять на терапевтические стратегии. Кроме того, понимание роли различных микроглиальных сигнатур может пролить свет на самую частую «патологию», включая, но не ограничиваясь ЦНС, которой является старение.
Мы уже обсуждали, как микроглия может стать гиперактивной или дисфункциональной, выделяя воспалительные цитокины и нейротоксические факторы, которые могут повреждать нейроны и внеклеточный матрикс. Это может способствовать патогенезу таких заболеваний, как AD и HD. Некоторые генетические мутации, например, в гене TREM2 или изоформе APOE4, могут изменять функцию микроглии, повышая вероятность повреждения мозга. В этих случаях дисфункциональная микроглия может рассматриваться как непосредственная причина заболевания. Примером этого являются так называемые микроглиопатии [19].
Микроглия может играть активную роль в формировании среды обитания нейронов. Если их деятельность изменена, они могут негативно влиять на синаптогенез, синаптическую пластичность и очистку от клеточного мусора, что приводит к дисфункции мозга. Микроглия тесно взаимодействует с нейронами, астроцитами и другими типами клеток в мозге. Изменения в этих взаимодействиях, вызванные первичными заболеваниями, могут привести к изменению сигнатур микроглии в качестве адаптивной реакции, что может усугубить заболевание.
Микроглия может активироваться в ответ на повреждение мозга или другие патологии. В этом случае изменения в их сигнатурах могут быть следствием присутствия патогенов, аномальных белковых отложений или повреждения нейронов. При нейродегенеративных заболеваниях нейровоспаление может быть вторичным ответом на первичные патологические процессы. Например, при AD микроглия может быть активирована отложениями амилоида.
Взаимосвязь между характеристиками микроглии и заболеваниями мозга, вероятно, будет двунаправленной и динамичной. В некоторых случаях дисфункциональная микроглия может активно способствовать возникновению и прогрессированию заболевания (причина), в то время как в других ситуациях она может представлять собой адаптивную или дезадаптивную реакцию на уже существующие повреждения или патологии (следствие).
Понимание этого сложного взаимодействия требует дальнейших исследований, включая продолжительные исследования и экспериментальные модели, позволяющие выделить различные факторы. Разгадка этой динамики может привести к созданию новых и более эффективных терапевтических стратегий для лечения заболеваний мозга, связанных с микроглией.
В данном обзоре были выделены основные микроглиальные сигнатуры. Очевидно, что в будущем будут выделены другие и, возможно, более сложные сигнатуры.
Наконец, если сигнатуры микроглии являются причиной, можно разработать профилактические мероприятия или методы лечения, направленные непосредственно на микроглию. Если же они являются следствием, то терапия должна быть направлена на устранение первичных причин заболевания, а микроглия будет выступать в качестве маркера прогрессирования болезни.
5. Future Perspectives
С появлением таких методов, как одноклеточное РНК-секвенирование и пространственный транскриптомный анализ, становится возможным получать все более подробные профили различных субпопуляций микроглии в различных физиологических и патологических состояниях, например, при AD, MS, HD и расстройствах аутистического спектра. Выявление специфических сигнатур для каждого состояния позволит нам отслеживать развитие заболеваний во времени и в конкретных областях мозга.
Выявление уникальных сигнатур для «про-воспалительной» или «защитной» микроглии может привести к разработке лекарств, специфически модулирующих поведение субпопуляций микроглии. Это может иметь решающее значение для лечения нейровоспалительных заболеваний, таких как болезнь Альцгеймера, при которой нарушается баланс между нейропротекторными и нейротоксичными микроглиями. Терапия может быть направлена на снижение токсичности микроглии и содействие восстановлению.
Также разрабатывается идея периферических биомаркеров, основанных на молекулах, выделяемых микроглией или модулируемых ее активностью, для диагностики или мониторинга течения заболеваний мозга. Например, специфические сигнатуры можно будет обнаружить с помощью анализа крови или спинномозговой жидкости, что сделает диагностику менее инвазивной по сравнению с существующими методами. Кроме того, использование органоидов мозга с микроглией, полученной из стволовых клеток человека, может обеспечить более подходящие модели для изучения конкретных заболеваний и сигнатур. Точная медицина может объединить профили микроглиальных сигнатур с другими молекулярными факторами для разработки персонализированных методов лечения. Например, у пациентов с нейродегенеративными заболеваниями специфическая характеристика микроглии может направить лечение препаратами, которые модулируют воспаление мозга или повреждение нейронов.
Учитывая важнейшую роль микроглии в синаптической пластичности и развитии нейронов, откроются новые возможности для изучения того, как микроглиальные сигнатуры могут влиять на такие нарушения развития, как аутизм и шизофрения. Лучшее понимание этой динамики может привести к созданию ранних терапий для коррекции микроглиальных аномалий на ранних этапах жизни. Наконец, растет интерес к разработке подходов иммунотерапии для модуляции активности микроглии. Они могут включать моноклональные антитела, направленные против специфических микроглиальных рецепторов, или использование препаратов, изменяющих сигнатуры экспрессии, чтобы сделать микроглию более нейропротективной. Кроме того, в ближайшее время будут усовершенствованы новые методы визуализации, такие как позитронно-эмиссионная томография, специфичная для микроглии, что позволит визуализировать сигнатуры микроглии у пациентов в режиме реального времени. Это может произвести революцию в мониторинге заболеваний мозга, давая представление об эффективности терапии на клеточном уровне.
|
 Рисунок 1. Гомеостатическая сигнатура микроглии выполняет функции контроля и наблюдения за состоянием нервной паренхимы. Эти функции являются региоспецифичными. В ответ на специфические внешние стимулы может формироваться воспалительный фенотип, вызывающий защитную реакцию. Противовоспалительный фенотип приводит к разрешению повреждения путем ограничения воспалительного ответа и возвращения микроглии в гомеостатическое состояние наблюдения. Старение и нейродегенеративные заболевания также могут вызывать воспалительный фенотип. Три фенотипа, представленные на рисунке, характеризуются специфическими признаками с многочисленными промежуточными состояниями между M1 и M2, которые подталкивают микроглии к более или менее воспалительной или противовоспалительной функции. Перечислены маркеры экспрессии генов для каждого состояния.
Рисунок 1. Гомеостатическая сигнатура микроглии выполняет функции контроля и наблюдения за состоянием нервной паренхимы. Эти функции являются региоспецифичными. В ответ на специфические внешние стимулы может формироваться воспалительный фенотип, вызывающий защитную реакцию. Противовоспалительный фенотип приводит к разрешению повреждения путем ограничения воспалительного ответа и возвращения микроглии в гомеостатическое состояние наблюдения. Старение и нейродегенеративные заболевания также могут вызывать воспалительный фенотип. Три фенотипа, представленные на рисунке, характеризуются специфическими признаками с многочисленными промежуточными состояниями между M1 и M2, которые подталкивают микроглии к более или менее воспалительной или противовоспалительной функции. Перечислены маркеры экспрессии генов для каждого состояния.
 Рисунок 2. В процессе старения микроглиальные реакции становятся менее интенсивными. В то время как молодые и взрослые микроглии осуществляют эффективные и адекватные реакции, стареющие микроглии уже не отвечают на стимулы должным образом. Этот измененный ответ обусловлен определенной сигнатурой, которая приводит к так называемой сенесцентной микроглии, а затем к дистрофической микроглии. Дистрофическая микроглия может способствовать нейродегенерации.
Рисунок 2. В процессе старения микроглиальные реакции становятся менее интенсивными. В то время как молодые и взрослые микроглии осуществляют эффективные и адекватные реакции, стареющие микроглии уже не отвечают на стимулы должным образом. Этот измененный ответ обусловлен определенной сигнатурой, которая приводит к так называемой сенесцентной микроглии, а затем к дистрофической микроглии. Дистрофическая микроглия может способствовать нейродегенерации.
 Figure 3. The pathological signatures of microglia show a complex relationship. Functional microglia in adults are subjected to physiological aging phenomena (red arrows), which can directly determine a senescent/dystrophic phenotype (black arrows) with a decreased ability to perform their functions and with cognitive and physical decline that is not caused by a neurodegenerative pathology. Aging microglia can also acquire a neurodegenerative signature (red arrows) with a frankly neurodegenerative phenotype, which will consequently determine a dystrophic phenotype (red arrows), worsening the pathology. Furthermore, functional microglia can acquire a senescent/dystrophic phenotype (yellow arrow), a prelude to non-aging neurodegenerative diseases or acquire a neurodegenerative signature such as, but not limited to, in type II microgliopathies (green arrow).
Figure 3. The pathological signatures of microglia show a complex relationship. Functional microglia in adults are subjected to physiological aging phenomena (red arrows), which can directly determine a senescent/dystrophic phenotype (black arrows) with a decreased ability to perform their functions and with cognitive and physical decline that is not caused by a neurodegenerative pathology. Aging microglia can also acquire a neurodegenerative signature (red arrows) with a frankly neurodegenerative phenotype, which will consequently determine a dystrophic phenotype (red arrows), worsening the pathology. Furthermore, functional microglia can acquire a senescent/dystrophic phenotype (yellow arrow), a prelude to non-aging neurodegenerative diseases or acquire a neurodegenerative signature such as, but not limited to, in type II microgliopathies (green arrow).
 Figure 4. APOE and microglia. The homeostatic microglia signature is characterized by low APOE expression. On the other hand, DAM and MGnD signatures are characterized by high APOE expression and TREM2 signaling. The APOE-Trem2 axis regulates the microglia responses and in APOE or TRE2M knockout mice, the microglia response to brain tissue damage is severely blunted. The DAM signature is conserved in aging and neurodegenerative diseases and is triggered by apoptotic neurons and other cellular debris that accumulate in brain tissue damage. Gene expression markers for each condition are listed.
Figure 4. APOE and microglia. The homeostatic microglia signature is characterized by low APOE expression. On the other hand, DAM and MGnD signatures are characterized by high APOE expression and TREM2 signaling. The APOE-Trem2 axis regulates the microglia responses and in APOE or TRE2M knockout mice, the microglia response to brain tissue damage is severely blunted. The DAM signature is conserved in aging and neurodegenerative diseases and is triggered by apoptotic neurons and other cellular debris that accumulate in brain tissue damage. Gene expression markers for each condition are listed.