|
|
|
Габриель Ортобаги и Франсиско Эстева
В МИРЕ НАУКИ, №9 (сентябрь), С. 57-63, 2008
|
|
Новейшие методы целевой терапии
позволяют подобрать наиболее
эффективную для больного схему лечения
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Molecular Oncology of Breast Cancer. Edited by Jeffrey S. Ross and Gabriel N.
Hortobagyi. Jones and Bartlett Publishers, 2005.
Long-Term Cardiac Tolerability of Trastuzumab in Metastatic Breast Cancer: The
M.D. Anderson Cancer Center Experience. Valentina Guarneri et al. in Journal of
Clinical Oncology, Vol. 24, No. 25, pages 4107- 4115; September 1, 2006.
Trastuzumab: Triumphs and Tribulations. Rit a Nahta and Francis co J. Es teva in
Oncogene, Vol. 26, No. 25, pages 3637–3643; May 28, 2007.
Advances in the Treatment of Breast Cancer. Stacy Moulder and Gabriel N. Hortobagyi
in Clinical Pharmacology & Therapeutics, Vol. 83, No. 1, pages 26–36; January 2008.
|
Рак молочной железы стоит по частоте встречаемости на первом месте среди онкологических заболеваний у женщин и на втором (после рака легких) по числу унесенных жизней. Но, в отличие от рака легких, в лечении
больных раком молочной железы достигнут значительный прогресс: продолжительность жизни женщин с этим недугом за последние 10 лет существенно увеличилась,и вскоре болезнь лишится своего «почетного» второго места.
Отчасти так ой прогресс связан с более ранней, чем прежде, диагностикой заболевания благодаря регулярному скринингу пациенток. Однако во многом он определяется успехами в исследовании самого патологического процесса и расширением спектра препаратов, комбинируя которые,
|
ОСНОВНЫЕ ПОЛОЖЕНИЯ
Благодаря своевременному обнаружению опухолей молочной железы и появлению
целевых противоопухолевых препаратов продолжительность жизни больных этим смертельным недугом в развитых стра нах неуклонно в озрастает.
Многие новые препараты имеют строго направленное действие, что позволяет подбирать схему лечения в соответствии с молекулярными особенностями опухоли.
Новообразования в молочной железе стали первыми солидными опухолями, для борьбы с которыми были применены препараты направленного действия. Достигнутые успехи вселяют на дежду на то, что подобный подход можно будет исп ользовать и в случае опухолей другой локализации. |
врач может подобрать схему, оптимальную для каждой больной. Появилась и такая возможность, к ак адресная
доставка лекарственного вещества к специфическим молекулам новообразования. Опухоль молочной железы стала первой солидной опухолью, для борьбы с которой был применен данный подход. Произошло этов 1998 г., когда в распоряжении врачей оказался препарат трастузумаб (герцептин). Его мишень, белок HER2, стимулирует опухолевый рост, и ускоренное его образование не сулит больной ничего хорошего. Теперь ситуация в корне изменилась — у клиницистов появилось новое оружие против новообразований такого типа.
Следующее десятилетие обещает быть продуктивным для прицельной противораковой терапии. Уже сейчас на животных и больных раком проводятся испытания целого ряда новых препаратов, мишенью которых являются разнообразные молекулы опухоли, играющие определенную роль в ее появлении и росте. Сочетание усовершенствованных традиционных методов и лекарственных средств нового поколения позволит клиницистам подбирать схему лечения, учитывающую молекулярные особенности опухоли и тот факт, что рак молочной железы — комплексное заболевание.
Нынешнее положение дел
Результаты прицельной химиотерапии, учитывающей молекулярные особенности конкретной опухоли, впечатляют, однако не следует забывать и о вкладе в увеличении продолжительности жизни больных раком молочной железы традиционных методов диагностики и лечения. Так, усовершенствование техники сканирования позволяет выявлять болезнь на более ранних стадиях, чем раньше. Это крайне важно, поскольку рак молочной железы относится к числу
онкологических заболеваний, хорошо поддающихся лечению в самом начале развития патологического процесса. В последнее время широкое распространение получила цифровая маммография, гораздо более чувствительна я, чем обычная. Женщины из группы риска проходят ежегодное МРТ-сканирование, хотя по-прежнему при обнаружении каких-либо аномалий при маммографическом или физикальном обследовании проводится ультразвуковая диагностика.
За последние 20 лет хирургическая практика также претерпела серьезные изменения: вместо полного удаления молочной железы даже при поражении небольшой ее части сегодня стараются ограничиваться в подобных случаях л учевой и химиотерапией. Облучение при этом носит строго направленный характер, что позволяет избежать поражения здоровых тканей и органов (прежде всего — легких и сердца).
Более изощренной стала и системная терапия, используемая как адъювантное (вспомогательное)средство. Теперь в арсенале онкологов имеются разнообразные современные препараты, обладающие меньшим побочным действием. Целью адъювантной терапии служит уничтожение раковых клеток, уцелевших после операции или облучения. Как правило, ее применение совершенно необходимо, поскольку даже опухоли небольших размеров дают микроскопические метастазы в разных частях тела. Атакуя невидимые точки опухолевого роста, адъювантная терапия продлевает жизнь больного.
Ее широко применяют и в тех случаях, когда болезнь вышла за рамки начальной стадии. В 1970-х гг. усилиями онкологов, рентгенологов и других специалистов, в число которых входили и авторы данной статьи, был разработан подход к лечению больных с инвазивной опухолью молочной железы. Обычно та кие люди попа дают в поле зрения врачей слишком поздно. Наш подход заключался в проведении неоадъювантной химиотерапии, благодаря которой опухоль уменьшалась до операбельных размеров, последующем ее удалении и назначении лучевой и химиотерапии. Применение метода «сэндвича» значительно повысило число излеченных больных в последние 30 лет. Даже те, у кого на момент диагностирования имеются метастазы, теперь получают шанс прожить достаточно долго.
Другое направление в лечении — гормонотерапия. Она эффективна по крайней мере в тех случаях, когда опухоль реагирует на эстроген или прогестерон. Гормонотерапию начали применять в 1890-х гг., когда было замечено обратное развитие опухолей молочной железы на поздних стадиях после удаления яичников женщинам в пременопаузе. В 1966 г. в различных тканях были идентифицированы рецепторы гормонов. Как показали дальнейшие исследования, до 75% опухолей молочной железы содержали эстрогеновые или прогестероновые рецепторы либо рецепторы обоих типов. Скоро они стали мишенью для химиотерапевтических препаратов.
В 1977 г. впервые для этой цели был использовано новое лекарственное средство — тамоксифен. Оно связывалось с рецепторами эстрогена и предназначалось для лечения пациенток в постменопаузе с опухолью молочной железы, реагирующей на данный гормон. Сегодня его применяют как в лечебных целях, так и для профилактики среди пациентов группы риска. Для женщин в постменопаузе еще более эффективными оказались ингибиторы фермента ароматазы, подавляющие выработку эстрогена в организме.
Итак, рецепторы эстрогена и прогестерона стали первыми молекулярными мишенями для лекарственных веществ, однако они принципиально отличаются от идентифицированных в последние 10 лет . Рецепторы стероидных половых гормонов стимулируют пролиферацию клеток не только здоровых,
|
ИНТЕРЕСНЫЕ ФАКТЫ
Мутации в гене BRCA1 повышают вероятность развития рака молочной железы на протяжении жизни в 10 раз, но только в прошлом году стало ясно, почему это происходит. Продукт гена BRCA1 участвует в репарации ДНК, и когда он перестает функционировать, в других генах накапливаются повреждения, способные привести к превращению клетки в раковую.
В 2002 г. был опубликован доклад, в котором сообщалось о повышении частоты заболеваемости раком молочной железы среди женщин, получавших гормонозаместительную терапию, в связи с чем ее применение было резко ограничено. Уже через год число диагностированных в США случаев инвазивных форм рака снизилось на 7,3%, а не-
инвазивных — на 5,5%. | |
но и опухолевых тканей, так что подавление их способности передавать сигналы к росту действительно помогает «держать опухоль в узде». Изменение конформации рецепторов или их функций иногда тоже позволяет влиять на свойства раковых клеток. Однако гены, кодирующие рецепторные белки, редко подвергаются мутациям, а это значит, что не они отвечают за раковую трансформацию клеток.
По-видимому, самым значимым событием в онкологии в «постгормональную» эру стало обнаружение генов (сегодня их называют онкогенами), изменения в которых запускают раковый процесс. Онкогенные мутации, например небольшие изменения в нуклеотидной последовательности в ДНК, могут вывести из строя ген-протектор или активировать онкоген. Иногда клеточная ДНК утрачивает целые гены, а какие-то гены напротив многократно дуплицируются (врезка на стр. 63).
Опухоли можно классифицировать в соответствии с тем, какие гены в их клетках становятся излишне активными или подавленными, и как изменяется поведение кодируемых этими генами белков (становится их больше или меньше,приобретают они новые функции или утрачивают старые и т.д.). Измененные гены могут быть неодинаковыми для разных опухолей. Такая гетерогенность лежит в основе различий в поведении опухолей молочной железы у разных больных. Одни опухоли обладают ограниченной инвазивностью и почти не дают метастазов, другие быстро разрастаются и образуют очаг и роста в разных частях тела. Определив молекулярный профиль конкретной опухоли, можно направленно воздействовать на те механизмы, которые играют основную роль в развитии патологического процесса, выбрав из широкого спектра препаратов ограниченный набор, оптимальный для данного больного. Эффективность такого подхода иллюстрируют успехи, достигнутые в результате использования трастузумаба и других лекарств, мишень которых — белок HER2.
| |
|
ОБ АВТОРАХ
Габриель Ортобаги (Gabriel N. Hortobagyi) — в недавнем прошлом президент Американского общества клиницистов-онкологов, сейчас профессор в области медицинских аспектов онкологических заболеваний молочной железы, руководит междисциплинарной исследовательской программой в Онкоцентре М. Андерсона при Техасском университете. Франсиско Эстева (Francisco J. Esteva) заведует лабораторией по изучению опухолей молочной железы
в этом же центре, является также ассистентом профессора в отделении молекулярной и клеточной онкологии и занимается «наведением мостов» между фундаментальными исследованиями и практической онкологией. |
Цель — белок HER2
В начале 1980-х гг. исследователи из Массачусетсского технологического института обнаружили мутантную форму гена, кодирующего HER2, в клетках опухолей нервной ткани крыс и назвали данный онкоген Neu. Вскоре выяснилось, что он представляет собой аналог вирусного гена ERBB, идентифицированного ранее, и теперь его обозначают как ERBB2. Белковый продукт гена ERBB2 близок к одному из мембранных белков, рецептору фактора роста эпидермиса (РФРЭ). Когда был изолирован человеческий вариант ERBB2-гена, он был назван геном рецептора фактора роста эпидермиса человека 2 (HER2, от англ.
human epidermal growth receptor 2).
Как оказалось, белки семейства РФРЭ активно участвуют в пролиферации клеток целого ряда опухолей. Присоединив соответствующий активатор, они посылают клетке сигнал, который запускает каскад межмолекулярных взаимодействий, включающих цепочку генов.
Избыточная активность определенных белков и генов в клетках опухоли молочной железы запускает цепочку межмолекулярных взаимодействий, которые стимулируют пролиферацию клеток и способствуют их выживанию в неблагоприятных условиях. К числу таких белков относятся в первую очередь поверхностные клеточные рецепторы
HER2 (из семейства рецепторов фактора роста эпидермиса, РФРЭ) и РИФР-1 (рецептор инсулиноподобного фактора роста)
ПРОЦЕСС ПОШЕЛ
Рецептор, присоединивший фактор роста, образует димер с соседним рецептором на клеточной поверхности. Фермент
тирозинкиназа фосфорилирует каждый рецептор, что служит сигналом к началу клеточной пролиферации. Таким образом, рецепторы факторов роста являются важной мишенью для противоопухолевых препаратов
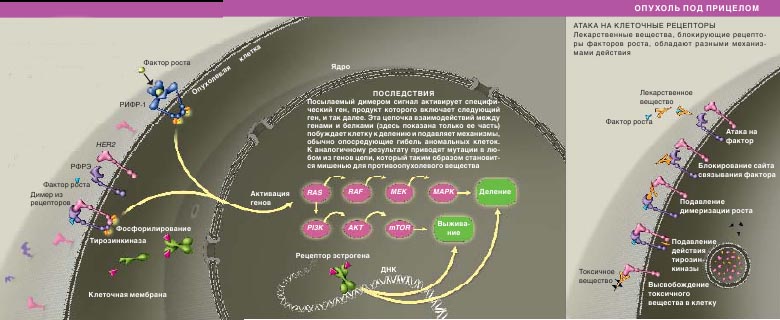 Подобно другим рецепторам факторов роста, эстрогеновый рецептор после присоединения лиганд а образует димер с соседним рецептором. Эта пара посылает сигнал ДНК (справа) к включению генов, обеспечивающих пролиферацию клеток и их выживание
Подобно другим рецепторам факторов роста, эстрогеновый рецептор после присоединения лиганд а образует димер с соседним рецептором. Эта пара посылает сигнал ДНК (справа) к включению генов, обеспечивающих пролиферацию клеток и их выживание
Вскоре после идентификации HER2-гена выяснилось, что в клетках опухоли молочной железы он часто дуплицирован, и чем больше число его копий, тем хуже прогноз.
Лабораторные исследования подтвердили это наблюдение: введение нескольких копий HER2-гена в нормальную клетку часто приводит к ее раковой трансформации, т.е. данный ген относится к категории онкогенов. Обнаружилось, что примерно 20% опухолей молочной железы продуцируют белок HER2 в избыточном количестве. В конце
1980-х гг. исследователи из фирмы Genentech, работая над получением моноклональных антител, которые связываются с рецептором HER2 и блокируют его активацию, создали препарат трастузумаб. Как показали клинические испытания, он увеличивал продолжительность жизни больных с опухолью молочной железы как на начальных, так и на поздних стадиях.
Окрыленные успехом, фармакологи продолжили работу и создали еще несколько препаратов на основе антител. Среди них — пертузумаб, который связывается с другим сайтом HER2, нежели трастузумаб, и блокирует его взаимодействие с соседним рецептором этого же семейства. Такое блокирование разрывало цепочку, по которой рас-
пространялся сигнал к пролиферации. Более того, было пока зано, что совместное введение трастузумаба и пертузумаба приводило к массовой гибел и раковых клеток, синтезирующих HER2 в избыточном количестве.
Еще один способ использования антител к рецептору HER2 состоит в присоединении к ним вещества с сильным токсическим действием. Как только пара токсин/антитело поглощается клеткой, токсин высвобождается и разрушает ее. Данный способ доказал свою эффективность в борьбе с таким грозным заболеванием, как острый миелолейкоз; проводятся так же его клинические испытания на больных с метастазирующими опухолями молочной железы.
Для того чтобы РФРЭ приобрел способность передавать клетке сигнал ы к пролиферации, его внутриклеточный домен должен быть фосфорилирован. Фермент тирозинкиназа, катализатор этой реакции, также является мишенью для противоопухолевых веществ, и целый ряд фармацевтических компаний уже проводят клинические испытания ее блокаторов. Один из них, лапатиниб (тикерб), оказывает двойное действие: он блокирует клеточную пролиферацию и стимулирует массовую гибель клеток опухолей молочной железы в культуре.
Из всего сказанного следует, что для повышения эффективности нацеленной на HER2 терапии имеет смысл использовать комбинацию таких препаратов, как трастузумаб и один из ингибиторов тирозинкиназы, например лапатиниб. Как показывают опыты с использованием культуры клеток опухоли молочной железы, при этом сдерживается пролиферация и повышается частота гибели раковых клеток. Даже те клеточные мишени, в которых после длительной инкубации с трастузумабом возникал а резистентность к нему, были по-прежнему чувствительны к лапатинибу. Недавно закончилась III фаза масштабных клинических испытаний на пациентках с HER2-гиперпродуцирующей опухолью, давшей многочисленные метастазы и резистентной к трастузумабу. Показано, что
комбинация лапатиниб/капецитабин приостанавливает процесс на срок вдвое больший, чем один только капецитабин. Учитывая это, FDA в 2007 г. выдало разрешение на применение данной комбинации для лечения пациенток с метастазирующей опухолью молочной железы. В настоя щее время проверяется возможность использования лапатиниба в качестве адъюванта при других состояниях опухоли. Аналогичную проверку проходят и альтернативные ингибиторы тирозинкиназы.
Поиск разных способов воздействия на од ни и те же мишени крайне важен, т.к. раковые клетки часто прибегают к ухищрениям, позволяющим ускользнуть от того или иного препарата. Сейчас онкологи пытаются выяснить, как и почему раковая клетка становится нечувствительной к трастузумабу. С учетом этой информации фармакологи будут вести поиск новых лекарственных средств для лечения больных с HER2-гиперпродуцирующими опухолями.
Опыты на лабораторных животных и культурах клеток, проводимые в нашей лаборатории, показал и, что раковые клетки обладают целым арсеналом средств, благодаря которым они выживают в присутствии трастузумаба. Среди них повышение уровня рецепторов других факторов роста, например инсулиноподобного фактора роста 1 (ИФР-1). Следует иметь в виду и тот факт, что клетки могут включать ген-супрессор PTEN, опосредующий подавление опухолевого роста. В норме продукт данного гена блокирует путь, позволяющий раковым клеткам игнорировать сигналы, которые «призывают» их к массовой гибели. Нам также встречались клетки, утратившие сайт связывания трастузумаба с HER2-рецептором.
Таким образом, выявление новых мишеней для препаратов, атакующих HER2-гиперпродуцирующие опухоли, а также мишеней в остальных 80% новообразований, которые несут мутации в HER2-генах, — приоритетная задача онкологов.
Пополнение арсенала
К числу наиболее перспективных с точки зрения химиотерапии мишеней, расположенных на поверхности клеток опухолей молочной железы, относится рецептор инсулиноподобного фактора роста РИФР-1. Мишенями являются и его лиганды — сами факторы роста (ИФР-1 и ИФР-2). Установлено, что увеличение концентрации ИФР-1 в крови коррелирует с повышением вероятности развития опухолей молочной железы, а многие лабораторные и клинические исследования указывают на роль рецепторов этого гормона в возникновении новообразований в других органах. Рецептор ИФР-1 участвует в регуляции разнообразных внутриклеточных процессов, в частности в формировании клетки и ее передвижении, а так же защищает клетку от гибели под действием неблагоприятных факторов. Посылаемые им сигналы опосредуют устойчивость к лучевой и химиотерапии. Как показа ли опыты на животных, блокирование рецепторов ИФР-1 во время таких процедур повышает чувствительность к ним раковых клеток. Исследуется также возможность использования ИФР-1-рецепторов как инструмента для предотвращения развития резистентности к другим терапевтическим препаратам — гормонам, трастузумабу и лапатинибу. Обмен информацией
межд у РИФР-1 и рецепторами других факторов роста (например, эстрогена, HER2, ФРЭ) — необходимая предпосылка к возникновению и развитию опухолей молочной железы. Взаимозависимость различных внутриклеточных сигнальных
путей, по-видимому, сказывается и на резистентности к различным видам воздействия на опухоль. По нашим данным, блокирование ИФР-1-рецептора с помощью какого-нибудь моноклонального антитела приводит к восстановлению чувствительности клеток к трастузумабу и прерывает связь между ИФР-1- и HER2-рецепторами. Кроме того, инактивация ИФР-1-рецептора вызывает гибель резистентных клеток. Далее, лапатиниб, по-видимому, оказывает ингибирующее действие на рецептор ИФР-1 в резистентных к трастузумабу клетках. Это предполагает, что его способность ограничивать пролиферацию клеток определяется не только подавлением активности рецепторов ФРЭ и HER2, но и прямым блокированием рецептора ИФР-1.
Сигнальная сеть, охватывающая рецепторы, о которых мы только что говорили, и процессы, управляющие поведением клетки (ее пролиферацией или противостоянием суициду несмотря на повреждение ДНК),устроена чрезвычайно сложно. Однако удалось установить, что те самые ключевые гены, которые под держивают работоспособность сети, в раковых клетках очень часто несут мутации или неправильно функционируют. Среди них ген PI3K,чей продукт химически модифицирует другой белок, АКТ, который в свою очередь модифицирует комплекс под названием mTOR (от англ.mammalian target of rapamycin, мишень рапамицина у млекопитающих). Цепочка PI3K-AKT-mTOR участвует в расщеплении глюкозы и других важных клеточны х процессах, и в раковых клетках она гиперактивирована, что увеличивает их выживаемость. Распространенность данного метаболического пути сдерживает применение в клинике препаратов, которые его блокируют, поскольку разрушены будут не только раковые, но и нормальные клетки.
Тем не менее некоторые mTOR-ингибиторы проходят клинические испытания — не только сами по себе, но и как компоненты комбинированной терапии. Результаты исследований, в которых применялся один из таких ингибиторов, антибиотик рапамицин, в сочетании с ингибитором ИФР-1-рецептора, дают основания полагать, что подобная терапия более эффективна, чем монотерапия.
Другой многообещающий подход — комбинирование препаратов, один из которых нацелен на саму опухоль, а другие — на ее окружение. Опухоль секретирует разнообразные факторы роста, которые привлекают к ней эндотелиальные клетки, участвующие в создании сети кровеносных сосудов. Избыточное образование таких важных сигнальных молекул, как фактор роста сосудистого эндотелия (ФРСЭ), делает опухоль более агрессивной и повышает ее инвазивность. Компания Genentech разработала препарат бевацизумаб (авастин), монокло-
ПРИЦЕЛЬНАЯ ТЕРАПИЯ

нальное антитело к ФРСЭ, который в 2004 г. был впервые использован для лечения больных, страдающих раком прямой кишки. Клинические испытания препарата на пациентах с раком молочной железы на поздних стадиях показали его ограниченную эффективность, но если больные получали помимо этого капецитабин, то результаты были намного лучше (см.: Джаин Р. Укоротите сосуды — и болезнь отступит // ВМН, № 4, 2008). Далее, показано, что метастазирующая HER2-негативная опухоль молочной железы развивалась медленнее, если больные получали одновременно паклитаксел и бевацизумаб вместо одного паклитаксела. Недавно было выдано разрешение на применение бевацизумаба для лечения больных раком молочной железы. Продолжается также тестирование других ингибиторов фактора роста сосудистого эндотелия, среди них — ингибитор тирозинкиназы сунитиниб (сутент) фирмы Pfizer, мишенью которого служит рецептор ФРСЭ.
Не прекращаются также и фундаментальные биологические исследования канцерогенеза, которые позволят обнаружить новые уязвимые места в опухолях. Тэруми Кови-Сигэмацу (Terumi Kohwi-Shigematsu) из Национальной лаборатории Лоуренса в Беркли идентифицировала ген SATB1, который служит «главным регулятором» активности более 1 тыс. генов, влияющих на образование метастазов при опухолях молочной железы. Как показала Кови-Сигэмацу, наличие белка SATB1 — необходимое и достаточное условие запуска процесса метастазирования. Возглавляемая ею группа уже занимается созданием ингибитора этого белка; его клинические испытания начнутся в ближайшие годы.
Прогресс в области прицельной и персонифицированной терапии во многом зависит от того, насколько успешными будут работы по созданию методов определения молекулярного профиля опухолей. Хорошими инструментами прогнозирования станут составление карты активности генов, а также тесты на способность организма пациентки метаболизировать лекарственные вещества. Особенно остро стоит эта проблема для тамоксифена, который должен перейти в активную форму уже после введения больной. Известны случа и, когда пациентка является носителем мутаций, замедляющих данный процесс.
Испытания различных комбинаций лекарственных препаратов также не утратил и своей актуальности. По их результатам можно будет судить об эффективности применения многоцелевой терапии в тех или иных случаях. Так, недавно начался набор добровольцев из 50 стран для тестирования трастузумаба как такового и в сочетании
с другими препаратами (врезка на
этой стр.).
|
ВСЕМ МИРОМ
Вся мощь прицельной терапии проявляется тогда, когда используется сразу несколько препаратов, каждый из которых направлен на свою мишень. Клинические испытания различных комбинаций позволяют определить, какие из
них наиболее эффективны при разных типах опухолей, и выявить взаимодействия между компонентами. Однако такие мероприятия очень трудоемки,и иногда проходит несколько лет, прежде чем удается получить статистически достоверные данные. Для решения этой проблемы был создан международный консорциум со штаб-квартирами в США и Европе, который должен организовать масштабные клинические испытания в 50 странах в рамках программы ALTTO (Adjuvant Lapatinib и/или Trastuzumab Treatment Optimization Study). Набор добровольцев в США уже начался. Предполагается, что в 1,5 тыс.центрах больные раком молочной железы на стадии I или II с гиперпродукцией белка HER2 будут проходить курс химиотерапии и получать либо трастузумаб или лапатиниб, либо сначала один препарат, потом другой, либо оба препарата одновременно. В ходе испытаний можно будет впервые сравнить два HER2-специфичных препарата с различающимися механизмами действия.
В тестировании примут участие 8 тыс. женщин со всех континентов, что позволит быстро получить результаты и тут же применить их на местах. Кроме того, можно будет выявить различия в эффективности действия препаратов и их токсичности для разных этнических групп. В результате лечащие врачи смогут подбирать схему лечения с учетом особенностей и генетики пациентки, и самой опухоли
|
Осознание важности фундаментальных исследований патогенеза новообразований в молочной железе и поисков новых способов борьбы с ними уже принесло свои плоды. Стоит только сравнить состояние дел в этой области с тем, чего удалось достичь за последние 10 лет в лечении больных раком легких или головного мозга. Сегодня врачи могут подбирать схему лечения, ориентируясь на молекулярные особенности конкретной опухоли молочной железы, и использовать те препараты и их комбинации, которые лучше всего подходят для данной ситуации. Благодаря этому в последние годы удалось значительно увеличить среднюю продолжительность жизни пациенток, и есть основания полагать, что в следующем десятилетии прогресс будет еще более ощутимым.
Перевод: Н.Н. Шафрановская
 Подобно другим рецепторам факторов роста, эстрогеновый рецептор после присоединения лиганд а образует димер с соседним рецептором. Эта пара посылает сигнал ДНК (справа) к включению генов, обеспечивающих пролиферацию клеток и их выживание
Подобно другим рецепторам факторов роста, эстрогеновый рецептор после присоединения лиганд а образует димер с соседним рецептором. Эта пара посылает сигнал ДНК (справа) к включению генов, обеспечивающих пролиферацию клеток и их выживание  нальное антитело к ФРСЭ, который в 2004 г. был впервые использован для лечения больных, страдающих раком прямой кишки. Клинические испытания препарата на пациентах с раком молочной железы на поздних стадиях показали его ограниченную эффективность, но если больные получали помимо этого капецитабин, то результаты были намного лучше (см.: Джаин Р. Укоротите сосуды — и болезнь отступит // ВМН, № 4, 2008). Далее, показано, что метастазирующая HER2-негативная опухоль молочной железы развивалась медленнее, если больные получали одновременно паклитаксел и бевацизумаб вместо одного паклитаксела. Недавно было выдано разрешение на применение бевацизумаба для лечения больных раком молочной железы. Продолжается также тестирование других ингибиторов фактора роста сосудистого эндотелия, среди них — ингибитор тирозинкиназы сунитиниб (сутент) фирмы Pfizer, мишенью которого служит рецептор ФРСЭ.
нальное антитело к ФРСЭ, который в 2004 г. был впервые использован для лечения больных, страдающих раком прямой кишки. Клинические испытания препарата на пациентах с раком молочной железы на поздних стадиях показали его ограниченную эффективность, но если больные получали помимо этого капецитабин, то результаты были намного лучше (см.: Джаин Р. Укоротите сосуды — и болезнь отступит // ВМН, № 4, 2008). Далее, показано, что метастазирующая HER2-негативная опухоль молочной железы развивалась медленнее, если больные получали одновременно паклитаксел и бевацизумаб вместо одного паклитаксела. Недавно было выдано разрешение на применение бевацизумаба для лечения больных раком молочной железы. Продолжается также тестирование других ингибиторов фактора роста сосудистого эндотелия, среди них — ингибитор тирозинкиназы сунитиниб (сутент) фирмы Pfizer, мишенью которого служит рецептор ФРСЭ.