Посещений: 
ПАТОЛОГИЯ МЕЖПОЗВОНОЧНЫХ ДИСКОВ
CRISPR/Cas9 редактирование генома
The potential of CRISPR/Cas9 genome editing for the study and treatment of intervertebral disc pathologies Olga Krupkova,Elena Cambria,Lenka Besse et al.
 JOR Spine 15 March 2018
https://doi.org/10.1002/jsp2.1003
| |
|
DISC DEGENERATION: THE NEED FOR NOVEL TREATMENTS
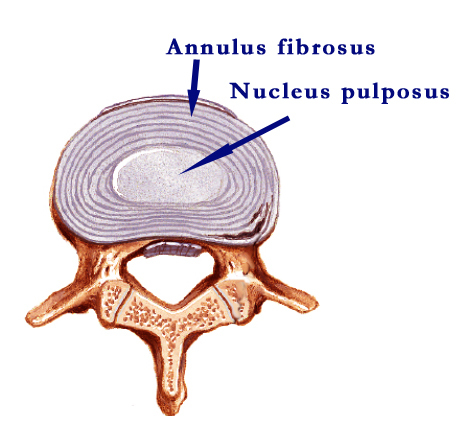
Дегенерация межпозвонковых дисков (IVD) является связанным с возрастом процессо, который характеризуется катаболическим сдвигом, приводящим к разрушению матрикса и в конечном итоге к структурной недостаточности. iВидимые дегенеративные изменения впервые появляются в nucleus pulposus (NP) и связаны со сдвигом от коллагена типа II к более фиброзному типу коллагена I, а также с редукцией протеогликанов и последующей потерей гидротации и высоты диска.1 Однако, annulus fibrosus (AF) также подвергаются дегенеративным изменениям, на что указывает дизорганизация ламеллярной структуры, возможно приводящая к структурным дефектам, таким как расщепления и слезы (tears).2 Измененный биохимический статус во время дегенерации вносит вклад в развитие тканевых повреждений путем возникновения областей с пиками напряжения, воздействующих на дизинтегрированную ткань гиперфизиологическими нагрузками, которым невозможно противостоять.3 Поскольку IVD обладают низкой регенеративной способностью и заживление возможно только на месте наружной части AF, где доставка питательных веществ наибвысшая, дегенерация постепенно прогрессирует при отсутствии лечения.
Хотя дегенерация дисков является главной причиной болей в спине, только у части она становится симптоматичной и ощущается как т. наз degenerative disc disease (DDD), которая связана с повышением давления воспалительных молекул, включая interleukins IL-1β, IL-8, and IL-6 и tumor necrosis factor (TNF)-α
(rev. References 4-7). В этот момент пациенты, страдающие от DDD первоначально лечатся консервативно, т.е. с помощью физиеотерапии и аналгетиков, но может быть также подвергнута дискэктомии, если симптомы не снижаются. Т.о., современное лечение нацелено на симптомы, но не подлежащие молекулярные процессы, вызывающие дегенерацию дисков и боли. Поэтому оновные усилия направлены на разработку новых, биологически нацеленных опций, с упором на 2 подхода: с одной стороны, регенеративная терапия для противодействия дегенеративному процессу пока без ясных результатов. Использование клеточной терапии, напр., лечение стволовыми клетками. негативно затрагивает микроокружение IVD, это характеризуется высокими механическими нагрузками, воспалительными цитокинами, гипоксией, низкими уровнями глюкозы, кислым pH и высокой осмолярностью.8 Использование анаболических субстанций приводит к затруднению продукции внеклеточного матрикса (ECM) из-за низкого количества клеток внутри IVD (4000 cells/mm3 в NP и 9000 cells/mm3 в AF) и ещё более из-за того, что эти немногие клетки метаболически не очень активн.9, 10 Результатом инъекций классических анаболических факторов, таких как bone morphogenetic protein (BMP)-7;, transforming growth factor (TGF)-β или growth differentiation factor (GDF)-5 становятся ещё большие проявления из-за короткогой полу-жизни этих ростовых факторов и их быстрой диффузии из IVD.8
С др. стороны многочисленные недавние исследования сфокусированы на способах модуляции воспаления в IVD, в основном путем подавления воспалительного каскада (напр., epigallocatechin gallate [EGCG], resveratrol или piperine) 11-13 или путем нейтрализации воспалительных медиаторов (напр., infliximab, a TNF-α ингибитор 14). Хотя такие молекулярные воздействия составляют новые способы молекулярной модуляции болезни, их успех скорее неудовлетворителен особенгно из-за повторяющихся инъекций лекарств в IVD. 15
2 TARGETED GENOME EDITING BY CRISPR/CAS9
геномное редактирование приводит к стабильному фенотипическому изменению и поэтому может постоянно устранять лежащуют в основе болезни причину болезни. Техника точного генетического репрограммирования обладает огромным потенциалом изменения традиционного "симптоматического" лечения не только моногенных болезней, но и также связанных с фозрастом и цивилизацией нарушений. Кроме того, эти техники могут быть применены к базовым и преклиническим исследованиям, чтобы генерировать болезненные фенотипы in vitro и in vivo/ Кстати, известная техника геномного редактирования базируется на ДНК-связывающих нуклеазах, а именно преобразованной Zinc Finger Nucleases (ZFN) и Transcription Activator-like Effector Nucleases (TALEN), а также на наводящих РНК нуклеазах, особенно Clustered Regulatory Interspaced Short Palindromic Repeats-associated Cas9 (CRISPR/Cas9).16 ZFNs и TALENs были использованы для непосредственгой коррекции мутаций, вызывающих болезни, связанные с гемофилией B или серповидно-клеточной болезнью. ZFN- и TALEN-базирующиеся терапии продемонстрировали успешность в клинических испытаниях, напр., для HIV, подтвердив потенциал геномного редактирования для использования в базовой науке, медицине и биотехнологии. Однако, их основным неудобством стали связанные с ними с проблемы (относительно затруднительная подготовка функциональных ДНК-связывающих нуклеаз) и затраты, связанные с их разработкой и развитием.17, 18 CRISPR/Cas9 вызывает разрывы двойной нити ДНК (DSB) в геномном локусе мишени, её легче препарировать и перепрограммировать.
Система CRISPR/Cas9 состоит из бактериальной эндонуклеазы Cas9, которая может быть напрправлена на любую последоваательность ДНК c помощью single-guide RNA (sgRNA). sgRNA - это короткая синтетическая РНК, состоящапя из каркасной последоваательности, необходимой для связывания Cas9, т.е. crRNA, петли, и транс-активирующей crRNA (tracrRNA), и польтзователем определяемый вариабельный в 17-20 нуклеотидов спейсер, определяющий мишень в геноме для модификации. 20 Короткий нуклеотидный спейсер в sgRNA является комплементарным последоваательности мишени в ДНК генома в тесной близи к protospacer adjacent motif (PAM)? который, в случае Cas9 получен из Streptococcus pyogenes, он законсервирован в виде NGG последоваательности. Однако, PAM не является частью gRNA т.к. он присутствует только в нижестоящей ДНК мишени (Figure 1). 21, 22 Распознавание ДНК мишени гарантируется формированием гетеродуплекса между нуклеотидами спейсера из sgRNA и комплементарной нитью ДНК мишени, это сопровождается обеспечиваемым c помощью Cas9 разрезами ДНК. 23 Обычно дикого типа Cas9 обнаруживает активность по разрезанию двунитчатой ДНК, обеспечиваемой двумя дорменами, RuvC и HNH. 24 По сравнению с др. компонентами наведения программируемая нуклеаза воздействует целенаправленно на ДНК локус, разработка и синтез sgRNA довольно просты и подходящи по цене. Однако sgRNA всё ещё может распознавать в геноме схожие одиночныеоснования, вызывая нежелательные DSB и мутации. Чтобы уменьшить это неудобство разрабатываются более точные sgRNA, синтетически продуцируются Cas9, или nickase-Cas9 (Cas9n) с точечной мутацией D10A, обладающей способностью разрезать только одну нить ДНК. 25-27 Система CRISPR/Cas9 была успешно использована для индукции мутаци1й одиночных генов, множественных мутаций в одной клетке, 28 и разрезание сильно метилированных регионов. 29 Более того, получен набор разнообразных мутаций. 25, 30, 31 Поэтому CRISPR/Cas9 представляет собой программируему, разностороннюю и эффективную систему редактирования любого гена. Кстати, система была использована для выявления точной функции генов, джля обнаруэжения новых лекарственных мишеней, продукции аккуратных моделей болезней человека и разработтки можной эффективной генотерапии. 32, 33
 Figure 1
Open in figure viewerPowerPoint
Figure 1
Open in figure viewerPowerPoint
Schematic representation of the CRISPR/Cas9 system. Single?guide RNA (sgRNA) consists of tracer RNA (trRNA); a loop; crispr RNA (crRNA); and protospacer sequence, which is homologous to the target DNA. wtCas9 possess 2 cleavage activities, HNH and RuvC. CRISPR/Cas9 editing tools consist of sgRNA guiding precisely the Cas9 enzyme to the DNA based on the homology between the protospacer motif and DNA. When the heteroduplex between sgRNA and target DNA is formed, Cas9 performs DNA cleavage in close proximity of the PAM sequence and introduces a double?strand DNA break
Базирующаяся на CRISPR/Cas9 техника может быть использована не только для разрушения, но и для репарации и/или регуляции экспрессии генов (Figure 2). Чтобы сгенерировать CRISPR/Cas9-обеспечиваемый нокаут, РНК-гид Cas9 индуцирует DSBs, обычно вызывающие путь репарации посредством соединения негомологичных концов the nonhomologous end-joining (NHEJ). NHEJ вызывает небольшие случайные вставки или делеции (indels), приводящие к мутациям сдвига рамки считывания и потере функциональных фенотипов. 34 CRISPR/Cas9-обеспечиваемое редактирование генов происходит в присутствии матричной ДНК, когда DSBs репарируются подобным образом, то это наз. путем homology-directed repair (HDR), который действуцет вместо NHEJ и делает возможной точную инсерцию донорской ДНК в сайт мишень. Помимо сайт-специфичности репарации ДНК, HDR может использоваться для генерации контролируемого нокаута генов и инверции маркерных последовательностей или гене резистентности для дальнейшей селекции клеток с желательным фенотипом. 35 CRISPR/Cas9-обусловленная регуляция транскрипции генов может быть достигнута с помощью CRISPR interference (CRISPRi) и CRISPR activation (CRISPRa), включая CRISPR/Cas9-обеспечиваемую эпигенетическую модификацию гистонов. Эти техники используют каталитически неактивную RNA-guided Cas9 (т. наз. dead Cas9, dCas9), слитую с транскрипиционными активаторами и репрессорами (VP64 и KRAB, соотв.) 36, 37 или с гистон-модифицирующими доменами (напр., p300, LSD1), которые могут регулировать транскрипцию путем изменения структуры хроматина. 38 Эти gRNA-dCas9 комплексы могут быть разработаны, чтобы обратимо целанеаправлено воздействовать на специфические регуляторные последовательности, действуя в качестве каркаса для различных факторов транскрипции или непосредственно взаимодействовать стволовые клеткией. 17, 33 Кроме того, технология CRISPR (в частности CRISPR/Cas13) может быть использована для редактирования РНК путем целанаправленного действия Cas13a белка на РНК, вместо ДНК. 39
 Figure 2
Open in figure viewerPowerPoint
Figure 2
Open in figure viewerPowerPoint
Mechanism of action of CRISPR/Cas9?based techniques. (1) CRIPSPR/Cas9 gene editing: wtCas9 with both cleavage activities is used to create a double?strand break on the target DNA, which can be repaired either by nonhomologous end joining (NHEJ) or by homology directed repair (HDR) in case a template DNA is provided. (2) CRISPR/Cas9 interference (i) or activation (a): deathCas9 (dCas9) without cleavage activity is guided to the DNA site around the transcription start site. dCas9 fused with KRAB domain is used for transcription repression, whereas dCas9 fused with VP64 is used for transcription activation of target gene. (3) CasFISH?mediated chromosome labeling. dCas9 is fused with fluorophore tag and guided in vitro to the target chromosomal DNA that shall be visualized
Table 1. Specifications of different CRISPR/Cas?based techniques
2.1 CRISPR/Cas9 in IVD research
2.1.1 Genome targeting
CRISPR/Cas9 позволяет определять, как генотип влияет на фенотиппутем выявления деталей генетической и эпигенетической регуляции функции клеток. изучению IVD исторически препятствовала медленная пролиферация и дедифференцировка клеток IVD, а также отсутствие стабильных клеточных линий. Недавно иммортализованные NP и AF клеточные линии крыс были получены с использованием rho-associated kinase (ROCK) ингибитора Y27632.40 Поскольку ингибиторы киназ часто обнаруживают неспецифические эффекты, точное целенаправленное воздействие на ROCK ген с помощью CRISPR/Cas9 д. стать альтернативным инструментом для иммортализации клеток IVD. Др. возможным использованием CRISPR/Cas9 в первичных IVD клетках может стать предупреждение их дедифференцировки.41 Целенаправленная экспрессия генов, ассоциированных с дедифференцировкой, таких как collagen II с помощью CRISPRa или collagen I с помощью CRISPRi, возможно позволит более длительно использовать культивируемые in vitro клетки IVD. Collagen II и aggrecan недавно были целенаправленно подвергуты действию CRISPRa в происходящих из тканей стволовых клетках (ASCs), чтобы изменить их клеточный фенотип в направлении IVD фенотипа и это может быть также применено непосредственно к клеткам IVD.42
Исследования хряща в клеточной линиии Swarm rat chondrosarcoma (RCS) обычно используюдтся для изучения специфических фенотипов хондроцитов, благодаря их сходству с нормальным хрящом крыс и способностью генерировать колониии клеток. Недано получена линия RCS клеток, стабильно экспрессирующая Cas9 (RCS-Cas9), и исполтьзована для изучения функции молекул ECM aggrecan и hyaluronan.43, 44 Нокаут aggrecan в RCS-Cas9 клетках предоставил дополнительные знания о роли aggrecan в прикреплении клеток, формировании хондросаркомы и регуляции генов,43, тогда как нокаут hyaluronan synthase-2 выявил важную роль hyaluronan в сборке матрикса вокруг хондроцитов.44 В хондрогенной линии клеток мышиной тератокарциномы (ATDC5), CRISPR/Cas9-вызванная делеция специфического сайта связывания microRNA miR-322, снижала уровни белка mitogen-activated protein kinase kinase 1 (MAP2K1 или MEK1) и предоставила новую информацию о развитии хряща.45
Подобно этим клеточным линиям клетки IVD со стабильной экспрессией Cas9 помогут объяснить взаимоотношения между генотипом и фенотипом IVD в будущем. Недавние исследования биологии IVD подчеркнули важность мембранных белков, а именно, рецепторов клеточной поверхности (напр., toll-like receptor (TLR) TLR246), каналов (напр., aquaporins47, transient receptor potential cation channel subfamily V member 4 (TRPV4)48) и ажгезивных молекул (напр., integrins49) , т.к. эти белки позволяют клеткам IVD воспринимать свое окружение и реагировать на его изменения. Хотя экспрессия и активность этих молекул изменяется во время DDD, понимание точной их функции остается неясным, поскольку ингибиторы/антагонисты и активаторы/агонисты часто не избирательны или имеют короткий период полу-жизни.50, 51 Система CRISPR/Cas9 позволяет исследовать точные взаимодействия между клетками и ECM с помощью функциональных нокаутов, нокдаунов или knockins рецепторов, специфических субъединиц и партнерров по интеграции. В качестве примера, gRNA-обусловленное молчание с помощью dCas9-KRAB-GFP (CRISPRi) было использовано для изучения роли N-cadherin (CDH2) в NP алетках свиньи и человека, показавшего, что CDH2 оегулирует фенотипы ювенильных NP клеток во время формирования кластеров из NP клеток.52 Как стабильные, так временные CRISPR/Cas9 модификации обнаруживали потенциал обнаружения механизмов, участвующих в обороте ECM (напр., matrix metalloproteinases [MMPs], disintegrin и metalloproteinase with thrombospondin motifs [ADAMTS]), жизнеспособности и старении и механотрансдукции клеток IVD. Кроме того, CRISPRi недавно был использован для изучения роли цитокиновых рецепторов TNFR1 и IL1R1 и их нижестоящей передачи сигналов, способствующих воспалению преимущественно в клетках IVD человека.53 Идентификация и анализ некодирующих регуляторныъх последовательностей, таких как энхансеры энзимов, деградирующих ECM, также возможны.54
Более того, трансдукция клеток мишеней объединенной лентивирусной библиотекой, несущей множественные gRNA и Cas9 белок или только gRNAs-Cas9 для орпделенных наборов генов, может позволить осуществить функциональный скрининг и идентификацию молекулярных путей, участвующих в разных болезнях, 55-57 возможно включая и DDD. CRISPR/Cas9 также вносит вклад в изучение геномных регионов, способных к молекулрням взаимодействиям, благодаря разработке CRISPR искусственных ДНК-связывающих молекул, обеспечивающих иммунопреципитацию хроматина (enChIP), где специфические антитела были слиты с dCas9 и экспрессировались одновременно с gRNA. 58 При изучении IVD, особенно в исследованиях, сфокусированных на насыщении кислородом IVD, enCHiP может, напр., быть использован для исследования взаимодействия между hypoxia-responsive elements (HREs) и факторами, вызывающими гипоксид, такими как HIF=1α. 47, 59 Ещё одно использование технологии CRISPR - это визуализация геномных локусов в клеточных ядрах или т. наз. Cas9-обусловленной флюоресценции in situ гибридизации (CASFISH) 60 (Figure 1). Путем использования многоцветных dCas9/sgRNAs, несколько локусов мишеней были мечены одновременно, 60 напр., fibronectin, TGF-β1, и MMPs в IVDs человека. 61, 62 По сравнению с традиционным методом, CASFISH может предупреждать разрушение пространственной организации генетических элементов. 60
2.1.2 Disease models
Система CRISPR/Cas9 может быть использована для генерации моделей болезней и для характеризации функциональности идентифицированных терапевтических мишеней и для разработки лекарств. In vitro модели животных могут быть получены из NP и AF клеток или органной культуры, предназначенной, чтобы стимулировать дегенеративный фенотип. Было продемонстрировано, что органная культура in vitro может быть более подходящей, чем клетки для изучения биологии и терапевтического тестирования IVD, т.к. они сохраняют биологические и биомеханические свойства, сходные с таковыми в IVDin vivo.63 Однако, характерные признаки дегенерации IVD обычно отсутствуют в органных кульурах и могут быть индуцированы с помощью нефизиологических инсультов, подобных инъекциям протеаз64 или высоких концентраций способствуюзих воспалению цитокинов.65 Создание органных культур с множественными отредактированными генами (aggrecan, collagen, MMPs, ADAMTS, ILs) может воспроизводить IVD патологии более натурально. CRISPR/Cas9 конструкции могут быть доставлены в ткани посредством разных методов, включая вирусные векторы,66 наночастицы,67 или как gRNA-Cas9 ribonucleoprotein (RNP) комплексы с помощью нуклеопортации.68
Др. подход использует производные тканей из индуцированных плюрипотентных стволовых клеток (iPSCs) человека, отредактированных с помощью CRISPR/Cas9, напр., при артрите. 69 Хрящ и в самом деле может быть получен посредством хондрогенеза из человеческих iPSCs.70 Нехватки могут быть сначала внесены в iPSCs с помощью CRISPR/Cas9, а искусственный хрящ затем станет предметом воздействия стимулов, вызывающих артрит, таких как способствующие воспалению цитокины или механические нагрузки. Лекарства кандидаты могут быть затем выделены по их потенциалу нормализовать фенотип. Органные культуры с искусственными модификациями многих генов и с iPSC-происходящими искусственными тканями могут служить в качестве альтернативы к экспериментамх на животных, снижая необходимость в использовании животных.
CRISPR/Cas9 вносит существенный вклад в генерацию in vivo моделей болезни, напр., у трансгенных мышей. По сравнению с традиционными методами этот подход быстрее, легче и приемлем по цене, а протоколы, связаные с инъекцией плазмидной конструкции, содержащей Cas9 и gRNA, в мышиные зиготы вполне доступны.71 Др. подход заключатся в замещении ядра изолированных ооцитов ядром из соматической клетки после редактирования гена.72 Помимо одиночных точек,73 крупные домены также могут быть мутированы,74 и множественные гены могут подвергнуться целенаправленному воздействию одновременно, при этом эффективность составля 95% для одиночных мутантов и 80% для двойных мутантов.28 Совсем недавно редактирование генома in vivo в специфической ткани было продемонстрировано с использованием коротко-живущих gRNA-Cas9 RNP комплексов.75 Предполагается, что главным вкладчиком в дегенерацию дисков и DDD является генетика,76 то модели in vivo, экспрессирующие Cas9 специфически в IVD или доставка коротко-живущих RNP специфически в IVD могут быть успешными для лучшего понимания роли генов кандидатов в прогрессировании болезни. Такие гены включают vitamin D рецептор, aggrecan, type IX collagen, asporin, MMP3, IL-1 и IL-6, т.к. полиморфизмы этих генов могут влиять на механизмы дегенерации IVD.77 In vivo индуцибельные системы, базирующиеся на dCas9, оказались наиболее пригодны для фенотипических и эпигенетических исследований у постнатальных млекопитающих и на моделях рака, делая возможными исследования на уровне изменений генов.78, 79 В частности, индуцированное эпигенетическое ремоделирование позволяет ослаблять симптомы болезни у мышей 80 и тем самым представляет интересный подход для IVD. Целенаправленно индуцированные эпигенетические изменения были осуществлены, чтобы исследовать эффекты передачи сигналов TNF-α и IL-1β преимущественно в клетках IVD.53
Мыши (и небольшие животные в целом) не являются наиболее подходящими моделями, чтобы вызывать патологию IVD и тестировать терапию. В отличие от IVDs человека, их IVDs слишком малы, содержать клетки хорды с собственным регенеративным потенциалом и неспособны воспроизвести ограничения диффузии человечкских IVD. С др.стороны, IVDs крупных животных(напр., овец или собак) имеют сравнимую биологию и расстояния диффузии с человеческими.81 CRISPR/Cas9 не ограничивается мышами, а используется также на одомашенных видах, таких как свиньи,72, 82 овцы,83 козы,84 и крупный рогатый скот,85, а такжесобаки 86 и не человекообразные обезьяны.87 Поскольку структурные модели дегенерации IVD, включая повреждения или химические воздействия, являются инвазивными и непрезентативными, то CRISPR/Cas9 может сделать возможной спонтанную индукцию болезни, напр., путем активации путей старения.
Модели на животных также используются для исследований биологии развития. Так, клетки хорды на сегодня представляют огромный интерес для IVD. В области развития позвоночника и хряща рыбки данио являются прекрасной и мощной моделью для in vivo CRISPR скрининга. 88 CRISPR/Cas9 kinesin-I делеция у рыбок данио выявляет роль этого гена в ремоделировании хряща и в поддержании хондроцитов во время черепно-лицевого морфогенеза, 89, поскольку CRISPR/Cas9 нокаут cavin1b в эмбриональной хорде показывает, что caveolae, которые образуются с помощью Cavin1b, обеспечивают механическую защиту клеток хорды во время развития. 90 Недавно рыбок данио, моделирующие идиопатический сколиоз, были получены с помощью CRISPR/Cas9 делеции mapk7. 91
2.2 CRISPR/Cas9 in preclinical testing for IVD therapy
Для эффективного лечения болезненной дегенерации IVD, необходимы пути для целенаправленного воздействия, которые обеспечивают воспаление и катаболические реакции, ощущения боли, устойчивость клеток к оксидативным стрессам и продукцию ECM. Напр., CRISPR/Cas9 может повышать экспрессию факторов роста и белков ECM, снижать экспрессию воспалительных медиаторов или корректировать нежелательные генные полиморфизмы у затронутых индивидов, обеспечивая специфиское для пациента лечение.77 Для достижения этого необходимо точное репрограммирование экспрессии и репрессии генов вместе с использованием подходящих протоколов, которые позволяют перенос в клинику. Было продемонстрировано, что CRISPR/Cas9 может одновременно активировать, репрессировать и вызывать нокаут нескольких самостоятельных генов в одиночной клетке.92 Эта возможность CRISPR/Cas9 для multiplexing может стать главным шагом в направлении лечения мультифакторных и дегенеративных болезней, таких как патологии IVD.
Др. тип Cas белка, Cas13, может быть пригоден для редактирования РНК с помощью целенаправленного воздействия CRISPR/Cas13 на РНК вместо ДНК 39, напр., чтобы скорректировать альтернативный сплайсинг. Было показано, что определенные сплайс-варианты мРНК fibronectin могут быть ассоциированы с дегенерацией IVD. 93 Альтернативный сплайсинг множественных мРНК также участвует в хондрогенной дифференцировке в ответ на гипоксию, но подобных данных не существует для клеток IVD. 94 Специфическое редактирование РНК с помощью CRISPR может быть использовано не только для коррекции неправильного альтернативного сплайсинга, но и также для воспроизведения защитных аллелей или для ведения дифференцировки стволовых клеток. CRISPR-обусловленные модификации генома IVD могут быть осуществлены непосредственно in vivo или косвенно ex vivo в терапевтических клетках, которые затем трансплантируются в IVD. Хотя целенаправленная CRISPR/Cas9-обеспечиваемая интеграция трансгена была бы идеальной, но пока это неосуществимо.
2.2.1 Ex vivo edited autologous IVD cells
Аутологические клетки IVD могут быть получены с помощью биопсии при хирургическом вмешательстве. Эти клетки часто затронуты уже существующей дегенерации и могут обладать низкой скоростью экспанции in vitro. 95, 96 Несмотря на это, клетки IVD являются предметом для обычной аденовирусной доставки TGF-β, BMP-2, BMP-7 или sex-determining region Y box 2 (SOX2), демонстрируя способность восстановления содержания кротеогликанов и модулирования биологических процессов in vitro и in vivo , 97, 98 , подтверждая возможность точного целенаправленного воздействия на гены в дегенерирующих клетках IVD. Недавно суставные хондроциты человека со стабильным CRISPR/Cas9 нокаутом IL1R1 были получены in vitro и было установлено, что они обладают превосходящими свойствами перед не отредактированными терапевтическими клетками, 99 при этом недавно получены доказательства, что TNFR1 и IL1R1 могут сходным образом быть целенаправлено обработаны посредством редактировния эпигенома первичных клеток IVD человека. 53 Это подтверждает, что делеция или нокдаун IL1R1 в терапевтичеких клетках могут улучшать исход клеточной терапии у пациентов, страдающих от болезней суставов.
2.2.2 Ex vivo edited stem cells
Стволовые клетки взрослых, такие как из костного мозга mesenchymal stromal/stem cells (MSCs) или ASCs, могут активировать признаки регенерации IVD. 100, 101 Некоторые из их преимуществ включают высокую скорость пролиферации и тем самым возможность распространения клеток с целенаправленными модификациями. Имплантация взрослых стволовых клеток животным моделям приводит к восстановлению IVD-подобного фенотипа и к многообещающему исходу (phase I/III клинических испытаний). 102 Однако, основным препятствием базирующейся на стволовых клетках терапии является низкая жизнеспособность имплантируемых клеток из-за предсуществующих катаболического и воспалительного окружения в IVD. 103-105 Farhang et al. недавно использовали CRISPR/Cas9 эпигеномное редактирование, чтобы модулировать воспалительные реакции человеческих ASCs путем репрессии цитокиновых рецептолров TNFR1 и IL1R1. Используя dCas9-KRAB- индуципрованное сайт-специфическое H3K9 метилирование промоторов TNFR1 и IL1R1, была получена резистентность ASCs к воспалительному окружению, это продемонстрировало возможность CRISPR/Cas9 эпигеномного редактирования моделировать передачу воспалительных сигналов в имплантируемых клетках (Figure 3). 106 Хотя этот метод и не приводит к полному нокауту экспрессии генов, эта система имеет преимущества становиться индуцибельной и обратимой. .
 Figure 3
Open in figure viewerPowerPoint
CRISPR epigenome editing in primary IVD cells and stem cells. (A) Lentiviral transduction of primary human IVD cells (69?years, female) expressing CRISPR epigneome editing system.53 Protection of adipose tissue?derived stem cells from TNF-α after CRISPR epigenome editing of TNFR1, as demonstrated by (B) pellet size and (C) H&E staining of pellets106
Figure 3
Open in figure viewerPowerPoint
CRISPR epigenome editing in primary IVD cells and stem cells. (A) Lentiviral transduction of primary human IVD cells (69?years, female) expressing CRISPR epigneome editing system.53 Protection of adipose tissue?derived stem cells from TNF-α after CRISPR epigenome editing of TNFR1, as demonstrated by (B) pellet size and (C) H&E staining of pellets106
В мышиных iPSCs, ставших предметом хондогенной дифференцировки, только полный гомозиготный CRISPR/Cas9 нокаут IL1R, но не гетерозиготный нокаут, приводит к цитокин-резистентному фенотипу храща бех хронического воспаления. 107 Далее резистентный к воспалению хрящ со способностью автономно регулировать свою собственную воспалительную реакцию был недавно получен с помощью CRISPR/Cas9 редактирования генов. В мышиных iPSCs, последовательность цитокинового антагониста IL1Ra и sTNFR1 была нацелена на первый экзон способствующего воспалениюхемокина (C-C) ligand 2 (Ccl2), общей мишени для TNF-α и IL-1β. В ответ на стимуляцию цитокина отредактированные клетки продуцировали антагонистов TNF-α и IL-1β и тем самым подавляли цитокинами обеспечиваемую передачу сигналов.108 Этот подход продемонстрировал потенциал CRISPR/Cas9 редактирования генов для автономной доставки противо-воспалительных агентов, используя клеточные петли обратной связи.
Помимо действия на воспаление IVD, терапевтические клетки стали также действовать и на др. изменения микроокружения, такие как низкий pH, нефизиологические нагрузки, гипоксия или голодание. Возможная стратегия против последствий такого жесткого микрокружения может предотвращать старение путем регуляции экспрессии циклин-зависимого киназногог ингибитора 2A (p16), клеточных антиоксдантных энзимов или путей повреждения ДНК. 109 CRISPR/Cas9-модифицированные, устойчивые а микроокружению клетки сб.
отредактированы так, чтобы ко=экспрессировали, напр., последовательности для усиленного синтеза ECM.
2.2.3 Targeted genome editing in vivo
Базирующиеся на CRISPR/Cas9 агенты могут доставляться непосредственно путем локального применения, чтобы защиofnm эндогенныt клетtb от хронического воспаления и болей, усиливая их анаболическую функцию и тем самым противодействуя дегенерации. Поскольку клетки IVD не являются идеальными мишенями для прямых in vivo генетических изменений, из-за их малочисленности и малой доступности, особенно в NP взрослых, редактирование др. типов клеток может быть использовано.
Активация нейронов ганглиев дорсальных корешков (DRG) и последующая боль, как известно,ассоциированы с воспалительной реакцией на дегенерацию, DRG-управляемое CRISPR/Cas9 эпигеномное редактирование может снижать боль в нижней части спины (LBP). 110 Целенаправленная доставка gRNA-dCas9-KRAB на промотор гена A Kinase Anchor Protein 150 (AKAP150) в нейронах DRG, стимулируется с помощью катаболической IVD-conditioned среды, устраняя болевую активность DRGs, в то же время сохраняя их непатологическую активность. Это исследование демонстрирует потенциал CRISPR/Cas9 эпигеномного редактирования связанных с болью генов в nociceptive нейронах в качестве терапевтической стратегии для болей в спине. 110 Недавно CRISPR/Cas9, базирующаяся на доставке с помощью adeno-associated virus (AAV) в нейроны, была осуществлена у крыс модулирующих дистрофию сетчатки для коррекции гена proto-oncogene tyrosine-protein kinase MER (Mertk) посредством homology-independent targeted integration (HITI). Хотя при этом достигалось лишь частичное восстановление функции, результат подтвердил пригодность AAV in vivo целенаправленной генотерапии в нейронах с возможностью использования при болях спины (LBP). 111
2.3 Clinical translation of CRISPR/Cas9 gene therapy
CRISPR/Cas9 уже используется на разных ст. клинических испытаний при ряде болезней. Первое применение терапевтического геномного редактирования связано с клиниеским тестированием редактирования C-C мотива хемокинового рецептора CCR5 в CD4 T-лимфоцитах у HIV-позитивных пациентов.112 Несмотря на трудности, клинические испытания, базирующиеся на аденовирусной доставке ZFN гена в T-лимфоциты было завершено. Планируется новое испытание безопасности и надежности модификации ex vivo CCR5 в CD34+ гематопоэтических стволовых клеток с помощью CRISPR/Cas9, которое уже проводится на HIV-позитивных пациентах, чтобы предупредить развитие AIDS (clinicaltrial.gov: NCT 03164135). Др. CRISPR/Cas9 использование у людей - это ex vivoзапрограммированная деактивация гена cell death protein 1 (PD1) в T-лимфоцитах пациентов с раком легких и последующее введение отредактированных клеток пациентам, которое базируется на предварительно обнадеживающих результатах in vitro.113, 114 Модификация гена PD-1 является многообещающим подходом, который д. быть клинически испытан и на др. злокачественных опухолях, но необходима осторожность при клиническом использовании CRISPR/Cas9 , что связано с этическими требованиями.115
Клиническое использование CRISPR/Cas9 системы напосредственно в теле человека предполагается для лечения HPV-родственных cervical intraepithelial neoplasia (clinicaltrial.gov: NCT03057912). Плазмиды. содержащие CRISPR/Cas9 разработаны для гена мишени, кодирующего вирусный E6/E7T1 белок и тем самым устраняющий вирусные гены из клеток, инфицированных HPV и предупреждающий их злокачественную трансформацию. На сегодня главной проблемой при использовании CRISPR/Cas9 in vivo является ограничение, связанное с вирусной доставкой из-за размера вектора, возможной иммуногенности, факторов опасности и регуляторных ограничений. Integrase-дефицитные лентивирусные векторы (IDLVs) для доставки CRISPR/Cas9 компонентов были разработаны недавно.116 Хотя прогресс и был достигнут, разработка более пригодных систем доставки продолжается вместе с разработкой стратегий, чтобы систематичски минимизировать эффекты вне мишени.117
Хотя редактирование генома в IVD всё ещё далеко от клинического применения, уже сегодня следует озаботиться об этических требованиях и безопасности, связанных с использованием CRISPR/Cas9.118 Эффекты вне мишени, которые особенно высоки в клетках человека по сравнению с др. видами, могут подвергнуть опасности пациентов из-за нарушения регуляции др. генов с высокой гомологией желательной последовательности в мишени ДНК. Это может вызывать тяжелые мутации с потенциално вредными последстивями, такими как клеточная гибель.
Перевод в клинику CRISPR/Cas9 для IVD патологий имеет перспективу, т.к. он позволяет цнленаправлено воздействовать на подлежащие молекулярные процессы, вносящие вклад в дегенерацию дисков и возникновение болей, это может обеспеить существенное улучшение. Поскольку подходы к базирующейся на CRISPR/Cas9 регенерации IVD пока не обнадеживают в отношении клинической практики из-за неблагоприятного соотношения между риском и выгодой 119 (особенно, если учесть, что дегенерация сама по себе не всегда вызывает страдания или боли), лечение, специфически нацеленное на связанные с дисками боли имеет высокие шансы для переноса в клинику. 120 Более того, способ улучшения механической стабильности AF посредством геномного редактирования и тем самым предупреждения образования грыжи IVD будет имет огромное значение для системы здравоохранения, 121, но этот подход д. базироваться строго на (пока не существующей) ранней идентификации пациентов с риском возникновения болезни.
3 CONCLUSION
While our understanding of the mechanisms of the CRISPR/Cas9 system and its application in the clinical setting are still developing, CRISPR/Cas9 has the potential to induce a paradigm shift in the study and treatment of human diseases, including DDD and LBP. CRISPR/Cas9 systems provide a novel tool to improve the modeling of DDD and allow studying functions from a macroscopic (body) to a microscopic (cell) scale across all mammalian species. Modeling of IVD degeneration has always been a challenge and is a limitation to the field's progression that may be overcome by CRISPR/Cas9. In addition, gene editing, knockout, and endogenous gene expression control represent powerful tools to advance cell engineering in novel and efficient ways, hindered thus far by technological limitations, complexity of applications, and/or the expense/rapidity of development. This will have profound effects on both cell therapeutics and gene therapies for IVD degeneration application. However, the field has much to learn about the delivery and safety of these systems. Despite these challenges, CRISPR/Cas9 represents a promising new tool that has the potential to break through technological barriers that have been impeding the field's progress and therefore change our thinking and treatment of IVD degeneration, DDD, and LBP.
|



