Посещений: 
ГЕНОТЕРАПИЯ С ПОМОЩЬЮ РЕГУЛЯТОРНЫХ Т КЛЕТОК
Животные модели и клинические испытания
Gene Therapy With Regulatory T Cells: A Beneficial Alliance Moanaro Biswas, Sandeep R. P. Kumar, Cox Terhorst and Roland W. Herzog ЖУРНАЛ
| |
|
Генотерапия обладает огромным потенциалом для полного излечения болезней, ранее классифицируемых как неизлечимые и некорректируемые. Коррекция достигается переносом функциональной копии гена, который мутантен при болезни, или редактированием дефектного гена в теле пациента (1, 2). Проверка клинической эффективности осуществлена на глазных болезнях (врожденная слепота), при дефиците природного иммунитета и при гемофилии (2-9). Подходы к генной терапии в клинике базируются на доставке in vivo пост-митотических клеток или тканей или ex vivo преобразование в аутологические hematopoietic stem cells (HSCs), сопровождаемое введением их обратно пациенту. Лечение слепоты in vivo с помощью переноса генов (NCT00999609 и NCT00516477) стало первым показательным лечением, одобренным в США Food and Drug Administration (Luxturna, Spark Therapeutics). Тем временем терапия раковых генов уже одобрена, сюда входит virotherapeutic Imlygic (an engineered oncolytic Herpes virus, Amgen), chimeric antigen receptor (CAR) T-клеточная терапия, такая как tisagenlecleucel-T (Kymriah, Novartis), и совсем недавно, axicabtagene ciloleucel (Yescarta, Kite Pharma). Последнее имеет осоло важное значение для данного обзора, т.к. оно раскрывает потенциал терапии, базирующейся на генетическом преобразовании Т клеток.
Immune Responses to Gene Therapy
Главным затруднением для генотерапии z' иммунная реакция со стороны хозяина на вирусный вектор и трансгенный продукт (10). Генотерапия с использованием вектора в иммуно-привилегированных сайтах, таких как головной мозг, глаза и семенники, была успешной и приводила к долговременной экспрессии трансгена (11, 12). Однако, доставка посредством вектора в иммунокомпетентные органы осложнялась преимущественно за счет нейтрализующих антител, которые ограничивали эффективность переноса у пациентов (13).
В настоящее время предложено несколько вирусных векторов в качестве инструмента для переноса генов. Наиболее распространенными среи них являются аденовирусные вектора, гамма ретровирусные вектора, adeno-associated virus (AAV) vectors, and lentiviral vectors (LVs). Для LV, генотерапия была клинически одобрена для ex vivo переноса генов (14, 15), и использование LVs для in vivo замещения генов было оценено на преклинических моделях (16, 17). Это облегчается низкими показателями нейтрализующих антител к LVs и способностью включать крупные гены. Новая генерация дефицитных по репликации векторов удобна и не патогенна. В отличие от гамма-ретровирусов, которые благоприятствуют интеграции вблизи точки старта транскрипции, LVs, как было установлено, интегрируются в активные гены, делая шансы инсерционного мутагенеза и клональной экспансии маловероятными (18). Потенциальные врожденные и приобретенные иммунные реакции, варьирующие по величине, могут развиваться и в отношении кодируемого трансгена (19), оболочки псевдотипа или белков, приобретаемых во время процесса упаковки (20). Запускаемые LV реакции врожденного иммунитета, такие как type I IFN прежде всего обусловливаются с помощью вирусного генома, вовлекаемого с помощью TLRs, возможно TLR9 и TLR7 (21-23).
Реакции Cytotoxic T lymphocyte (CTL) на вирусный антиген и трансген наблюдались с ранними генерациями аденовирусов и пре-клиническими моделями in vivo при аденовирусном переносе генов (24-26). Дефицитные по репликации, первого и второго поколения аденовирусные вектора теперь используются при генотерапии рака в пре-клинических испытаниях, особенно солидного рака (NCT01811992, NCT02630264, NCT01310179, NCT00870181 и NCT01147965). Наивысшая иммуногенность аденовирусных векторов делает их также привлекательными кандидатами в качестве переносчиков вакцин. Напр., недавняя опустошительная вспышка Ebola привела к быстрой фазе I клинического испытания для переноса вакцины дефектным по репликации, аденовирусом шимпанзе type 3-vectored Ebola virus (cAd3-EBO) (27). Эта третья генерация аденовирусных векторов с пониженной иммунной реакцией (28). Однако, реакции врожденного иммунитета всё ещё сохранялись (29).
для доставки генов in vivo рекомбинантный AAV является вектором, на котрый падает выбор, из-за легкости конструирования, широкого тканевого тропизма и предполагаемого отсутствия патогенности, т.к. он не эффективно трансдуцирует макрофаги, зрелые DC и др. antigen-presenting cells (APCs), хотя эндоцитоз AAV ассоциирует с активацией врожденного иммунитета (30). Было показано, что путь TLR9-MyD88 является критическим для cross priming AAV capsid-specific CD8+ T клеток, процесса, который необходим для кооперации pDC и cDC субнаборов дендритных клеток, также как и для активации трансген-специфичной CD8+ T-клеточной реакции (31, 32). Anti-capsid эффекторных T клеток реакции были выявлены в клинических испытаниях, при которых вектор применялся вне сетчатки или ЦНС. Они, как было установлено, ответственны за вредные иммунные реакции против клеток, экспрессирующих трансген, что влияет на эффективность терапии (33-36). Anti-capsid реакции эффекторных Т клеток не были предсказаны пре-клиническими исследованиями (34).
Treg Types and Characteristics
Молекулярные характеристики, которые помогают Tregs модулировать активацию откликающихся Т клеток, наделяют их уникально подходящей ограниченной иммунной реакцией на терапевтический ген. Tregs обладают мощными иммуно-супрессирующими свойствами, которые могут быть использованы для обеспечения антиген-специфичной иммуномодуляции в терапевтических наборах (37). Активность Treg необходима для поддержания иммунного гомеостаза в присутствии аутореактивных Т клеток. Т.о., они выполняют определенные роли в разнообразных клинических условиях, включая рак, аутоиммунные болезни и отторжение трансплантатов (38-40). Наиболее распространенными среди них являются исследования CD4+CD25+FoxP3+-экспрессирующих Treg субнаборов, которые происходят из тимуса и называются тимусными, натуральными или центральными Tregs (41). Натуральные Tregs обычно обладают специфичностью к само-антигенам и являются важными для поддержания толерантности к собственным тканям. Клетки Treg, происходящие помимо тимуса, часто обозначаются как индуцированные, адаптивные или периферические Tregs. Они могут быть антиген-специфичными эффекторными Т клетками, индуцированными, чтобы экспрессировать FoxP3, или клетками type 1 Treg (Tr1), которые являются FoxP3-, экспрессирующими поверхностные LAG-3 (CD223) и CD49b, и секретирующими IL-10 (42, 43). Недавно субнабор FoxP3- с регуляторной активностью, экспрессирующий latency-associated peptide (LAP) на поверхности в качестве латентных TGF-β комплексов, был также идентифицирован, он может быть расщеплен, чтобы высвобождать активный TGF-β (44). Тем не менее имеется консенсус среди учёных, что каждый субнабор Treg обладает супрессирующей способностью и является неотъемлемой частью для поддержания толерантности, как это наблюдается при лечении аутоиммунных болезнях и генотерапии.
Покоящиеся натуральные клетки Tregs являются обычно CD25hi, CD127?, L-selectin (CD62L)+, CTLA-4 (CD152)+ и ICOS±. Др. маркеры натуральных Treg, такие как neuropilin, являются специфичными для мышей (45, 46). Активация натуральных и периферических индуцируемых Tregs (iTreg) ассоциирует с индуцибельной активацией маркеров, многие из которых не являются исключительными для Treg, но общи и активированным эффекторным, и запоминающим (memory) T клеткам. Сюда относятся, но не ограничиваются CD69, CD25, CD44 (47,48), CD39 и CD73 (49), galectin-1 и -10 (50, 51), glycoprotein A repetitions-predominant (GARP), и LAP (52, 53), CTLA-4 (CD152) (54), Ki67, GITR (TNFRSF18), TNFR2, и ICOS (55). В частности, CTLA-4 , как было установлено, регулирует многие аспекты супрессии Treg и может контролировать прогрессирование аутоиммунных болезней (56-59). В некоторых случаях активированные Tregs были связаны с повышением экспрессии FoxP3 (60-62).
Супрессивная функция регуляторных Т клеток, как было установлено, прежде всего, контакт-зависима от TCR. Передача сигналов TCR является критической для развития, дифференцировки и супрессирующей функции Treg (63). Tregs используют множественные механизмы, чтобы супрессировать иммунные реакции, в зависимости от природы и ткане-специфического расположения антигенов (лимфоидной и не лимфоидной ткани). Сюда входят антиген-специфическая и случайная (bystander) супрессия, ассоциированные с высвобождением цитокинов, таких как IL-10, TGF-β, и IL-35 (64), с подавлением IL-2, непосредственным убийством клеток (65), продукцией промежуточных метаболитов (66, 67), и с модуляцией созревания дендритных клеток и со стимулирующей функцией (68, 69).
Evidence that Tregs Limit Immune Responses in Muscle Gene Transfer
Доставка генов с мышцы является привлекательным потенциальным источником для терапевтической экспрессии белка. Генотерапия мышц является идеальной при дегенеративных нарушениях, подобных мышечным дистрофиям, нарушениям хранения, ведущих к метаболической миопатии, такой как болезнь Pompe или к продукции энзима, подобного alpha-1 antitrypsin (AAT) (70). Главным препятствием при генотерапии мышц является перенос генов, необходимый для доставки замещающего гена по всему телу, необходимость во множественных инъекциях в разные места тела, при этом увеличивается сила воспалительной иммунной реакции (71, 72). Далее, часто необходимы высокие дозы вектора, что также увеличивает риск провокации иммунной реакции. Физиологически, доставка в мышцы вызывает воспаление, преимущественно обусловленное высокой частотой присутствующих макрофагов.
Клинические испытания с использование переноса мышечных генов оказались многообещающими для многих нарушений, некоторые из которых имели очень плохой прогноз при обычной терапии. Напр., ген-заместительная терапия является вполне пригодным подходом для лечения нарушения лизосомного хранения, болезни Pompe, которая особенно действует на скелетные и кардиальные мышцы и нервную ткань. Первые клинические испытания с болезнью Pompe показали, что прямая доставка AAV1-hGAA в диафрагму затронутых детей является безопасной, хорошо переносится и эффективна (73, 74). Возникновение нейтрализующих антител против hGAA трансгенного продукта и вирусного вектора препятствует терапевтической эффективности и повторному использованию вектора, соотв. (75, 76). Интересно, что не наблюдается реакции T клеток в отношении вектора (73). Пре-клинические данные показали, что лентивирусная коррекция HSCs с помощью ex vivo трансдукции эффективна в отношении ослабления болезни Pompe у модельных мышей (77), это может стать важной альтернативой для предупреждения иммунных реакций с помощью облегчения центральной толерантности.
Выявление реакций Т клеток на капсиды в моноядерных клетках периферической крови не всегда ассоциирует с вредной иммунной реакцией, как это наблюдалось во время испытаний по переносу генов AAT. Несмотря на обнаружение реактивности T клеток против вектора и инфильтратов в обработанной мышце, трансген всё ещё экспрессируется в субнаборах, которые получили AAV1 вектор. кодирующий AAT (78-81). Интересно, что CD4+CD25+FoxP3+ Tregs были найдены внутри инфильтрующих клеток (~10%) в мышцах после инъекции вектора и были связаны с зависимым от времени снижением мышечного воспаления, это может предупреждать деструкцию трансдуцированных мышечных волокон (82).
Сходным образом, популяция Tregs накапливается в мышцах дистрофических мышей и мышечных биоптатах от пациентов с Duchene muscular dystrophy (DMD) (83, 84). Эти IL-10-секретирующие Tregs ослабляют дистрофический фенотип путем уменьшения воспаления, связанного с болезнью, а их устранение приводит к ухудшению болезненного фенотипа. Терапевтическое целенаправленное действие Tregs с IL-2/anti-IL-2 комплексами оказывает благоприятный эффект на снижение мышечного воспаления и повреждений у дистрофичных мышей. Т.о., эти наблюдения демонстрируют потенциал агентов, модулирующих Treg, по индукции локальной популяции Treg в мышцах во время переноса гена, чтобы снизить мышечное воспаление и способствовать поддержанию экспрессии трансгена при DMD. Др. допустимая альтернатива - это иммунотерапия с помощью поликлональных размноженных или антиген-специфичных Tregs во время генотерапии. В более раннем важном исследовании применение экзогенных трансген-специфичных Tregs с сопутствующим AAV переносом генов, была показана более низкая анти-трансген иммунная реакция и более стабильная экспрессия трансгена в нормальных мышцах (85). Это показало, что воспринятые перенесенные CD4+CD25+ регуляторные Т клетки могут индуцировать устойчивое приживление трансгена в плотной ткани. Комбинированное исследование с использованием воспринимаемого переноса Treg в качестве дополнительной терапии может тем самым повышать терапевтический эффект доставки гена путем возникновения толерантности по отношению к устройству для переноса гена или к трансгенному продукту.
The Liver as an Ideal Site for Immune Regulation
Систематическое применение генотерапии приводит к быстрому накоплению высоких уровней векторных частиц в печени. Специализированные располагающиеся в печени клетки обеспечивают "эффект толерантности печени," который обеспечивает локальную и системную устойчивость к собственным и чужеродным антигенам. Это приписывается экспрессии ингибирующих лигандов на клеточной поверхности для активации T клеток и продукции противо-воспалительных медиаторов (86).
Использование нацеленных на печень вирусов, искусственно приготовленных векторных серотипов и печень-специфических промоторов и энхансерных элементов улучшает доставку генов в печень и повышает экспрессию генов до соотв. клинических терапевтических уровней (87). Имеется значительный интерес к разработке направленной на печень генотерапии, исходя из недавних клинических успехов по лечению X-сцепленного нарушения каогуляции hemophilia B, с восстановлением до клинических уровней factor IX (FIX) у пациентов с гемофилией B , устойчиво сохраняющихся более 5 лет (7, 36). Временное повышение в печени энзимов, преимущественно обусловленное реактивацией реакции memory CTL на вектор, наблюдалось ранее, хотя воздействие кортикостероидов при первых признаках гепатоцеллюлярных повреждений может сдерживать повышение печеночных энзимов и устойчивую экспрессию FIX (34). Сходным образом, высокие эндогенные уровни фактора свёртывания были описаны при недавних клинических испытаниях при hemophilia A и B (88, 89).
Возникновение ингибирующих антител, нейтрализующих фактор VIII (FVIII) или FIX, является главным осложнением заместительной белковой терапии , также как и генотерапии у пациентов с гемофилией (90). Пре-клинические исследования на малых и крупных животных моделях гемофилии продемонстрировали, что стратегии генотерапии и непрерывное воздействие фактора свёртывания могут способствовать толерантности и уничтожению уже имеющихся антител (91-94). Несмотря на это всё ещё имеется риск возникновения нейтрализующих антител для фактора свертывания, формирующегося после переноса гена в печень (95). Имеются строгие доказательства, что Tregs являются важным элементом механизма, с помощью которого поддерживается аутотолерантность и возникновение ингибиторов, и предупреждается зависимая от T helper реакция (96-99). Во многих случаях иммунная толерантность к переносу печеночных генов hFIX была также ассоциирована с индукцией Tregs (100-102). Мы полагаем, что приемлемый перенос Tregs при организации генотерапии печени обладает потенциалом избегать общей иммуносупрессии, когда оказываются задействованы многие кортикостероидные соединения, вместо того, чтобы способствовать толерантности к трансгенам, безопасности и временному действию.
Др. область, в которой генотерапия печени привлекает интерес, является лечение аутоиммунных нарушений, подобных ревматоидному артриту, множественному склерозу и type 1 diabetes (T1D). Доставка замещающего гена в этих случаях осложняется возникновением иммунной реакции на терапевтический ген. Исследования продемонстрировали, что генотерапия в tolerogenic микроокружении в печени может устранять возникновение experimental autoimmune encephalomyelitis (EAE), даже если антиген мишень для реакции воспалительных Т клеток находится в удаленном органе, таком как ЦНС (103, 104). Защита от EAE зависит от индукции антиген-специфичных CD4+CD25+Foxp3+ клеток Tregs (103, 104). Используя тот же самый принцип на пре-клинической мышиной модели T1D, Akbarpour et al. показали, что целенаправленное воздействие LV-обеспечиваемой экспрессии инсулинового гена индуцирует регуляторные Т клетки, специфичные по инсулину, которые поддерживают инфильтрацию иммунных клеток в панкреатические островки и защищают от T1D (105). Т.о., очевидно, что целенаправленное воздействие переноса генов в гепатоциты может способствовать индукции антиген-специфических Tregs систематически, делая печень привлекательной мишенью для достижения толерантности к трансгенам.
In Vivo Tolerance Induction with Treg
Учитывая критическую роль Treg в поддержании регуляции иммунной реакции на специфические трансгены, становится обычным выбор воздействия in vivo в виде индукции антиген-специфичных Treg с помощью специфического или комбинированного лекарственного воздействия. Глобальная иммунная супрессия с помощью действия стероидов или химиотерапевтических лекарств, благотворна. если осуществляется временно, но она теряет свои преимущества, чем больше воздействий и длительность реакции на трансгенный продукт у специфических Treg. Одним из методов индукции Treg является совместное применение антигена с macrolide иммуносупрессорным rapamycin (sirolimus), который ингибирует ход клеточного цикла активированных T клеток с помощью блокады пути mTOR, приводя к отсутствию энергии или делеции T клеток (106). В то же самое время подавление активности, стимулирующей T клетки (107) и зависимой от mTOR передачи сигналов с помощью Tregs (108) приводит к обогащению антиген-специфичными CD4+CD25+FoxP3+ клетками Treg (109-111). Этот эффект может быть усилен добавлением цитокинов, таких как IL-10 или Flt3L, которые, как было установлено, способствуют толерантности при заместительной белковой терапии (96, 99). Профилактическая терапия с помощью комбинации IL-10 с rapamycin и антигеном оказалась успешной по предупреждению и рецидиву реакций ингибирующих антител при переносе в мышцы терапевтического гена для FIX при гемофилии B у мышей (96, 99, 112). Сходным образом, внесение rapamycin при печеночной генотерапии приводило к заметному улучшению экспрессии человеческой acid-α-glucosidase у не человеко-образных приматов, это, скорее всего, было обусловлено индукцией печеночной аутофагии и д. быть оценено при повторном использовании AAV вектора (113).
Толератность к антигенам, принемаемым через рот, - это др. подходом к ингибированию специфичных к антигенам иммунных реакций путем целенаправленного воздействия на ассоциированную с кишечником лимфоидную ткань (114). Многие типы иммунных клеток, как известно, участвуют в обеспечении такого состояния нечувствительности, включая находящиеся в кишечнике дендритные клетки, FoxP3+ Tregs и CD4+CD25?LAP+-экспрессирующие Tregs (115-117). Кишечные самонаводящие (homing) рецепторы и цитокины, такие как TGF-β и IL-10, как было установлено, ответственны за инфильтрацию, дифференцировку и локальную распространенность этих подтипов Treg и индукцию толерантности (118). Существенно, что оральная tolerization улучшает долговременную персистенцию и экспрессию трансгена как было установлено в исследовании с использованием AAV-обеспечиваемого переноса генов модального антигена OVA (119).
Cellular Therapy with Treg
Обширные клинические исследования продемонстрировали, что Tregs играют ключевую роль в индукции и поддержании толерантности. Адоптиная иммунотерапия с аутологичными или донорскими Tregs, как было установлено, является многообещающей в нескольких клинических испытаниях при аутоиммунных нарушениях и при трансплантациях (120, 121). Согласно новому GMP протоколу FoxP3+ Tregs могут подвергаться поликлональной или антиген-специфической экспансии с высокой точностью (122, 123). Протоколы генерации донор-специфических Tr1 клеток также хорошо известны (124-126). Клинические испытания с только что выделенными или ex vivo размноженными FoxP3+ (127-130) или Tr1 клетками (ALT-TEN trial) (131) (из крови пупочного канатика или периферической крови) в качестве клеточной терапии, применяемой непосредственно или вскоре до/после трансплантации были проведены для обеспечения толерантности трансплантата в отношении хозяина (graft-versus-host disease (GvHD)) у пациентов, подвергшихся действию allo-HSCT для гематологического озлокачествления. Напротив, ультра-низкие дозы (ULD) IL-2 , как полагали, селективно умножали nTreg in vivo, супрессируя аллореактивные реакции при GvHD профилактике и лечении (132-134). Добавление инфузии Treg к ULD IL-2 способствовало персистенции и выживанию Treg при лечении онко-гематологических болезней (NCT02991898).
Исследования, проверяющие безопасность и пригодность вливаний поликлональных или alloantigen-специфичных Treg для вызывания толерантности при трансплантациях плотных органов сегодня в работке [NCT02145325 (TRACT), NCT02088931, NCT02711826 (TASK), UMIN-000015789] (135). ThRIL исследование (NCT02166177) было инициировано, чтобы оценить эффективность терапии клетками Treg в комбинации с лекарствами, супрессирующими иммунитет у реципиентов печеночных трансплантатов.
ONE Исследование (www.onestudy.org) это фаза I/IIa клинического испытания с целью проверки надежности и пригодности 7 разных популяций регуляторных Т клеток в живых трансплантатах донорских почек. Это multicenter исследование сравнивало аутологичные ex vivo умноженные поликлональные CD4+CD25+ nTregs из периферической крови, Tr1 клетки, происходящие из донорских аллоантигенов Tregs (darTreg), и происходящие из аллоантигенов T клетки anergized с помощью совместной стимуляции блокады, tolerogenic дендритные клетки и регуляторные макрофаги (Mregs). Сравнение было проведено между пациентами, получающими стандартное иммуносупрессирующее лечение (basiliximab followed by tacrolimus, mycophenolate mofetil, and prednisolone) и получающими иммунотерапию (136).
Наконец, Treg терапия была также использована для аутоиммунных и воспалительных болезней (напр., TRIBUTE испытание для Crohn's). Аутологическая антиген-специфическая Tr1 терапия для упорной болезни Crohn's разрабатывается (Ovasave, Txcell). При исследовании педиатрических пациентов с T1D, одиночные и повторяющиеся вливания поликлональных размноженных Tregs оказались безопасными и эффективными (137). Как в случае с GvHD, эффект низкой дозы IL-2 на индукцию in vivo Tregs для 12 аутоиммунных и воспалительных болезней были исследовано в испытаниях в разных центрах (TRANSREG, NCT01988506). Более того, исследования оценивали безопасность Treg иммунотерапии вместе с IL-2 и персистенцию введенных аутологичных Tregs у пациентов недавно начавшимся T1DM (TILT study, NCT02772679) (138). В первом сообщении той же самой группы, исследование 14 взрослых субъектов с T1D, которые получали ex vivo размноженные поликлонаьные Tregs, было установлено, что Tregs сохраняются в кровообращении в течение года после введения (139).
Итак, показано. что вливания ex vivo размноженных FoxP3+ или FoxP3- (Tr1) клеток безопасно, хорошо переносится и может влиять на толерантность при многих воспалительных и аутоиммунных нарушениях.
Supplementing Gene Therapy with Treg Adoptive Transfer
Свойства супрессии иммунитета у Tregs вызывали интерес к использованию этой популяции клеток для возникновения толерантности в отношении трансгенного продукта. Не только Tregs оказались критическими для становления центральной толерантности во время развития и для предотвращения аутоиммунитета, они также участвуют в индукции толерантности в отношении экзогенных антигенов, таких как терапевтические белки. В идеале, модуляция иммунитета. чтобы супрессировать реакцию на вектор или трансген, д. устранять нежелательные иммунные клетки, при этом умерять защитный иммунитет.
Имеется достаточно доказательств, что адоптивная иммунотерапия с помощью поликлональных или искусственно преобразованных Tregs может улучшать заместительную белковую терапию при наследуемых белковых дефицитах (98). С др. стороны, проведены очень немногие исследования в вливаниями Tregs для повышения толерантности к генотерапии. Так, генотерапия в иммуно-привелигированных местах, таких как глаза, не была связана с вредной иммунной реакцией. Сходным образом, доставка генов в tolerogenic органы, особенно в печень, как было установлено, индуцируют Tregs in vivo. Однако, нацеленная на печень генотерапия, поскольку успешно снижала иммунные реакции в отношении трансгенного продукта, была не в состоянии устранить полностью развитие цитотоксических T клеток, которые могли впоследствии приводить к потенциальному, обусловленному иммунитетом устранению клеток, экспрессирующих трансген (140). Сходным образом, хотя развитие нейтрализующих антител на трансгенный продукт пока не наблюдалось в немногих клинических испытаниях генотерапии, остаются сомнения, поскольку они наблюдались в пре-клинических исследованиях иммуногенной FVIII молекулы (140, 141) (unpublished observations). Стратегии, такие как использование microRNA target sequences (miR-142-3p) в LV для de-target трансгенной экспрессии из профессиональных APCs, связанные с ограниченной экспрессией или в гепатоцитах или печеночных эндотелиальных клетках, привели к улучшению экспрессии трансгенов. Это оказалось скоррелированным с появлением специфичных к трансгену Tregs, которые вызывали толерантность у пре-клинических моделей гемофилии A и B (17, 142, 143).
В более раннем исследовании дополняющей генотерапии с адоптивным переносом Treg , Gross et al. установили, что инъекции influenza hemagglutinin (HA)-специфических CD4+CD25+ Tregs, одновременно с переносом генов, делает возможной персистенцию трансгена HA в мышцах мышей (85). Цитоксические реакции T клеток, также как и циркуляция в крови anti-IgG антител к HA, были ослаблены у реципиентов HA-Treg. Эти находки оказались применимы к разработке лечения для гемофилии A, где невирусный перенос генов в терапевтической FVIII плазмиде приводил к сверх-физиологическим уровням FVIII, но индуцировались ингибирующие антитела и терялась функциональная активность FVIII. Приемлемый (Adoptive) перенос клеток, обогащенных по FVIII-специфическим Tregs, в нативных гемофилических мышей сопровождалось проблемами с плазмидами, что приводило к достоверному уменьшению образования ингибирующих антител в течение более длительного периода по сравнению с контролем (144). Эти исследования показали потенциал Tregs для модуляции иммунных реакций на трансгенный продукт антиген-специфическим способом (Figure 1). Наша группа расширила эти первоначальные исследования, продемонстрировав, что adoptively перенесенные ex vivo размноженные Treg, могут быть использованы для улучшения генотерапии FIX на мышиной модели гемофилии B (98). В этом исследовании поликлональные ex vivo размноженные аутологичные CD4+CD25+FoxP3+ Treg, примененные в дозах, сходных с теми, что сегодня используются при клинических испытаниях (~5 х 10 7 cells/kg), оказались способны предупреждать образование адаптивного иммунного ответа у мышей с гемофилией B, получающих AAV1 hFIX в мышцы с помощью целенаправленного переноса. Несмотря на ограниченную персистенцию in vivo adoptively перенесенные клетки были в состоянии устойчивой супрессии в течение 10 недель. Это было приписано возникновению антиген-специфической супрессии посредством индукции эндогенных Treg, которая облегчалась с помощью трансплантированных Treg (Figure 2A). Показано. что ex vivo экспансия улучшает супрессивные свойства поликлональных Tregs, предоставляя им сверх функциональность по сравнению с только что выделенными Tregs (145). Размноженные Tregs обнаруживают высокую активность экспрессии CTLA-4, которая конкурирует с ко-стимулирующей молекулой CD28 за связывание CD80/86 на APCs. Субоптимально активированные APCs облегчают индукцию iTreg клеток (57, 146).
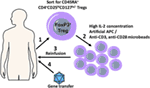 Figure 1. A scheme detailing combination regulatory T cell (Treg) adoptive therapy with gene transfer for tolerization of immune responses. FoxP3+ Treg cells with polyclonal specificity are harvested from the patient (1) and ex vivo expanded in the presence of high IL-2 concentrations and artificial APC (aAPC) or anti-CD3, anti-CD28 microbeads using GMP protocols (2); expanded Tregs are transplanted back into the patient (3), which is followed shortly by gene transfer (4).
Figure 1. A scheme detailing combination regulatory T cell (Treg) adoptive therapy with gene transfer for tolerization of immune responses. FoxP3+ Treg cells with polyclonal specificity are harvested from the patient (1) and ex vivo expanded in the presence of high IL-2 concentrations and artificial APC (aAPC) or anti-CD3, anti-CD28 microbeads using GMP protocols (2); expanded Tregs are transplanted back into the patient (3), which is followed shortly by gene transfer (4).
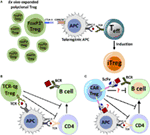
Figure 2. Proposed mechanisms for immune suppression by adoptive transfer of polyclonal FoxP3+ regulatory T cell (Treg), chimeric antigen receptor (CAR)-Treg or TCR-transgenic (TCR-tg) Treg. (A) Adoptively transferred ex vivo expanded Treg with polyclonal specificity can interact with antigen-presenting cell (APC). Inhibitory receptors like CTLA-4 can compete with the costimulatory molecule CD28 to bind to CD80/86 receptors, and combined with other factors, it can lead to APC tolerization. Tolerogenic APCs interact with activated antigen-specific T effector (Teff) cells, which leads to conversion of Teff to induced Treg (iTreg). (B) Natural Treg engineered with TCR specificity for antigen (TCR-tg Treg) can recognize antigen presented by APCs, directly suppressing the APC's capacity to costimulate Teff cells. TCR-tg Treg can also directly inhibit CD4+ T helper cells, which in turn affects T cell help to antigen-specific B-cells.(C) Putative mechanisms for antigen recognition and suppression by CAR-Treg. CAR-Tregs may recognize either a B-cell bound antigenic epitope or antigen on the surface of APC, which can trigger the activation and proliferation of the CAR-Treg through transmembrane and intracellular-signaling domains. The mechanisms by which CAR-Tregs exert their suppressive effects are not clearly defined, but may include interactions with key cell types.
Хотя клеточная терапия с помощью размноженных поликлональных Tregs имеет множество преимуществ, бывло продемонстрировано, что антиген-специфические Tregs являются более мощными при более низких частотах в 10-100 раз (147). Один из способов определения достаточности количества антиген-специфичных Tregs - это размножение их в присутствии аллоантигенов в ходе процесса непрямой allospecificity. Это успешно было использовано, чтобы способствовать трансплантационной толерантности за счет расширения пула Treg в направлении донорских антигенов (148-151). В некоторых случаях экспансия Treg и терапевтический потенциал улучшались добавлением IL-2 и IL-12 (152). Однако, остается неясным, действительно ли возможно выделять редкие антиген-специфические Tregs чтобы дополнить генотерапию, особенно в случаях наследуемого дефицита белка, когда антиген не экспрессируется , или в случае, когда центральная толерантность не может быть достигнута.
Therapy with Genetically Modified Cells
Недавно пригодность генотерапии обратилась к коррекции генов при широком спектре болезней. Клетки с модифицированными генами, такие как CAR-модифицированные T клетки для искоренения гематологических раков, совершили прорыв в успешных клинических испытаниях (153-156). Glaxo Smithkline предоложила впервые ex vivo генотерапию стволовых клеток для лечения пациентов с ADA-SCID, Strimvelis, получившая разрешение от European Medicines Agency в 2016 (157). Zalmoxis, предлагает клеточную терапию с помощью происходящих от донора T клеток, используемых для H-SCT. Эти новые и успешные испытания прокладывают путь для др. продвинутых технологий, таких как разработка техники редактирования генов с использованием CRISPR-Cas для повышения стабильности CAR-T клеток (NCT03166878) или для лечения злокачественных гематологических состояний у пациентов с HIV (NCT03164135).
Модификации генов для увеличения специфичности к антигену была недавно применена к Tregs. Трудности изолирования клеток с редкой специфичностью к антигенам из естественного поликлонального Т-клеточного репертуара, затрудняют переход к к таргетной терапии сс помощью антиген-специфичных Tregs. С др. стороны, воздействие поликлональных размноженных Tregs необходимо для вливания больших количеств в клинике аутологических клеток с возможностью к общей иммуносупрессии. Использование в клинике LVs с генетически репрограммированными клетками является привлекательной стратегией для настройки популяций Treg на особую специфичность (Figure 2B). Одним из примеров является эктопическая избыточная экспрессия FoxP3 в обычных CD4+ T клетках от здоровых доноров с целью генерации большого количества гомеогенных и функциональных популяций Treg клеток. Эта техника была успешно применена к обычным CD4+ T клеткам пациентов с иммунными нарушениями, polyendocrinopathy, enteropathy, X-linked (IPEX) синдромом (дисфункция гена FoxP3 ), и к др. пре-клиническим животным моделям аутоиммунности (158-161). Вероятность реверсии к фенотипу эффекторных T клеток затруднена, учитывая пластичность природы большинства популяций Treg. Однако, adoptively переносимые Tregs с избыточной экспрессией FoxP3, как было установлено, стабильные при стационарном режиме и воспалительных состояниях и остаются супрессирующими in vivo (161). Потребность в антиген специфичности клеток, переносящих ген FoxP3, и в дозе клеток, необходимых для супрессии, также как и персистенция in vivo, это вопросы. требующие разрешения.
Др. сходный подход для искусственного преобразования специфичности Treg является использование переноса гена TCR, который, как было установлено, улучшает потенциал Treg, как это наблюдалось на пре-клинических моделях диабета, трансплантационной толерантности, артритах и гемофилии A (61,162-165). Искусственно преобразованные TCRs предоставляют жизненно важную альтернативу переориентации специфичности Treg к одиночному антигенному эпитопу с потенциально высоким сродством TCR . Однако, этот подход ограничен HLA и поэтому ограничивает число пациентов с общими HLA аллелями.
Инспирированное клиническими успехами использование CAR-T клеток для лечения определенных типов рака, сходно с подходом, использующим искусственно преобразованные Tregs для экспрессии внеклеточных single-chain antigen-binding доменов (scFv), слитых с молекулами внутриклеточной передачи сигналов (Figure 2C). CARs могут непосредственно распознавать им соответствующие антигены независимо от HLA. Далее не возникают вопросы, такие как неправильное спаривание цепи TCR, которое в принципе касается переноса гена TCR. На сегодня неясно, как CAR-Tregs осуществляют свой супрессирующий эффект и с какими популяциями клеток они взаимодействуют. Предполагается, что оптимальная активация CAR-Tregs нуждается в присутствии APCs (62). Возможно, что CAR-Tregs распознают антиген, который иммобилизован на поверхности APC, хотя молекулярные взаимодействия или рецепторы, которые могут принимать участие, ещё предстоит определить. Способность CAR-Tregs отвечать непосредственно на растворимый антиген или на распознаваемый антиген. связанный с B-cell receptor (BCR) также всё ещё остается открытым вопросом (Figure 2C).
Химерные по антигенному рецептору регуляторные Т клетки были проверены на пре-клинических моделях EAE, отторжения аллотрансплантата, колита, ревматического артрита и гемофилии A (62, 166-174). Первое испытание CAR-Treg фр. компанией TxCell, для предупреждения отторжения трансплантата будет законкно в 2018. Такие клинические испытания будут способны ответить на вопросы, такие как иммуногенность новых CAR молекул (175), или возможность синдрома высвобождения цитокинов, который является серьезным побочным эффектом воздействия CAR-T клеток при раке (176). Тем временем разрабатываются новые стратегии CAR для повышения специфичности и функции CAR-модифицированных T клеток и Tregs. Напр., временная экспрессия конструкции CAR, которая распознает молекулу FITC, может быть использована для целенаправленного воздействия функции Treg на трансплантируемый орган за счет соединения с FITC-conjugated моноклональными антителами против донорских MHC антигенов (174). Напротив, экспрессия на поверхности антигенного домена скорее, чем scFv, конъюгированных первичных и вторичных сигнальных молекул, может связать BCR из соотв. антиген-специфичной B-клетки, способствуя тем самым истощению B-клеток или супрессии, как это продемонстрировано на м одели аутоиммунности и гемофилии A (177, 178).
Challenges and Future Directions
Beginning with the discovery in 1990 and 1995 that adoptively transferred CD4+CD25+ Tregs can maintain tolerance in an autoimmune animal model (179) and Treg-suppressive mechanisms can counter immune activation caused by gene replacement therapy.
For example, existing obstacles faced in recent clinical trials such as unwanted immune responses to gene therapy and the inability to readminister vector could be mitigated by the codelivery of Treg with the vector. Adoptive immunotherapy with Tregs has shown clinical efficacy in autoimmune diseases such as T1D (which is characterized by a detrimental inflammatory response) and can tolerize against inflammatory reactions to a transplanted organ. We therefore propose that augmenting gene transfer applications, either by promoting the in vivo induction and expansion or Tregs or by immunomodulation with adoptively transferred Tregs can work synergistically and lead to successful gene transfer.
It is crucial, however, to emphasize the importance of good manufacturing practice-compliant cell therapy procedures, especially for the generation of polyclonal Tregs, which require dosing at larger cell numbers to reach therapeutic efficacy (180). A current challenge with using Tregs in the clinic is the need for the isolation and expansion of a pure population of functional and stable cells in sufficient numbers. FoxP3 is an intracellular marker and can be transiently expressed by activated CD4+ and CD8+ T cells. Optimization of cell sorting, such as employing double sorting of CD4+CD25hiCD127lo cells can ensure increased purity of the starting population to help control for the outgrowth of effector T cells, which expand exponentially faster than Tregs in culture.
The formation of neutralizing antibodies constitutes a major obstacle to vector readministration, as they are elicited at high titers following gene transfer and can persist for years. Repeat administration of vector may be required when the gene product does not reach therapeutic levels, or when administered to pediatric patients, where an increasing organ turnover may limit the therapeutic dose over time. Plasmapheresis and transient immunosuppression (anti-CD40 Ab, CTLA-4 Ig, high-dose corticosteroids, rapamycin, rituximab, or combinations of these treatments) are currently being tested to allow for repeat injections (NCT02240407) (76, 113, 181). The use of adoptive Treg therapy in these scenarios has not been tested.
|

