Visits: 
СУИЦИДАЛЬНАЯ ГЕНОТЕРАПИЯ
Подходы
Origins of Suicide Gene Therapy Nejat Duzgunes Suicide Gene Therapy pp 1-9|
| |
|
Концепция суицидальной генотерапии была предложена первоначально как "tumor chemosensitivity" благодаря стабильному внедрению гена herpes simplex virus thymidine kinase в линии мышиных клеток BALB/c , что сопровождалось воздействием 9-([2-hydroxy-1-(hydroxymethyl)ethoxy]methyl)guanine, позднее названного "ganciclovir" [1, 2]. Кроме того, опухоли были сгенерированы у BALB/c мышей с использованием этих клеточных линий и мыши подвергались лечению ganciclovir. Такое воздействие вызывало регрессию опухоли. Эти исследования открыли область суицидальной генотерапии. Многие исследования in vitro и in vivo по суицидальной генотерапии были рассмотрены в обзоре Lal et al. [3], Duarte et al. [4], Zarogoulidis et al. [5] и Karjoo et al. [6].
2 Systems Used for Suicide Gene Therapy
2.1 HSV Thymidine Kinase and Ganciclovir
Разные pyrimidine deoxyribo- и arabino-nucleosides подавляют репликацию линии herpes simplex virus (HSV-1KOS), который индуцирует активность deoxythymidine-deoxycytidine kinase а культивируемых клетках кроликов и человека. Однако, эти агенты не подавляют репликацию HSV-2333, который не индуцирует киназную активность [7]. Эти находки указывают на то, что thymidine киназа необходима для репликации HSV. После первоначальной литической фазы, вирус впадает в латентное состояние в сенсорных ганглиях. Реактивация латентного вируса нуждается в активности thymidine kinase. Специфические ингибиторы HSV thymidine kinase, N2-phenyl-2'-deoxyguanosine и N2-(m-trifluoromethylphenyl) guanine, подавляют реактивацию вируса в культивируемых кусочках такни из латентно инфицированных ганглиев тройничного нерва мыши [8].
Эти наблюдения показывают, что аналоги нуклеозидов, такие как ganciclovir, могут быть использованы в качестве субстратов для HSV-тимидин киназы после внедрения его гена в раковые клетки с целью деструкции. HSV-тимидин киназа обычно превращает deoxythymidine в deoxythymidine monophosphate; клеточные киназы затем дифосфорилируют этот продукт в deoxythymidine triphosphate. В клетках, инфицированных HSV и обработанных ganciclovir, вирусная тимидин киназа превращает нуклеозид в ganciclovir монофосфат, а клеточные киназы дифосфорилируют этот продукт в ganciclovir трифосфат (Fig. 1). Ganciclovir трифосфат внедряется в ДНК с помощью ДНК полимеразы и вызывает завершение цепочки из-за отсутствия deoxyribose, а значит и 3'-OH. Обрыв цепочки запускает апоптические сигналы.
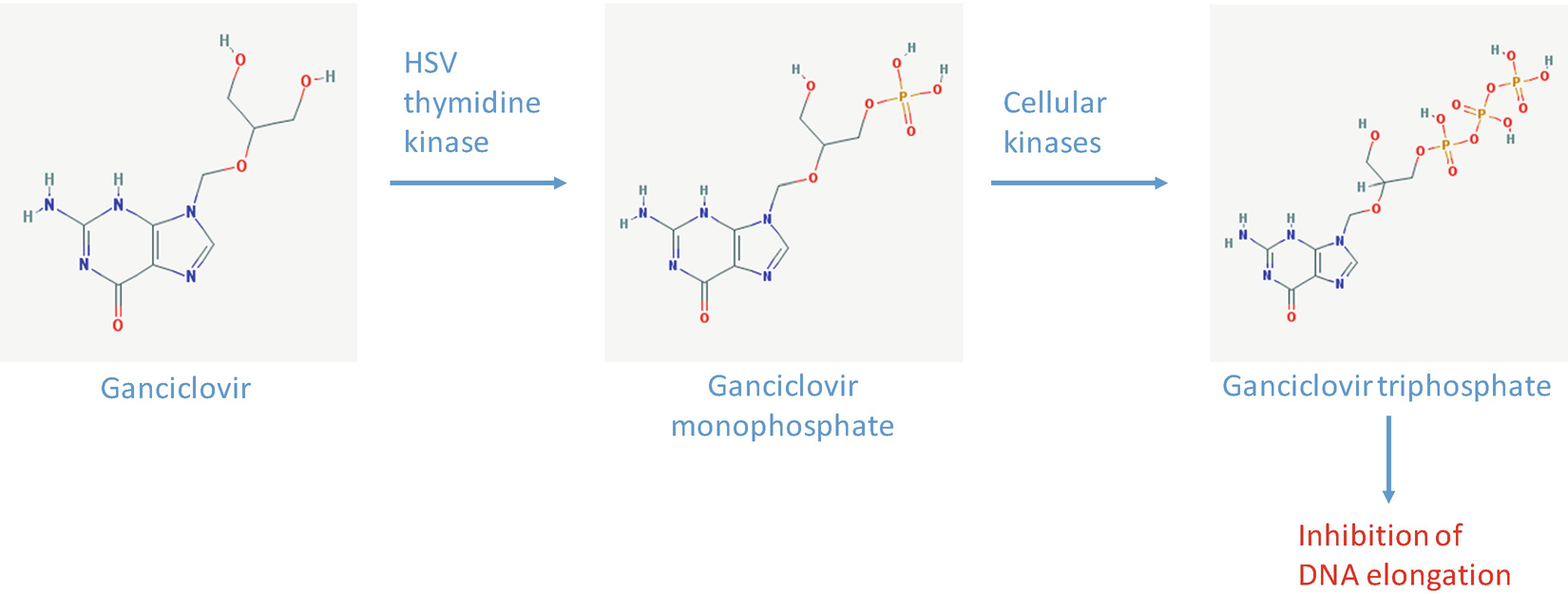 Fig. 1.
Conversion of ganciclovir to toxic ganciclovir triphosphate . Delivery of the HSV-tk gene to target cells results in the expression of viral thymidine kinase , which selectively phosphorylates ganciclovir (GCV). Monophosphorylated GCV is further phosphorylated by cellular enzymes into an active triphosphate compound. The molecular structures were adapted from PubChem Одним из вопросов при использовании системы HSV-thymidine kinase/ganciclovir, как достигнуть опухоль-специфической экспрессии гена. Независимо от вектора для доставки гена (вирусные или не вирусные векторы), крайне желательно иметь ген под контролем опухоль-специфических промоторов. Напр., промотор FBJ murine osteosarcoma viral oncogene homolog (FOS) в аденовирусном векторе облегчает в значительно большей степени транскрипционную активность в линии клеток глиомы по сравнению с нормальными астроцитами [9]. Высокий процент серозных и эндометриоидных эпителиальных овариальных раковых клеток экспрессирует human epididymis protein 4 (HE4), который является важным фактором в адгезии и подвижности раковых клеток яичников. Аденовирусная конструкция, экспрессирующая HSV-тимидин киназу, управляемую промотором HE4 вызывает значительную гибель в овариальных линиях клеток, чувствительных и резистентных к cisplatin [10]; однако, HE4 промотором управляемая экспрессия HSV-тимидин киназы в не раковых клетках не была оценена. Обычно соматические клетки человека обладают очень низкими уровнями активности telomerase и обладают ограниченной продолжительностью жизни из-за транскрипционного молчания теломеразы во время дифференцировки. Напротив, активность теломеразы обнаруживается в большом проценте опухолей, а также в в стволовых клетках и тканях зародышевой линии взрослых [11]. Промотор human telomerase reverse transcriptase (hTERT) может быть использован, чтобы контролировать экспрессию HSV-тимидин киназы в аденовирусном векторе. После воздействия ganciclovir этот вектор снижает жизнеспособность клеточной линии клеточной карциномы почек, но не в нормальных фибробластах [12]. Он также подавляет рост ксенотрансплантированных опухолей у мышей более эффективно, чем вектор, экспрессирующий тимидин киназу с промотора цитомегаловируса.
2.2 Cytosine Deaminase and 5-Fluorocytosine
Энзим цитозин деаминаза, клонированный из Escherichia coli , может деаминировать цитозин и 5-fluorocytosine [13]. Т.о., не токсический 5-fluorocytosine может превратиться в токсическую молекулу 5-fluorouracil (Fig. 2). Внесение гена the cytosine deaminase в линию клеток колоректальной карциномы человека вызывает подавление клеточного роста с помощью 5-fluorocytosine при IC 50, что в 566 раз ниже, чем это необходимо для родительской клеточной линии без cytosine deaminase [13]. При исследовании линии клеток колоректальной карциномы, WiDr, сконструированный, чтобы экспрессировать или cytosine deaminase или HSV-thymidine kinase, был использован для продукции ксенотрансплантировнных опухолей, и было установлено, что обе системы могут давать полностью лишенных опухолей животных после воздействия ganciclovir или 5-fluorocytosine, соотв. [14]. Когда опухоли состояли из 90% дикого типа раковых клеток и только из 10% HSV-thymidine kinase-экспрессирующих клеток, то воздействие ganciclovir оказывалось неэффективным, подтверждая, что в этом случае не происходит эффекта bystander. Однако, когда опухоли, содержали 4% клеток, экспрессирующих cytosine deaminase, и 96% дикого типа опухолевых клеток, 60% животных становилось свободными от опухолей, указывая тем самым, что продуцируемый 5-fluorouracil может проникать в соседние клетки, не экспрессирующие энзим и вызывать цитотоксичность [14].
 Fig. 2 Conversion of 5-fluorocytosine to 5-fluorouracil triphosphate. Cytosine deaminase cloned from Escherichia coli deaminates 5-fluorocytosine to 5-fluorouracil, which is phosphorylated by 5-fluorouracil phosphoribosyl transferase. Monophosphorylated 5-fluorouracil is further phosphorylated by cellular enzymes into an active triphosphate compound. The molecular structures were adapted from PubChem Ретровирусы, кодирующие ген cytosine deaminase, управляемый промоторами, происходящими с промоторных регионов carcinoembryonic антигенов, были использованы для трансдукции клеток колоректальной карциномы человека, которые становились чувствительными к воздействиям 5-fluorocytosine [15]. Клетки, продуцирующие эти ретровирусы, были использованы для лечения внутрибрюшинно рассеянных клеток колоректальной карциномы вместе с 5-fluorocytosine. Такое воздействие увеличивало жизнеспособность животных по сравнению с воздействием клеток, продуцирующих cytosine deaminase без специфических промоторов и также избегло супрессии костного мозга, наблюдаемой у нецелевых ретровирусов.
При очень отличном подходе к генотерапии, мезенхимные стволовые клетки, экспрессирующие ген cytosine deaminase, были использованы для создания bystander, цитотоксического эффекта соседние клетки C6 глиомы, в присутствии 5-fluorocytosine, и этот эффект был пропорциональным количеству энзима, продуцируемого стволовыми клетками [16]. Мезенхимные стволовые клетки, экспрессирующие cytosine deaminase, были использованы для лечения ранней стадии C6 глиомных опухолей и снижения опухолевой массы как функции от дозы 5-fluorocytosine. Подавление роста установлено у опухолей, требовавших множественные инъекции мезенхимных стволовых клеток.
Одним из ограничений для cytosine deaminase является низкое сродство к 5-fluorocytosine по сравнению с цитозином. Идентифицированы мутантные энзимы, обладающие обладающие значительно более низкой активностью в отношении cytosine и несколько более высокой активностью в отношении 5-fluorocytosine; напр., мутантный D314A обнаруживает почти в 20-раз более высокую активность в отношении 5-fluorocytosine, чем цитозина [17]. Будучи доставленным с помощью лентивирусного вектора, этот мутант подавлял рост клеток ксенотрансплантанта карциномы толстой кишки в 6 раз сильнее по сравнению с дикого типа cytosine deaminase, в присутствии 5-fluorocytosine [18]. Мутант F186W вызывал цитотоксичность клеток A549 рака легких человека с достоверно более низким IC 50 для 5-fluorocytosine по сравнению с легким типом cytosine deaminase [19].
2.3 Purine Nucleoside Phosphorylase and 6-Methylpurine Deoxyriboside or Fludarabine
Фермент purine nucleoside phosphorylase Escherichia coli катализирует превращение deoxyadenosine аналога, который является не токсическим аналогом токсического аденина (Fig. 3). Когда этот энзим экспрессируется даже на уровне менее 1% в клетках карциномы колона человека и культура подвергается воздействию deoxyadenosine аналога 6-methyl-purine-2'-deoxyribonucleoside, то по существу все находящиеся рядом клетки погибают [20]. Напротив, контрольные клетки, которые не были трансфицированы или фиктивно трансфицированы, не затрагивались ощутимо, частично потому, что этот аналог не являлся субстратом для purine nucleoside phosphorylase человека.
 Fig. 3 Conversion of fludarabine to toxic fluoroadenine by purine nucleoside phosphorylase of Escherichia coli . The molecular structures were adapted from PubChem Эта система была использованы для воздействия на злокачественные глиомные опухоли человека, экспрессирующие ген E. coli purine nucleoside phosphorylase у мышей nude [21]. Мыши подвергались воздействию субстрата энзима (6-methylpurine-2?-deoxyriboside или arabinofuranosyl-2-fluoroadenine monophosphate). Продукты действия энзима были токсичны для опухолей, без возникновения явной системной токсичности на животных. Применение трех доз 6-methylpurine-2'-deoxyriboside опухоли в основном уничтожались.
В фазе I клинического испытания ген purine nucleoside phosphorylase внедряли в опухоли за счет прямых инъекций аденовирусного вектора и исходного внутривенно [22]. Достоверная регрессия опухолей наблюдалась у большинства пациентов, получавших наивысшие дозы fludarabine. Fluoroadenine продуцировался локально и не онаруживался в сыворотке.
2.4 Horseradish Peroxidase and Indole-3-Acetic Acid
Растительный гормон indole-3-acetic acid (auxin) может быть превращен с помощью horseradish peroxidase в токсический продукт, 3-methylene-2-oxindole [23] (Fig. 4). Когда кДНК для horseradish peroxidase внедряли в экспрессионный вектор млекопитающих и трансфицировали в T24 клетки карциномы мочевого пузыря человека, то воздействие indole-3-acetic acid вызывало цитотоксичность[24, 25]. Воздействия одного auxin или одной horseradish peroxidase в эквивалентных концентрациях не оказывало эффекта. Токсический продукт, скорее всего, затрагивал nitrogenous основания ДНК и thiol группы белков и мог также проникать через клеточные мембраны. Следовательно, межклеточные контакты необязательны для bystander эффекта.
 Fig. 4 Conversion of indole-3-acetic acid to toxic 3-methyl-2-oxindole by horseradish peroxidase. The molecular structures were adapted from PubChem Эти возможности суицидальной генотерапии тестировали на SCID мышах, которым вводили FaDu человеческие nasopharyngeal squamous cell carcinoma клетки, экспрессирующие horseradish peroxidase [26]. Millimolar концентрации indole-3-acetic acid или 5-bromo-indole-3-acetic acid могут достигать опухолевых тканей, когда вводятся внутрибрюшинно в нетоксических дозах. Однако, наблюдается лишь умеренная задержка роста опухолей при такой системе. В экспериментах с культурами клеток стабильно трансфицированные FaDu клетки обнаруживали более высокую активность, чем временно трансфицированные клетки, но система horseradish peroxidase/indole-3-acetic acid была не столь эффективной в стабильно трансфицированных клетках [26].
Dai et al. [27] получили аденовирус, экспрессирующий horseradish peroxidase isoenzyme C под контролем alpha-fetoprotein промотора (pAdv-AFP-HRPC), трансдуцирующий клетки гепатоцеллюлярной карциномы (H22, Hep-G2, Huh 7, Hep-B3) с помощью этой конструкции, и клетки, обработанные с помощью indole-3-acetic acid. Цитотоксичность возрастала с увеличением дозы indole-3-acetic acid и времени инкубации. Контрольные эпителиальные клетки почек Vero African зеленых мартышек не затрагивались. Та же самая система была использована для лечения H22 hepatoma xenografts, при жтом и размер и вес опухолей подавлялся по сравнению с контрольной группой. Horseradish peroxidase экспрессировалась в опухоли, но не в др. органах [27].
2.5 Other Systems
Jounaidi et al. [28] описали систему суицидальной генотерапии, базирующуюся на активации oxazaphosphorine лекарств, таких как cyclophosphamide, с помощью cytochrome P450. Гены для cytochrome P450 2B6 энзима и для P450 reductase экспрессируются в клетках 9L gliosarcoma, усиливая цитотоксический эффект cyclophosphamide in vitro и in vivo.
Bridgewater et al. [29] трансдуцировали клетки NIH3T3 геном E. coli nitroreductase, используя рекомбинантный ретровирус и воздействовали на клетки с помощью prodrug CB1954 (5-(aziridin-1-yl)-2,4-dinitrobenzamide). Nitroreductase превращает prodrug в бифункциональный алкилирующий агент, который убивает клетки. Эта система была эффективной для меланомы, мезотелиомы, карциномы яичников, и колоректальных и панкреатических раковых клеток [29, 30].
Ген carboxylesterase вносили в клетки A549 лёгочной карциномы человека посредством аденовирусного вектора, чтобы превратить irinotecan (CPT-11) в активный метаболит 7-ethyl-10-hydroxy-camptothecin (SN-38), который подавляет topoisomerase I [31]. Это воздействие приводит к аресту роста клеток in vitro и уменьшает размер подкожных ксенотрансплантатов у мышей nude.
|



