Посещений: 
ЛЕЙКЕМИЯ
CAR-T терапия
Gene therapy as advanced technology for the treatment of Leukemia: CAR-T therapy Raman Kumar Tripathi , Shamsher Singh  Asian Journal of Pharmacy and Pharmacology 2018; 4(3): 245-251 DOI: https://doi.org/10.31024/ajpp.2018.4.3.1 2455-2674/Copyright © 2018
| |
|
Генотерапия - это перенос терапевтического гена пациенту для лечения беолезни (Naldini, 2015). Ряд испытаний проведен с 1989, чтобы проанализировать эффективность генотерапии. Трансплантации костного мозга и органов сходны с генотерапией, поскольку они также делают возможным перенос ДНК в клетки. Надежное лечение нарушений, при которых лекарства первой линии непригодны или неэффективны для лечения (Ginn et al., 2013). Этот подход пригоден для нарушений, вызываемых мутацией одиночного гена, таких как кистозный фиброз, серповидно-клеточная анемия, талассемия, гемофилия и мышечная дистрофия. Тогда взамен нужно вводить один ген пациенту, редактирование гена также может быть использовано для лечения болезней. подобных раку или вирусным болезням (Prakash et al., 2016).
Основым методом редактиврования генов являются CRISPER zinc
finger нуклеазы. При этом перенос гена в клетку мишень с помощью вектора вирусного и не-вирусного (Ramamoorth et al., 2015). Перенос ДНК или генетического материала в клетку хозяин помогает реплицироваться, чтобы продемонстрировать его экспрессию ( et al., 2014).
Кодирующая ДНК предоставляет определенные инструкции, чтобы продуцировать специфические новые копии вирусов, которые смогут инфицировать больше клеток. Мы можем использовать вирусы для доставки терапевтических генов внутрь клеток пациента (Finer et al., 2017). После переноса гена вирус удаляется (Rabinovichet al., 2017). Не-вирусные векторы являются такими переносчиками, которые могут помочь в переносе генов в клетки пациента без помощи вируса (Harde et al., 2017). Сюда входят биологические векторы и искусственно созданные векторы. Инъекции голой ДНК, портация с помощью звука, магнита, выстрела гена (Gene gun), электропортация используют олигонуклеотиды, дендримеры, липоплексы (lipoplexes) и неорганические наночастицы. Генетическая пушка (Gene gun( и электропортация являются широко используемыми техниками. Липоплексы и олигонуклеотиды также используются для лечения некоторых болезней (Slivac et al., 2017; Figure 1 . Kaji EHet al., 2001; ).
Рак является болезнью, возникающей из-за аномального роста клеток, а также благодаря их способности распространяться из одной части тела в др. (Swisher et al., 2017). Образование петли является первым признаком рака, кроме того, это сопрвовждается аномальной кровоточивостью, необъяснимой потерей веса, нарушениями стула и постоянным кашлем (Stefani et al., 2017). На ранней стадии трудно понять, но имеются некоторые указывающие сигналы, которые клетки обнаруживают, когда они становтся злокачественными. Избегание апоптоза, облегчение образования кровеносных сосудов, непрерывный рост и деления даже если это не нужно для и образование метастазов, которые распространяются от источика возникновения во вторичные места в теле хозяина (Ibrahim et al., 2015). В среднем, примерно 1 на 1000 беременных женщин затрагивается раком, который может затрагивать плод. Рак груди, рак шейки матки, лейкемия, лимфома, меланома, рак яичника и колоректальный рак широко распространены во время беременности (Salani et al., 2015).
Рак характеризуется типом клеток, которые становятся опухолевыми клетками и выглядят похожими на них. Эти типы включают карциномы, лимфомы, саркомы, опухоли зародышевых клеток и бластомы. Карцинома: рак, происходящий из эпителиальных клеток (Tran et al., 2014). Рак груди, легких, простаты, поджелудочной железы и толстой кишки являются карциномного типа. Саркомы возникают из соединительной ткани, они затрагивают кости, хрящи, жировуют ткань нервные клетки. Обычно каждая клетка развивается из клеток, инициируемых мезенхимными клетками (Kumar, 2017). Лимфома и лейкемия возникают из гематопоэтических клеток, кторые созревают в клетки крови и лимфатических узлов после выхода из костного мозга (Goetsch et al., 2017). Опухоли зародышевых клеток происходят из плюрипотентных клеток и их нелегко обнаружить на ранних стадиях в семенниках и яичниках ( Oosterhuis et al., 2017). Сходным образом, бластома развивается из клеток предшественников или эмбриональной ткани.
Table 1. Cause and death percentages by cancer
Sr. No. Causes Death Percentage
1. Tobacco 22%
2. Obesity, lack of physical activity and 10%
drinking of alcohol
3. Infections such as hepatitis B, hepatitis 20%
C and human papilloma virus infection
4. Inherited genetic defects 2-10% Рак является многофакторным нарушением, но основными причинными факторами являются изогенетичекие и эпигенетические типы (Vineis et al.,
2014). Онкогены и гены супрессоры опухолей являются повреждаемыми генами (Liuet al., 2014). Онкогены способствуют росту клеток, репродукции, а гены супрессоры опухолей подавляют деления клеток и жизнеспособность клеток. Из-за неспособности генов супрессоров опухолей, происходит избыточная экспрессия онкогенов, это приводит к превращению нормальных клеток в опухолевые (Bradneret al., 2017). Мутации, транслокации хромосом и ошибки митозов постоянно вовлекаются в альтераци целостности ДНК и её функции. Благодаря репликации измененной ДНК поврежденные гены сильно повреждают клетки (Bartek et al., 2017). Иногда клетки могут подвергаться саморазрушению, т.е процессу апоптоза, это может запускать перенос инфицированных мутантных клеток с места возникновения у матери к её потомку, где они начинают делиться и превращаются в раковые (Davidson et al., 2017; Merlo LM et al., 2006) (Figure 4).
При эпигенетических состояниях воздействуют как энгдогенные (с питанием связанные макрофаги и нейтрофилы усиливают ROS, RNS), так и экзогенные агенты (курение, облучени е, металлы, вирусы и др. генотоксические агенты), приводящие к повреждениям ДНК (Ow et al., 2017). Повреждения ДНК нарушают MiRNA. Разные гены репарации ДНК помогают устранять повреждения, но в случае дефицита репарации ДНК шансы соматических мутаций и эпигенетических альтераций резко возрастают (Crean et al., 2017). В результате мультипликации измененной области дефекта с мутациями драйверов будут способствовать прогрессированию опухоли (Neureiter et al., 2014; Kanwal et al., 2012) (Figure 5).
В последнее время ряд техник был использован для предупреждения соматических и генетических мутаций, также как целенаправленное воздействие гипер иммунных клеток, но все были неспособны супрессировать раковый рост. Недавно заставили некоторые из антибиотиков целенаправленно воздействовали на специфические клетки , техника наз. CAR-T терапия. CARs являются рецепторами, которые помогают в связывании специфических антител с T клетками, помогая при этом помещать кодирующую последовательность внутрь ретровирусов (Poirot et al., 2015). Приемлемым является также перенос клеток
Figure 2. Squamous Cell Carcinoma (Grossman et al., 2008)
Figure 3. Femoral osteosarcoma (Jeon et al., 2007)
Figure 4. Genetic pathology of cancer (Merlo et al., 2006)
Для успешного лечение рака с использованием CARs. T-клетки от пациента собираются и затем они модифицируются таким образом, что они оказываются способны распознавать раковые клетки и затем убивать их. CARs обладают тремя доменами, т.е. эктодоменом, трансмембранным доменом и эндодоменом (Kenderian et al., 2017). Эктодомен присутствует вне клетки, обращенным во внеклеточное пространство и находится вне цитоплазмы. Эктодермальный домен экспозирован во внеклеточное пространство подобно поверхностному рецептору. В эндоплазматическом ретикулуме белок управляется сигнальным пептидом. scFv обычно находится в регионе, распознающем антиген, хотя многие др. регионы также присутствуют (Kershaw et al., 2013). Часть, обладающая высоким сродством к сайту мишени, может быть использована в качестве региона, распознающего антиген. Соединение антиген связывающего домена с трансмембранным доменом является спейсерным регионом (Richter et al., 2017). Так, спейсерные регионы антиген связывающего домена помогают распознавать и обеспечивают связь с распознаваемым антигеном, напр., IgG1. Трансмембранный домен проходит через мембрану. Функциональные концы рецептора ведут себя как эндодомен (Zani et al., 2015; Zhang et al., 2017) (Figure 6).
Gene therapy for leukemia treatment
Лейкемия - это группа раковых опухолей, которые возникают в костном мозге и вызывают пролиферацию клеток белой крови, известных как лейкозные клетки (Petrella et al., 2015). Широко распространенными симптомами являются кровотечения и проблемы с ушибами, сопровождаемые небольшим повышением температуры и утомляемостью. Существует также повышенный риск инфекций после незанчительных столкновений с неблагоприятной окружающей средой. Причиной белокровия является ионизирующая радиация, курение, синдром Дауна и предшетвующая химиотерапия. Лейкемия уществут в виде 4-х типов, таких как acute lymphoblastic leukemia (ALL), chronic lymphocytic leukemia (CLL), acute myeloid leukemia (AML) и chronic myeloid leukemia (CML)(Modak et al., 2014). Диагностика лейкемии базируется на полном анализе крови и исследовании костного мозга вместе с симптомами. Необязательно, что анализ крови подтвердит, что пациент имеет лейкемию, это широко распространено на ранних стадиях. При некоторых ситуациях биопсия лимфатических узлов также необходима для диагностики определенных типов лейкемии (Soni et al., 2015). MRI, рентгеновское и ультразвуковое исследование используются, чтобы сдерживать проблемы, связанные с возникновением лейкемии. Лимфатические узлы, присутствующие в грудной клетке, могут быть определены с помощью обычного CT сканирования (Latifi et
al., 2015).
Генотерапия лейкемии рассматривается как основная генотерапия. Пациенты с устойчивыми B-клеточными предшественниками при acute lymphoblastic leukemia (ALL) подвергаются воздействию с помощью tisagenlecleucel (Wells et al., 2017). Tisagenlecleucel - это техника, которая включает chimeric antigen receptor(CAR) T-клеточную терапию, при которой специфические иммунные клетки пациента используются для лечения лейкемии. The CAR-T клетки являются рекомбинантными клетками, которые обладают антителами к специфическим опухолевым антигенам.
Разрешение для kymriah впервые было дано FDA в июле 2017 (Bach et al., 2017). CART
клетки имеют три части: трансмембранный домен, внеклеточный антиген-распознающий домен (single chain variable fragment) scFV и внутриклеточный
Figure 5. Epigenetic pathology of cancer (Kanwal et al., 2012)
Figure 6. Chimeric Antigen Receptor (Zhang et al., 2017)
активационный домен из CD3ζ. Nthfgbz CAR-T нацелена специфически на
CD19-положительную ALL. При CAR-T терапии Т клетки пациентов собираются и генетически модифицируются, чтобы рецептор специфически воздействовал CD19, присутствующие на поверхности раковых клеток (Olweus, 2017). После модификации эти клетки переносятся в пациентов, чтобы убивать злокачественные клетки в специфической области и без какой-либо токсичности. При CAR-T терапии пациент д. иметь возраст 25 лет или выше. Испытания на 63 детях и взрослых пациентах с ALL привели к её разрешению. Общая величина ремиссии составляла в 83%- 84% спустя 3 мес. после лечения с помощью Kymriah (Hallek, 2014). Tisagenlecleucel is
having a boxed warning for CRS that is a response which can
activate the proliferation of CAR-T cells leading to high fever
and flu like symptoms. Для лечения тяжелых случаев CRS, FDA одобрила Tocilizumab, которые широко известны как Actemra у пациентов в возрасте 2-х лет или выше (Valecha et al., 2017). Разрешение tocilizumab базируется на излечении 69% пациентов
с CRS в течение 2 недель, получивших 1 или 2 дозы лекарства.
Kenneth C Anderson, MD, American Society of Hematology president, of the Dana-Farber Cancer Institute in Boston заявляет “Разрешение CAR T-клеточной терапии для лейкемии у детей отмечает важный сдвиг в парадигме лечения рака крови” (Ding et al., 2017). CAR-T терапия была разрешена после оценки риска и компенсационных мер, она необходима госпиталям и клиникам для безопасной и эффективной доставки лекарства. Профессиональный состав здравохранения д. быть оснащен соотв. знаниями по распознаванию CRS и нейрологических событий. Недавно, лекарство, разработанно Novartis для лечения, но цена его лечения для пациента составляет $475000 (Brower et al., 2017; Zhao L et al., 2018) (Figure 7).
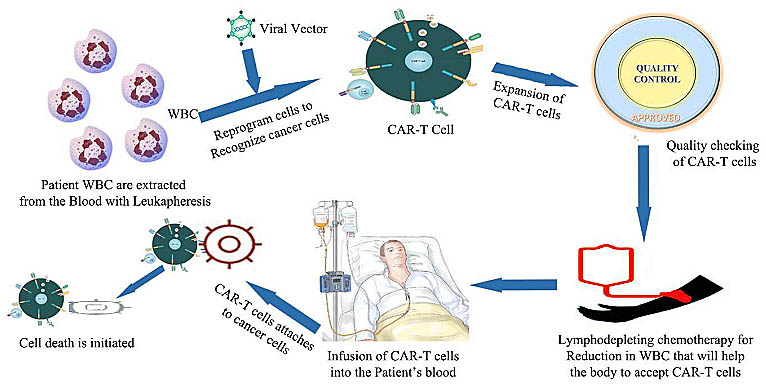
Conclusion
Now a day's gene therapy is an efficient technique used to
treat various types of disorders like monogenic, polygenic
and infectious diseases. However, from the last few years the
cancer is the major illness infecting the mankind. The
leukemia commonly known as blood cancer is a silent and
running with a big mortality rate. Basically the over
proliferation of hematopoietic cells give birth to leukemia.
Presently, gene therapy for leukemia includes the kymriah
treatment which was recently approved by the FDA in July
2017. Its foremost target is CD19 ALL in a specific way with
negligible chances of organ toxicity. In this therapy the WBC
of the patients are collected and modified and further use to
kill cancerous cell in his own body. So due to less side effect
of kymriah as compared to the other medications it is using as
lifesaving therapy because it kill only the leukemia cells
without damaging to the normal cells functioning.
The CAR-T Therapy is based on the adoptive cell transfer
technique. In starting, CAR-T therapy was restricted to some
of the small trails but now days it is being used for the
treatment of acute lymphoblastic Leukemia and lymphomas.
|
